- Бериллий (Beryllium)
- Магний (Magnesium)
- Щелочноземельные элементы
- Радий
- Общие химические свойства
- Щелочноземельные металлы – перечень, свойства и польза элементов
- Что представляют собой
- История
- Формы нахождения в природе
- Физико-химические характеристики
- Где используются
- Щелочноземельные металлы
- Способы получения
- Применение щелочноземельных металлов
- Характерные химические свойства Be, Mg и щелочноземельных металлов
- Химические свойства щелочноземельных металлов + Be
- Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
- Физические свойства
- Химические свойства
- Нахождение в природе
- См. также
- Ссылки
- Литература
- Какие металлы являются щелочными и Щелочноземельными?
- Какие металлы называют щелочными Каковы особенности?
- Как определить щелочные металлы?
- Какой из этих металлов самый лёгкий?
- Где металлы в таблице Менделеева?
- Какой из металлов наиболее активно реагирует с водой?
- В каком виде встречаются в природе щелочные металлы почему?
- Какой из металлов более активен?
- Как металлы реагируют с кислородом?
- Как щелочные металлы реагируют с водой?
- Какие металлы называют щелочными Каковы особенности электронного строения?
- Где хранятся щелочные металлы?
- Почему все металлы твердые?
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен.
По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Бериллий (Beryllium)
 Бериллий
Бериллий
Многие минералы бериллия – берилл 3BeO∙Al2O3∙6SiO2, хризоберилл BeAl2O4 и их разновидности (изумруд, аквамарин, александрит) – известны очень давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl.
В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия.
Исходные соли бериллия выделяют при переработке бериллиевой руды.
 Берилл
Берилл
Бериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом.
Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2.
На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в.
обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов.
В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний (Magnesium)
 Магний
Магний
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в.
При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3.
При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.
 Каинит
Каинит
В некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью.
На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2.
Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н+: Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь.
Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике.
Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементы
 Кальций
Кальций
К семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
Название «кальций» происходит от латинского calx – «известь». Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу.
В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка).
Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
 Гипс
Гипс
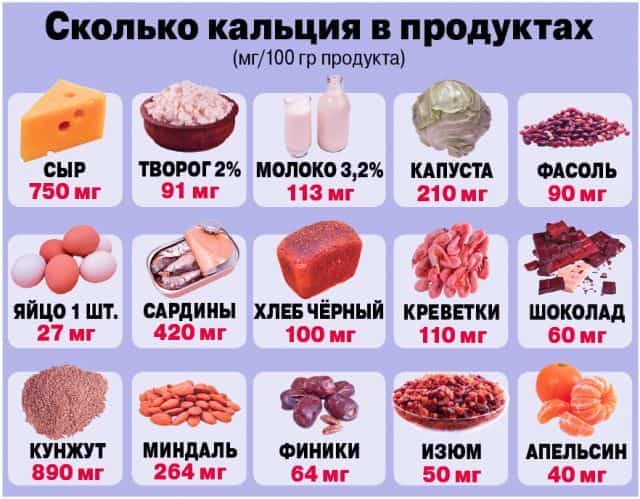
В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов.
В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция.
При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis – «небесный») – сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий – в виде барита (тяжелого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
 Стронций
Стронций
Годом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле и его ученик Юхан Готлиб Ган установили, что в тяжелом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Растворимые соединения бария еще более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8-0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или магния. При этом в организме образуется сульфат бария – нерастворимый и потому безопасный.
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.
 Минерал целестин
Минерал целестин
Щёлочноземельные металлы по химической активности уступают лишь щелочным. Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид.
Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов.
Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.
 Барий
Барий
Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
Радий
Последним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде.
Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран.
Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом.
Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.
Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Общие химические свойства
- По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
- Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.
- Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
- 2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
- Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
- Ca + Cl2 = CaCl2 Mg + Cl2 = MgCl2
- Ca + S = CaS Mg + S = MgS
- 3Ca + N2 = Ca3N2 3Mg + N2 = Mg3N2
- Ca + H2 = CaH2 Mg + H2 = MgH2
- Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
Реакция кальция с водой
- Ca + 2H2O = Ca(OH)2 + H2↑
- Mg + 2H2O = Mg(OH)2 + H2↑
- Щелочноземельные металлы и магний энергично вытесняют водород из кислот:
- Ca + 2HCl = CaCl2 + H2↑
- Mg + H2SO4 = MgSO4 + H2↑
Щелочноземельные металлы – перечень, свойства и польза элементов
Этой группе металлов отдан весь второй столбец таблицы Менделеева. И атомщики, и ювелиры используют щелочноземельные металлы. С ними интересно экспериментировать, но требуется осторожность.

Что представляют собой
Щелочноземельные металлы – это вся вторая группа таблицы Менделеева.
К щёлочноземельным металлам относятся:
- бериллий,
 Бериллий, чистота более 99%, поликристаллический фрагмент
Бериллий, чистота более 99%, поликристаллический фрагмент - магний,
 Металлический магний
Металлический магний - кальций.
 Кальций в атмосфере аргона
Кальций в атмосфере аргона
Плюс:
- стронций,

- барий,
 Барий металлический Ba 99,9%
Барий металлический Ba 99,9% - радий.
 Советский армейский компас. Жёлтая краска содержит радий
Советский армейский компас. Жёлтая краска содержит радий
То есть «щелочноземельный» список насчитывает шесть позиций, которые обычно располагаются по возрастанию атомного номера – от бериллия к радию.
История
Двойное название группы – отражение природы и характеристик входящих в нее элементов:
- Они способны образовывать щелочи.
- Ряд свойств их оксидов близки окислам алюминия и железа. Такие вещества еще средневековые алхимики именовали «землями».
Сегодняшний состав щелочноземельной группы сформировался не сразу: бериллий и магний отсутствовали.
Это объяснялось отличием свойств данных элементов от остальных:
- По большинству характеристик они ближе к алюминию, чем к другим элементам группы.
- Их гидроксиды – не щелочи.
- Магний взаимодействует с водой в замедленном режиме, у бериллия реакция в таком растворе нулевая. Та же картина при контакте с неметаллами.
Однако специалисты Международного союза теоретической и прикладной химии (IUPAC) решили все-таки причислить бериллий и магний к щелочноземельной группе.
Формы нахождения в природе
Щёлочноземельным металлам присуща чрезмерная активность, поэтому в природе они как самостоятельный элемент отсутствуют.
Почти всегда это составляющая минералов либо руд:
- Самый распространенный элемент щелочноземельной группы – кальций (2,9-12,9% по массе). Его получают из известняков, им насыщены мрамор, гранит.
- Почти три процента забирает магний.
- В сто раз реже в литосфере представлены барий со стронцием.
- Содержание остальных элементов измеряется тысячными долями процента.
Самым редким на планете щёлочноземельным металлом является радий. Но найти его легче других: это обязательный компонент урановых рудников.
Физико-химические характеристики
Элементы группы наделены общими физическими свойствами:
- Серебристый с сероватостью цвет.
- Твердость в стандартных условиях, ножом режется только стронций.
- Металлический блеск.
- Тускнение на воздухе с разной скоростью вследствие образования оксидной пленки.
- Хорошая пропускная способность для тепла и электричества.
- Два электрона на внешнем слое атома у каждого элемента, степень окисления – всегда +2. Это отражают формулы соединений, образованных металлами группы.
Самая тяжелая «щелочная земля» – радий. Кубик вещества с ребром в 1 см весит 5,5 грамма.
Более интересны химические свойства «земель».
Есть общие и оригинальные:
- Покрытый пленкой-оксидом бериллий способен на реакцию только при 600+°С (кроме фтора).
- Окисленный магний при средней температуре не реагирует ни с чем. Получение соединений металла возможно при температуре от 645°C.
- Кальций окисляется неспешно и только если воздух влажный. При незначительном нагреве горит, растворяется водой.
- Осмотрительности требуют барий, стронций, радий. На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
Общие свойства щёлочноземельных металлов – растворение в кислотах, образование солей, щелочей при взаимодействии с водой.
Химическая активность щелочноземельных металлов усиливается с увеличением габаритов атома – от бериллия к радию.
Где используются
Свойства металлов щелочноземельной группы обусловили применение каждого во всех сегментах – от авиастроения до медицины и ювелирного дела:
- Бериллий. Исходник при выплавке сплавов, включая «атомные», получения ракетного топлива. Компонент ювелирных минералов первого ряда – аквамарина, гелиодора, изумруда.
- Кальций. Базис большинства огнеупоров, строительных материалов. Металл задействован при производстве топлива, аптечных препаратов.
- Магний. Самый легкий щелочноземельный металл. Как восстановитель нашел применение в металлургии. Без проблем куется, раскатывается. Чаще используется как «ингредиент» сплавов, снижающий их массивность, – материал корпусов и деталей ракет, самолетов, автомобилей, электроники. А также приборов для нужд оборонного комплекса и предприятий приборостроения.
Сегодня на первое место по использованию магниевых сплавов выходят смартфоны, планшеты, другие гаджеты.
- Стронций. Металлургами используется как лигатура сплавов, очиститель сталей, чугуна, меди от серы, других вредных примесей. Сырье закупают производители радиоэлектроники, химических источников тока, атомщики, пиротехники. Продукция «высокого сегмента» из металла – чистый уран, керамика-сверхпроводник, вакуумный инструментарий.
Стронций создает насыщенно-красные оттенки огней салюта. Изотопом вещества лечат онкологию.
- Барий. Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
На особом счету радий. Это самый редкий щелочноземельный металл: на планете его получено всего полтора килограмма.
Даже микродозы радиоактивного вещества смертельно опасны для человека. Однако это свойство используется исследователями ядерных процессов и для лечения онкологии.
Шкалы, стрелки компасов, бортовых приборов, изготовленных до 1970-х годов, покрыты краской, содержащей радий. Она светится в темноте, но с тех пор не используется как опасная для человека.
Значение щелочноземельных элементов разнообразно:
- Без кальция не формируется скелет, зубы, не сокращаются мышцы. Элемент «курирует» параметры крови.
- Магний – компонент биологических структур (к примеру, хлорофилла у растений). В организме человека содействует синтезу нуклеиновых кислот, работе ферментов, нервной системы.
- Микродозы стронция присутствуют в организме как аналог кальция. Особо важен щелочноземельный элемент для детей младше четырех лет.
Барий, радий, бериллий, их соединения ядовиты. Поэтому для биологических структур опасны.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Щелочноземельные металлы
К понятию щелочноземельных металлов относится часть элементов II группы системы Менделеева: бериллий, магний, кальций, стронций, барий, радий. Четыре последних металла имеют наиболее ярко выраженные признаки щелочноземельной классификации, поэтому в некоторых источниках бериллий и магний не включают в список, ограничиваясь четырьмя элементами.
Свое название металла получили благодаря тому, что при взаимодействии их оксидов с водой образуется щелочная среда.
Физические свойства щелочноземельных металлов: все элементы имеют серый металлический цвет, при нормальных условиях имеют твердую структуру, с ростом порядкового номера увеличивается их плотность, имеют очень высокую температуру плавления.
В отличие от щелочных металлов, элементы данной группы не режутся ножом (за исключением стронция). Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.

Характеристика щелочноземельных металлов свидетельствует об их высокой активности. В особенности это относится к элементам с большим порядковым номером. Например, бериллий в нормальных условиях не ступает во взаимодействие с кислородом и галогенами.
Для запуска механизма реагирования его необходимо нагреть до температуры свыше 600 градусов по Цельсию. Магний в нормальных условиях имеет на поверхности оксидную пленку и также не реагирует с кислородом. Кальций окисляется, но достаточно медленно.
А вот стронций, барий и радий окисляются практически мгновенно, поэтому их хранят в безкислородной среде под керосиновым слоем.
Все оксиды усиливают основные свойства с ростом порядкового номера металла. Гидроксид бериллия представляет собой амфотерное соединение, которое не реагирует с водой, но хорошо растворяется в кислотах.
Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция — сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде.
А гидроксид радия — это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Способы получения
Получают гидроксиды щелочноземельных металлов путем воздействия воды на чистый элемент. Реакция протекает при комнатных условиях (кроме бериллия, для которого требуется повышение температуры) с выделением водорода. При нагревании все щелочноземельные металлы реагируют с галогенами.
Полученные соединения используются в производстве большого ассортимента продукции от химических удобрений до сверхточных деталей микропроцессора.
Соединения щелочноземельных металлов проявляют такую же высокую активность, как и чистые элементы, поэтому их используют во многих химических реакциях.

Чаще всего это происходит при реакциях обмена, когда необходимо вытеснить из вещества менее активный металл. В окислительно-восстановительных реакциях принимают участие в качестве сильного восстановителя. Двухвалентные катионы кальция и магния придает воде так называемую жесткость.
Преодоление этого явления происходит путем осаждения ионов при помощи физического воздействия или добавления в воду специальных смягчающих веществ. Соли щелочноземельных металлов образуются путем растворения элементов в кислоте либо в результате реакций обмена.
Полученные соединения имеют прочную ковалентную связь, поэтому обладают невысокой электропроводностью.
В природе щелочноземельные металлы не могут находиться в чистом виде, так как быстро вступают во взаимодействие с окружающей средой, образую химические соединения. Они входят в состав минералов и горных пород, содержащихся в толще земной коры.
Наиболее распространен кальций, немного уступает ему магний, довольно часто встречаются барий и стронций. Бериллий относится к редким металлам, а радий — к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла.
Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.

Получают щелочноземельные металлы путем разложения сложных веществ и выделения из них чистого вещества. Бериллий добывают путем восстановления его из фторида при воздействии высокой температуры. Барий восстанавливает из его оксида. Кальций, магний и стронций получают путем электролиза их хлоридного расплава.
Сложнее всего синтезировать чистый радий. Его добывают путем воздействия на урановую руду. По подсчетам ученых в среднем на одну тонну руды приходится 3 грамма чистого радия, хотя встречаются и богатые месторождения, в которых содержится целых 25 грамм на тонну.
Для выделения металла используются методы осаждения, дробной кристаллизации и ионного обмена.
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов очень обширен и охватывает многие отрасли. Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы.
Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии.
Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют как один из восстановителей при получении титана. Его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет.
Оксид магния горит ярким ослепительным пламенем, что нашло отражение в военном деле, где он используется для изготовления зажигательных и трассирующих снарядов, сигнальных ракет и светошумовых гранат.
Является одним из важнейших элементов для регуляции нормального процесса жизнедеятельности организма, поэтому входит в состав некоторых лекарств.

Кальций в чистом виде практически не применяют. Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани.
Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами.
Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
Характерные химические свойства Be, Mg и щелочноземельных металлов
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
- •Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
- • Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
- • Сильные восстановители
- •Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
- • К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
- • Бериллий по большинству свойств ближе к алюминию
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
- В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
- Mg + 2H 2 O – t° → Mg(OH) 2 + H 2 ↑
- Ca + 2H 2 O → Ca(OH) 2 + H 2 ↑
2. Реакция с кислородом.
- Все металлы образуют оксиды RO, барий-пероксид – BaO 2 :
- 2Mg + O 2 → 2MgO
- Ba + O 2 → BaO 2
- 3. С другими неметаллами образуют бинарные соединения:
- Be + Cl 2 → BeCl 2 (галогениды)
- Ba + S → BaS (сульфиды)
- 3Mg + N 2 → Mg 3 N 2 (нитриды)
- Ca + H 2 → CaH 2 (гидриды)
- Ca + 2C → CaC 2 (карбиды)
- 3Ba + 2P → Ba 3 P 2 (фосфиды)
- Бериллий и магний сравнительно медленно реагируют с неметаллами.
- 4. Все щелочноземельные металлы растворяются в кислотах:
- Ca + 2HCl → CaCl 2 + H 2
- Mg + H 2 SO 4 (разб.) → MgSO 4 + H 2
- 5. Бериллий растворяется в водных растворах щелочей:
- Be + 2NaOH + 2H 2 O → Na 2 [Be(OH) 4 ] + H 2
- 6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
- соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО 2- 2 . Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s 2 2s 2 2p 6 3s 2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е — .
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца.
Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg 2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку.
Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO 4 и хлорид CaCL 2 . Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство.
Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Все соединения бария, кроме BaSO 4 , ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны.
Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90 Sr.
Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т 1/2 = 1617 лет).
Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний.
Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов ИИА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
- Be+H 2 O+2NaOH=Na 2 [Be(OH) 4 ]+H 2 .
- Магний активно реагирует с азотом:
- 3 Mg + N 2 = Mg 3 N 2 .
- В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (20 0 С) | Растворимость, г/л | |
Be(OH) 2
|
8∙10 -6
|
3,4∙10 -4
|
Традиционная техническая проблема – жесткость воды , связанная с наличием в ней ионов Mg 2+ и Ca 2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
Li
|
10 -4
|
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п.
Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия.
В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов).
Кроме построения костей и зубов на основе гидроксилапатита Ca 10 (PO 4 ) 6 (OH) 2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция.
В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.
Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше.
Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются.
Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры).
Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры.
Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
Какие металлы являются щелочными и Щелочноземельными?
Какие металлы называют щелочными Каковы особенности?
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов.
Как определить щелочные металлы?
Щелочны́е мета́ллы — элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
Какой из этих металлов самый лёгкий?
Самый легкий металл, известный науке, это, безусловно, литий. Как и остальные легчайшие металлы, он относится к группе щелочных металлов, которой свойственная высокая химическая активность. Плотность лития – 0,534 грамма на кубический сантиметр, т. е.
Где металлы в таблице Менделеева?
Менделеева В Периодической системе химических элементов Д. И. … Металлы располагаются в начале периодов, к ним относятся s-элементы 1 и 2 групп, р-элементы 13 группы, все, кроме бора, 14 группы: германий, олово, свинец, 15 группы: сурьма, висмут, а также все d- и f- элементы.
Какой из металлов наиболее активно реагирует с водой?
Какие металлы реагируют с водой?
- Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
- Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
В каком виде встречаются в природе щелочные металлы почему?
Объяснение: Щелочные металлы в природе встречаются только в виде соединений ( карбонатов, хлоридов, сульфатов, фосфатов, силикатов, вследствие очень лёгкой окисляемости на воздухе, образуя оксиды и при взаимодействии с водой щёлочи.
Какой из металлов более активен?
Наиболее активные металлы на Земле — литий, цезий и франций.
Как металлы реагируют с кислородом?
Металлы взаимодействуют с кислородом, образуя оксиды. Металл + кислород → оксид. Например, при взаимодействии магния с кислородом образуется оксид магния: 2 Mg 0 + O 0 2 → 2 Mg + 2 O − 2 .
Как щелочные металлы реагируют с водой?
Взаимодействие щелочных металлов с водой Щелочные металлы: литий, натрий, калий — очень активны. … Литий энергично реагирует с водой с выделением водорода и образованием щелочи — гидроксида лития. При добавлении капли раствора фенолфталеина в чашку Петри появляется малиновая окраска.
Какие металлы называют щелочными Каковы особенности электронного строения?
Щелочными металлами называются химические элементы-металлы IA группы Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Электронное строение атомов.
Где хранятся щелочные металлы?
Другие щелочные металлы, а также щелочноземельные металлы хранят либо в запаянных стеклянных ампулах в атмосфере азота, либо в стеклянных сосудах под слоем обезвоженного минерального масла. При хранении щелочных металлов в обезвоженном керосине наблюдается окисление их поверхности.
Почему все металлы твердые?
В металлах существует особый вид связи — металлическая химическая связь. … При обычных условиях все металлы (за исключением ртути, её температура плавления — –39 °C) являются твёрдыми веществами. Способность металлов отражать падающий на них свет является причиной наличия у них особого металлического блеска.
Интересные материалы:
В каком году родился Мономах? В каком году родился Никита Пресняков? В каком году родился Патрик Суэйзи? В каком году родился Павел Воля? В каком году родился певец Борис Моисеев? В каком году родился пророк Адам? В каком году родился режиссер Никита Михалков? В каком году родился с я Маршак? В каком году родился Санта Клаус? В каком году родился Сергей Челобанов?






