- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Химические свойства углекислого газа, реакции с другими веществами
- Взаимодействие с другими веществами:
- Заключение
- Оксиды углерода — урок. Химия, 9 класс
- Физические и химические свойства углекислого газа
- Химические свойства углекислого газа
- Физические свойства углекислого газа
- Получение и применение углекислого газа
- Примеры решения задач
- Реакции с участием оксида и диоксида углерода
- Соединения углерода
- Диоксид углерода (углекислый газ)
- Угольная кислота и карбонаты
- Химические свойства оксидов для ЕГЭ 2022
- Классификация оксидов:
- Оксид углерода 2 и 4
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
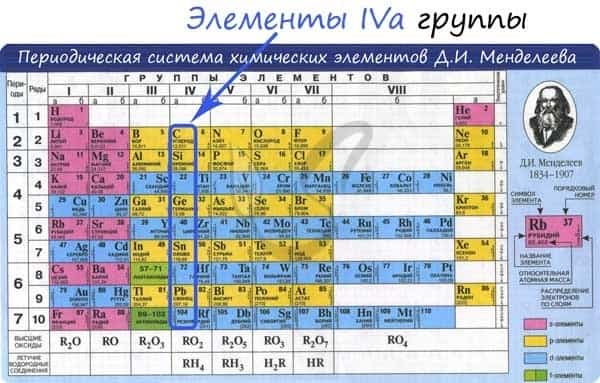
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
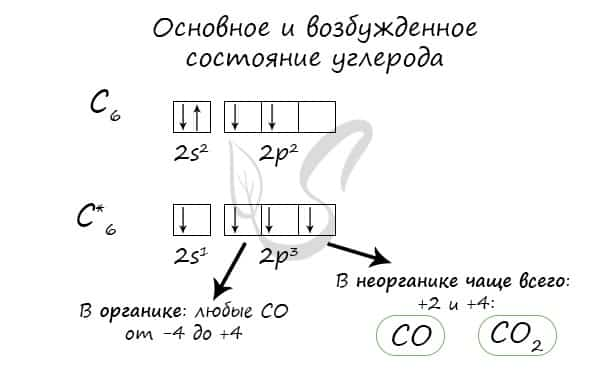
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония
 Углеаммонийная соль
Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO
 Оксид цинка
Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж
 Горение газа на плите
Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q
 Молекула этанола
Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2
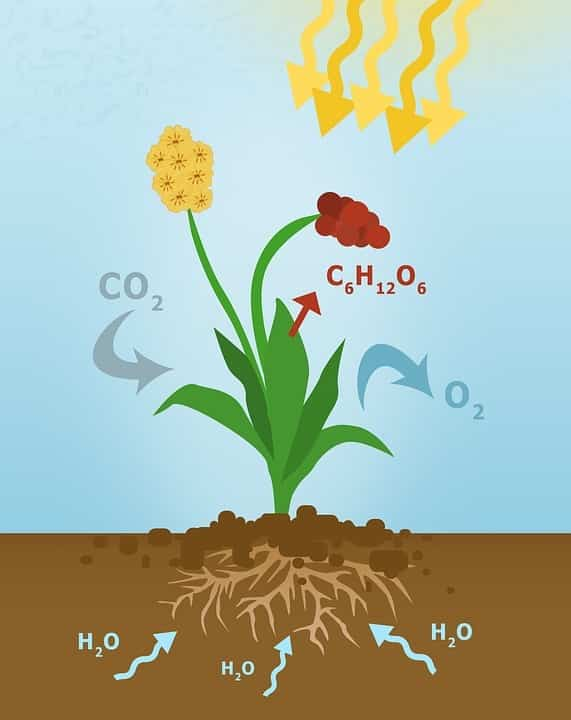 Образование глюкозы
Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
 Колба с пероксидом натрия
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Оксиды углерода — урок. Химия, 9 класс
Оксид углерода((II)), или угарный газ
Оксид углерода((II)) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде ((2,3) см³ в (100) см³ при (20) °С). Оксид углерода((II)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода((II)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода((II)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
- Cu+2O+C+2O=tCu0+C+4O2.
- Оксид углерода((II)) горит на воздухе голубым пламенем:
- 2C+2O+O02=t2C+4O−22.
- В реакции выделяется большое количество тепла.
Оксид углерода((IV)), или углекислый газ
Оксид углерода((IV)) CO2 — бесцветный газ без запаха. Он примерно в (1,5) раза тяжелее воздуха.
Малорастворим в воде (при комнатной температуре в (1) объёме воды растворяется (0,88) объёма CO2).
При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Рис. (1). Сухой лёд
Оксид углерода((IV)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
- CO2+H2O⇄H2CO3.
- В реакциях с основными оксидами и щелочами образуются карбонаты:
- CO2+CaO=CaCO3,
- CO2+2NaOH=Na2CO3+H2O.
- При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
- CO2+NaOH=NaHCO3.
- В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
- C+4O2+2Mg0=t2Mg+2O+C0.
- Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
- В промышленности для его получения используют прокаливание известняка:
- CaCO3=tCaO+CO2↑.
- В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
- Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Источники:
Рис. 1. Сухой лёд © ЯКласс
Физические и химические свойства углекислого газа
Формула – СО2. Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
- CO2 + H2O ↔ CO2×H2O(solution) ↔ H2CO3.
- При нагревании углекислый газ распадается на угарный газ и кислород:
- 2CO2 = 2CO + O2.
- Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
- CaO + CO2 = CaCO3;
- Al2O3 + 3CO2 = Al2(CO3)3;
- CO2 + NaOH(dilute) = NaHCO3;
- CO2 + 2NaOH(conc) = Na2CO3 + H2O.
- Углекислый газ не поддерживает горения, в нем горят только активные металлы:
- CO2 + 2Mg = C + 2MgO (t);
- CO2 + 2Ca = C + 2CaO (t).
- Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
- CO2 + 4H2 = CH4 + 2H2O (t, kat = Cu2O);
- CO2 + C = 2CO (t).
- При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
- 2CO2 + 2Na2O2 = 2Na2CO3 + O2↑.
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
- Выделяют промышленные и лабораторные способы получения углекислого газа.
Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
- CaCO3 = CaO + CO2 (t) (1);
- CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O (2).
- Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Реакции с участием оксида и диоксида углерода
Диоксид углерода в смысле доступности и опасности отличается от CO радикально. Колоссальные количества этого вещества находятся в атмосфере и ежесекундно вырабатываются при сжигании топлива и жизнедеятельности живых организмов. Проблема глобального потепления как раз и связана с значительным повышением концентрации диоксида углерода в атмосфере по причине деятельности человека.
Любители спорить с этим как-то совершенно не учитывают тот очевидный факт, что человечество за сто с небольшим лет достало из недр земли и вернуло в атмосферу то, что в этих недрах накапливалось миллионами лет, уходя как раз из атмосферы за счёт фотосинтеза и захоронения растительных остатков на больших глубинах.
Тут как раз неплохо бы не доказывать, почему в атмосфере так сильно возрос уровень углекислоты, а желающим это опровергнуть – попробовать объяснить, куда подевался такой чудовищный объём возвращённого в атмосферу углекислого газа, и как может такое быть, что такое кратковременное изменение состава атмосферы вообще не имеет последствий.
А объём действительно чудовищный, ведь львиная доля потребностей всего человечества в энергии была покрыта за счёт сжигания ископаемого топлива.
Многим приходит в голову идея, что углекислый газ нужно из атмосферы забирать. А куда девать? Самое надёжное было бы отправить обратно в глубины земли. Но как это сделать совершенно непонятно.
И поскольку человек – существо недальновидное, но промысловатое, рождаются идеи как бы не просто углекислый газ из атмосферы забирать, но ещё что-то полезное из этого делать, что можно хорошо продать и тем самым покрыть расходы на это производство, да еще и наварить немного.
Получить пока из CO2 ничего особенного не удалось, но саму эту идею удалось хорошо продать политикам разных стран и чиновникам международных организаций так, что исследования в этой области в последние 10 лет стали финансировать не просто щедро, а прямо баснословно щедро.
В научных журналах последних 10 лет просто глаза рябит от статей про новые реакции из CO2, и в начале почти каждой такой статьи будет обязательно написано про благородную цель избавить человечество от медленного поджаривания и одновременное получение ценнейших материалов, лекарств, полимеров, и т.п. Большинство таких исследований производят совершенно комическое впечатление.
Что-то полезное в них подчас действительно получается, но авторы умудряются не замечать двух вещей: мизерных потребностей человечества в предлагаемых продуктах и огромных затрат материалов и энергии на осуществление предлагаемой реакции.
Проблема в том, что CO2 из атмосферы нужно убирать в масштабах десятков гигатонн, а всё производство органической продукции химической промышленности оценивается величинами в сто раз меньшими.
Поэтому даже в совершенно фантастическом варианте, когда вообще все органические материалы будут получать из CO2, количество забранного из атмосферы на эти цели диоксида углерода было бы пренебрежимо мало и на баланс углерода серьёзного влияния бы не оказало.
Точность современных оценок этого баланса гораздо больше, чем эти количества, и титанических усилий планета наша просто не заметила бы. Но, увы, это ещё не всё. На любой химический процесс тратится очень много энергии и материалов. В расчётах все такие затраты пересчитывают на затраченную энергию, и делают простую оценку, сколько CO2 при этом будет выброшено обратно в атмосферу – это называется “углеродным следом” продукции или процесса. Проблема ведь в том, что энергию до сих пор в основном получают сжиганием ископаемого топлива. Можно просто взять энергетические и топливные балансы крупных стран, чтобы в этом убедиться. Да, когда-нибудь энергию будут получать целиком из возобновляемых источников с нулевым углеродным следом. Но тогда и выброс CO2 в атмосферу уменьшится действительно радикально, планета придёт к новому балансу, и смысла забирать из атмосферы углекислоту не будет.
Очень забавный пример уровня таких рассуждений – часто приводимый пример того, что диоксид углерода уже используется в больших масштабах в промышленности – производство карбамида, то есть мочевины из аммиака и углекислого газа. Это действительно очень крупномасштабный процесс.
И мочевина совершенно официально считается органическим соединением, и даже более того – первым органическим соединением, полученным синтезом из более простых, официально неорганических соединений. Считается, что именно с этой реакции, реакции Вёлера, идёт вся органическая химия как наука.
Это всё очень трогательно, если забыть, для чего используется получаемая таким образом мочевина. Но – это удобрение, азотное удобрение, очень хорошее. И первое, что с ним происходит, когда оно попадает в почву – расщепление микроорганизмами на ион аммония и – диоксид углерода.
Это Бог дал – Бог и взял. А у нас всё наоборот – углекислый газ взяли – углекислый газ и отдали. Ну, хоть растения растут, но CO2 вернулся в атмосферу.
На самом деле даже в гораздо больших количествах, чем взяли, потому что аммиак, необходимый для этой реакции, образуется очень энергозатратным синтезом Габера-Боша, имеющим очень большой углеродный след.
Всё это безусловно не значит, что заниматься химией CO2 не стоит. Химией вообще заниматься стоит, но именно с целью получения полезных материалов и веществ. Если будет хороший процесс с использованием углекислоты – очень хорошо.
Пока с этим не очень хорошо, но нас должна вдохновлять Природа, которая очень хорошо справляется с CO2 – для неё это основной источник углерода (carbon feedstock) для синтеза всех органических соединений, и это не только фотосинтез, но и довольно многочисленные реакции ферментативного карбоксилирования.
Соединения углерода
Способы получения угарного газа
В промышленности угарный газ получают:
- при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
- паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3:
СН4 + Н2O → СО + 3Н2
- взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3):
СН4 + CO2 → 2СО + 2Н2
- горение углерода в недостатке кислорода (неполное окисление углерода):
2C + O2 → 2CO
- неполное окисление метана:
2СН4 + О2 → 2СО + 4Н2
В лаборатории угарный газ можно получить:
- Нагреванием муравьиной кислоты в присутствии концентрированной серной кислоты:
НСООН → CO + H2O
- Нагреванием щавелевой кислоты в присутствии концентрированной серной кислоты:
- H2C2O4 → CO + CO2 + H2O
- Химические свойства угарного газа
- СО – несолеобразующий оксид
- Формально СО
можно рассматривать как ангидрид муравьиной кислоты, т.к. он образуется при
дегидратации муравьиной кислоты:
- НСООН → CO + H2O
- А также
образование формиата натрия в реакции с гидроксидом натрия при высоком
давлении: - CO + NaOH → HCOONa
- Однако при обычных условиях он не вступает в реакции с
водой, кислотами и щелочами, поэтому относится к типу несолеобразующих оксидов. - Является сильным восстановителем, поэтому реагирует с окислителями:
- Горит синим пламенем в атмосфере кислорода:
2СO + O2→ 2CO2
- Окисляется
хлором в присутствии катализатора или под
действием света с образованием ядовитого газа фосгена:
CO + Cl2 → COCl2
- Окисляется другими сильными окислителями до углекислого газа или
карбонатов:
CO + Na2O2→ Na2CO3
- Восстанавливает
металлы из оксидов (при Т~300 — 1500ºС):
- СО + CuO → Cu + CO2
- СО + NiO → Ni + CO2
- 4CO + Fe3O4→ 3Fe + 4CO2
- Восстановление
водорода из воды в присутствии катализатора Fe, Cr при температуре 400-500 ºС:
СО + Н2О= CO2 + Н2
- Восстановление некоторых благородных металлов из солей:
СО + PdCl2 + Н2О→ Pd + CO2 + 2HCl
- Взаимодействие с водородом при повышенном давлении. Из синтез-газа (смеси угарного газа и водорода) при определенных условиях (P, T, kt) можно получить метанол, метан, или другие углеводороды:
- СО + 2Н2 → СН3ОН
- СО + 3Н2 → СН4 +
Н2О - nСО + (2n+1)Н2 → СnН2n+2 + nН2О
- Образование
карбонилов металлов при
нагревании:
4СO + Ni = [Ni(СO)4]
4СO + Fe = [Fe(СO)5]
- Образование
карбоксигемоглобина при
связывании угарного газа с гемоглобином крови подобно кислороду:
HbO2 + CO = HbCO + O2
Этим свойством СО и объясняется его
высокая токсичность для организма человека.
Диоксид углерода (углекислый газ)
Способы получения углекислого газа
- CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
- Образуется
при действии сильных
кислот на карбонаты
(растворимые и нерастворимые) и гидрокарбонаты
металлов:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HBr → NaBr +H2O +CO2
- При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
2AlCl3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6KCl
- При
термическом разложении нерастворимых
карбонатов и при разложении растворимых гидрокарбонатов:
CaCO3 → CaO + CO2
2NaHCO3 → Na2CO3 + H2O +CO2
- При сжигании всех видов топлив:
СxHy + O2 = H2O + CO2
- При
спиртовом брожении глюкозы под действием ферментов:
- С6H12O6 → 2CO2 + 2C2H5OH
- Химические свойства углекислого газа
- Углекислый
газ — типичный кислотный
оксид. Проявляет слабые окислительные
свойства
- Качественная реакция на углекислый газ — помутнение известковой воды:
Ca(OH)2 + CO2 → CaCO3 + H2O
- Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
CO2 + H2O ↔ H2CO3
- С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
- Na2O + CO2 → 2Na2CO3
- KOH + CO2 → KHCO3
- 2KOH + CO2 → K2CO3+ H2O
- С карбонатами, с образованиемгидрокарбонатов:
Na2CO3 + CO2+ H2O → 2NaHCO3
- С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
C6H5OK + CO2+ H2O → C6H5OH + KHCO3
- С
некоторыми восстановителями:
- CO2 + 3H2 → 2CН3OН + H2O
- CO2 + C → 2CO
- 2Мg +
CO2→C
+ 2MgO
Внимание! Магнийгорит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями.
- В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
nCO2 + mH2O = Cn(H2O)m + nO2
- С пероксидом натрия, с образованием карбоната натрия:
2CO2 + 2Na2O2 → 2Na2CO3 + O2
- Синтез карбамида (мочевины):
CO2 + 2NH3 = CO(NH2)2 + H2O
- Получение питьевой соды по методу Сольвэ:
NaCl + CO2 + NH3 + H2O= NaHCO3 + NH4Cl
Угольная кислота и карбонаты
- Химические свойства угольной кислоты и карбонатов
- Угольная
кислота – слабая двухосновная
кислота - Угольная кислота существует только в водном растворе, где количество ее
молекул и анионов в сотни раз меньше, чем количество растворенных молекул
углекислого газа CO2
- Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
- H2CO3 ↔ H+ + НCO3—
- НCO3— ↔ H+ + CO32-
- H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра) ~ 11,7:
Na2CO3 + H2O = NaOH + NaHCO3
CO32-+ H2O = OH— + HCO3—
- Все
карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более
900ºС) разлагаются до оксида металла и оксида углерода (IV):
- CaCO3 → CaO + CO2
- Карбонат аммония при нагревании разлагается иначе:
- (NH4)2CO3 → 2NH3 + 2H2O + CO2
- Качественной реакцией является взаимодействие с кислотами является на ионы СО32─ и НСО3− в результате которой происходит выделение СО2:
Na2CO3 + 2HCl → 2NaCl +
CO2 ↑ + H2O
- при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
- NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
- CO2 + Сa(OH)2 = CaCO3↓ + H2O
- При дальнейшем пропускании раствор вновь становится прозрачным,
помутнение исчезает: - CaCO3 + CO2 + H2O = Сa(НCO3)2
- Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Na2CO3 + CO2 + H2O = 2NaНCO3
Na2CO3 + HCl → NaНCO3 + NaCl
- Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
НCO3—+ H2O = OH— + H2CO3
- при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
2NaHCO3 → Na2CO3 + CO2 ↑+ H2O
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑+ H2O
Химические свойства оксидов для ЕГЭ 2022
добавить в закладки
Классификация оксидов:
1 группа — несолеобразующие — N2O, NO, CO, SiO.
2 группа — солеобразующие:
- Основные — это такие оксиды, которым соответствуют основания. Оксиды металлов, степень окисления которых +1, +2 : Na2O, CaO, CuO, FeO, CrO. Реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания: 1) щелочные металлы; 2) щелочноземельные металлы; 3) некоторые — CrO, MnO, FeO. Типичные реакции основных оксидов:
- Основный оксид + кислота → соль + вода (реакция обмена).
- Основный оксид + кислотный оксид → соль (реакция соединения)
- Основный оксид + вода → щелочь (реакция соединения).
- Кислотные —— это такие оксиды, которым соответствуют кислоты.Оксиды неметаллов. Оксиды металлов, степень окисления которых > +5: SO2, SO3, P2O5, CrO3, Mn2O7. Реагируют с избытком щелочи с образованием соли и воды. Типичные реакции кислотных оксидов:
- Кислотный оксид + основание → соль + вода (реакция обмена).
- Кислотный оксид + основный оксид → соль (реакция соединения).
- Кислотный оксид + вода → кислота (реакция соединения)
- Амфотерные — это оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Оксиды металлов, степень окисления которых +2, +3, +4: BeO, ZnO, Al2O3, Cr2O3, MnO2. Взаимодействуют как с кислотами так и с основаниями. Реагируют с основными и кислотными оксидами. Амфотерные оксиды с водой непосредственно не соединяются. Типичные реакции амфотерных оксидов:
- Амфотерный оксид + кислота → соль + вода (реакция обмена).
- Амфотерный оксид + основание → соль + вода или комплексное соединение.
Оксид углерода 2 и 4
Оксид углерода(II) в химическом отношении – инертное вещество. Не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa.
- Взаимодействие с кислородом
- При нагревании в кислороде сгорает красивым синим пламенем: 2СО + О2 = 2СО2.
- Взаимодействие с водородом: СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами. При облучении и в присутствии катализатора взаимодействует с галогенами: СО + Cl2 = COCl2 (фосген). и серой СО + S = COS (карбонилсульфид).
- Восстановительные свойства
- СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
- C+2O + CuO = Сu + C+4O2.
- Взаимодействие с переходными металлами
- С переходными металлами образует карбонилы:
- Ni + 4CO = Ni(CO)4;
- Fe + 5CO = Fe(CO)5.
Оксид углерода (IV) (углекислый газ, диоксид углерода, двуокись углерода,угольный ангидрид) — CO2, бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом. Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа: С + СО2 = 2СО.
- Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа: 2Mg + CO2 = 2MgO + C.
- Свойства кислотного оксида
- Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
- Na2O + CO2 = Na2CO3,
- 2NaOH + CO2 = Na2CO3 + H2O,
- NaOH + CO2 = NaHCO3.
Качественна реакция — для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат: CaCO3 + H2O + CO2 = Сa(HCO3)2.
Изучай химические свойства
- кислот,
- металлов и неметаллов,
- солей,
- оснований и амфотерных гидроксидов.
Решай с ответами:
- задание 5 по химии
- задание 7 по химии
- задание 10 по химии






