- Урок 10: Металлы и неметаллы
- Физические свойства металлов
- Физические свойства неметаллов
- Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
- Закономерности в таблице Д.И. Менделеева
- Способы получения металлов
- Химические свойства металлов
- Способы получения неметаллов
- Химические свойства неметаллов
- Коррозия металла
- Химическая коррозия
- Электрохимическая коррозия
- Способы защиты от коррозии
- Биологическая роль металлов и неметаллов
- Применение металлов и неметаллов
- Металлы
- Большая Рнциклопедия Нефти Рё Газа
- § 44. Общие химические свойства металлов
- Ряд активности металлов
Немного углубимся в этот раз в химию: рассмотрим строение атома, расположение электронов, принципы взаимодействия элементов между собой.
Химический элемент – это атомы с одинаковым зарядом ядра. Т.е. каждый химический элемент в таблице Менделеева отличается от предыдущего и последующего своим количеством протонов в ядре.
Если коротко, то атом состоит из электронной оболочки и ядра в центре. Электронную оболочку можно разделить на некоторые части – это энергетические уровни и орбитали.
Энергетический уровень – это слой, где обитают электроны с примерно одинаковыми значениями энергии.
Орбиталь – это место примерного нахождения электрона. Орбитали формируют энергетические уровни.
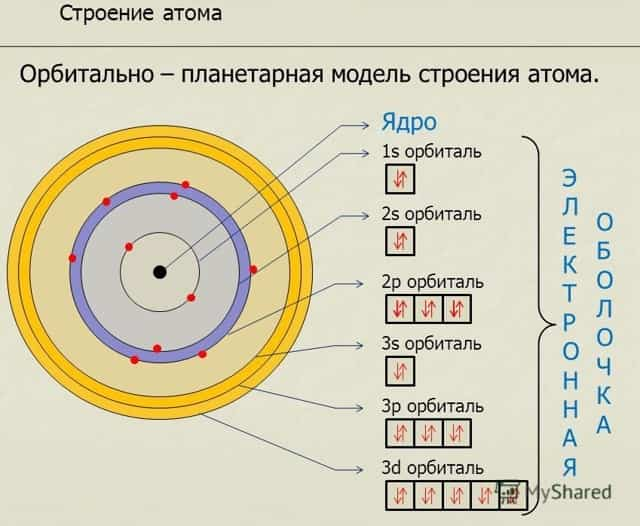
Количество вышеописанных вещей зависит от количества электронов, чем их больше, тем больше уровней и орбиталей. Количество энергетических уровней зависит от номера периода. А каждый уровень может вместить в себя строго определённое количество электронов.
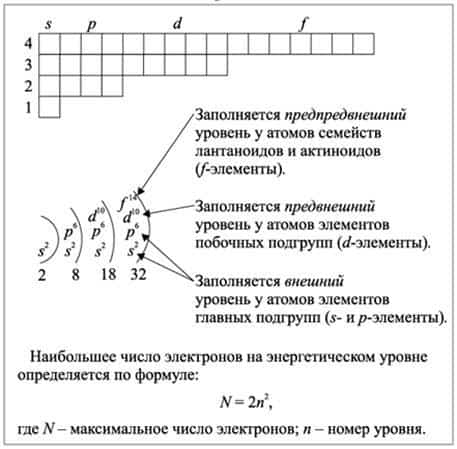
Высчитывается число по следующей формуле – 2n2. 1 уровень (n=1) включает в себя 2 электрона, 1 энергетический уровень и одну орбиталь. 2 уровень – (n=2) это 8 электронов, 2 энергетических уровня и 4 орбитали.
Такое количество орбиталей объясняется тем, что на каждой может летать не больше двух электронов.
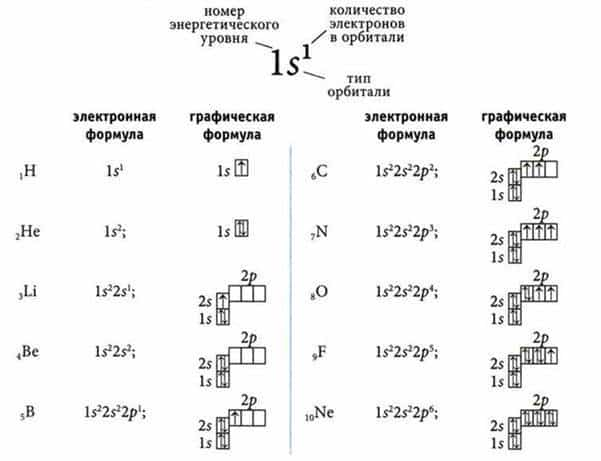
Общий принцип расположения всех электронов такой: «В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром)».
Количество электронов на внешнем энергетическом уровне показывает номер группы.
Очень интересная статья про строение атома, размеры частиц, историю открытия:
https://geektimes.ru/post/295043/
Из-за принципа минимума энергии все атомы стараются сделать так, чтобы на внешнем энергетическом уровне было 8 электронов. Поэтому можем разделить все имеющиеся химические элементы на несколько типов.
Одним легче «отдать» электроны, а другим принять, чтобы получить на внешнем уровне восемь. Те химические элементы, что отдают, называются Металлы. Принимающие – Неметаллы.
Есть особое подразделение неопределившихся, которые выступают за одних или за других – амфотерные металлы.
Теперь поговорим про взаимодействие элементов меж собой.
Как же соединяются неметаллы между собой, если каждый хочет себе забрать электроны у других элементов?
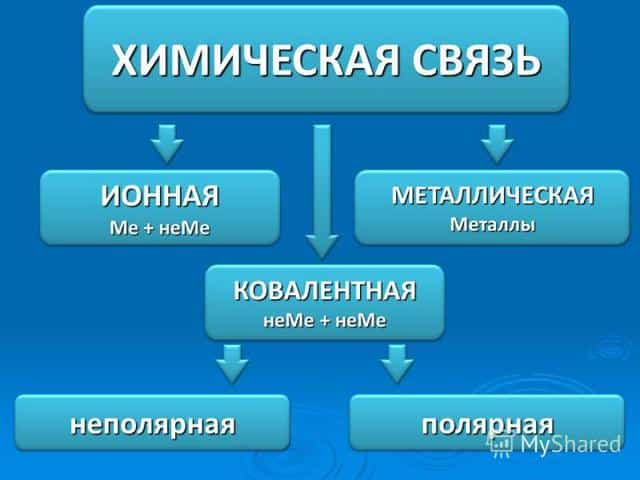
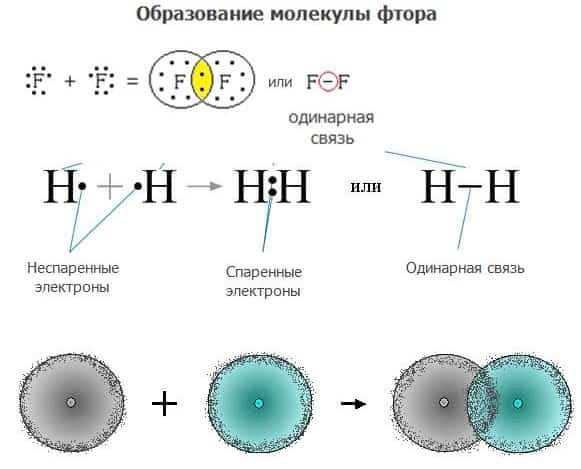
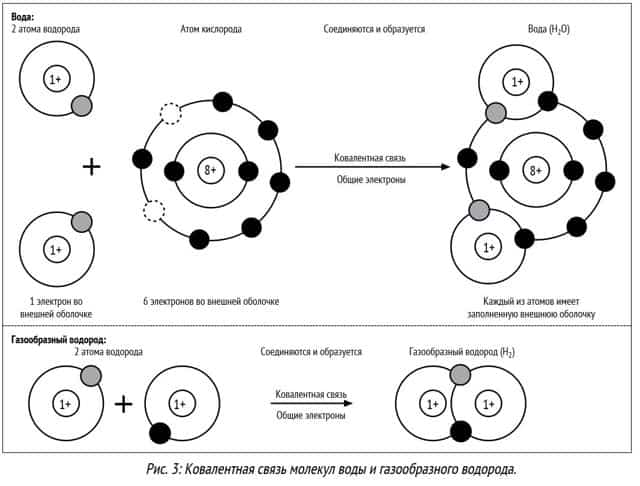
При взаимодействии атомов неметаллов образуется ковалентная связь – когда формируется общая электронная пара. При этой связи элементы заключают некий общий договор, их неспаренные (свободные электроны на внешнем уровне) электроны перемещаются на место объединения и принадлежат как одному атому, так и другому.
Общие электроны могут быть оставаться посередине, на одинаковом отдалении от ядер. Такая связь называется неполярной и образуется при взаимодействии двух одинаковых элементов неметаллов.
Если пара переходит ближе к кому-либо ядру, то связь называют ковалентной полярной. Она возникает при взаимодействии разных элементов неметаллов. Полярность зависит от элетроотрицательности химических элементов.
Электроотрицательность – это способность оттягивать к себе электронные пары. Она зависит от расстояния между ядром и неспаренными электронами, чем меньше радиус атома и больше свободных электронов, тем сильнее тем выше ЭО.
Очень хорошие статьи на этом сайте:
Электроотрицательность. Степень окисления и валентность химических элементов
http://www.hemi.nsu.ru/text134.htm
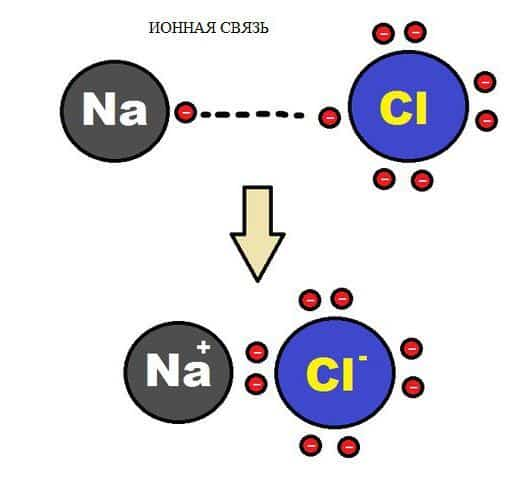
Ионная связь – это взаимодействие ионов между собой, т.е. положительно и отрицательно заряженных атомов. Это связь между металлом и неметаллом.
Металл отдаёт свой электрон и заряжается положительно, а неметалл принимается электрон и заряжается отрицательно. Разноимённые заряды притягиваются друг к другу.
На самом деле, никаких плюсов и минусов нет. Мы придумали такие названия, исходя из свойств частиц, особенностей их взаимодействия.
Огромное спасибо за внимание!
Урок 10: Металлы и неметаллы
- План урока:
- Физические свойства металлов
- Физические свойства неметаллов
- Способы получения металлов
- Химические свойства металлов
- Способы получения неметаллов
- Химические свойства неметаллов
- Коррозия металла
- Биологическая роль металлов и неметаллов
- Применение металлов и неметаллов
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.

Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.

Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
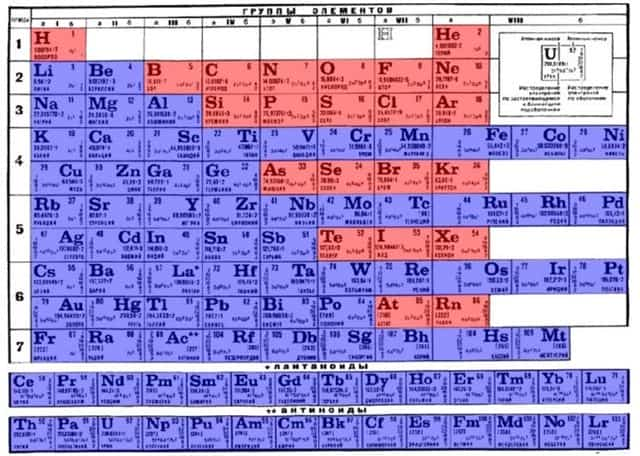
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
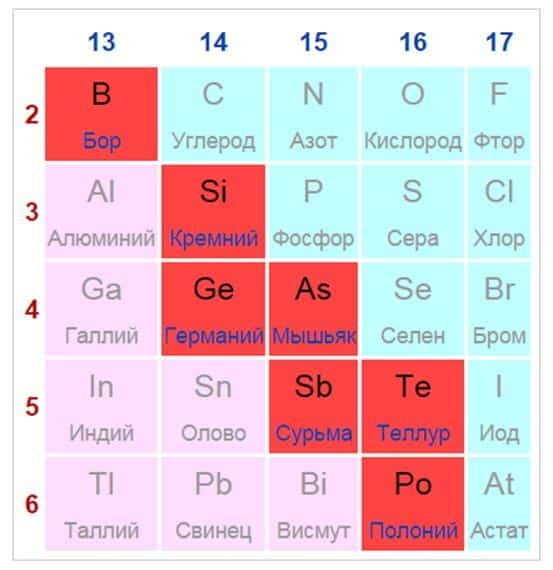
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.

Способы получения металлов
- Большую часть металлов получают из оксидов при нагревании.
- Fe2O3 + 3 CO →2 Fe + 3 CO2
- MnO2 + 2 C → Mn + CO2
- Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
- NaCl → Na+ + Cl-
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.

- Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
- 4 Li + O2→ 2 LiO2
- 3 Mg + N2 → Mg3N2
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
- 2 Ca + MnO2 → 2 CaO + Mn(нагревание)
- Mg + H2SO4(разб)→MgSO4 + H2
- Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
- Fe + CuSO4→ Cu + FeSO4
- Cu + 2 AgNO3→ 2 Ag + Cu(NO3)2
- Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Ca + 2 H2O →Ca(OH)2 + H2
Способы получения неметаллов
- Неметаллы синтезируют из природных соединений с помощью электролиза.
- 2 KCl → 2 K + Cl2
- Также неметаллы получают в результате окислительно-восстановительных реакций.
- SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
- Неметаллы вступают в реакции со следующими веществами.
- 3 F + 2 Al → 2 AlF3 (нагревание)
- S + Fe →FeS (нагревание)
- 2 F2 + C → CF2 (нагревание)
- S + O2→ SO2(нагревание)
- 4 F2 + CH4→CH3F + HF
- 3 O2 + 4 NH3→ 2 N2 + 6 H2O
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
4 H2 + Fe3O2 → 3 Fe + 4 H2O
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.

Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
3 Fe + 2 O2 → Fe3O4
2 Fe + 3 Cl2 → 2 FeCl3
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe2+ — 2e → Fe0
Катод: 2H+ + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.
Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор.
Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе.
Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами.
Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
- Любой гидроксид содержит гидроксидные группы – OH.
- Слева направо:
- а. Радиус атомов уменьшается;
- б. Заряд ядра увеличивается;
- в. Электроотрицательность увеличивается;
- г. Число электронов на внешнем слое увеличивается;
- д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Поэтому:
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть.
Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая.
Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
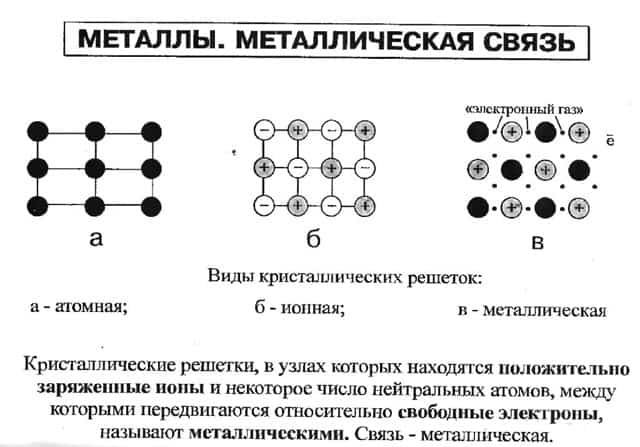
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи.
Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке.
Атомы металла легко отдают валентные электроны и превращаются в положительные ионы.
Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова.
В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается.
Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
- Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
- 2. Альдегиды
- Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Большая Рнциклопедия Нефти Рё Газа
Cтраница 4
Атомы металлов в химических реакциях способны лишь отдавать электроны и быть восстановителями. [46]
Атомы металлов сравнительно легкр отдают валентные электроны и переходят в положительно заряженные ионы.
Поэтому металлы являются восстановителями.
В этом, собственно, и состоит их главное и наиболее общее химическое свойство. [47]
Атомы металлов чаштрихопаны вертикальными линиями. [48]
Атомы металлов РјРѕРіСѓС‚ только отдавать, РЅРѕ РЅРµ принимать электроны — проявлять только электроположительную валентность.
Но наиболее общее химическое свойство металлических элементов, отличающее их от неметаллических, заключается в способности металлов образовывать свободные ( хотя и гидратированные) положительные ионы. [50]
Атомы металлов присоединять электроны не могут, они обладают только восстановительными свойствами. Поэтому металлы часто называют элементами-восстановителями. [51]
Атом металла может находиться точно в экваториальной плоскости, но может и быть вне ее. [52]
Атомы металлов восьмой группы имеют во внешнем слое не больше двух электронов.
В соединениях они чаще всего проявляют электроположительную валентность 3 и 4, более высокая валентность наблюдается редко.
Высшая положительная валентность 8 известна только для осмия и рутения. [53]
Атомы металла РІРѕ фталоцианинах связаны весьма прочно; фталоциашш меди, например, возгоняется РїСЂРё 500 — 600, растворяется РІ ЕЫСОКОКР�РџРЇР©Р�РҐ органических растворителях Рё может быть таким СЃРїРѕСЃРѕР±РѕРј перекристаллизован. Фталоцианин железа способен разлагать каталитически перекись РІРѕРґРѕСЂРѕРґР°. Фталоцианины являются очень прочными Рё красивыми красителями. РћРЅРё находят применение РІ лакокрасочной промышленности Рё, особенно, для цветной печати. [54]
Атомы металла РІРѕ фталоцианинах связаны весьма прочно; фталоцианин меди, например, возгоняется РїСЂРё 500 — 600, растворяется РІ высококипящих органических растворителях Рё может быть таким СЃРїРѕСЃРѕР±РѕРј перекристаллизован. Фталоцианин железа способен разлагать каталитически перекись РІРѕРґРѕСЂРѕРґР°. Фталоцианины являются очень прочными Рё красивыми красителями. РћРЅРё находят применение РІ лакокрасочной промышленности Рё, особенно, для цветной печати. [55]
Атомы металла в таких комплексах соединены через атомы галоида, а не через группы СО. [56]
Атомы металлов образуют кристаллическую решетку, в узлах которой, кроме нейтральных атомов, находятся также положительно заряженные ионы, образовавшиеся в результате потери валентных электронов частью атомов. Оторвавшиеся от атомов электроны перемещаются по всему объему металла и не принадлежат какому-либо определенному атому. Благодаря наличию легко перемещающихся электронов металлы хорошо проводят электричество и тепло. Лучшими проводниками тепла и электричества являются серебро, медь и алюминий. [57]
Атомы металлов, как уже указывалось ( § 25), при химических превращениях легко отдают свои валентные электроны, превращаясь при этом в положительно заряженные ионы.
�оны типичных металлов всегда заряжены положительно.
Наиболее легко отдают СЃРІРѕРё валентные электроны РїСЂРё химических взаимодействиях атомы так называемых щелочных металлов — лития Li, натрия Na, калия Рљ, СЂСѓР±РёРґРёСЏ Rb Рё цезия Cs.
Наоборот, для атомов неметаллов более характерна способность присоединять к себе электроны от других атомов. [58]
Страницы: 1 2 3 4
§ 44. Общие химические свойства металлов
Общие химические свойства металлов
По химическим свойствам металлы являются восстановителями, так как легко отдают свои электроны атомам неметаллов, превращаясь в положительно заряженные ионы — катионы.
Способность атомов металлов отдавать, а их катионов — присоединять электроны может служить мерой их химической активности.
Так, алюминий на воздухе очень быстро покрывается оксидной плёнкой, а с золотом заметных изменений не происходит. Цинк активно взаимодействует с соляной кислотой, а серебро — нет.
Поэтому алюминий и цинк можно отнести к активным металлам, а золото и серебро — к неактивным.
Ряд активности металлов
Химическую активность разных металлов легко сопоставить, анализируя их поведение в водных растворах солей и кислот.
Например, если в раствор сульфата меди(II) опустить цинковую пластинку или железный гвоздь, то практически сразу же на их поверхности появляется красноватый налёт меди.
Это свидетельствует о том, что цинк и железо вытесняют медь из раствора. Эти процессы можно представить следующими уравнениями:
- Zn + CuSО4 = ZnSО4 + Сu↓,
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Fe + CuSО4 = FeSО4 + Сu↓,
- Fe0 + Cu2+ = Fe2+ + Сu0.
В этих реакциях цинк и железо отдают свои электроны ионам меди, то есть они окисляются. Ионы меди принимают электроны, поэтому медь восстанавливается.
Если поступить наоборот и в раствор сульфата цинка поместить медную пластинку, то на ней не произойдёт осаждения цинка. В чём тут причина?
Экспериментальным путём, изучая способность одних металлов вытеснять другие из водных растворов их солей, русский учёный Н. Н. Бекетов расположил металлы в ряд. В нём металлы, находящиеся левее, способны восстанавливать последующие из растворов их солей. Поскольку эта способность металлов связана с их восстановительной активностью, то этот ряд получил название ряда активности металлов.
Ряд активности металлов
Li K Ba Sr Cа Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H2) Cu Hg Ag Pd Pt Au
Чем левее в этом ряду расположен металл, тем большими восстановительными свойствами в водном растворе он обладает, то есть легче отдаёт свои электроны окислителю и переходит в виде катиона в раствор; тем труднее катион этого металла восстанавливается. Цинк и железо легче отдают свои электроны, чем медь, и поэтому восстанавливают Cu2+ из раствора.
- По положению цинка в ряду активности можно прогнозировать, что этот металл способен восстановить из раствора ионы олова, меди и серебра:
- Zn0 + Sn2+ = Zn2+ + Sn0;
- Zn0 + Сu2+ = Zn2+ + Cu0;
- Zn0 + 2Ag+ = Zn2+ + 2Ag0.
- В то же время медь будет восстанавливать только ионы серебра, но не восстановит ионы олова:
- Cu0 + 2Ag+ = Cu2+ + 2Ag0.
Это означает, что цинк обладает большей восстановительной способностью. Он легче отдаёт электроны, чем олово, медь и серебро. Поэтому цинк считается более активным металлом, чем эти металлы. В свою очередь, медь — более активный металл, чем серебро.
Ряд активности металлов позволяет не только прогнозировать поведение металлов в реакциях с растворами солей, но и сравнивать их отношение к воде, растворам кислот, а также к неметаллам и ряду других веществ.
Так, слева от водорода расположены металлы, которые вытесняют водород из воды и кислот (то есть восстанавливают ионы водорода Н+). Металлы, расположенные справа от водорода, такой восстановительной активности в реакциях с растворами кислот не проявляют. Например, цинк реагирует с соляной кислотой, вытесняя водород:
- Zn + 2НСl = ZnCl2 + Н2↑,
- Zn0 + 2Н+ = Zn2+ + ,
- а серебро водород не вытесняет.
Взаимодействие металлов с простыми и сложными веществами
К общим химическим свойствам металлов относят их реакции с неметаллами, водой, кислотами, солями. Для некоторых металлов также характерны реакции с растворами щелочей. Часть металлов вступает в реакции с органическими веществами.
Многие перечисленные взаимодействия вам известны из предыдущих глав пособия. Кроме того, вы изучали химические свойства металлов в 9-м классе. Поэтому на данном этапе обучения мы систематизируем известные вам свойства, составив таблицу 31.
Таблица 31. Общие химические свойства металлов
| Реагенты и уравнения реакций | Особенности взаимодействия с металлами |
| Неметаллы | Образуют бинарные соединения: оксиды, гидриды, нитриды, галогениды. Реакции протекают как при обычных условиях, так и при нагревании |
|
Вода |
|
|
Щелочные металлы реагируют с кислотами-окислителями HNO3(конц), H2SO4(конц) со взрывом. Pb пассивируется в разбавленных HCl, H2SO4. Напомним, что при взаимодействии металлов с кислотами-окислителями HNO3(конц) и H2SO4(конц) водород не выделяется, а образуются продукты восстановления азота и серы |
|
В водных растворах металлы s-элементов, обладая сильными восстановительными свойствами, вытесняют из воды водород, а не ионы менее активных металлов из солей. Остальные металлы реагируют в соответствии с положением в ряду активности |
| Растворы щелочей | В такие реакции вступают цинк, алюминий, бериллий |
Отметим, что с водой при нормальных условиях взаимодействуют все металлы s-элементов, кроме бериллия и магния. Магний реагирует с водой при нагревании. Алюминий взаимодействует с водой при комнатной температуре, но только после удаления с его поверхности плёнки оксида алюминия.
При этом образуются гидроксиды металлов. Остальные металлы от марганца до водорода в ряду активности взаимодействуют с парами воды при нагревании, образуя, как правило, оксиды металлов. Металлы, находящиеся в ряду напряжений после водорода, не взаимодействуют с водой ни при каких условиях.
Активные металлы (Na, K) вступают в реакции с карбоновыми кислотами, спиртами, фенолами.
Положение металла в ряду активности металлов позволяет прогнозировать его поведение в окислительно-восстановительных реакциях, протекающих в водных растворах.
Атомы металлов во всех химических превращениях являются восстановителями.
Металлы в химических превращениях являются восстановителями и легко отдают свои электроны, превращаясь в положительно заряженные ионы — катионы.
Активность металлов в окислительно-восстановительных реакциях, протекающих в водных растворах, определяется по их положению в ряду активности: чем левее в этом ряду расположен металл, тем большими восстановительными свойствами он обладает и тем труднее катионы этого металла восстанавливаются.
Более активные металлы восстанавливают менее активные металлы из растворов их солей. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из разбавленных кислот (кроме азотной). Металлы s-элементов, за исключением бериллия и магния, вытесняют водород из воды при обычной температуре.
- Назовите характерные для металлов физические свойства.
- Перечислите p-элементы, которые относятся к элементам-металлам.
- Расставьте коэффициенты в уравнении реакции методом электронного баланса: Cu + HNO3(разб) → Cu(NO3)2 + NO↑ + H2O.
- Составьте уравнения возможных химических реакций с учётом, что медь окисляется до степени окисления +2:
- а) Ag + НСl →; б) Сu + Hg(NО3)2 → ;
- в) Mg + H2SО4(pазб) →; г) Ni + NaCl → ;
- д) Zn + АgNО3 → ; е) Au + H2O → .
- Составьте уравнения реакций взаимодействия цинка с неметаллами (O2, P), кислотами (разбавленными HCl, H2SO4), с растворами щелочей (NaOH, KOH), с солями (AgNO3, Pb(NO3)2).
- Цинк массой 1,3 г растворили в концентрированном растворе гидроксида натрия. Рассчитайте объём выделившегося газа.
- Составьте уравнения реакций, которые могут протекать на поверхности активного металла, например лития, на воздухе.
- Укажите, как изменится масса цинковой пластинки (увеличится, уменьшится, не изменится) при погружении её на небольшое время в раствор: 1) серной кислоты; 2) гидроксида натрия; 3) сульфата магния; 4) сульфата меди(II); 5) нитрата серебра(I).
- Определите объём водорода, который выделится при взаимодействии 260 г цинка с раствором серной кислоты объёмом 250 см3. Массовая доля H2SO4 равна 15 %, плотность — 1,1 г/см3.
- Железную пластинку массой 90 г погрузили в раствор медного купороса. Через некоторое время её вынули, промыли, высушили и взвесили. Масса стала равна 92,4 г. Определите массу прореагировавшего железа и массу меди, осевшей на пластинке.
*Самоконтроль
1. В порядке увеличения восстановительной активности металлы расположены в ряду:
- а) Mg, Ca, Na;
- б) Cu, Ag, Hg;
- в) Cа, K, Cs;
- г) Zn, Al, Pb.
2. Реагируют с растворами щелочей:
- а) Zn;
- б) Ca;
- в) Al;
- г) Be.
3. Реагируя с парами воды, образуют оксиды:
- а) Li;
- б) Ag;
- в) Fe;
- г) Zn.
4. Масса цинковой пластинки увеличится при погружении её в раствор:
- а) Hg(NO3)2;
- б) Cu(NO3)2;
- в) AgNO3;
- г) HNO3.
5. На растворение 13 г цинка требуется раствор, содержащий гидроксид натрия массой (г):
- а) 40;
- б) 20;
- в) 16;
- г) 4.






