- Атом и молекула неона. Формула неона. Строение атома неона:
- Изотопы и модификации неона:
- Свойства неона (таблица): температура, плотность, давление и пр.:
- Физические свойства неона:
- Химические свойства неона. Взаимодействие неона. Химические реакции с неоном:
- Получение неона:
- Применение неона:
- Что такое неон? Особенности химического элемента и его свойства как простого вещества :
- Что такое неон?
- История открытия
- Свойства
- Распространение в природе
- Как его получают?
- Сферы использования
- Неон, свойства атома, химические и физические свойства
- Общие сведения:
- Свойства атома неона:
- Химические свойства неона:
- Физические свойства неона:
- Кристаллическая решётка неона:
- Дополнительные сведения:
- Примечание:
- Источники:
- Неон
- Происхождение названия
- Распространённость
- Во Вселенной
- Земная кора
- Определение
- Физические свойства
- Химические свойства
- Изотопы
- Применение
- Физиологическое действие
- Неон
- Немного из истории открытия неона
- Свойства неона
- Применение неона
- Получение неона
Ne 10 Неон
20,1797(6) 1s2 2s2 2p6
Неон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 10. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), втором периоде периодической системы.
Атом и молекула неона. Формула неона. Строение атома неона
- Изотопы и модификации неона
- Свойства неона (таблица): температура, плотность, давление и пр.
- Физические свойства неона
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном
Получение неона
Применение неона
Таблица химических элементов Д.И. Менделеева
Атом и молекула неона. Формула неона. Строение атома неона:
Неон (лат. Neon, от греч. νέος – «новый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ne и атомным номером 10. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), втором периоде периодической системы.
Неон – неметалл. Относится к группе инертных (благородных) газов.
- Неон обозначается символом Ne.
- Как простое вещество неон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
- Молекула неона одноатомна.
- Химическая формула неона Ne.
Электронная конфигурация атома неона 1s2 2s2 2p6. Потенциал ионизации (первый электрон) атома неона равен 2080,66 кДж/моль (21,564540(7) эВ).
Строение атома неона. Атом неона состоит из положительно заряженного ядра (+10), вокруг которого по двум оболочкам движется 10 электронов. При этом 2 электрона находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку неон расположен во втором периоде, оболочек всего две.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома неона на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома неона состоит из 10 протонов и 10 нейтронов.
Неон относится к элементам p-семейства.
Радиус атома неона (вычисленный) составляет 38 пм.
Атомная масса атома неона составляет 20,1797(6) а. е. м.
Неон – пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Содержание неона в земной коре составляет 3,0×10-7 %, в морской воде и океане – 1,2×10-8 %.
Неон – химически инертный химический элемент.
Неон, свойства атома, химические и физические свойства
Изотопы и модификации неона:
Свойства неона (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Неон |
| 102 | Прежнее название | |
| 103 | Латинское название | Neon |
| 104 | Английское название | Neon |
| 105 | Символ | Ne |
| 106 | Атомный номер (номер в таблице) | 10 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Моррис Уильям Траверс, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,0014 % |
| 119 | Содержание в земной коре (по массе) | 3,0·10-7 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,13 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 20,1797(6) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 |
| 203 | Электронная оболочка | K2 L8 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 38 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус | 58 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 154 пм |
| 209 | Электроны, Протоны, Нейтроны | 10 электронов, 10 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | |
| 302 | Валентность | |
| 303 | Электроотрицательность | 4,4 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 2080,66 кДж/моль (21,564540(7) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | -116(19) кДж/моль (-1,2(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,00090035 г/см3 (при 0 °C и 101,325 кПа, состояние вещества – газ),
|
| 402 | Температура плавления* | -248,59 °C (24,56 K, -415,46 °F) |
| 403 | Температура кипения* | -246,046 °C (27,104 K, -410,883 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,335 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 1,71 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| 411 | Молярный объём | 22,42 см³/моль |
| 412 | Теплопроводность | 0,0491 Вт/(м·К) (при стандартных условиях), 0,0493 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная  |
| 513 | Параметры решётки | 4,430 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 63 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS |
- Примечание:
- 401* Плотность неона согласно [1] составляет 1,207 г/см3 (при -246,046 °C и иных стандартных условиях, состояние вещества – жидкость).
- 402* Температура плавления неона согласно [3] составляет -248,6 °C (24,55 K, -415,48 °F).
- 403* Температура кипения неона согласно [3] составляет -246,05 °C (27,1 K, -410,89 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) неона согласно [4] составляет 0,33 кДж/моль.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) кислорода согласно [3] и [4] составляет 1,74 кДж/моль и 1,79 кДж/моль соответственно.
Физические свойства неона:
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном:
Получение неона:
Применение неона:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
неон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле неона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Что такое неон? Особенности химического элемента и его свойства как простого вещества :
Химический элемент неон широко распространен во Вселенной, а вот на Земле он считается довольно редким. Тем не менее, его научились получать и без визитов в открытый космос, и теперь его применяют в промышленности, для изготовления радио- и фототехники, а также для глубоководного дайвинга. Что такое неон? Какими свойствами и особенностями он обладает? Об этом мы и поговорим.
Что такое неон?
В Периодической таблице Менделеева этот элемент располагается в восьмой группе под номером десять. Он обозначается символом Ne. В качестве простого вещества он представляет собой одноатомный газ, который не имеет запаха, цвета и вкуса.
Он существует в виде трех изотопов 20Ne, 21Ne и 22Ne, стабильных по своей природе. Чаще всего встречается именно нуклид 20Ne. В атмосфере нашей планеты его распространенность составляет почти 90%, а то время как у изотопа 22Ne – 9,25 %, а у изотопа 21Ne – только 0,27 %.
Последние два изотопа образуются в основном благодаря космическому излучению, которое воздействует на ядра натрия, кремния, алюминия и других элементов. Именно поэтому на Земле они чаще всего присутствуют в воздухе, а не в воде или земной коре. Источник образования на нашей планете Неона-20 до сих пор не известен.
Кроме этих изотопов, известно выделяют около 16 нестабильных нуклидов с периодом распада от 9 зептосекунд до 3,38 минуты.
История открытия
О том, что такое неон, стало известно только в конце XIX века. До этого наука открыла лишь два инертных газа – аргон и гелий, занимающих первый и третий периоды таблицы Менделеева.
При этом место второго периода оставалось пустым, поэтому исследователи предполагали о существовании в природе, как минимум еще одного подобного вещества. В 1997 году шотландский химик Рамзай даже посвятил ему доклад, который так и назывался «Неоткрытый газ».
А уже в следующем году ему посчастливилось обнаружить недостающий элемент.
Чтобы найти его, ученый анализировал гелий и арагон, изучал состав минералов, но успех пришел, когда тот обратился к воздуху.
Он сжижал и медленно испарял газовую смесь, а затем по фракциям пропускал ее через специальную разрядную трубку с электрическим током.
Неоткрытое вещество должно было иметь свойства близкие к гелию, поэтому Рамзай надеялся обнаружить его в самой легкой фракции, которая испарится раньше всего.

Так и произошло. Взаимодействуя с электронами в трубке, первая фракция воздуха начала светиться, и рядом со спектром гелия и аргона ученый увидел и другие линии. Они стали подтверждением того, что существования ранее неизвестного газа. Открытому элементу Рамзай дал греческое название «неон», что в переводе означает «новый».
Свойства
О том, что такое неон, лучше всего судить исходя из его физических и химических свойств. Этот газ является одним из самых легких. Его плотность составляет 0,0089999 г/см³. Закипает он при температуре −246,05 °C, а плавится при −248,6 °C.
Неон практически не реагирует с другими веществами. Он с трудом отдает или присоединяет к себе электроны, поэтому его относят к благородным газам. По инертности с ним может сравниться только гелий. До сих пор не удалось получить ни одного его валентного соединения. Он слабо растворяется в воде, но неплохо адсорбируется активированным углем.
Как и другие благородные газы, он обладает хорошей электропроводностью. Если провести через него ток высокого напряжения – он начнет светиться. В спектре газа насчитывается около 900 линий разных цветов, но самые яркие из них – красные и оранжевые.
Такое свойство неона нашло широкое применение в сфере наружной рекламы. Уже через двенадцать лет после его открытия на улицах стали появляться красные светящиеся вывески с названиями магазинов и кафе.
Первый патент на них оформила компания Claude Neon Lights Inc.

Распространение в природе
Неон, или Ne, можно назвать внеземным газом, ведь в открытом космосе и на других астрономических объектах его гораздо больше, чем на нашей планете. Особенно много его в атмосфере Урана, Нептуна, Сатурна, Юпитера, в туманностях и очень горячих звездах. Кроме того, он содержится в метеоритах и других космических телах.

Во всей Вселенной газ занимает пятое место по распространенности, уступая пальму первенства водороду, гелию, кислороду и углероду. Его содержание по массе составляет примерно 0,13 % по массе.
На Земле он считается редким элементом. В земной коре его содержится около 7·10−9 %, примерно 2·10−8 % — в водах океана и соленых водоемах. Наибольшая концентрация этого химического элемента наблюдается в атмосфере планеты, там его содержание составляет 1,82·10−3 % по объему.
Как его получают?
Из-за небольшой распространенности неона в горных породах и воде, его основным источником является атмосферный воздух. Из него газ получают при помощи сильного охлаждения. При температуре жидкого азота неон кристаллизуется и легко отделяется от гелия, который при этом остается в газообразном состоянии.

Его также получают в качестве побочного продукта, во время добычи из воздуха азота и кислорода. В таком случае, для отделения газа используют адсорбции активированным углем. Для определения неона обычно применяется спектральное излучение или хроматографический анализ.
Сферы использования
Химический элемент неон до сих пор применяется в вывесках и рекламных баннерах, при этом для получения разных цветов его смешивают и с другими веществами. Вместе с гелием он используется при изготовлении лазеров, самостоятельно – для производства фотоаппаратуры.

Жидкий неон обладает лучшей теплоемкостью, чем гелий, и стоит гораздо дешевле. Вместе с водородом его применяют в качестве хладагента для различных холодильных установок.
Криогенные камеры на основе этих газов необходимы в медицине для замораживания живых тканей.
Смесь неона и гелия используется для облегчения состояния пациентов с затруднением дыхания, для этого ее распространяют в комнатах которые наполняют безазотным воздухом.
Неон, свойства атома, химические и физические свойства
Ne 10 Неон
20,1797(6) 1s2 2s2 2p6
Неон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 10. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), втором периоде периодической системы.
- Общие сведения
- Свойства атома неона
- Химические свойства неона
- Физические свойства неона
- Кристаллическая решётка неона
- Дополнительные сведения
Таблица химических элементов Д.И. Менделеева
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Неон |
| 102 | Прежнее название | |
| 103 | Латинское название | Neon |
| 104 | Английское название | Neon |
| 105 | Символ | Ne |
| 106 | Атомный номер (номер в таблице) | 10 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Моррис Уильям Траверс, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,0014 % |
| 119 | Содержание в земной коре (по массе) | 3,0·10-7 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,13 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) |
Свойства атома неона:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 20,1797(6) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 |
| 203 | Электронная оболочка | K2 L8 M0 N0 O0 P0 Q0 R0 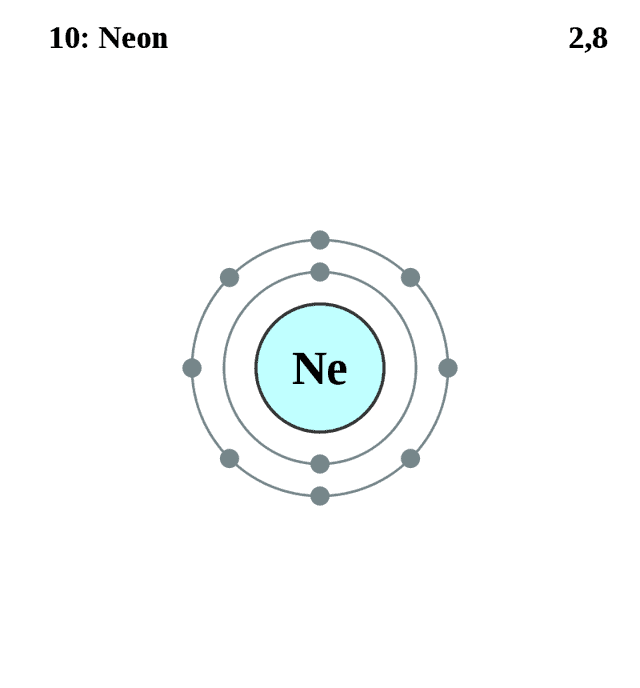 |
| 204 | Радиус атома (вычисленный) | 38 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус | 58 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 154 пм |
| 209 | Электроны, Протоны, Нейтроны | 10 электронов, 10 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения |
Химические свойства неона:
Физические свойства неона:
| 400 | Физические свойства | |
| 401 | Плотность* | 0,00090035 г/см3 (при 0 °C и 101,325 кПа, состояние вещества – газ),
|
| 402 | Температура плавления* | -248,59 °C (24,56 K, -415,46 °F) |
| 403 | Температура кипения* | -246,046 °C (27,104 K, -410,883 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,335 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 1,71 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| 411 | Молярный объём | 22,42 см³/моль |
| 412 | Теплопроводность | 0,0491 Вт/(м·К) (при стандартных условиях), 0,0493 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура* | |
| 416 | Критическое давление* | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Кристаллическая решётка неона:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная  |
| 513 | Параметры решётки | 4,430 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 63 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Дополнительные сведения:
| 900 | Дополнительные сведения |
| 901 | Номер CAS |
Примечание:
* — доступно в платной версии.
Источники:
[know]
Таблица химических элементов Д.И. Менделеева
Неон
Неон (Ne, лат. neon) — химический элемент 18-й группы (по устаревшей классификации — элемент главной подгруппы VIII группы) второго периода периодической системы с атомным номером 10.
Пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Как простое вещество представляет собой инертный одноатомный газ без цвета и запаха. Обнаружен (наряду с ксеноном и аргоном) в 1898 году путём вывода из жидкого воздуха водорода, кислорода, аргона и углекислого газа.
Неон открыли в июне 1898 года английские химики Уильям Рамзай и Морис Траверс. Они выделили этот инертный газ «методом исключения» после того, как кислород, азот, аргон и все более тяжёлые компоненты воздуха были сжижены. В декабре 1910 года французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
Происхождение названия
Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Распространённость
Во Вселенной
В мировой материи неон распределён неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе.
Наибольшая концентрация неона наблюдается на Солнце и других горячих звёздах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна.
В атмосфере многих звёзд неон занимает третье место после водорода и гелия.
Земная кора
Из всех стабильных элементов второго периода неон — самый малораспространённый на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82⋅10−3% по объёму, а его общие запасы оцениваются в 7,8⋅1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объёме воздуха содержится только 5,2 см³ гелия).
Среднее содержание неона в земной коре мало − 7⋅10−9% по массе. Всего на нашей планете около 6,6⋅1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу.
В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
Определение
Качественно неон определяют по спектрам испускания (характеристические линии 585,25 нм и 540,05 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа.
Физические свойства
Свечение неона в газоразрядной трубке.
- Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
- Инертные газы обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятся, в частности, неон — огненно-красным светом, так как самые яркие его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до инфракрасных линий. Линии, находящиеся в невидимых глазом участках спектра, изображены белым цветом).
- Насыщенность внешних электронных оболочек атомов инертных газов обусловливает более низкие точки сжижения и отвердевания, чем у других газов с близкими молекулярными массами.
Химические свойства
Все благородные газы имеют завершённую электронную оболочку, поэтому они химически инертны. Химическая инертность неона исключительна, в этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения.
Даже так называемые клатратные соединения неона с водой (Ne·6H2O), гидрохиноном и другими веществами (подобные соединения тяжелых благородных газов — радона, ксенона, криптона и даже аргона — широко известны) получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Изотопы
Основная статья: Изотопы неона
Существует три стабильных изотопа неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %).
Кроме трёх стабильных нуклидов неона, существует ещё шестнадцать нестабильных изотопов. Повсеместно преобладает лёгкий 20Ne.
Во многих альфа-активных минералах относительное содержание тяжелых 21Ne и 22Ne в десятки и сотни раз больше содержания их в воздухе.
Это вызвано тем, что основными механизмами образования этих изотопов являются ядерные реакции, происходящие при бомбардировке ядер алюминия, натрия, магния и кремния продуктами распада ядер тяжёлых элементов.
Кроме того, подобные реакции происходят в земной коре и атмосфере под воздействием космического излучения.
Зафиксирован также ряд малопродуктивных ядерных реакций, при которых образуются 21Ne и 22Ne — это захват альфа-частиц ядрами тяжёлого кислорода 18O и фтора 19F:
818O + 24He → 1021Ne + 01n 919F + 24He → 1022Ne + 11H
- Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не установлен.
- Обычно, Неон-20 образуется в звёздах вследствие альфа-процесса, при котором альфа-частица поглощается ядром атома кислорода
- с излучением гамма-кванта:
816O + 24He → 1020Ne + γ;
Но этот процесс требует температуры более 100 миллионов градусов и массы звезды более трех солнечных.
Вполне возможно, источником изотопа являлась сверхновая, после взрыва которой образовалось газопылевое облако, из части которого сформировалась Солнечная система.
Считается, что в космическом пространстве неон также преимущественно представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne, но эти нуклиды предположительно образуются в самих метеоритах под воздействием космических лучей за время странствий во Вселенной.
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха на крупных промышленных установках. Разделение «неоно-гелиевой» смеси осуществляется несколькими способами за счёт адсорбции и конденсации и низкотемпературной ректификации.
Адсорбционный метод основан на способности неона, в отличие от гелия, адсорбироваться активированным углём, охлаждаемым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом, ректификационный способ основан на разнице температур кипения гелия и азота.
Неон извлекают из воздуха в аппаратах двукратной ректификации жидкого воздуха. Газообразные неон и гелий скапливаются в верхней части колонны высокого давления, то есть в конденсаторе-испарителе, откуда под давлением около 0.
55 МПа подаются в трубное пространство дефлегматора, охлаждаемое жидким N2.
Из дефлегматора обогащенная смесь Ne и Не направляется для очистки от N2 в адсорберы с активированным углем, из которых после нагревания поступает в газгольдер (содержание Ne + He до 70 %); степень извлечения смеси газов 0.5-0.6.
Последнюю очистку от N2 и разделение Ne и Не можно осуществлять либо селективной адсорбцией при температуре жидкого N2, либо конденсационными методами — с помощью жидких H2 или Ne. При использовании жидкого водорода дополнительно проводят очистку от примеси водорода с помощью CuO при 700 °C. В результате получают неон 99,9%-ной чистоты по объёму.
Основным промышленным способом получения неона (в последнее десятилетие) является разделение неоно-гелиевой смеси путём низкотемпературной ректификации — смесь неона и гелия предварительно очищают от примеси азота и водорода (водород выжигают в печи, заполненной катализатором), а азот в низкотемпературных дефлегматорах и в блоке криогенных адсорберов, заполненных активированным углём (уголь охлаждается змеевиками с кипящим в них под вакуумом азотом). После удаления азота неоно-гелиевая смесь сжимается компрессором и поступает в ректификационную колонну (предварительно охлаждаемая до температуры кипящего под вакуумом азота) для разделения. Для понижения температуры охлаждённая смесь дросселируется с 25 МПа до 0,2-0,3 МПа (в зависимости от режима работы установки). В верхней части колонны, из-под крышки конденсатора, отбирается гелий с примесью до 20 % неона, в нижней части колонны в жидком виде получается неон. В качестве холодильного цикла используется дроссельный холодильный цикл с рабочей средой-хладагентом чистым неоном. Ректификационный метод разделения неоно-гелиевой смеси позволяет получить неон чистотой до 99,9999 %.
Промышленные установки по получению неона высокой чистоты построены и успешно эксплуатируются на Украине — г. Мариуполь (предприятие «Ингаз») и г. Одесса (предприятие «Айсблик»), в Российской Федерации — г. Москва.
Применение
Жидкий неон используют в качестве охладителя в криогенных установках. Ранее неон применялся в промышленности в качестве инертной среды, но был вытеснен более дешёвым аргоном. Неоном наполняют газоразрядные лампы, сигнальные лампы в радиотехнической аппаратуре, фотоэлементы, выпрямители. Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелий-неоновый лазер).
Трубки, заполненные смесью неона и азота, при пропускании через них электрического разряда дают красно-оранжевое свечение, в связи с чем они широко используются в рекламе.
По традиции «неоновыми» часто называют также разрядные трубки других цветов, в реальности использующие свечение других благородных газов или флуоресцирующего покрытия (см. справа).
Для получения любых цветов, кроме красного, используют электрический разряд в аргоне с добавлением небольших количеств паров ртути в газоразрядных трубках, изнутри покрытых люминофором нужного цвета свечения, преобразующих ультрафиолетовое излучение разряда в видимый свет, или разряд в смеси других благородных газов.
Неоновые лампы применяются для сигнальных целей на маяках и аэродромах, так как их красный цвет очень слабо рассеивается туманом и мглой.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах не регистрируется, а при повышении давления первыми возникают симптомы «неврологического синдрома высокого давления» (НСВД).
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов, водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Высокая концентрация неона во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии.
Неон
Неон – один из элементов периодической системы химических элементов. Этот инертный газ, относится к группе благородных инертных газов, в которую входят еще ксенон, гелий и аргон. На Земле этот элемент содержится в воздухе атмосферы.
Современная наука оценивает его запасы около 7,1·1011 тонн, это означает, что 1 куб воздуха содержит 16 кубических сантиметров неона. Неон является шестым по распространённости на Земле. Перед ним углерод, кислород, гелий, водород и азот.
Немного из истории открытия неона
История открытия неона уходит в далёкий XIX век.
Открытие этого газа было бы невозможно без двух знаменательных событий, это изобретение в 1859 году метода спектрального анализа и опубликование в 1869 году, русским химиком Менделеевым, периодической системы химических элементов (таблицы).
В опубликованной таблице тогда было всего 63 элемента из известных сейчас 118. Неона тоже не было в этой таблице, а был неоткрытый элемент под номером 10.
Лишь только в 1898 году ученые из Англии — Уильям Рамзай и Моррис Трэверс догадались провести спектральный анализ испаряющихся остатков жидкого воздуха, для того чтобы обнаружить предсказанный Менделеевым элемент под номером 10. В том же году этому элементу было дано название неон, от греческого слова « νέος» — новый, и присвоен символ «Ne».
Свойства неона
Одной из главных особенностей инертных газов является отсутствие вступления их, в какие либо химические реакции с другими элементами таблицы Менделеева. Неон это одноатомный газ, без цвета и запаха, в 1,44 раза легче воздуха, относящийся к группе лёгких инертных газов, куда входят также гелий.
Неон, содержится, в атмосфере воздуха состоящей из трёх из трех изотопов 20Ne, 21Ne и 22Ne с преобладанием 20Ne (90,92%). Этот элемент обладает исключительной химической инертностью, сравнимой только с гелием.
До настоящего времени не удалось получить ни одного соединения неона, с другими элементами таблицы Менделеева Инертность неона обусловлена тем, что он имеет электронную оболочку с восемью электронами на орбитах вокруг ядра атома. Такую оболочку называют завершённой.
Неон обладает низкой абсорбцией и растворимостью в воде, так в 100 граммах воды можно растворить всего лишь 1,56 мг этого газа. Температура его кипения -2460С, а температура плавления -248,60С. При всём этом неон, в отличии от гелия, хорошо абсорбируется активированным углём, который охлаждён жидким азотом.
Тяжёлые инертные газы такие как криптон, аргон и пр. при вдыхании их человеком иди животным оказывают наркотическое действие.
Не лишён этого свойства и неон, только для того что бы появились первые симптомы наркотического опьянения смесь кислорода и неона должна быть под давлением не менее 25кг/см2.
При более низком давлении неон, из-за своей низкой растворяемости в жирах и крови живого организма такого действия не оказывает.
Неон обладает хорошей электропроводностью и свечением яркого красного цвета при пропускании через него электрического тока, при этом насыщенность, оттенки и яркость этого свечения зависят от величины приложенного напряжения и силы протекающего через газ тока. По этому цвету определяют неон при проведении спектрального анализа воздуха.
Применение неона
Ещё относительно недавно свойство неона светиться ярким красным цветом находило применение в газоразрядных лампах, из которых делами красивую рекламу. Но на смену таким лампам пришли светодиодные источники света, как более дешёвые и экономичные.
Неоновая вывеска
Так как неон взрывобезопасен и в сжиженном состоянии тяжелее воды он имеет теплоту испарения больше чем у водорода и гелия, а также малые потери при хранении его в сжиженном состоянии при давлении 150 кн/см2, эти его особенности всё больше и больше находят применение во всевозможной криогенной технике, в качестве хладагента. Так жидким неоном можно создать температуру для хранения ракетного топлива, консервации тканей животных или имитации условий космоса. В химической промышленности применение жидкого неона позволяет проводить реакции прямого синтеза и также получать фториды кислорода.
Малая растворимость неона находит свое применение в неоногелиевых смесях для дыхания, водолазов и больных людей, страдающих заболеваниями органов дыхания.
Применение этих смесей для дыхания позволяет избежать азотной эмболии и азотного наркоза, с меньшим охлаждением организма во время дыхания.
Смесь неона и гелия используется не только для дыхания, но и как основ для создания излучения в газовых лазерах.
Интересен тот факт, что элемент под номером 10 помог в открытии нового вещества из периодической таблицы химических элементов Менделеева. Этот открытый в 1964 году элемент, имеет № 104 и сейчас называется курчатовий. Открыт он был в городе Дубна при помощи циклотрона.
Получение неона
Для промышленных целей неон выделяют из воздуха, как побочный продукт при выделении из воздуха жидкого азота и кислорода, двумя способами: адсорбционным или конденсационным.
Первый способ основан на адсорбции неона на активированном угле при выделении из воздуха жидкого азота и кислорода и многократного повторения этого процесса.
Второй основан на охлаждении воздуха до температуры жидкого водорода, при которой неон, находящийся в воздухе кристаллизуется, а гелий остаётся в газообразном состоянии и отсасывается специальными насосами.






