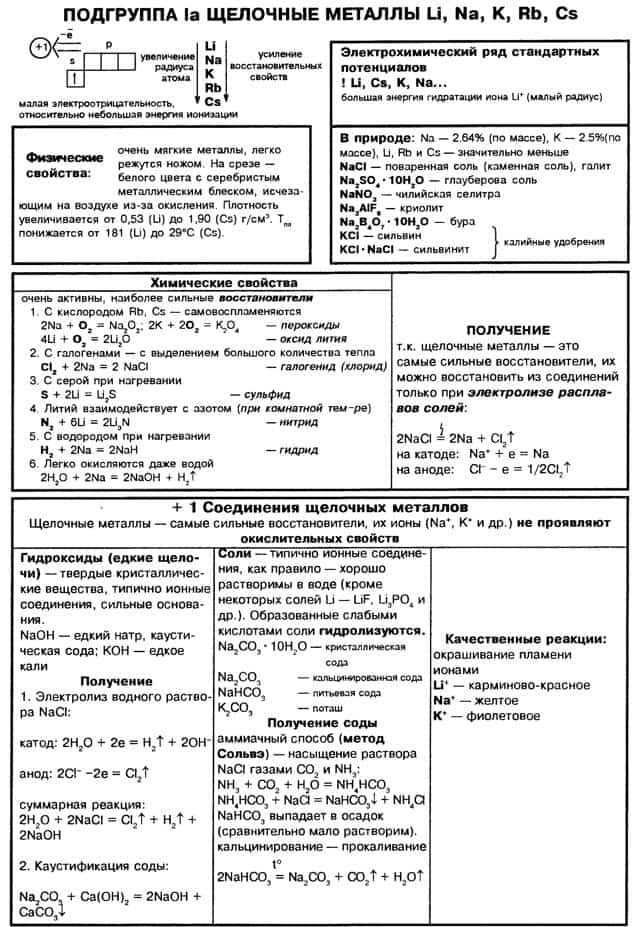
- Щелочные металлы
- Химические свойства
- Оксиды щелочных металлов
- Гидроксиды щелочных металлов
- Пероксиды щелочных металлов
- Фактчек
- Проверь себя
- Характерные химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
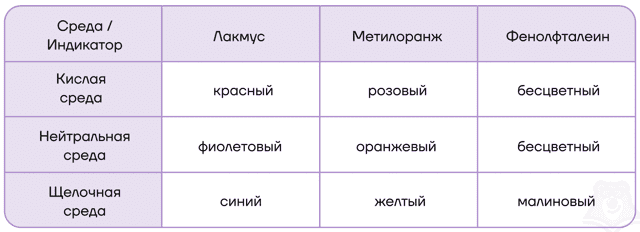
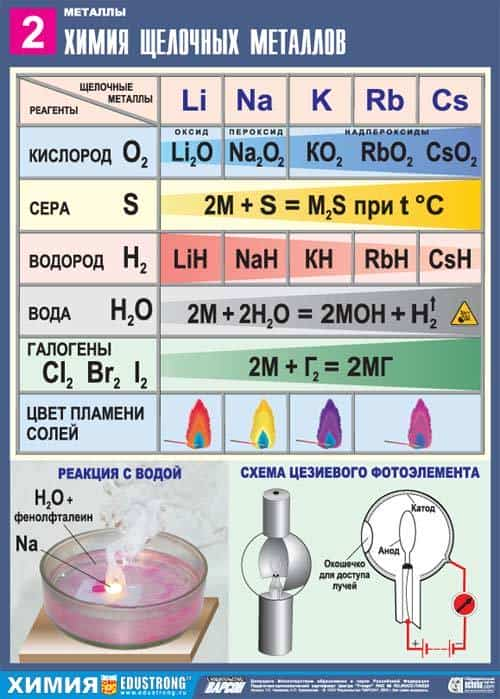
- 7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Получение щелочных металлов
- Особенности химических свойств s-элементов I группы и их физиологическое действие
- Щелочные металлы
- Химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- Кодовое название — щелочные металлы. Откуда оно произошло?
- Почему щелочные металлы не берут в реакции с кислотами?
- Рассмотрим химические и физические свойства щелочных металлов;
- Как можно распознать катионы щелочных металлов?
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
| Кодовое название — щелочные металлыДанные металлы получили такое название, так как большинство их соединений растворимы в воде («выщелачивать» означает «растворять»). |
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
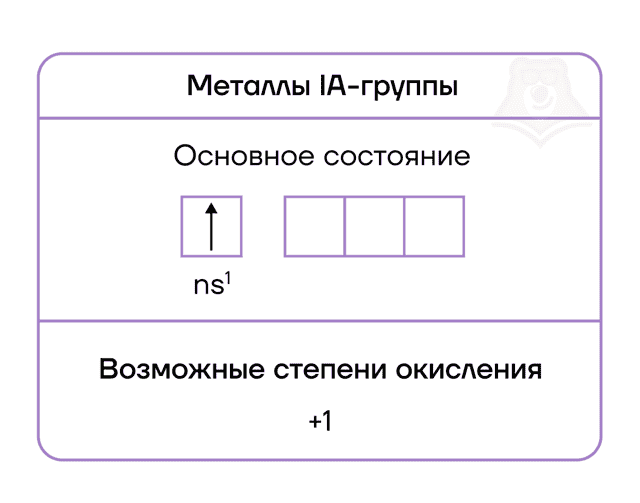
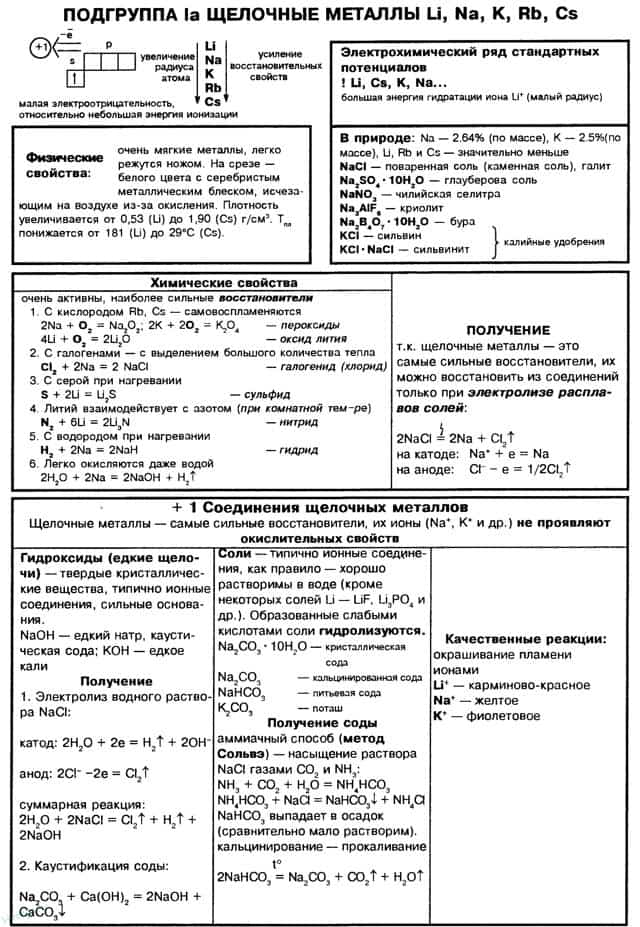
- Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns1.
- Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
- Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
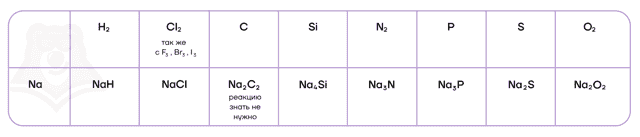
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;4Li + O2 = 2Li2O
- натрий образует пероксид;2Na + O2 = Na2O2
- калий и все нижестоящие металлы — надпероксиды/супероксиды.K + O2 = KO2
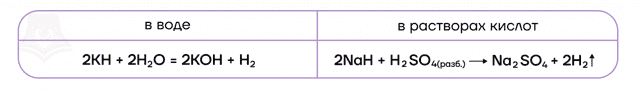
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
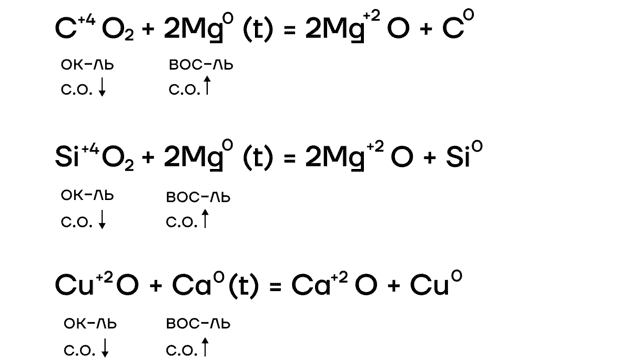
| Почему щелочные металлы не берут в реакции с кислотами?Щелочные металлы из-за своей бешенной активности взаимодействуют сначала с водой, крайне бурно, со взрывом! Поэтому для таких реакций их не берут! |
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
Они являются основными оксидами, поэтому:
- реагируют с водой с образованием оснований:
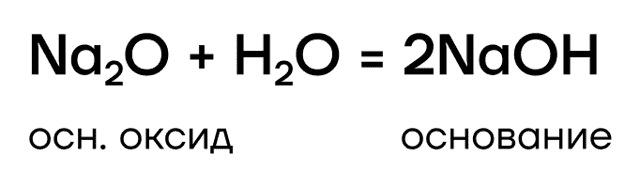
- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
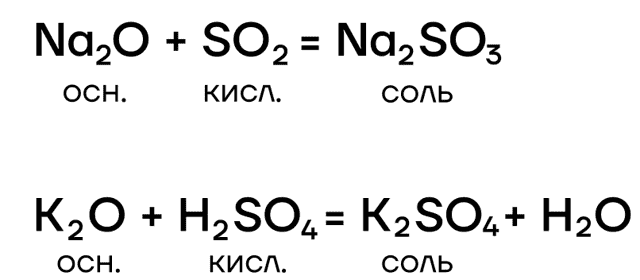
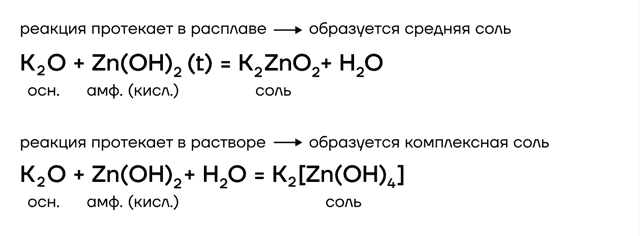
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:
Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
| Как можно распознать катионы щелочных металлов?Как же можно отличить катионы щелочных металлов друг от друга? Самый простой и распространенный метод — по окраске цвета пламени! Соединения этих металлов придают пламени характерные цвета, которые приведены в таблице. Кстати, это используют в пиротехнике при изготовлении смесей для салютов и фейерверков. |
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.Какой из щелочных металлов имеет самое большое число электронов?
- Литий;
- Натрий;
- Калий;
- Рубидий;
- Цезий;
- Франций
Задание 2.Щелочные металлы имеют постоянную степень окисления:
Задание 3.Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Характерные химические свойства щелочных металлов
- •Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
- •Все соединения щелочных металлов имеют ионный характер.
- •Практически все соли растворимы в воде.
- •Низкие температуры плавления,
- •Малые значения плотностей,
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги.
Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
-

- 2Na + 2H 2 O → 2NaOH + H 2
- 2Li + 2H 2 O → 2LiOH + H 2
2. Реакция щелочных металлов с кислородом:
- 4Li + O 2 → 2Li 2 O (оксид лития)
- 2Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl 2 → 2LiCl (галогениды)
- 2Na + S → Na 2 S (сульфиды)
- 2Na + H 2 → 2NaH (гидриды)
- 6Li + N 2 → 2Li 3 N (нитриды)
- 2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Li + – карминово-красный

- Na + – желтый
- K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
- Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2 В небольших масштабах используется также вакуум-термическое получение натрия и калия:
- 2NaCl+CaC 2 =2Na+CaCl 2 +2C; 4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4 .
- Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
-
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия).
Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл.
От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды.
Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1.
Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика.
Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами.
Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток.
Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния.
Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв.
Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте.
При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов.
В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа.
Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали.
Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р.
Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей.
Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации.
Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах.
Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно.
Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах.
В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
- Перечисленные вещества реагируют с водой:
- Li 3 N + 3 H 2 O = 3 LiOH + NH 3 ;
- Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2 ;
- K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2 .
- Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
- Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2 ;
- K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2 .
- В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных. Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
- 2Li+H 2 =2LiH.
- Гидрид лития используется как сильный восстановитель.
- Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
- SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
- Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ; б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O; в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ; г) гидроксид натрия NaOH называют каустической содой или каустиком.
Щелочные металлы
Чтобы поделиться, нажимайте
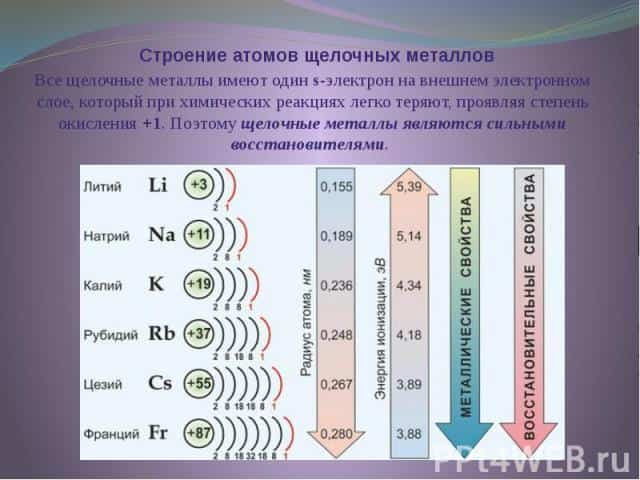
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1.
Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т. е. химическая активность.
В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.
Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов – твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
- 4Li + O2 → 2Li2O (оксид лития)
- 2Na + O2 → Na2O2 ( пероксид натрия)
- K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl2 → 2LiCl (галогениды)
- 2Na + S → Na2S (сульфиды)
- 2Na + H2 → 2NaH (гидриды)
- 6Li + N2 → 2Li3N (нитриды)
- 2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- Li+ – карминово-красный
- Na+ – желтый
- K+, Rb+ и Cs+ – фиолетовый
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.






