- Где он в природе
- История открытия и природные свойства
- Osmium
- Стоимость
- Применение
- Опасность и техника безопасности
- Несомненная польза тяжелейшего металла
- Коммерческий интерес
- Как избежать коррозии — гальванические пары: таблица, описание
- Пример недопустимых гальванических пар:
- Как защитить конструкцию или узел от контактной коррозии?
- Как отличить серебро от других металлов в домашних условиях
- Свойства металла
- Бабушкины подсказки
- Современная домашняя лаборатория
- Просто и быстро
- По стопам Менделеева
- Проба и пробирный камень
- В каких приборах ссср есть детали из чистого палладия
- Какие радиодетали богаты палладием?
- Резисторы, реле – в каких ещё радиодеталях есть палладий?
- Применение s-металлов и их соединений
- Применение щелочных металлов и их соединений

Не золото и не платина самые дорогостоящие металлы из таблицы Д. И. Менделеева, а осмий металл. Это редчайший и дорогущий металл серебристо-белого цвета с серым оттенком голубого отлива. У химиков этот металл считается благородным, относящийся к группе платиновых.
Состоит из нескольких изотопов. Их очень трудно разделить, что и отражается на стоимости. Самый востребованный из них изотоп – Осмий-187.
Предполагается, что на 0,5% масса земной коры состоит из осмия, а находится он в ядре. Удивляет пропорция между размером и весом. Килограмм соединения по размеру сопоставим со средним размером куриного яйца. Ёмкость, объёмом 0,5 л.
, наполненная осмиевым порошком, весит больше 15 кг.
Но желание отлить гантельки из такого удобного, в плане соотношения размер/вес, материала, сразу пропадает не только из-за цены на порошок, для кого-то это и не проблема, а ввиду его чрезвычайной редкости и недоступности.
Где он в природе
Найти слитки в лесах, горах, водоёмах не получится. До сих пор не найдено ни одного самородка. Добывают его на рудных месторождениях в составе с иридием, платиной, в платиново-палладиевой руде, в медных и никелевых рудах.
Но содержание осмия в нём составляет 0,001%. И ещё он встречается в метеоритах. Правда, отделяются изотопы от них больше чем через 9 месяцев.
Поэтому промышленные производства с применением осмия обходятся вторичным сырьём, что ненамного дешевле.
Общая выработка самого тяжёлого металла в год во всём мире составляет несколько десятков килограмм. Но увеличивается добыча платины, где осмий присутствует и попутно извлекается. Называют цифры уже 200 кг в год. Так, встаёт задача не столько искать осмий, сколько найти более дешёвый способ отделения его от «соседей».
На Норильском горно-металлургическом комбинате добились определённых успехов в этой задаче. Получили чистый металл из медно-никелевых руд. Количество его на планете – 0,000005% от всей массы горных пород. Но в России есть. И в Казахстане. А основные запасы располагаются в Тасмании, Америке, Австралии. Самые большие сосредоточены в Южной Африке. Она-то и диктует цены.
История открытия и природные свойства
В 1803-1804 годах в Англии, при проведении опытов над платиной с царской водкой (смесь азотной кислоты с соляной), в полученном неизвестном осадке, после растворения платины, появился резкий, неприятный запах, напоминающий хлор. Благодаря этому запаху, только что открытый металл и получил своё название. Правда, на греческом языке. С греческого «осмий» переводится, как «запах».
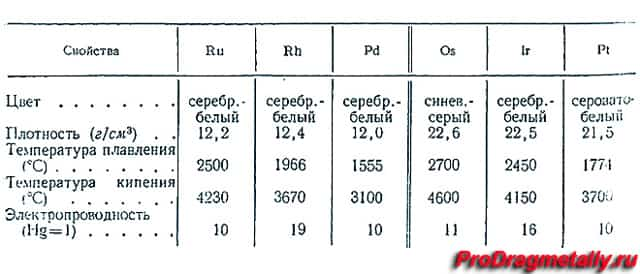
Формально это благородный металл, потому что входит в платиновую группу. На этом истинное благородство и заканчивается. Свойства этого металла как химические, так и физические, до сих пор до конца не изучены. Физические характеристики более-менее уточнили несколько лет назад.
Osmium
| Не растворяется в щелочах и кислотах | Внешне кристаллы твёрдые и хрупкие, имеют красивый серебристый блеск с оттенками от серого до голубого. Слитки – тёмно-синего цвета, порошок – фиолетового. И все с изумительным серебристым блеском. |
| Не реагирует на адскую смесь азотной и соляной кислот – единственный из металлов на планете. | Температура сплавов такая, что производить плавку предпочтительнее на поверхности Солнца. |
| Инертен. Возможно использование сплавов и покрытий из осмия в агрессивных средах. | Высочайшая токсичность, не позволяющая использовать такую красоту для изготовления ювелирных изделий. |
| Чрезмерно токсичен, даже в малых дозах. Особенно летучий оксид осмия, выделяющийся из платины. | Чрезвычайно хрупок. Механической обработке неподвластен. |
| Кипит при температуре 5500°С, но точно не определена – для проверки не существует расчётов | Тугоплавкость. Размягчается только при температуре свыше 3000 градусов С. |
| Не имеет магнитных свойств. | |
| Потрясающая твёрдость. Сплав с добавлением осмия становится более износостойким, долговечным, с повышенной сопротивляемостью коррозиям и механическому воздействию. | |
| Высочайшая плотность 22,61 г/см3. |
Стоимость
Высокая стоимость вызвана ограниченным количеством. Поскольку его мало в природе, а добыча дорогая, то рынок реагирует соответственно. Если сравнивать с золотом, то это будут тысячи тонн золота против нескольких десятков килограммов добычи. Отсюда и цена – она начинается с 15 тысяч и доходит до 200 тысяч долларов за грамм. На мировом рынке золото в 7.5 раз дешевле.
Такие цифры говорят о непопулярности материала для широкого употребления. Основную роль в применении этого тяжёлого металла в сплавах играет прочность. Изделия становятся невероятно износоустойчивы за счет добавления совсем небольших порций металла в состав.
Применение
В широком промышленном производстве осмий применяют редко из-за его дороговизны. Но там, где эффект может превысить материальные затраты, его, конечно, используют. Сырьём он выступает, чаще всего, в порошке. Сам металл хрупкий, крошится легко. Получение порошка несложное.
Еще варианты использования:
- Химическая промышленность применяет его в качестве катализатора. Иногда он срабатывает быстрей платины. Вообще, почти половина мировых запасов осмия отдана на нужды химической промышленности.
- Тетраоксид осмия применяют при синтезировании некоторых лекарств.
- В химических лабораториях помогает в окрашивании живых тканей под микроскопом. Обеспечивает сохранность микроструктуры клеток.
- В аэрокосмической промышленности.
- При производстве ядерного оружия полезен для изготовления тары под ядерные отходы. Вот тут стоимость осмий металла оправдана в полной мере.
- Благодаря отсутствию магнитных свойств такой металл приветствуется при изготовлении дорогих часов, элитных моделей. Цена «Ролексов» включает не только брендовую стоимость, качество механизма и драгоценность корпуса. Содержание корпуса с использованием благородного сплава тоже повышает цену.

- В росписи фарфора, как краситель чёрного цвета.
- Минеральное производство включает соли осмия для вытравки разных материалов, синтеза аммиака, гидрирования органических веществ.
- Придумали даже авторучки с наконечниками из осмия – это металл, который позволяет продукцией из него пользоваться вечно. Этого нельзя сказать о металлических перьях из чистого золота или других металлов.
- Высокоточные приборы. Электронная микроскопия.
- Механика использует соединения металла для улучшения прочности сплавов для узлов трения.
- Изотопы Осмия187 задействованы в ракетостроении, авиа- и кораблестроении.
- В военных боеголовках.
Не все соединения осмия применимы к использованию. Но учёные работают над этим.
Опасность и техника безопасности
Как и другие тяжёлые металлы, осмий оказывает не самое благоприятное влияние на живые организмы, не обходя и человеческий. Любые соединения с осмием поражают внутренние органы, вызывают потерю зрения.
Отравление парами элемента приводит и к летальному исходу. При наблюдении за животными наблюдалось резкое развитие малокровия, и лёгкие переставали функционировать. Полагают, что это быстроразвивающийся отёк.
Что такое тетраоксид осмия OsO4? А это и есть то самое вещество, благодаря которому элемент носит своё имя. Крайне агрессивен. Его запах нельзя не заметить. Ужасней и омерзительнее запаха в природе не существует. При отравлении задеваются и кожные покровы. Дерма зеленеет, чернеет, а может и вовсе омертветь. Возможно появление пузырей, язв. Заживает всё очень долго.
Опасность отравления грозит, прежде всего, работникам производственных помещений при малейшей концентрации паров в воздухе. Ни о каких допустимых нормах учёные уже не заикаются. Поэтому предусмотренная специальная одежда, респираторы – обычное явление на производствах с применением оксида осмия. Всё герметизировано, ёмкости закупорены и хранятся в соответствии с уже испытанными правилами.
Если всё же по какой-то немыслимой причине соединение осмия попадёт в глаза, промывать их надо продолжительное, минут 20, время. Чистой проточной водой. И сразу к врачу. При попадании в организм через дыхательные пути пары осмия нейтрализуются бикарбонатом натрия. Он выпускается в аэрозольной упаковке. Много молока внутрь. И промыть желудок.
Несомненная польза тяжелейшего металла
По мнению английских учёных этот тяжёлый металл блокирует развитие раковых клеток. Методы терапии онкозаболеваний с задействованием осмия хоть и очень медленно, но уже разрабатываются.
В медицине, в кардиостимуляции, его используют в имплантах, изготовление которых требует благородных металлов для предотвращения развития аллергий. Состав импланта, заменяющего элементы сердца, включает 10% осмия и 90% платины. Конечно, такие приборы и оцениваются соответственно. Такая же пропорция применяется для изготовления лёгочных клапанов.

Применение соединений осмия для медицинских потребностей заметно при производстве особо прочных, длительного использования, инструментов, таких, как скальпели, всевозможные металлокерамические резцы. И нужно для этого совсем немного сырья, а эффект потрясающий.
Микроскопические добавки осмия к стали режущих сортов позволяют создавать острейшие лезвия.
Изделия, применение которых подразумевает использование самого тяжелого металла, оказываются непревзойдёнными в износоустойчивости.
Коммерческий интерес
Разнообразные потрясающие свойства металла осмия вызывают несомненный интерес и неподдельное удивление. Но эти же свойства убивают коммерческий интерес наповал. И, несмотря ни на что, цена на рынке не падает.
Как избежать коррозии — гальванические пары: таблица, описание

Контактная коррозия происходит при непосредственном контакте двух разнородных металлов. Нельзя, к примеру, соединять алюминиевые листы медной заклепкой, так как при определенных условиях они образуют сильную гальваническую пару.
Разные металлы имеют разные электродные потенциалы. В присутствии электролита один из них играет роль катода, а другой анода. В результате химической реакции, протекающей между ними, начнется коррозионный процесс, в котором медь (катод) будет беспощадно разрушать алюминий (анод).
Почти все пары разнородных металлов, находящиеся в контакте между собой, подвержены коррозии, так как даже влага из воздуха может выступить в роли электролита и активировать их электродный потенциал. Но одни пары уязвимы в большей степени, а другие – в меньшей.
Например, алюминий отлично контактирует с оцинкованной сталью, хромом и цинком, а латунь совершенно не «дружит» со сталью, алюминием и цинком. Чтобы узнать, какие металлы совместимы, а какие нет, обратимся к основам химии.
В ряду электрохимической активности металлы стоят в следующей последовательности:

Электрохимический ряд напряжения металлов
Для примера рассмотрим пару алюминий – медь. Алюминий стоит в ряду слева от водорода и имеет электроотрицательный потенциал равный -1.7В, а медь находится справа и имеет положительный потенциал +0.4В.
Большая разница потенциалов приводит к разрушению более активного алюминия. Медь сильнее всех, впереди стоящих элементов, поэтому в паре с любым из них она выйдет победителем.
Чем дальше друг от друга в ряду стоят элементы, тем выше их несовместимость и вероятность протекания гальванической коррозии.
Данные о совместимости некоторых металлов представлены в таблице:
| Алюминий | Латунь | Бронза | Медь | Оцинкованная сталь | Железо | Свинец | Нержавеющая сталь | Цинк | |
| Алюминий | Д | Н | Н | Н | Д | О | О | Д | Д |
| Медь | Н | О | О | Д | О | Н | О | Н | Н |
| Оцинкованная сталь | Д | О | О | О | Д | О | Д | О | Д |
| Свинец | О | О | О | О | Д | Д | Д | О | Д |
| Нержавеющая сталь | Д | Н | Н | Н | О | О | О | Д | Н |
| Цинк | Д | Н | Н | Н | Д | Н | Д | Н | Д |
Д – абсолютно допустимые контакты (низкий риск ГК); О – ограничено допустимые контакты (средний риск ГК); Н – недопустимые контакты (высокий риск ГК).
Приведенная таблица может служить кратким справочником для определения совместимости некоторых конструкционных металлов. Допустимость и недопустимость контактов разнородных в электрохимическом отношении металлов устанавливает ГОСТ 9.005-72.
Пример недопустимых гальванических пар:

Гальваническое действие может возникнуть, если строительную конструкцию из нержавеющей стали скреплять оцинкованными болтами. В этой нежелательной паре пострадает высоко анодный крепеж, поскольку его электроны будут перемещаться в направлении катодной нержавеющей стали. Поэтому, крепежные детали должны быть изготовлены из менее гальванически активного металла, чем материал металлоконструкции.

На скорость течения гальванокоррозии оказывает влияние площадь поверхности анода и катода. Если большой по размеру анод соединить с маленьким катодом, то анод будет ржаветь медленно, а если сделать наоборот, то быстро. Например, используйте болты из нержавеющей стали для крепления алюминия, но не наоборот.
Степень интенсивности протекания контактной коррозии зависит и от условий эксплуатации соединения.
В обычных атмосферных условиях процесс будет протекать менее быстро и возрастает в агрессивной электропроводной среде, например, растворах кислот и щелочей.
Присутствие в воде других веществ увеличивает проводимость электролита и скорость коррозии. Поэтому при проектировании конструкций важна оценка окружающей среды.
Как защитить конструкцию или узел от контактной коррозии?
Если по конструктивным соображениям невозможно избежать нежелательного контакта разнородных металлов, то можно попытаться уменьшить гальваническую коррозию с помощью следующих методов:
- окраска поверхностей в районе их стыка;
- нанесение совместимых металлических покрытий;
- изоляция соединения от внешней среды;
- электрическая изоляция;
- установка неметаллических прокладок, вставок, шайб в болтовых соединениях.
Практика показывает, что в тех случаях, когда пренебрегают требованиями к допустимости контактов разных металлов, приходится дорого за это расплачиваться. Неправильная компоновка контактных пар выводит из строя узлы крепления, металлоконструкции и может стоять человеческой жизни.
Как отличить серебро от других металлов в домашних условиях
12.11.2018
Свойства металла
Не менее шести тысячелетий человечество знает, как выглядит серебро. Белый (сейчас к этому определению можно добавить — металлический) блеск, скорее всего, и привлек к его самородкам первых людей. Изначально аргентум нашел применение в изготовлении оружия и украшений, но и не только.
Подмеченные предками свойства аргентума определяют его использование и сейчас:
- Серебро клали в воду (или держали ее в емкостях из этого металла). Металл убивал вредные микробы. Христианские священники используют этот метод и сейчас, а в продаже есть специальные изделия для очистки воды, бактерицидные лекарства на основе Ag.
- «Сребряну воду, вкусом отменну» отмечала еще российская императрица Екатерина II. Ионы металла и сегодня применяются при бутилировании минеральных вод. Считается, что он дает не только целебный, но и омолаживающий эффект.
- Металл применялся в качестве талисманов от злых духов, оружие из него использовалось для борьбы с черными силами. Амулеты из серебра популярны и в XXI веке. Таковыми можно считать любые украшения из него.
- Предки делали из металла зеркала. Ag отличается идеальными отражающими свойствами. В наши дни из него изготавливают высокоточные зеркала, которые используются в науке и технике.
- Несмотря на тугоплавкость, серебро очень пластично, удобно в обработке. Поэтому и ювелирные изделия из него уникальны и разнообразны. Тончайшие нити из серебра применяются в оптике, электротехнике.
Это действительно уникальный металл с богатыми свойствами. Раньше блестящие монетки клали в молоко, чтобы оно дольше не скисало. Сейчас из аргентума, который может держать огромные нагрузки, изготавливают некоторые элементы для подводных аппаратов и космических кораблей. Серебро наверняка шагнет с человеком в далекое будущее.
Бабушкины подсказки
В ювелирном деле металл не используется в своем первозданном, чистом виде (это же касается и производства столовых приборов). В сплав добавляются другие составляющие, которые придают дополнительную крепость. Классическим вариантом здесь является медь. Чтобы отличить настоящее серебро от подделки, нужно говорить не об Ag как таковом, а о проценте его содержания в сплаве.
Определять чистоту металла без всяких препаратов и приспособлений умели еще прабабушки живущих сегодня людей:
- Аргентум очень теплопроводен — быстро греется, быстро остывает. Если зажать его в кулаке, он тут же приобретет температуру тела. Можно опустить в кипяток (если украшение не имеет камней), а затем взять в руки. Настоящий металл будет жечь, но совсем недолго.
- Изделие можно несколько минут потереть в ладонях. Если кожа осталась чистой, сплав хороший, если остались темные следы — имеются лишние примеси (чаще всего цинковые).
- Серебряный звон — не просто устойчивое словосочетание. Бижутерия при аккуратном постукивании дребезжит, аргентум легко и протяжно вибрирует. В качестве ударного инструмента следует использовать что-то сродни вязальной спице.
- Если ложечку из Ag положить на солнце, она ярко отразит лучи, будет блестеть. Дешевый сплав даст тусклый отсвет, а то и совсем еле заметный.
- Люди с тонким обонянием (и хорошим опытом) отличали серебро по запаху. Они уверяли, что чистый металл пахнет свежестью, ландышем. Сейчас этот способ вряд ли подходит для всех — современная парфюмерия заставит и железо пахнуть розами.
- Аргентум обладает большой плотностью. Даже маленькое изделие из него должно чувствоваться в руке. И сегодня так легко отличить серебро от гораздо более легкого алюминия.
- Раньше колечко облепляли мякишем ржаного хлеба и оставляли так на два дня. Если украшение за это время заметно чернело, это был хороший знак — сплав признавался качественным. С сегодняшним хлебом этот тест может и не пройти.
- Ложку (тарелку) можно попытаться согнуть. Предмет из нормального аргентума поддастся довольно легко, почти не будет пружинить. Но стопроцентной гарантии этот способ не даст: согнуть можно и прибор из стали. Да и вернуть предмету первоначальный вид будет затруднительно.
Все эти тесты строились на знании свойств Ag. Знающие люди могли определить подлинность металла по внешнему виду. Наверное, это и сейчас доступно опытным ювелирам.
Современная домашняя лаборатория
В современных условиях отличить серебро от подделки можно и дома. К услугам людей сейчас достижения физики, наборы юного химика, медицинские препараты. Просто нужно знать, как применить тот или иной способ.
Просто и быстро
Переходящий из века в век способ — царапнуть внутреннюю сторону колечка иголкой. Когда это удается слишком легко, а под верхним слоем обнаруживается другой оттенок, налицо подделка с напылением. Но сейчас мошенники умеют делать фальшивки, которые пройдут такой примитивный тест.
Есть более надежные домашние способы:
- Уксус. Процарапать ободок кольца. Капнуть уксусом (подальше от камней). Если появится зеленая пенка, то изделие, скорее всего, поддельное.
- Ляпис. Он содержит ионы Ag. Работать нужно в перчатках. Потереть ляписом украшение и понаблюдать за реакцией. Нормальный сплав продемонстрирует ее отсутствие. Фальшивка почернеет.
- Серная мазь. Нанести ее на изделие и оставить на 2−3 часа. Затем протереть украшение и сполоснуть его. Аргентум станет темным. Подделка, в зависимости от использованных металлов, либо не среагирует, либо даст желтый, розовый или зеленоватый оттенок.
- Йод. Понадобится белая тарелочка. Положить на нее изделие. Капнуть йодом. Если нет реакции, аргентум ненастоящий (возможно, под его видом приобретен мельхиор). Появилось синее пятно — много цинка. Чернота определяет качественное украшение.
- Мел (подойдет обычный белый). Кольцо или цепочку нужно сильно им потереть. Если украшение чернеет, оно содержит достаточно Ag.
- Магнит. Серебро не примагнитится. Но это не очень верный метод — некоторые металлы среагируют так же. Зато этот способ может дать эффект, когда звенья цепочки изготовлены из разных сплавов. Частью украшение будет притягиваться, а частью — нет.
- Лед. Положить его кусочек на украшение, которое хранилось при комнатной температуре либо только снято с руки. Если лед сразу начинает таять, это является хорошим показателем.
Некоторые из этих способов опасны тем, что могут испортить и изделие, и используемую посуду. Но сама чистка украшения способна стать дополнительным тестом. Аргентум можно снова заставить сиять лунным светом с помощью протирания нашатырным спиртом или сырым картофелем. Цинковый сплав прежнего блеска уже не даст.
По стопам Менделеева
Истинные любители химии могут заставить работать свое увлечение на пользу в определении подлинности украшений. Примеси в лунном металле позволят определить различные кислоты и их смеси. В отдельных случаях можно будет не только убедиться в наличии добавок, но и классифицировать их.
Соблюдая технику безопасности, можно поставить такие опыты:
- С азотной кислотой. Изделие придется поцарапать. Кислотой нужно капнуть на поврежденное место. Сильный зеленый налет покажет излишек меди. Проба 925 и выше даст бежевый оттенок. Очень чистый Ag почернеет.
- С дихроматом калия. Он применяется в фотографии и пиротехнике. Изделие почистить, протереть спиртом, просушить. С интервалом в несколько секунд капнуть на него два-три раза раствором. Излишки тут же удалить салфеткой. Проба 750 и более среагирует красным цветом. Чем больше в сплаве аргентума, тем краснее будет пятно.
- С хлорным золотом. Оно готовится на основе смеси соляной и азотной кислоты (царской водки). Изделие очистить. Нанести на него реактив. Результат проявляется сразу же. Если осадок будет чернильным — тестируется качественное изделие. Желтый и коричневый цвета подскажут присутствие алюминия, излишек меди.
- С азотно-кислым серебром. Светло-серый цвет этого реагента на изделии покажет высокую пробу (от 750). Мутно-белый — наоборот.
Нужно понимать, что украшение можно повредить, применяя кислоты. Подделки же могут совсем прийти в негодность. Так как цинк и олово разъедаются быстро, цепочка может просто порваться.
Большинство тестов не дают полной уверенности в точности произведенной оценки. Нужен еще и опыт. Но все они хотя бы частично позволяют понять, с каким изделием человек имеет дело.
Проба и пробирный камень
Современные правила, заложенные в основу обращения драгоценных металлов, дают возможность отличить от серебра медь и другие добавки, а также определить их содержание в изделии. Для этого установлена мера, так называемая проба. А для контроля за исполнением правил изобретены специальные приборы.
О системе проб и правилах их применения нужно знать:
- Проба показывает, сколько Ag содержится в сплаве. Она представляет собой трехзначное число. Условно каждая единичка здесь обозначает 1 грамм в 1 килограмме. Но килограммовые украшения остались в прошлом. Поэтому мерная единица на современных изделиях просто показывает каждую десятую процента аргентума.
- При изготовлении украшений чаще всего используются сплавы пробы 925. Это значит, что в них содержится 92,5% Ag и 7,5% меди.
- Менее распространенные пробы: 750, 800, 875, 916, 960. Сплав 999 (почти чистый драгоценный металл) используется только для специальных слитков, дорогих коллекционных монет и в некоторых высокоточных областях науки.
- Если изделие претендует называться серебряным, на нем в обязательном порядке должна быть указана проба. Она наносится способом клеймения. Также информация о ней указывается на прикрепленном ярлычке товара. Крепление ярлыка должно быть пломбировано. Если продавец не соблюдает эти обязательные, установленные законом условия, есть большой шанс столкнуться с подделкой.
- В ярлыке, помимо пробы, должна быть указана и другая информация об украшении. Это его название, вес, общая цена и цена за 1 грамм, наименование производителя, описание камней (если они есть). Если изделие имеет покрытие (например, родий), то это также должно быть указано.
- Информация о названии, весе, пробе, цене товара должны быть пробиты и в чеке о покупке.
- Протестировать изделие на пробу и добавки можно с помощью пробирного камня. Для этого нужно будет сделать на украшении царапинку и капнуть реагентом. Коричневый цвет, например, скажет о наличии латуни. Желтый цвет поможет отличить серебро от олова (также желтым просигнализирует о себе и свинец).
Россия, конечно, не Латинская Америка, страны которой являются мировыми лидерами по добыче аргентума. Но серебра в государстве тоже достаточно. С подделками граждане сталкиваются не так уж часто. Чтобы избежать их, как правило, достаточно приобретать украшения в специализированных магазинах, а не на рыночных развалах или в привокзальных ларьках.
Как отличить серебро от других металлов в домашних условиях Ссылка на основную публикацию
В каких приборах ссср есть детали из чистого палладия
12 января 2021
В советское время палладий был общедоступным металлом. Из него даже изготавливались недорогие ювелирные украшения. Страна была богата золотом, платиной и палладием.
Причем, стоимость платины на мировых рынках была высока, в золото вкладывали многие страны, а палладий долгие годы не был никому интересен.
Поэтому его применяли вместе с серебром активно в активно развивающейся советской электронике.
Какие радиодетали богаты палладием?
В наше время стоимость палладия огромна. Грамм палладия стоит почти в два раза дороже, чем золото- 5900 рублей. Поэтому добывать палладий из радиодеталей крайне выгодно. Тем более, этот металл не растворяется в серной и соляной кислотах, поэтому получить его из советских радиодеталей можно с помощью кислот – быстро и эффективно.
Эксперты давно заприметили драгметалл палладий в радиодеталях советской электроники. Этот металл активно применялся и при производстве ЭВМ, и при изготовлении телевизоров, также этого чрезвычайно дорого металла много в оборудовании спецназначения- измерительных приборах, датчиках, военной аппаратуре.
Палладиевые ламели присутствуют в большинстве образцах советских ЭВМ. В компьютерах, произведенных в СССР, может находиться до десяти грамм этого ценного металла. Также стоит отметить и наличие резисторов ПП-3, в которых палладий находится в изобилие в контактах. Причем, как указывают эксперты, резисторные контакты богаты 80процентным палладием.
В стандартных советских телевизорах «Горизонт», «Рубин», «КВН», «Сапфир», «Электроника» драгметалл палладий присутствовал в малых количествах. Палладий чаще всего напыляли на КМ конденсаторы очень тонким слоем.
Чем более старше техника, тем она более богата радиодеталями с драгметаллами. В одном телевизоре ПТУ-58 содержится 120 грамм чистейшего серебра, а золота почти 15 граммов. Палладий же вместе с платиной активно применялись в качестве контактов в старой советской технике вместе с серебром. Цены тогда на драгметаллы все же еще были совсем иные, чем сейчас.
Резисторы, реле – в каких ещё радиодеталях есть палладий?
Некоторые эксперты утверждают, что для тех людей, которые не очень желают вникать в тонкости выявления деталей с содержанием палладия и золота, можно поступить предельно просто – просто растворять всю электронику в серной кислоте. Все кроме золота, палладия и платины растворится, так как эти «благородные металлы» носят свое гордое название именно по той причине, что они не растворяются в кислотах, в отличие от всех остальных металлов таблицы Менделеева.
Достаточно популярные в советское время реле РЭС-8 имеют в своем составе 80% палладий. В каждом реле РЭС-8 и РЭС-7 содержится до полутора грамма этого ценного металла. Именно за радиодеталями в реле и идет настоящая охота у тех, кто хочет разбогатеть на добыче палладия.
Изделия КСП богаты палладиевой начинкой. В них имеется палладиевые контакты, общий вес которых составляется где-то 3,5 граммов палладия с 20 процентами добавок.
Также стоит отметить и некоторую долю палладия в резисторах СП5, ПП3 и ПП5. Но самыми распространенными в СССР радиодетали с палладием считались КМ конденсаторы зеленого цвета, которые использовались и в производстве телевизоров, в производстве радиол, магнитофонов и прочей советской техники.
- Конденсаторы из палладия считались самыми лучшими, так как служили очень длительный срок и их частенько устанавливали в более дешевую отечественную электронику во время ремонта.
- Стоит сконцентрировать внимание на добычи либо массово используемых в советское время КМ конденсаторов зеленого цвета, либо попытаться выискивать реле РЭС-8, где повышенное количество почти чистого палладия обеспечено.
- Некоторые компании и частные лица специализируются на поиске радиодеталей с палладием – настолько этот металл сейчас дорог, а прибыль может быть действительно крайне высокой.
◄ Назад к новостям
Применение s-металлов и их соединений
Все 5-металлы нашли широкое практическое использование как в виде простых веществ, так и в виде соединений. С древнейших времен такие соединения щелочных металлов, как поваренная соль (NaCl), сода (Na2COs), поташ (К9С03), калийная селитра (KN03), порой определяли ход истории в отдельных регионах.
На таких соединениях щелочноземельного металла кальция, как известняк, мрамор (СаС03) и гашеная (Са(ОН)2) и негашеная (СаО) известь, в буквальном смысле держатся фундаменты и стены большей части исторических сооружений всех времен и народов.
Однако наиболее полно практическое значение 5-металлов выявилось только после того, как они были получены в чистом виде и оказались вовлеченными в технологические революции XX и XXI вв.
Применение щелочных металлов и их соединений
Литий. Мировое производство лития составляет около 1000 т/год. Металлический литий широко используется в новом поколении химических источников тока (ХИТ) и аккумуляторов.
При использовании неводных электролитов литий может использоваться в качестве анода.
Литиевые ХИТ и аккумуляторы сегодня являются источниками энергии в компьютерах, ноутбуках, цифровых фотоаппаратах, мобильных телефонах и даже в стимуляторах сердца. Они дают ЭДС до 3,5 В.
Металлический литий (изотоп 'Li) применяется как жидкий теплоноситель в атомных реакторах и как компонент сплавов. Добавка всего 0,1% лития к алюминию позволяет получить сплавы аэрон и склерон, которые, помимо легкости, обладают высокой прочностью, пластичностью и стойкостью против коррозии.
Рекордным по легкости является сплав, содержащий 14% лития, 1% алюминия и 85% магния. Он имеет плотность всего 1,35 г/см3! Добавка 0,04% лития к свинцово-кальциевым подшипниковым сплавам повышает их твердость и понижает трение. Соли лития являются компонентами высококачественных смазок.
Их производство в России — десятки тысяч тонн в год. Порошковые материалы, получаемые спеканием порошков карбида лития с алюминием или титаном, являются легкими жаропрочными материалами для аэрокосмической техники.
Литий, точнее его изотоп 61л в виде дейтерида 61лЕ>, является основным компонентом термоядерной взрывчатки (знаменитая «Лидочка» В. Л. Гинзбурга).
Своеобразие химии лития открывает широкие перспективы его использования в самых разнообразных областях. Вот некоторые уникальные свойства лития, еще ждущие своего технического применения. При растворении металла в жидком аммиаке объем раствора всегда больше суммарного объема компонентов.
В результате такого разбухания раствора его плотность непрерывно надает с увеличением концентрации (чего не бывает у водных растворов солей и других твердых соединений).
Концентрированный раствор лития в жидком аммиаке — самая легкая при обычных условиях жидкость, ее плотность при 20°С составляет всего лишь 0,48 г/см3 (легче этого раствора только сжиженные при низких температурах водород, гелий и метан).
Литию принадлежит и другой своеобразный рекорд: его концентрированный раствор в жидком аммиаке — самый легкоплавкий «металл», который замерзает лишь при -183°С, т.е. при температуре сжижения кислорода (источник: Химия и жизнь. 1985. № 12. С. 24— 28).
Натрий. Металлический натрий — самый объемный и востребованный продукт из всех щелочных металлов.
Главная область применения металлического натрия — производство титана, циркония и других металлов восстановлением их хлоридов.
Меньшие количества натрия используются для получения таких соединений, как гидрид, пероксид и алкоголяты. Диспергированный натрий является ценным катализатором при производстве резины и эластомеров.
Растет применение расплавленного натрия в качестве теплообменной жидкости в ядерных реакторах на быстрых нейтронах.
Низкая температура плавления натрия, низкая вязкость, малое сечение поглощения нейтронов в сочетании с чрезвычайно высокой теплоемкостью и теплопроводностью делают его (и его сплавы с калием) незаменимым материалом для этих целей. Натрием надежно очищают трансформаторные масла, эфиры и другие органические вещества от следов воды.
Наиболее важными соединениями натрия являются его хлорид (ЫаС1), гидроксид (ЫаОН), карбонат в виде соды (кристаллической — Ыа2С03 • 10Н2О и кальцинированной — Ыа2С03), сульфат (Ыа2504), нитрат (№Ы03) и нитрит (ЫаЫ02).
Хлорид натрия — необходимейший компонент человеческой пищи. Считается, что человек начал употреблять его в неолите, т.е. около 5—7 тыс. лет назад. В далеком прошлом соль приравнивалась но цене к золоту. В Древнем Риме легионерам часто платили жалование не деньгами, а солью, отсюда и произошло слово солдат.
В Киевской Руси пользовались солью из Прикарпатья, из соляных озер и лиманов на Черном и Азовском морях. Она обходилась настолько дорого, что на торжественных пирах се подавали на столы знатных гостей, прочие же расходились «несолоно хлебавши».
Гидроксид натрия. Сегодня гидроксид натрия — наиболее важная щелочь в промышленности. Ежегодное производство только в США превышает 10 млн т. Ее получают в огромных количествах электролизом рассолов. При электролизе раствора хлорида натрия образуется гидроксид натрия и выделяется хлор. Электролиз сопровождается концентрированием щелочи в огромных выпаривателях.
Самый большой в мире имеет высоту 41 м и диаметр 12 м. Около половины производимого гидроксида натрия используется непосредственно в химической промышленности для получения различных органических и неорганических веществ. Кроме того, гидроксид натрия применяется в производстве бумаги и пульпы, мыла и моющих средств, масел, текстиля.
Карбонаты натрия. Во многих случаях карбонат натрия взаимозаменяем с гидроксидом натрия (например, при получении бумажной пульпы, мыла, чистящих средств). Около половины карбоната натрия используется в стекольной промышленности.
Одна из развивающихся областей применения — удаление сернистых загрязнений в газовых выбросах предприятий энергетики и мощных печей.
В топливо добавляют порошок карбоната натрия, который реагирует с диоксидом серы с образованием твердых продуктов, в частности сульфита натрия, которые могут быть отфильтрованы или осаждены.
Гидрокарбонат натрия №НС03 (пищевая сода) применяется главным образом как источник диоксида углерода при выпечке хлеба, изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, как компонент огнетушащих составов и лекарственное средство. Это связано с легкостью его разложения при 50— 100°С.
Сульфат натрия. Долгое время сульфат натрия мало использовался.
Теперь это вещество — основа бумажной промышленности, так как Ыа2304 является главным реагентом в сульфатной варке целлюлозы для приготовления коричневой оберточной бумаги и гофрированного картона.
Древесные стружки или опилки перерабатываются в горячем щелочном растворе сульфата натрия. Он растворяет лигнин (компонент древесины, соединяющий волокна) и освобождает волокна целлюлозы, которые затем отправляют на изготовление бумаги.
Нитрат натрия (чилийская селитра) применяют как удобрение. Он является компонентом жидких солевых хладагентов, закалочных ванн в металлообрабатывающей промышленности, теплоаккумулирующих составов.
Тройная смесь из 40% ЫаК02, 7% №N0^ и 53% КЫ03 может использоваться от температуры плавления (142°С) до ~600°С.
Нитрат натрия используется как окислитель во взрывчатых веществах, ракетных топливах, пиротехнических составах и в производстве стекла.
Нитрит натрия КаК02, кроме использования с нитратами в качестве теплопроводных расплавов, широко применяется в производстве азокрасителей, для ингибирования коррозии и консервации мяса (источник: http://wvvw.knigosvet.ru/ enc/nallka_i_tehnika/hilтнya/NATRI.htm]?page=0).
Калий. Одна из важнейших областей применения — получение надпе- роксида К09 прямым сжиганием металла на воздухе:
Надпероксид К02 — эффективный реагент в системах регенерации воздуха. Процесс протекает по уравнению
Металлический калий используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. Сплав калия с натрием служит теплоносителем в атомных реакторах. Он же является восстановителем в производстве титана. Из соединений калия следует отметить его хлорид (КС1), гидроксид (КОН), карбонат (К2С03) и нитрат КМ03.
Хлорид калия. Калий является важным элементом жизни растений, и развитие диких растений часто ограничивается доступностью калия.
При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть. Калийные удобрения являются основным видом калийсодержащей продукции (95%).
Больше всего используется КС1, на его долю приходится более 90% калия, используемого в качестве удобрений.
Гидроксид калия. Гидроксид калия КОН — сильное основание, относится к щелочам. Его традиционное название «едкое кали» отражает разъедающее действие этого вещества на живые ткани.
В промышленности гидроксид калия получают электролизом водных растворов хлорида или карбоната калия с железным или ртутным катодом (мировое производство составляет около 0,7 млн т/год).
Гидроксид калия применяют для получения жидкого мыла и различных соединений калия. Кроме того, он служит электролитом в щелочных аккумуляторах.
Карбонат калия. Карбонат калия К2С03 называют также поташом. Получают при действии углекислого газа на растворы гидроксида калия или суспензии карбоната магния в присутствии хлорида калия. Является побочным продуктом при переработке нефелина в глинозем.
Значительное количество карбоната калия содержится в растительной золе. Именно из нее и получали поташ вплоть до XX в., сжигая для этого древесину. Производство было сосредоточено в местах, богатых лесом, — кое-где в Европе, но в основном в России и Северной Америке. Больше всего калия в золе подсолнечника — 36,3%.
В золе дров оксида калия значительно меньше — от 3,2% (еловые дрова) до 13,8% (березовые дрова). Еще меньше калия в золе торфа. Карбонат калия применяется главным образом для производства высококачественного стекла, используемого в оптических линзах, трубках цветных телевизоров и флуоресцентных лампах.
Применяется и в производстве фарфора, красителей и пигментов.
Нитрат калия. Нитрат калия — отличное удобрение, содержащее одновременно калий и азот, однако применяется меньше, чем хлорид калия, из-за высокой стоимости производства. Нитрат калия используется для изготовления пиротехнических составов, в производстве стекла, спичек и черного пороха.
В процессе его приготовления при растирании белого кристаллического (исключительно сухого) нитрата калия КЫ03 с углем получается черная смесь. За это порох стали называть черным.
При его использовании возникает довольно большое количество дыма — смесь твердых продуктов сгорания — поэтому порох называется также дымным:
В настоящее время такой порох используется в охотничьих патронах и при изготовлении фейерверков.






