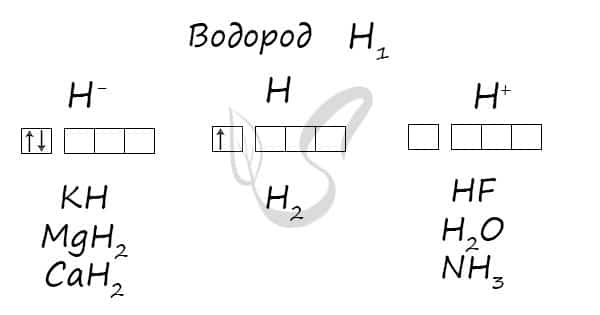
- Степени окисления
- Получение
- Химические свойства
- Вода
- Кристаллогидраты
- Пероксид водорода
- Гидриды — свойства, формулы и применение водородных соединений
- Типы и классификация
- Соединения с ионным типом связи
- Когда связь ковалентна
- 2.3.1. Химические свойства водорода и галогенов
- Взаимодействие водорода с простыми веществами
- с металлами
- с неметаллами
- Взаимодействие водорода со сложными веществами
- с оксидами металлов
- c оксидами неметаллов
- c кислотами
- c солями
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- водородом
- фосфором
- серой
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- Свойства, типы, номенклатура и примеры гидридов / химия
- Как образуются гидриды?
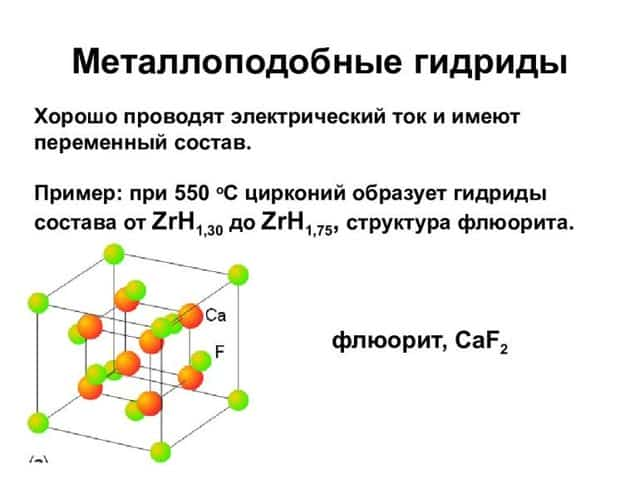
- Физико-химические свойства гидридов
- Гидриды металлов
- Неметаллические гидриды
- Номенклатура, как они названы?
- примеров
- Гидриды металлов
- Неметаллические гидриды
- ссылки
- Свойства водорода — урок. Химия, 9 класс
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
- H2 + O2 → (t) H2O
- H2 + F2 → HF (со взрывом в темноте)
- H2 + Cl2 → (t) HCl (со взрывом только на свету)
- H2 + N2 → NH3
- H2 + S → H2S
- H2 + ZnO → Zn + H2O
- Как окислитель реагирует с металлами

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- C + H2O → CO + H2
- H2O + CO → (кат.) CO2 + H2
- H2O + CH4 → (кат.) CO + H2
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды. K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления! CaO + H2O → Ca(OH)2 P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3). Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания) Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании) 
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата меди.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
- Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
- K2O2 + H2O → KOH + H2O2
- BaO2 + H2SO4 → BaSO4 + H2O2
- В разбавленных растворах пероксид водорода легко разлагается:
- H2O2 → H2O + O2↑
- Также перекись проявляет окислительные свойства:
- KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Гидриды — свойства, формулы и применение водородных соединений
Время на чтение: 21 минута 
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:

- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:

- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
2.3.1. Химические свойства водорода и галогенов
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s1. С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов.
Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов.
Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
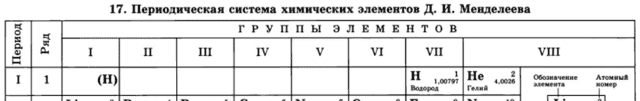
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
- Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
- Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
- При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
- В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
| F2 | Светло-желтый газ с резким раздражающим запахом |
| Cl2 | Желто-зеленый газ с резким удушливым запахом |
| Br2 | Красно-бурая жидкость с резким зловонным запахом |
| I2 | Твердое вещество с резким запахом, образующее черно-фиолетовые кристаллы |
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns2np5, где n – номер периода таблицы Менделеева, в котором расположен галоген.
Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике.
Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
F2 > Cl2 > Br2 > I2
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ.
Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены.
К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
- При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
- Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
- Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
- Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5).
При этом происходит образование пентафторида фосфора:
- При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
- При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
- Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
- Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
- Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
- Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
- Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
- Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
- а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
Свойства, типы, номенклатура и примеры гидридов / химия
гидрид водород в своей анионной форме (H-) или соединения, которые образуются из комбинации химического элемента (металлического или неметаллического) с водородным анионом. Из известных химических элементов водород является самой простой структурой, потому что когда он находится в атомном состоянии, в его ядре есть протон и электрон.
Несмотря на это, водород обнаруживается только в его атомной форме в условиях довольно высоких температур. Другой способ распознавания гидридов состоит в том, когда наблюдается, что один или несколько центральных атомов водорода в молекуле имеют нуклеофильное поведение в качестве восстановителя или даже в качестве основания..
Таким образом, водород обладает способностью объединяться с большинством элементов таблицы Менделеева с образованием различных веществ..
индекс
- 1 Как образуются гидриды?
- 2 Физико-химические свойства гидридов
- 3 Гидрида металла
- 4 неметаллических гидрида
- 5 Номенклатура как они названы?
- 6 примеров
- 6.1 Гидриды металлов
- 6.2 Неметаллические гидриды
- 7 ссылок
Как образуются гидриды?
Гидриды образуются, когда водород в его молекулярной форме связан с другим элементом — либо металлического, либо неметаллического происхождения — непосредственно путем диссоциации молекулы с образованием нового соединения..
Таким образом, водород образует связи ковалентного или ионного типа, в зависимости от типа элемента, с которым он соединен. В случае ассоциации с переходными металлами образуются межузельные гидриды с физическими и химическими свойствами, которые могут сильно варьироваться от одного металла к другому..
Существование гидридных анионов в свободной форме ограничено применением экстремальных условий, которые не возникают легко, поэтому в некоторых молекулах правило октета не соблюдается.
Возможно, что другие правила, связанные с распределением электронов, не приводятся, поскольку для объяснения образования этих соединений необходимо применять выражения связей нескольких центров..
Физико-химические свойства гидридов
С точки зрения физических и химических свойств можно сказать, что характеристики каждого гидрида зависят от типа связи, которая осуществляется.
Например, когда гидридный анион связан с электрофильным центром (обычно это ненасыщенный атом углерода), образующееся соединение ведет себя как восстановитель, применение которого очень широко распространено в химическом синтезе..
Напротив, в сочетании с такими элементами, как щелочные металлы, эти молекулы реагируют со слабой кислотой (кислотой Бренстеда) и ведут себя как сильные основания, выделяя газообразный водород. Эти гидриды очень полезны в органическом синтезе.
Затем наблюдается, что природа гидридов очень разнообразна, способна образовывать дискретные молекулы, твердые вещества ионного типа, полимеры и многие другие вещества..
По этой причине они могут быть использованы в качестве осушителей, растворителей, катализаторов или промежуточных соединений в каталитических реакциях. У них также есть многократное использование в лабораториях или отраслях промышленности для различных целей.
Гидриды металлов
Существует два типа гидридов: металлический и неметаллический..
Металлические гидриды — это те бинарные вещества, которые образуются в результате сочетания металлического элемента с водородом, обычно электроположительного, такого как щелочная или щелочно-земельная, но также включают промежуточные гидриды..
Это единственный тип реакции, в котором водород (степень окисления которого обычно равна +1) имеет дополнительный электрон на своем внешнем уровне; то есть его валентное число преобразуется в -1, хотя природа связей в этих гидридах не была полностью определена несоответствием ученых предмета.
Гидриды металлов обладают некоторыми свойствами металлов, такими как их твердость, проводимость и яркость; но в отличие от металлов гидриды обладают определенной хрупкостью, и их стехиометрия не всегда соответствует весовым законам химии.
Неметаллические гидриды
Этот тип гидрида возникает в результате ковалентной связи между неметаллическим элементом и водородом, так что неметаллический элемент всегда имеет самую низкую степень окисления, чтобы генерировать один гидрид с каждым.
Также установлено, что соединения этого типа по большей части газообразны в стандартных условиях окружающей среды (25 ° С и 1 атм). По этой причине многие неметаллические гидриды имеют низкие точки кипения из-за сил Ван-дер-Ваальса, которые считаются слабыми.
Некоторые гидриды этого класса представляют собой дискретные молекулы, другие принадлежат к группе полимеров или олигомеров, и даже водород, который прошел процесс хемосорбции на поверхности, может быть включен в этот список..
Номенклатура, как они названы?
- Чтобы написать формулу гидридов металлов, начните с написания металла (символ металлического элемента), за которым следует водород (MH, где М — металл).
- Называть их начинается со слова гидрид, за которым следует название металла («М гидрид»), поэтому LiH читается как «гидрид лития», CaH2 на нем написано «гидрид кальция» и так далее.
- В случае неметаллических гидридов, противоположное написано для металлических гидридов; то есть начинается с записи водорода (его символа), полученного неметаллом (НХ, где Х — неметалл).
- Чтобы назвать их, начните с названия неметаллического элемента и добавьте суффикс «уро», заканчивающийся словами «водород» («X-uro de водород»), поэтому HBr читается как «бромистый водород», H2S читает «сероводород» и так далее.
примеров
Существует много примеров гидридов металлов и неметаллов с различными характеристиками. Вот некоторые из упомянутых:
Гидриды металлов
- — LiH (гидрид лития).
- — NaH (гидрид натрия).
- — KH (гидрид калия).
- — CsH (гидрид цезия).
- — RbH (гидрид рубидия).
- — Бех2 (Гидрид бериллия).
- — MgH2 (гидрид магния).
- — CaH2 (гидрид кальция).
- — WRS2 (гидрид стронция).
- — ба2 (гидрид бария).
- — AlH3 (гидрид алюминия).
- — SrH2 (гидрид стронция).
- — MgH2 (гидрид магния).
- — CaH2 (гидрид кальция).
Неметаллические гидриды
- — HBr (бромистый водород).
- — HF (фтористый водород).
- — HI (йодистый водород).
- — HCl (хлористый водород).
- — H2S (сероводород).
- — H2Те (теллурид водорода).
- — H2Se (селенид водорода).
ссылки
- Wikipedia. (2017). Wikipedia. Получено с en.wikipedia.org
- Чанг, Р. (2007). Химия. (9-е изд). McGraw-Hill.
Свойства водорода — урок. Химия, 9 класс
Водород имеет молекулярное строение. Его молекула H2 состоит из двух атомов, соединённых ковалентной неполярной связью.
При комнатной температуре водород представляет собой бесцветный газ без запаха и вкуса. Это самое лёгкое вещество на Земле. Его плотность равна примерно (0,09) г/дм³. Водород в (14,5) раз легче воздуха.
В воде водород растворяется плохо (примерно (2) объёма на (100) объёмов воды), но может поглощаться некоторыми металлами. Например, (1) объём палладия может растворить до (900) объёмов водорода.
Температура кипения водорода низкая. Она равна (–253) °С. Ниже температура кипения только у гелия.
Молекулы водорода благодаря своей малой массе и размерам могут проникать сквозь стенки сосуда, в котором он содержится. Заполненный водородом шарик через некоторое время сдувается. При температуре (300)–(600) °С водород способен диффундировать сквозь стенки стеклянного или металлического сосуда.
Химические свойства
При комнатной температуре химическая активность водорода низкая. Она значительно повышается при нагревании.
1. Взаимодействие с простыми веществами-неметаллами (кроме фосфора, кремния, инертных газов).
- Водород реагирует с кислородом. При этом образуется вода:
2H2+O2=t2H2O.
Смесь водорода с кислородом или с воздухом взрывоопасна.
- При освещении или нагревании идёт реакция с хлором, и образуется хлороводород:
H2+Cl2=hν2HCl.
Подобным образом водород реагирует и с другими галогенами: фтором, бромом, иодом.
- Если водород пропускать над нагретой серой, то образуется сероводород:
H2+S=tH2S.
- В присутствии катализатора при повышенном давлении водород реагирует с азотом с образованием аммиака:
N2+3H2=t,p,k2NH3.
Обрати внимание!
В реакциях с неметаллами водород является восстановителем.
2. Взаимодействие с простыми веществами-металлами.
- При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:
- 2Na+H2=t2NaH,
- Ca+H2=tCaH2.
Обрати внимание!
В реакциях с металлами водород является окислителем.
3. Взаимодействие со сложными веществами.
- Водород способен реагировать с оксидами металлов (кроме оксидов щелочных и щелочноземельных металлов, бериллия, магния, алюминия):
WO3+3H2=tW+3H2O,
CuO+H2=tCu+H2O.
- Водород реагирует с угарным газом с образованием метилового спирта:
CO+2H2→CH3OH.
- Водород вступает в реакции со многими органическими веществами.






