- Реакции, взаимодействие алюминия. Уравнения реакции алюминия с веществами
- Реакции, взаимодействие алюминия с неметаллами. Уравнения реакции:
- Реакции, взаимодействие алюминия с полуметаллами. Уравнения реакции:
- Реакции, взаимодействие алюминия с оксидами. Уравнения реакции:
- Реакции, взаимодействие алюминия с солями. Уравнения реакции:
- Реакции, взаимодействие алюминия с кислотами. Уравнения реакции:
- Реакции, взаимодействие алюминия с основаниями. Уравнения реакции:
- Реакции, взаимодействие алюминия с водородсодержащими соединениями. Уравнения реакции:
- 2.2.3. Характерные химические свойства алюминия
- Взаимодействие алюминия с простыми веществами
- с кислородом
- с галогенами
- с серой
- с азотом
- с углеродом
- Взаимодействие алюминия со сложными веществами
- с водой
- с оксидами металлов
- с кислотами-неокислителями
- с кислотами-окислителями
- -концентрированной серной кислотой
- — концентрированной азотной кислотой
- — разбавленной азотной кислотой
- со щелочами
- Характерные химические свойства солей
- Классификация солей
- Химические свойства солей
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
- Учебная цель: обобщить знания о металлах и их свойствах.
- Образовательные результаты, заявленные во ФГОС третьего поколения:
- Обучающийся должен знать:
- — понятие металлов;
- — строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- — понятие металлической связи; типы кристаллических решеток разных металлов;
- — зависимость физических свойств металлов от их строения;
- — распространенность металлов в природе в зависимости от их активности.
- Обучающийся должен уметь:
— характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
— устанавливать связь между строением веществ и их свойствами.
Задачи практического занятия:
-
Закрепить теоретические знания о свойствах металлов.
-
Ответить на вопросы для закрепления теоретического материала.
-
Выполнить практические задачи.
-
Ответить на вопросы для контроля.
Обеспеченность занятия:
-
Учебно-методическая литература:
- Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
- Периодическая система химических элементов им. Д.И. Менделеева;
- Ряд стандартных электродных потенциалов Е0;
- Типы кристаллических решеток металлов.
- Ряд напряженности металлов.
-
Тетрадь для практических и контрольных работ.
-
Ручка.
- Краткие теоретические и учебно-методические материалы по теме практического занятия
- Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
- Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение.
По плотности металлы разделяют на легкие (до 3000 кг/м3) и тяжелые (от 6000 кг/м3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К).
Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
M – ne = Mn+
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
- По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е0 (приложение 4).
- Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
- Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
- Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
- Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
- Элементарная ячейка характеризует особенности строения кристалла.
- В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
- Вопросы для закрепления теоретического материала к практическому занятию
-
Перечислить общие физические свойства металлов.
-
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
-
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
-
Решить предложенные задачи.
-
Правильно оформить их в тетрадь для практических и контрольных работ.
-
Ответить на вопросы для контроля.
-
Отчитаться о выполненной работе преподавателю.
Задание 1
| Напишите уравнение реакции взаимодействия металла с кислотой | |
| Вариант 1 | Вариант 2 |
| алюминий + серная кислота | железо + соляная кислота |
- Образец решения задания № 1
- Напишите управление реакции цинка с соляной кислотой.
- Алгоритм решения
- Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
- Zn + 2HCl ZnCl2 + H2
- В результате реакции выделяется газ (H2) водород.
- Задание 2
| Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла | |
| Вариант 1 | Вариант 2 |
| алюминий + железный купорос | железо + медный купорос |
- Образец решения задания № 2
- Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
- Алгоритм решения
- Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
- Zn + CuSO4 ZnSO4 + Cu
- В результате реакции выделяется металлическая медь (красный осадок).
- Задание 3
| Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится. | |
| Вариант 1 | Вариант 2 |
| Магний оксид магния хлорид магния гидроксид магния сульфат магния Mg MgO MgCl2 Mg(OH)2 MgSO4 | Медь оксид меди сульфат меди гидроксид меди оксид меди Cu CuO CuSO4 Cu(OH)2 CuO |
Образец решения задания № 3
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
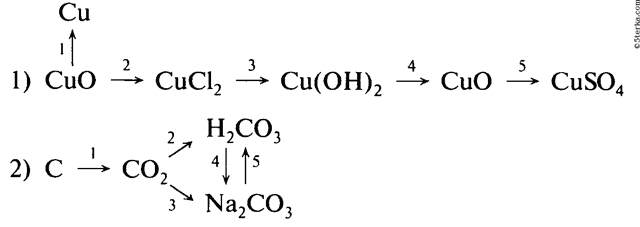
Алгоритм решения
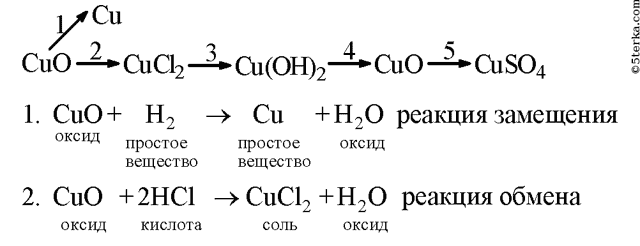
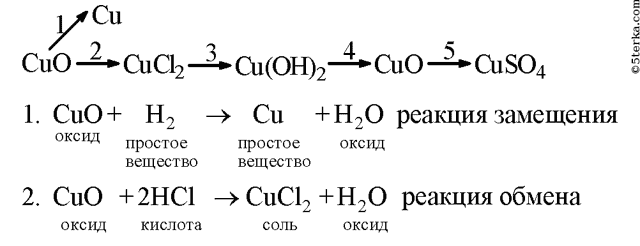
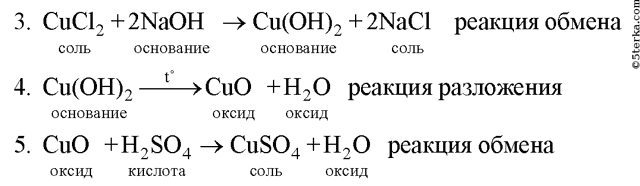
Вопросы для контроля
-
Перечислите основные химические свойства металлов?
-
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
-
Запишите, где в вашей профессии и в жизни применяются металлы.
- Форма контроля выполнения практического задания:
- Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
- 5
Реакции, взаимодействие алюминия. Уравнения реакции алюминия с веществами
Алюминий реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, основаниями, солями и пр. веществами.
- Реакции, взаимодействие алюминия с неметаллами
- Реакции, взаимодействие алюминия с полуметаллами
- Реакции, взаимодействие алюминия с оксидами
- Реакции, взаимодействие алюминия с солями
- Реакции, взаимодействие алюминия с кислотами
- Реакции, взаимодействие алюминия с основаниями
- Реакции, взаимодействие алюминия с водородсодержащими соединениями
Реакции, взаимодействие алюминия с неметаллами. Уравнения реакции:
- 1. Реакция взаимодействия алюминия и серы:
- 2Al + 3S → Al2S3 (t = 150-200 °C).
- Реакция взаимодействия алюминия и серы происходит с образованием сульфида алюминия.
- 2.
Реакция взаимодействия алюминия и фосфора:
- 4Al + P4 → 4AlP (t = 500-800 °C).
Реакция взаимодействия алюминия и фосфора происходит с образованием фосфида алюминия.
Реакция протекает в атмосфере водорода.
- 3. Реакция взаимодействия алюминия и селена:
- 3Se + 2Al → Al2Se3 (t = 600-650 °C).
- Реакция взаимодействия алюминия и селена происходит с образованием селенида алюминия.
- 4. Реакция взаимодействия алюминия и кислорода:
- 4Al + 3O2 → 2Al2O3 (t°).
Реакция взаимодействия алюминия и кислорода происходит с образованием оксида алюминия. Реакция представляет собой сгорание порошка алюминия на воздухе.
- 5. Реакция взаимодействия алюминия и углерода:
- 4Al + 3C → Al4C3 (t = 1500-1700 °C).
- Реакция взаимодействия алюминия и углерода происходит с образованием карбида алюминия.
- 6. Реакция взаимодействия алюминия и фтора:
- 2Al + 3F2 → 2AlF3 (t = 600 °C).
- Реакция взаимодействия алюминия и фтора происходит с образованием фторида алюминия.
- 7. Реакция взаимодействия алюминия и хлора:
- 2Al + 3Cl2 → 2AlCl3.
- Реакция взаимодействия алюминия и хлора происходит с образованием хлорида алюминия.
- 8. Реакция взаимодействия алюминия и брома:
- 2Al + 3Br2 → 2AlBr3.
- Реакция взаимодействия алюминия и брома происходит с образованием бромида алюминия.
- 9. Реакция взаимодействия алюминия и йода:
- 2Al + 3I2 → 2AlI3 (kat = капля H2O).
- Реакция взаимодействия алюминия и йода происходит с образованием йодида алюминия.
- 10. Реакция взаимодействия алюминия и азота:
- 2Al + N2 → 2AlN (t = 800-1200 °C).
- Реакция взаимодействия алюминия и азота происходит с образованием нитрида алюминия.
Реакции, взаимодействие алюминия с полуметаллами. Уравнения реакции:
- 1. Реакция взаимодействия алюминия и сурьмы:
- Sb + Al → AlSb (t°).
- Реакция взаимодействия алюминия и сурьмы происходит с образованием стибида алюминия.
- 2. Реакция взаимодействия алюминия и теллура:
- 3Te + 2Al → Al2Te3 (t > 500 °C).
Реакция взаимодействия алюминия и теллура происходит с образованием теллурида алюминия.
Реакция протекает в атмосфере аргона.
Реакции, взаимодействие алюминия с оксидами. Уравнения реакции:
1. Реакция взаимодействия алюминия и воды:
2Al + 6H2O → 2Al(OH)3 + 3H2.
Реакция взаимодействия алюминия и воды происходит с образованием гидроксида алюминия и водорода. Реакция протекает при условии отсутствия оксидной пленки на алюминии.
- 2. Реакция взаимодействия алюминия и оксида алюминия:
- 4Al + Al2O3 ⇄ 3Al2O (t = 1450 °C).
- Реакция взаимодействия алюминия и оксида алюминия происходит с образованием оксида алюминия (I).
- 3. Реакция взаимодействия алюминия и оксида железа (III):
- Fe2O3 + 2Al → 2Fe + Al2O3 (t°).
- Реакция взаимодействия алюминия и оксида железа (III) происходит с образованием железа и оксида алюминия.
- 4. Реакция взаимодействия алюминия и оксида хрома:
- Cr2O3 + 2Al → 2Cr + Al2O3 (t = 800 °C).
- Реакция взаимодействия алюминия и оксида хрома происходит с образованием хрома и оксида алюминия.
- 5. Реакция взаимодействия алюминия и оксида марганца:
- Mn2O3 + 2Al → Al2O3 + 2Mn (t = 800 °C),
- 3MnO + 2Al → 3Mn + Al2O3 (t = 800 °C).
- Реакция взаимодействия алюминия и оксида марганца происходит с образованием марганца и оксида алюминия.
- 6. Реакция взаимодействия алюминия и оксида лития:
- 3Li2O + 2Al → 6Li + Al2O3 (t > 1000 °C).
- Реакция взаимодействия алюминия и оксида лития происходит с образованием лития и оксида алюминия.
- 7. Реакция взаимодействия алюминия и оксида меди:
- 3CuO + 2Al → 3Cu + Al2O3 (t = 1000-1100 °C).
- Реакция взаимодействия алюминия и оксида меди происходит с образованием меди и оксида алюминия.
- 8. Реакция взаимодействия алюминия и оксида бария:
- 3BaO + 2Al → 3Ba + Al2O3 (t = 1200 °C).
Реакция взаимодействия алюминия и оксида бария происходит с образованием бария и оксида алюминия. Реакция протекает в вакууме.
- 9. Реакция взаимодействия алюминия и оксида кальция:
- 2Al + 6CaO → 3CaO•Al2O3 + 3Ca или 2Al + 6CaO → Ca3Al2O6 + 3Ca (t°),
- 4CaO + 2Al → 3Ca + Ca(AlO2)2 (t = 1200 °C).
- Реакция взаимодействия алюминия и оксида кальция происходит с образованием в первом случае – оксида алюминия-кальция (алюмината трикальция) и кальция, во втором – кальция и алюмината кальция.
- 10. Реакция взаимодействия алюминия и оксида бора:
- B2O3 + 2Al → Al2O3 + 2B (t = 800-900 °C).
- Реакция взаимодействия алюминия и оксида бора происходит с образованием оксида алюминия и бора.
Реакции, взаимодействие алюминия с солями. Уравнения реакции:
- 1. Реакция взаимодействия алюминия и карбоната лития:
- 3Li2CO3 + 2Al → 6Li + Al2O3 + 3CO2 (t = 550-600 °C).
- Реакция взаимодействия карбоната лития и алюминия происходит с образованием лития, оксида алюминия и оксида углерода.
- 2.
Реакция взаимодействия алюминия и бромида циркония (IV):
- 3ZrBr4 + Al → 3ZrBr3 + AlBr3.
- Реакция взаимодействия бромида циркония (IV) и алюминия происходит с образованием бромида циркония (III) и бромида алюминия.
- 3.
Реакция взаимодействия алюминия и хлорида циркония (IV):
- 3ZrCl4 + Al → 3ZrCl3 + AlCl3 (t = 230-270 °C).
- Реакция взаимодействия хлорида циркония (IV) и алюминия происходит с образованием хлорида циркония (III) и хлорида алюминия.
- 4.
Реакция взаимодействия алюминия и хлорида кальция:
- 3CaCl2 + 2Al → 3Ca + 2AlCl3 (t = 600-700 °C).
- Реакция взаимодействия хлорида кальция и алюминия происходит с образованием кальция и хлорида алюминия.
- 5.
Реакция взаимодействия алюминия и йодида циркония (IV):
- 3ZrI4 + Al → 3ZrI3 + AlI3 (t = 310 °C).
- Реакция взаимодействия йодида циркония (IV) и алюминия происходит с образованием йодида циркония (III) и йодида алюминия.
- 6.
Реакция взаимодействия алюминия, ортофосфата натрия и воды:
- 2Al + 2Na3PO4 + 8H2O → 2Na[Al(OH)4] + 2Na2HPO4 + 3H2 (t°).
Реакция взаимодействия алюминия, ортофосфата натрия и воды происходит с образованием тетрагидроксоалюмината натрия, гидроортофосфата натрия и водорода. В ходе реакции используется концентрированный раствор ортофосфата натрия. Реакция протекает при кипении.
- 7. Реакция взаимодействия алюминия и хлорида железа:
- Al + FeCl3 → Fe + AlCl3 (t = 200 °C).
- Реакция взаимодействия хлорида железа и алюминия происходит с образованием хлорида алюминия и железа.
- 8. Реакция взаимодействия алюминия и хлорида меди:
- 3CuCl2 + 2Al → 2AlCl3 + 3Cu.
- Реакция взаимодействия хлорида меди и алюминия происходит с образованием хлорида алюминия и меди.
- 9. Реакция взаимодействия алюминия и хлорида алюминия:
- 2Al + AlCl3 ⇄ 3AlCl (t > 800 °C).
- Реакция взаимодействия хлорида алюминия и алюминия происходит с образованием монохлорида алюминия.
Реакции, взаимодействие алюминия с кислотами. Уравнения реакции:
- 1. Реакция взаимодействия алюминия и азотной кислоты:
- Al + 4HNO3 → Al(NO3)3 + NO + 2H2O,
- Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O.
Реакция взаимодействия алюминия и азотной кислоты происходит с образованием в первом случае – нитрата алюминия, оксида азота (II) и воды, во втором – нитрата алюминия, оксида азота (IV) и воды.
В ходе первой реакции используется разбавленный раствор азотной кислоты, в ходе второй – концентрированный раствор азотной кислоты.
Аналогичные реакции протекают и с другими минеральными кислотами.
Реакции, взаимодействие алюминия с основаниями. Уравнения реакции:
1. Реакция взаимодействия алюминия, гидроксида натрия и воды:
2Al + 6H2O + 6NaOH → 2Na3[Al(OH)6] + 3H2.
Реакция взаимодействия алюминия, гидроксида натрия и воды происходит с образованием гексагидроксоалюмината натрия и водорода. Реакция протекает в горячей воде и концентрированном растворе гидроксида натрия.
2. Реакция взаимодействия алюминия, гидроксида калия и воды:
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2.
Реакция взаимодействия алюминия, гидроксида калия и воды происходит с образованием тетрагидроксоалюмината калия и водорода. Реакция протекает в горячем концентрированном растворе гидроксида калия.
Реакции, взаимодействие алюминия с водородсодержащими соединениями. Уравнения реакции:
1. Реакция взаимодействия алюминия и фтороводорода:
2Al + 6HF → 2AlF3 + 3H2 (t = 450-500 °C).
Реакция взаимодействия алюминия и фтороводорода происходит с образованием фторида алюминия и водорода. В ходе реакции используется разбавленный раствор фтороводорода.
- 2. Реакция взаимодействия алюминия и сероводорода:
- 2Al + 3H2S → Al2S3 + 3H2 (t = 600-1000 °C).
- Реакция взаимодействия алюминия и сероводорода происходит с образованием сульфида алюминия и водорода.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
2.2.3. Характерные химические свойства алюминия
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s22s22p63s23p1. Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне.
В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3.
Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
4Аl + 3О2 = 2Аl2О3
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
- 2Al + 3I2 =2AlI3
- С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
- 2Al + 3Br2 = 2AlBr3
- Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
- 2Al + 3Cl2 = 2AlCl3
с серой
При нагревании до 150-200 оС или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 oC образуется нитрид алюминия:
с углеродом
При температуре около 2000oC алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде.
При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000оС. В результате этой реакции образуется высокочистое расплавленное железо:
2AI + Fe2O3 = 2Fe + Аl2О3
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
- а) 2Аl + 3Н2SO4(разб.) = Аl2(SO4)3 + 3H2↑
- 2Аl0 + 6Н+ = 2Аl3+ + 3H20;
- б) 2AI + 6HCl = 2AICl3 + 3H2↑
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
— разбавленной азотной кислотой
- Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
- 8Al + 30HNO3(разб.) = 8Al(NO3)3 +3N2O↑ + 15H2O
- 8Al + 30HNO3(оч. разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
со щелочами
- Алюминий реагирует как с водными растворами щелочей:
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑
- так и с чистыми щелочами при сплавлении:
- В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
- Аl2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
- Аl2О3 + 2NaOH = 2NaAlO2 + Н2О
- В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
- 2Al + 6H2O = 2Al(OH)3 + 3H2↑
- Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
- Al(OH)3 + NaOH = Na[Al(OH)4]
Характерные химические свойства солей
Характерные химические свойства солей добавить в закладки
Соли –это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металлов.
Общим способом получения солей является взаимодействие оснований с кислотами:
NaOH + HCl = NaCl + H2O (так же эту реакцию называют реакцией нейтрализации, т.к. соли не имеют среды – она нейтральна)
Общая формула солей: Mex(Ac)y, где
- Me – металл,
- x и y – индексы,
- Ac – кислотный остаток.
Классификация солей
(III) Приставка «ди» используется, если в молекуле основной соли с одним атомом Me связаны с гидроксильными группами.
- Средние (нормальные) соли – это продукты полного замещения атомов водорода на металл.
Название средней соли = название Ac + название Me + валентность Me
- NaCl – хлорид натрия
- Fe(NO3)2 — нитрат железа (II)
- Кислые соли – это продукты неполного замещения атомов водорода на Me.
Название кислой соли = «Гидро» или «Дигидро» + название Ac + название Me + валентность Me
- NaHCO3 – гидрокарбонат натрия
- KH2PO4 – дигидрофосфат калия
- Основные соли – это соли, которые кроме ионов Me и Ac содержат гидроксогруппы.
Название основной соли = «Гидроксо-» или «Дигидроксо-» + название Ac + название Me + валентность Me
- CaOHCl – гидроксохлорид кальция
- Ca(OH)2SO4 – гидроксосульфат кальция
- Fe(OH)2NO3 – дигидроксонитрат железа
- Комплексные соли – соли, содержащие комплексный ион.
- [Ag(NH3)2]Сl – хлорид диаммин серебра (I)
- [Cu(NH3)4]SO4 – сульфат тетрааммин меди (II)
- K4[Fe(CN)6] – гексацианоферрат (II) калия
Химические свойства солей
I. Средние соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и анионы Ac.
К примеру, хлорид калия в водном растворе распадается на катионы калия и анионы хлора.
KCl ↔ K— + Cl—
- Соли могут взаимодействовать с металлами, при этом каждый Me, стоящий левее в ряду напряжений Me, способен вытеснять Me, стоящие правее, из их солей.
- Щелочные и щелочноземельные металлы с солями реагировать не будут, так как вступают в реакцию с водой.
- Например, при взаимодействии сульфата меди с железом, происходит замещение меди железом, так как железо более активный металл, чем медь и находится в электрохимическом ряду напряжений левее водорода.
- CuSO4 + Fe → FeSO4 + Cu↓
При взаимодействии сульфида железа с цинком происходит тот же процесс, но в данной реакции более активным металлом является цинк. Цинк вытесняет железо из соединения, в результате происходит образование чистого железа.
FeS + Zn → ZnS + Fe↓
- Реакция растворов солей с растворами щелочей возможна в том случае, когда образующиеся основание или соль выпадают в осадок.
Взаимодействие хлорида железа (III) с раствором гидроксида калия является качественной реакцией на ионы Fe3+. Продуктом реакции будет гидроксид железа (III), который представляет собой бурый осадок с амфотерными свойствами.
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой кислоты или нерастворимой соли.
В представленной ниже реакции осуществляется взаимодействие между хлоридом бария и серной кислотой. Продуктами реакции являются нерастворимая соль и сильная кислота. Данная реакция является качественной на сульфаты, так как образуется сульфат бария – осадок белого цвета.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
- Для солей характерно взаимодействие между собой. В этом случае одним из продуктов реакции должна быть нерастворимая соль.
Взаимодействие нитрата серебра с хлоридом калия сопровождается выпадением осадка белого цвета – хлорида серебра. Эта реакция является качественной на хлорид-ионы.
AgNO3 + KCl → AgCl↓ + KNO3
- При нагревании разлагаются соли слабых кислот, соли аммония, а также образованные сильными окислителями или восстановителями.
- Все карбонаты при термическом разложении распадаются на основный оксид и углекислый газ.
- При разложении нитратов следует учитывать следующие условия:
- Если металл находится в ряду напряжений левее магния, то в результате реакции образуется нитрит и кислород. Реакция протекает по следующей схеме:
- Если металл расположен в электрохимическом ряду напряжений между магнием и медью, при этом будет происходить образование оксида металла, диоксида азота и кислорода.
- Если металл находится в ряду напряжений металлов правее меди, при этом наблюдается образование металла, оксида азота (IV) и кислорода.
- Разложение солей аммония также может протекать по-разному. Во многом это зависит от того, каким кислотным остатком она образована.
- Если в состав соли аммония входит кислотный остаток летучей кислоты, то в результате будет образовываться аммиак и летучая кислота.
- Если соль аммония образована нелетучей кислотой, то продуктами реакции будет аммиак и кислая соль.
- Если кислотный остаток соли проявляет окислительные свойства, то в результате разложения образуется молекулярный азот или оксид азота (I).
II. Кислые соли
- Растворимые соли в водных растворах диссоциируют на ионы – катионы Me и сложный анион Ac. Диссоциация протекает в две стадии. Первая стадия всегда необратима, по второй стадии протекает обратимая диссоциация.
KHSO4 → K— + HSO4— HSO4— ↔ H+ + SO42—
- Кислые соли могут взаимодействовать с металлами, стоящими левее водорода. Не стоит в таких реакциях использовать щелочные металлы, так как они прежде всего реагируют с водой. Реакция щелочных металлов с водой протекает бурно с выделением большого количества энергии, при таких условиях может произойти взрыв.
В результате данной реакции образуется средняя соль и водород. Гидросульфат калия при взаимодействии с магнием образует в качестве продуктов реакции молекулярный водород, сульфаты магния и калия.
2KHSO4 + Mg → H2↑ + MgSO4 + K2SO4
- При взаимодействии кислой соли с раствором щелочи образуется средняя соль и вода. Гидрокарбонат натрия способен вступать в реакцию с раствором щелочи, продуктами реакции будут сульфит натрия и вода.
NaHCO3 + NaOH → Na2SO3 + H2O
- При взаимодействии соли с кислотой, для того чтобы осуществилась реакция, необходимо образование более слабой или летучей кислоты. Этот процесс можно рассмотреть на примере реакции гидросульфида калия с серной кислотой. Продуктами реакции является летучая кислота – сероводородная, а также сульфат калия.
2KHS + H2SO4 → K2SO4 + 2H2S
- Для кислых солей характерно взаимодействие со средними солями. Однако, при такой реакции должны образоваться вода, газ или осадок. В противном случае взаимодействие происходить не будет. Очень хорошо это просматривается на примере взаимодействия гидросульфата калия и хлорида бария. Продуктами реакции будут сульфат бария – осадок белого цвета, сульфат калия и хлороводородная кислота.
2KHSO4 + BaSO4↓ + K2SO4 + 2HCl
- При нагревании некоторые соли разлагаются. Ярким примером может служить разложение гидрокарбонатов. В результате реакции образуется вода, углекислый газ и карбонат натрия.
- Реакции разложения гидрокарбонатов кальция и магния являются причиной образования накипи в водонагревательных приборах.
III. Основные соли
- Способны в водных растворах разлагаться на сложные катионы и анионы Ac. Диссоциация проходит в несколько ступеней, причем по первой ступени разложение проходит необратимо. Все последующие ступени протекают обратимо.
Al(OH)2CH3COO → Al(OH)2+ + CH3COO— Al(OH)2+ ↔ AlOH2+ + OH— Al(OH)2+ ↔ Al3+ + OH—
- Основные соли могут взаимодействовать с растворами щелочей с образованием нерастворимого основания и кислой соли. Гидроксонитрат железа (III) и раствор едкого калия при взаимодействии друг с другом образуют нитрат калия и гидрокисд железа (II) – осадок белого цвета.
Fe(OH)NO3 + KOH → Fe(OH)2↓ + KNO3
- При взаимодействии основной соли с кислотой, образуется средняя соль и вода. Взаимодействие гидроксохлорида меди (II) и соляной кислоты протекает с образованием хлорида меди (II) и воды.
CuOHCl + HCl → CuCl2 + H2O
- Характерно термическое разложение основных солей. При разложении дигидроксокарбоната меди (II) образуется оксид меди (II), углекислый газ и вода.
IV. Комплексные соли
- Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, то есть как сильные электролиты (первичная диссоциация).
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4—
Комплексные ионы, в свою очередь, диссоциируют как слабые электролиты, многоступенчато и обратимо. Это — вторичная диссоциация комплексных ионов.
- [Fe(CN)6]3— ⟷ [Fe(CN)5]2— + CN— [Fe(CN)5]2— ⟷ [Fe(CN)4]— + CN— [Fe(CN)4]— ⟷ [Fe(CN)3] + CN— [Fe(CN)3] ⟷ [Fe(CN)2]+ + CN— [Fe(CN)2]+ ⟷ [Fe(CN)2]2+ + CN— [Fe(CN)]2+ ⟷ Fe3+ + CN—
- Данную многоступенчатую диссоциацию можно выразить суммарно в виде следующего уравнения:
- [Fe(CN)6]3— ⟷ Fe3+ + 6CN—
- Комплексные соли способны вступать в реакции обмена со средними солями. В результате такой реакции образуется две другие соли – комплексная и средняя.
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]↓ + 3KCl
Данная реакция является качественной реакции на ионы Fe3+. Нерастворимое соединение, образовавшееся в результате реакции, обладает ультрамариновым цветом и получило название «берлинской лазури» или гексацианоферрат(II) железа(III)-калия.
- При нагревании комплексных солей происходит их разложение.
Тетрагидроксоалюминат натрия распадается на алюминат натрия и воду.
Na[Al(OH)4] → NaAlO2 + 2H2O
- При взаимодействии комплексной соли со средней, происходит разрушение комплексов за счёт образования малорастворимых соединений.
2[Cu(NH3)2]Cl + K2S → CuS↓ + 2KCl + 4NH3↑
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства кислот
- Взаимосвязь различных классов неорганических веществ






