- От Библии до наших дней
- Свойства натрия
- Минералы, месторождения
- Добыча и переработка
- Плюсы и минусы
- Натрий вокруг нас
- Купить металл
- Натрий – полезные свойства и опасность металла
- Что представляет собой
- История
- Формы нахождения в природе
- Месторождения, добыча
- Способы получения
- Физико-химические характеристики
- Где используется
- Промышленность
- Другие сферы
- Цены
- Значение для человека
- Питание
- Симптомы дефицита/избытка вещества
- Предостережение
- Натрий (Na, Natrium)
- Общая характеристика натрия
- Нахождение в природе
- Физические и химические свойства
- Суточная потребность в натрии
- Продукты питания богатые натрием
- Полезные свойства натрия и его влияние на организм
- Усвояемость натрия
- Взаимодействие с другими
- Применение натрия в жизни
- Признаки нехватки натрия
- Признаки избытка натрия
- Натрий — мягкий металл с интересными свойствами
- Свойства
- Это интересно
- Меры предосторожности
- Применение
- Натрий
- Нахождение в природе
- Получение
- Физические свойства
- Химические свойства
- Применение
- Изотопы натрия
- Биологическая роль
- Меры предосторожности
Главная › Металлы
10.10.2020
Соединения металлов натрия-калия контролируют солевой баланс в наших организмах. Нарушения этого баланса опасно для жизни. В составе крови соединения этих металлов создают своеобразный электролит, необходимый для работы любой клетки организма.
От Библии до наших дней
История героя статьи тянется с библейских времен. Именно в Библии упомянуто вещество, которым пользовались для мытья, отбеливания хлопковых тканей. В переводе слово νίτρον (нитрон) означает мыло или щелок.

Природной содой или щелоком из золы многие века люди пользовались для домашних нужд.
Свойства натрия
Характеристики:
- Легко режется ножом.
- Чистый натрий имеет белый серебристый цвет; на воздухе быстро покрывается слоем оксида Na2O.
- Структура кристаллической решетки объемноцентрированная, кубическая.
- Natrium легче воды; если бросить кусочек в воду, он будет плавать на ее поверхности.
Металл настолько активный, что хранят его в минеральном масле или в керосине, без доступа воздуха.
Химические свойства:
- Натрий реагирует с разбавленными кислотами, как рядовой металл.
- В реакции с концентрированными кислотами образуются продукты восстановления.
- Бурная реакция с водой идет с выделением водорода, поэтому металл загорается или взрывается.
- Как все щелочные металлы, активно реагирует со многими неметаллами.
Известен один стабильный изотоп — 23-Na.
| На́трий / Natrium (Na), 11 |
| 22,98976928 ± 0,00000002 а.е.м.[1] а. е. м. (г/моль) |
| [Ne] 3s1, 1s22s22p63s1 |
| 190 пм |
| 154 пм |
| 97 (+1e) пм |
| 0,93 (шкала Полинга) |
| -2,71 В |
| −1 (в алкалидах)[2]; 0; +1 (наиболее частая) |
| 495,6(5,14) кДж/моль (эВ) |
| 0,971 г/см³ |
| 370,96 К; 97,81 °C |
| 1156,1 К; 882,95 °C |
| 2,64 кДж/моль |
| 97,9 кДж/моль |
| 28,23[3] Дж/(K·моль) |
| 23,7 см³/моль |
| кубическая объёмноцентрированная |
| 4,2820 Å |
| 150 K |
| (300 K) 142,0 Вт/(м·К) |
| 7440-23-5 |
Рекомендуем: ЦВЕТНЫЕ МЕТАЛЛЫ — всё, кроме железа
Минералы, месторождения
В природе встречаются минералы:
- мирабилит (глауберова соль);
- галит (каменная соль);
- бура (формула Na2В4О7 • 10Н2О);
- криолит.

Месторождений металлического натрия на планете нет. В любом месте (даже в пустынях) найдется вода, с которой металл мгновенно прореагирует.
Добыча и переработка
Для производства натрия ведется добыча минералов во многих странах:
- Россия;
- США;
- Германия;
- Мексика;
- Италия.
 Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Основной способ промышленного получения натрия — электролиз NaOH или NaCl.
Возможно получение с помощью термического разложения NaN3.
Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», спектральный дублет 588,9950 и 589,5924 нм
Плюсы и минусы
Достоинства соединений натрия не перечислить. Самое главное — без него невозможна биологическая жизнь на планете.
К недостаткам можно отнести дороговизну натриевых реакторов (необходимость промежуточного контора, усиленные системы безопасности). Реакторы на БН дороже, чем ВВЭР (водо-водяные).
Натрий вокруг нас
Применение металла и его соединений чрезвычайно широко:
- Металлический Na работает теплоносителем в реакторах на быстрых нейтронах (БН) и в ионных ракетных двигателях.
 Металлический натрий, сохраняемый в минеральном масле
Металлический натрий, сохраняемый в минеральном масле - Восстановительные свойства применяют в получении тугоплавких металлов.
- NaCl, поваренная cоль — самый известный консервант и применяемое большинством вкусовое средство.
- Бензоат C6H5COONa — пищевая добавка Е211. Применяется в пищевой промышленности для производства газированных напитков, консервации мясных, рыбных, плодово-овощных изделий.
- Металл работает в натрий-серных аккумуляторах.
- Чилийская селитра (NaNO3) работает в качестве удобрений, в производстве стекла. В пищевой промышленности значится как пищевая добавка Е251.
Купить металл
Цена металлического Natrium за килограмм у разных производителей колеблется от 900 до 1500 руб/кг.
Натрий — соль жизни Ссылка на основную публикацию 
Натрий – полезные свойства и опасность металла
Этот химический элемент известен каждому. На бытовом уровне натрий – это родная поваренная соль. Без нее еда не еда.

Что представляет собой
- Натрий – это элемент периодической системы Дмитрия Менделеева под № 11.
- Мягкое серебристо-белое вещество, относится к металлам щелочной группы.
- Структура кристаллической решетки вещества – куб.
По составу вещество представляет собой два десятка изотопов, из которых только один стабилен.
Большинство не «живет» дольше минуты, «долгожитель» – радиоактивный изотоп Na-22 (более года).
Официальное обозначение вещества: Na, Natrium.
История
История взаимодействия человека с натрием исчисляется тысячелетиями:
- Натуральную соду использовали еще древние египтяне и иудеи: как мыло, консервант (при бальзамировании), отбеливатель, компонент красок, эмалей, пищевую приправу. На местных рынках продавали кусковую соду.
- Вещество упоминается Ветхим Заветом.
- Натрий как металл выделил в 1807 году Гемфри Дэви. Английский химик расплавил гидроксид вещества методом электролиза.
Термин «натрий» восходит к древнеегипетскому ntr. Одно из его значений – сода. Его переняла латынь: natrium – сода.
Название предложил шведский ученый Йенс Берцелиус – автор, «окрестивший» многие химические вещества.
Формы нахождения в природе
В свободном виде вещество в природе не зафиксировано, только минералы либо соединения.
Самые известные минералы: содалит, галит («каменная соль»), полевые шпаты.
Тонна земной коры содержит в среднем 25 кг натрия, литр воды морей и океанов – 10,5 г соединений вещества.
Месторождения, добыча
Залежи натриевого сырья, особенно полевые шпаты, рассредоточены по планете.
Например, галит добывают Украина, Индия, США, Польша, ФРГ.
В России крупнейшие месторождения разрабатываются в Крыму, Красноярском и Пермском краях, Архангельской, Иркутской, Волгоградской, Астраханской областях, Оренбуржье.
Добыча ведется открытым либо шахтным способом.
Способы получения
Традиционный способ получения натрия – восстановление металла по способу Девиля. Карбонат натрия загружают в емкость с углем и нагревают до 1000°C.
 Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Со времен промышленной революции основным стал электролиз. Исходное вещество – расплав хлорида натрия либо едкого натра.
Физико-химические характеристики
 Металлический натрий, сохраняемый в минеральном масле
Металлический натрий, сохраняемый в минеральном масле
Физические характеристики вещества:
- Режется ножом. По этому признаку его легко отличить от прочих металлов.
- Хорошо проводит тепло и ток. Это достоинство оценили промышленники.
- Свежесрезанная поверхность металла блестит.
- Тонкие пластины отсвечивают фиолетом.
- Под давлением серебристо-белый металл становится прозрачно-красным.
Более интересны химические свойства.
Это очень активный металл:
- На воздухе мгновенно окисляется.
- Вступает в реакцию с большинством веществ.
Взаимодействие вещества с водой подобно шоу. Кусочек натрия всплывает, нагревает воду, плавится. Наконец становится белым шариком, который хаотично плавает по водной поверхности.
| На́трий / Natrium (Na), 11 |
| 22,98976928 ± 2,0E−8 а. е. м. (г/моль) |
| [Ne] 3s1, 1s22s22p63s1 |
| 190 пм |
| 154 пм |
| 97 (+1e) пм |
| 0,93 (шкала Полинга) |
| -2,71 В |
| −1 (в алкалидах); 0; +1 (наиболее частая) |
| 495,6(5,14) кДж/моль (эВ) |
| 0,971 г/см³ |
| 370,96 К; 97,81 °C |
| 1156,1 К; 882,95 °C |
| 2,64 кДж/моль |
| 97,9 кДж/моль |
| 28,23 Дж/(K·моль) |
| 23,7 см³/моль |
| кубическая объёмноцентрированная |
| 4,2820 Å |
| 150 K |
| (300 K) 142,0 Вт/(м·К) |
| 7440-23-5 |
Реакцию венчает фонтан водорода. Однако газ способен самопроизвольно загореться.
Присутствие натрия в образце обнаруживают по ярко-желтому цвету пламени.
Где используется
Человек использует натрий как чистый металл и соединения.
Промышленность
Главные потребители сырья – металлургия и химия. Здесь металл нашел применение как восстановитель.
Сферы использования, ассортимент продукции из металла:
- Качественный анализ органических веществ.
- Производство энергоемких аккумуляторов.
- Материал проводов, работающих под высоким напряжением.
- Теплоноситель для АЭС, других объектов (в сплаве с калием, цезием, рубидием).
- Основа ионных ракетных двигателей (в сплаве с калием и цезием).
- Наполнитель газоразрядных ламп для освещения больших пространств.
 Свежесрезанный натрий
Свежесрезанный натрий
Металлурги с помощью соединений щелочного металла выделяют золото из руды, наносят золотое, серебряное гальванопокрытие. Обходчики – убирают растительность на железнодорожном полотне.
Другие сферы
Ученые задействуют изотопы натрия в исследованиях. С их помощью диагностируют и лечат лейкемию.
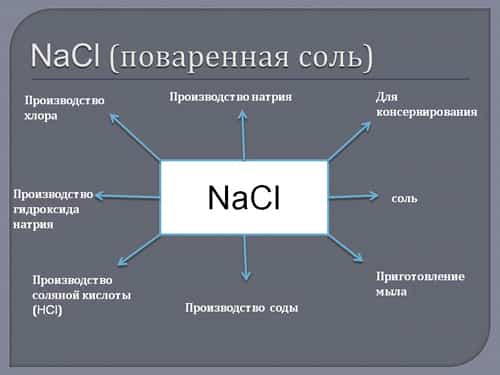
Самая известная «натриевая» формула – NaCl. Это хлорид натрия, или поваренная соль.
Вещество – один из первых консервантов и вкусовых приправ. Сегодня пищепром без него не обходится.
Речь о добавках:
- Глутамат натрия (Е621) – усилитель вкуса (особенно мясного).
- Бензоат (Е215) – консервант.
- Нитрит (Е250) – консервант.
- Цитрат (Е331) – эмульгатор, стабилизатор.
Плюс пищевая сода.
Цены
На рынке представлен ассортимент продукции из соединений натрия.
Цена определяется видом (руб./кг):
- Бихромат – 180-200.
- Сульфат – 17-25.
- Нитрит (технический) – 46-48.
Один из самых дорогих вольфрамосиликат – 7,4 тыс. руб. за кг.
Значение для человека
Натрий критично важен для жизнедеятельности человека.
Суточная потребность в микроэлементе для взрослых – до 510 мг, для детей до 18 лет – 500-900 мг, в зависимости от возраста.
Беременным требуется 500 мг. При физических, эмоциональных нагрузках, вызывающих обезвоживание, еще больше.
Чайная ложка содержит 2,3 г соли.
Питание
80% натрия человек получает из поваренной соли.
Другие источники вещества:
- Субпродукты, рыба, морепродукты (включая морскую капусту).
- Крупы – рис, гречка, перловка, овсянка, пшенка.
- «Борщевой набор» – морковь, томаты, капуста, свекла.
- Металлом насыщены бобовые, куриные яйца, сельдерей, молочный ассортимент.
- Натрий аккумулируется в межклеточной жидкости.
- Задействован в следующих биологических процессах:
- Кислотно-щелочной баланс.
- Водно-солевой обмен.
- Выработка желудочного сока.
- Работа мышц, нервной системы.
- Регулирование кондиций крови.
В этом его почти всегда дополняет калий.
Симптомы дефицита/избытка вещества
О нехватке натрия организм сигнализирует повышенной потливостью.
Ее могут дополнять:
- Головокружение.
- Забывчивость.
- Утрата аппетита.
- Быстрая утомляемость.
- Судороги.
Возможны высыпания на коже, проблемы с ЖКТ (вздутие, тошнота, рвота, спазмы).
Избыток натрия проявляется отечностью, аллергией, неутолимой жаждой.
Предостережение
Опасен металлический натрий. На воздухе самопроизвольно воспламеняется. При контакте с водой, увлажненной поверхностью взрывается либо создает ожог.
- Этими недостатками металла обусловлены условия хранения и правила работы.
- Условия хранения вещества:
- Плотно закрываемая стеклянная тара.
- В ней вещество залито бензином, керосином, вазелиновым маслом.
- Тару держат в закрытом несгораемом коробе.
При работе с веществом соблюдается строгий алгоритм:
- Надеть защитные очки либо маску.
- Не брать вещество руками – только щипцами либо пинцетом. От кожной влаги оно взрывается либо оставляет сильный ожог.
- Нужное количество металла отрезать ножом на сухом стекле (не на столе).
- Остаток сразу возвратить обратно.
- С куском металла работать не откладывая.
- По окончании работы посуду и остатки материала залить крепким спиртом, затем «обезвредить» слабым раствором кислоты.
Остатки вещества нельзя выбрасывать в мусоропровод либо канализацию. В первом случае возникнет пожар, во втором – взрыв и разрушение водопровода.
Перед работой с натрием обязателен инструктаж по технике безопасности.
Это актуально для уроков химии в школе/вузе и любителей домашних химических опытов. Хотя домашние манипуляции с веществом не приветствуются.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Натрий (Na, Natrium)
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий.
Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас.
Привычное название натрий (от латинского natrium – сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na (от латинского natrium).

Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.

Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.

Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
Натрий — мягкий металл с интересными свойствами
Натрий — неорганическое вещество, простой элемент таблицы Менделеева, входит в группу щелочных металлов. Занимает шестое место по распространенности в земной коре; его больше всего среди металлов, растворенных в водах морей и океанов. В виде соединений встречается в таких минералах, как галит, мирабилит, тенардит, натриевая селитра, трона, бура и пр. В чистом виде не встречается.
Промышленный способ получения: электролиз расплава хлористого натрия (поваренной соли). Одновременно получают натрий и хлор.
Свойства
Пластичный металл серебристого цвета. На воздухе быстро окисляется и тускнеет. Мягкий настолько, что его можно резать скальпелем, прокатывать, прессовать. Легче воды. Хорошо проводит ток и тепло. Цвет пламени окрашивает в ярко-желтый цвет. Эта реакция является характерной для обнаружения многих соединений натрия.
Относится к химически очень активным металлам, обладает осно́вными свойствами. Вступает в реакцию с кислородом, углекислым газом, разбавленными и концентрированными кислотами, спиртами, газообразным и жидким аммиаком, оксидами.
Самовоспламеняется при взаимодействии с хлором и фтором, бурно реагирует с водой (иногда — со взрывом), бромом, серой. Вступает в реакции практически со всеми неметаллами (иногда для этого требуются особые условия, электроразряд или высокая температура). С водой образует сильную щелочь — гидроокись натрия (едкий натр).
Образует соединения со ртутью и некоторыми другими металлами, с органическими веществами.
Это интересно
У натрия весьма существенная разница между температурами плавления и кипения — почти 800 градусов. Плавитcя он при t около +98 °С, кипит при t +883 °С. Благодаря этому свойству из натрия получается хороший теплоноситель для мощных атомных реакторов, не закипающий до высоких температур.
Меры предосторожности
Натрий нельзя брать руками, так как он тут же вступает в реакцию с влагой кожи и образует щелочь, вызывая сильные химические и термические ожоги.
Хранят натрий под слоем керосина или минерального масла в герметичных железных контейнерах (жидкость должна полностью покрывать реактив). Если хранят в стеклянной емкости, то ее, в свою очередь, нужно поместить в несгораемый металлический шкаф.
После работы с металлическим натрием остатки следует нейтрализовать спиртом, ни в коем случае не допуская попадания частиц натрия в мусорное ведро или канализацию, поскольку это может вызвать пожар и быстрое разрушение канализационных труб.
Применение
• Поваренная соль используется в водоочистке.
• Гидроокись натрия востребована в производстве бумаги, мыла, синтетических волокон; как электролит.• Карбонаты и гидрокарбонаты натрия применяются в пожаротушении, фармацевтике.• Фосфат натрия необходим для изготовления моющих средств, красок, в стекольной индустрии, фотоделе.• Силикаты натрия используются в производстве огне- и кислотоупорных бетонов.
• Применение находят азид, цианид, хлорат, пероксид, тетраборат, сульфат, тиосульфат натрия и многие другие его соединения.
Натрий
Натрий (Na, лат. natrium) — химический элемент первой группы, третьего периода периодической системы Менделеева, с атомным номером 11. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета.
На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдаёт, превращаясь в положительно заряженный катион Na+. Единственным стабильным изотопом является 23Na. В свободном виде не встречается, но может быть получен из различных соединений.
Натрий — шестой по распространённости элемент в земной коре: он находится в составе многочисленных минералов, включая полевые шпаты, содалит и «каменную соль» (галит, хлорид натрия).
Соединения натрия известны и использовались с давних времён.
В древнегреческом переводе Библии — Септуагинте — упоминается слово νίτρον (в латинском переводе — Вульгате — ему соответствует слово nitroet ) как название вещества типа соды или поташа, которое в смеси с маслом служило моющим средством(Иер. 2:22).
В Танахе слову νίτρον соответствуют др.-евр. ברית — «мыло» и נתר — «щёлок»(мыльная жидкость). Сода (натрон) встречается в природе в водах натронных озёр в Египте.
Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
https://www.youtube.com/watch?v=fFuA8XC8tIM
Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр».
Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода.
Ранее (а также до сих пор в английском, французском и ряде других языков) элемент именовался содий (лат.
sodium) — это название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли.
Металлический натрий впервые был получен английским химиком Хемфри Дэви электролизом расплава гидроксида натрия. Дэви сообщил об этом 19 ноября 1807 года в Бейкеровской лекции (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия).
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л. Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля):
Na2CO3 + 2C →1000oC 2Na + 3CO
Вместо угля могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия:
4NaOH →электрический ток 4Na + 2H2O + O2 , 2NaCl →электрический ток 2Na + Cl2 .
В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить цирконийтермическим методом или термическим разложением азида натрия.
Физические свойства
Металлический натрий, сохраняемый в минеральном маслеКачественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм
Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
- Под высоким давлением становится прозрачным и красным, как рубин.
- При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2.
- При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.
Химические свойства
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
4Na + O2 → 2Na2O
При горении на воздухе или в кислороде образуется пероксид натрия:
2Na + O2 →to Na2O2
Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:
2Na + 2H2O → 2NaOH + H2↑
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, йода, углерода, благородных газов):
2Na + Cl2 → 2NaCl 2Na + H2 →250−400oC,p 2NaH
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
6Na + N2 → 2Na3N
С разбавленными кислотами взаимодействует как обычный металл:
2Na + 2HCl → 2NaCl + H2↑
С концентрированными окисляющими кислотами выделяются продукты восстановления:
8Na + 10HNO3 → 8NaNO3 + NH4NO3 + 3H2O
Растворяется в жидком аммиаке, образуя синий раствор:
Na + 4NH3 →−40oC Na[NH3]4
С газообразным аммиаком взаимодействует при нагревании:
2Na + 2NH3 →350oC 2NaNH2 + H2
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Реагирует со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Применение
Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира.
Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод.
Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Жидкометаллический теплоноситель в ядерных реакторах на быстрых нейтронах БН-600 и БН-800.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет.
Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения.
Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
- Хлорид натрия (NaCl) (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
- Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
- Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
- Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
Основная статья: Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23Na. У большинства изотопов период полураспада меньше одной минуты, лишь один радиоактивный изотоп — 22Na — имеет период полураспада больше года.
22Na претерпевает позитронный распад с периодом полураспада 2,6027 года, его используют в качестве источника позитронов и в научных исследованиях. 24Na, с периодом полураспада по каналу β−-распада 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
Натрий входит в состав всех живых организмов. В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше, чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов.
Для взрослых по данным Американской Ассоциации сердечных заболеваний минимальная необходимая доза составляет меньше 500 миллиграммов, рекомендуемая до 1500 миллиграммов в день (за исключением некоторых болезней или профессий, при которых нужно повышенное количество натрия).
В виде поваренной соли в 3/4 чайной ложки содержится 1725 миллиграммов натрия. По другим данным здоровым взрослым стоит ограничивать употребление натрия 2300 миллиграммами, а людям с повышенным давлением и рядом других заболеваний 1500 или меньшим количеством.
Натрий содержится практически во всех продуктах в разных количествах, хотя большую его часть организм получает из поваренной соли, в том числе в составе консервов, полуфабрикатов, соусов, колбасных изделий и т.п.
В качестве источника натрия служат также такие пищевые добавки как глутамат натрия, пищевая сода (бикарбонат натрия), нитрит натрия, сахаринат натрия и бензоат натрия. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако чрезмерно солёная пища и пища, богатая белками, препятствуют нормальному всасыванию.
Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако некоторые проблемы могут возникнуть при голодании. Временный недостаток может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды.
Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте и нарушение усвоения аминокислот и моносахаридов. Продолжительный недостаток вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, повышенное выделение калия с мочой, у некоторых людей повышенное кровяное давление и скопление жидкости. Максимальное количество соли, которое может быть переработано почками, составляет примерно 20—30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
Чистый металлический натрий огнеопасен. На воздухе склонен к самовоспламенению. Особенно опасен контакт с водой и влажными поверхностями, так как натрий очень бурно реагирует с водой, часто со взрывом, образуя едкую щёлочь (NaOH).
В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, лигроина, бензина или вазелинового масла так, чтобы слой жидкости покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе).
Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке); необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в керосин, либо тут же вводят в реакцию.
Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по охране труда. Лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов.
Для показательных опытов, например, в школе на уроках химии, следует брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты.
Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать взрыв и разрушение трубы. Все работы с натрием, как и вообще с щелочами и щелочными металлами, должны проводиться в очках или защитной маске. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может причинить серьёзные травмы и ожоги.
Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щёлочью.
Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающий разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).






