- Бериллий (Beryllium)
- Магний (Magnesium)
- Щелочноземельные элементы
- Радий
- Общие химические свойства
- Металлы ii группы щелочноземельные металлы магний и бериллий
- Бериллий, магний и щёлочноземельные металлы
- Характерные химические свойства бериллия, магния и щелочноземельных металлов
- Взаимодействие с простыми веществами
- с кислородом
- с галогенами
- с неметаллами IV–VI групп
- с водородом
- Взаимодействие со сложными веществами
- с водой
- c кислотами-неокислителями
- c кислотами-окислителями
- − разбавленной азотной кислотой
- − концентрированной азотной кислотой
- − концентрированной серной кислотой
- с щелочами
- с оксидами
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен.
По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Бериллий (Beryllium)
 Бериллий
Бериллий
Многие минералы бериллия – берилл 3BeO∙Al2O3∙6SiO2, хризоберилл BeAl2O4 и их разновидности (изумруд, аквамарин, александрит) – известны очень давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.). Ученые заинтересовались бериллом лишь в конце XVIII в. Французский химик Луи Никола Воклен установил, что в состав этого минерала входит новая «земля» (так в старину называли некоторые оксиды металлов), отличная от алюмины – оксида алюминия. Он же впервые получил ее соли – соли бериллия. Они оказались сладкими на вкус, поэтому новой земле Воклен дал имя глицина (от греч. «гликис» — «сладкий»), а элементу – глициний. Это название употреблялось во Франции вплоть до XIX в., пока немецкий химик Мартин Генрих Клапрот не добился переименования его в бериллий (Berillium) – в честь минерала берилла.
В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl.
В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия.
Исходные соли бериллия выделяют при переработке бериллиевой руды.
 Берилл
Берилл
Бериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом.
Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2.
На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в.
обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов.
В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний (Magnesium)
 Магний
Магний
Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в.
При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3.
При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.
 Каинит
Каинит
В некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью.
На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2.
Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н+: Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь.
Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике.
Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементы
 Кальций
Кальций
К семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
Название «кальций» происходит от латинского calx – «известь». Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк подвергали обжигу, получая негашеную известь (оксид кальция). Производство этого вещества описал еще Плиний Старший в «Естественной истории».
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу.
В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка).
Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
 Гипс
Гипс
В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов.
В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция.
При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis – «небесный») – сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий – в виде барита (тяжелого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
 Стронций
Стронций
Годом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле и его ученик Юхан Готлиб Ган установили, что в тяжелом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжелый»), а образующий ее элемент – «барий». В виде простых веществ барий и стронций были выделены Г.Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Растворимые соединения бария еще более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8-0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или магния. При этом в организме образуется сульфат бария – нерастворимый и потому безопасный.
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.
 Минерал целестин
Минерал целестин
Щёлочноземельные металлы по химической активности уступают лишь щелочным. Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид.
Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов.
Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.
 Барий
Барий
Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
Радий
Последним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде.
Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран.
Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом.
Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.
Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Общие химические свойства
- По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
- Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.
- Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
- 2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
- Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
- Ca + Cl2 = CaCl2 Mg + Cl2 = MgCl2
- Ca + S = CaS Mg + S = MgS
- 3Ca + N2 = Ca3N2 3Mg + N2 = Mg3N2
- Ca + H2 = CaH2 Mg + H2 = MgH2
- Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
Реакция кальция с водой
- Ca + 2H2O = Ca(OH)2 + H2↑
- Mg + 2H2O = Mg(OH)2 + H2↑
- Щелочноземельные металлы и магний энергично вытесняют водород из кислот:
- Ca + 2HCl = CaCl2 + H2↑
- Mg + H2SO4 = MgSO4 + H2↑
Металлы ii группы щелочноземельные металлы магний и бериллий









ХИМИЧЕСКИЕ СВОЙСТВА — ВОССТАНОВИТЕЛИ 1. С неметаллами образуют бинарные соединения • Реакция с кислородом. Все металлы образуют оксиды RO, барий может-пероксид – Ba. O 2: • Ba + O 2 = Ba. O 2 пероксид • Ca + O 2 = Ca. O • Ba + S = Ba. S сульфид • Ca + H 2 = Ca. H 2 гидрид • Ca + 2 C = Ca. C 2 карбид • 3 Ba + 2 P = Ba 3 P 2 фосфид • Ca + N 2 = Ca 3 N 2 нитрид • Ca + Cl 2 = Ca. Cl 2 хлорид
• 2. Реакция с водой. Образуют щелочи. В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. • Ca + 2 H 2 O = Ca(OH)2 + H 2 ( при о. у. ) • Mg + H 2 O = Mg(OH)2 + H 2 (при t )
• 3. Все металлы растворяются в кислотах: • Ca + 2 HCl = Ca. Cl 2 + H 2 • 4. С особыми кислотами (Be похож на Al) • Сa + HNO 3(к) = N 2 O + Ca(NO 3)2 + H 2 O • Ca + HNO 3(р) = NH 4 NO 3 + Ca(NO 3)2 + H 2 O (N 2 O, NH 3) • Ca + H 2 SO 4(к) = H 2 S + Ca. SO 4 + H 2 O • Be с азотной кислотой пассивирует, реакция на холоду не идет в независимости от концентрации кислоты
• 5. Сa, Mg с оксидами тяжелых металлов • Восстанавливают металлы из их оксидов — пирометаллургия (кальцетермия, магнетермия) • Ca + Cu. O = Cu + Ca. O ( t ) • 2 Mg + Ti. O 2 → 2 Mg. O + Ti • 5 Ca + V 2 O 5 → 5 Ca. O + 2 V • 2 Mg + CO 2 → 2 Mg. O + C горение Mg в углекислом газе
6. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета: • Ca 2+ — темно-оранжевый • Sr 2+- темно-красный • Ba 2+ — светло-зеленый
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ ОБОБЩЕНИЕ М Е + Cl 2 Хлорид фосфид Т + P + H 2 + N 2 нитрид А + S Сульфид Л + O 2 Оксид + C карбид Л Ca, Sr, Ba + Н 2 О Ы + кислоты Гидрид Щелочь + Н 2 соли и водород
ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Закончите уравнения реакций, назовите продукты реакций и составте о-в реакции. Ca + H 2 O Sr + H 2 O Ba + Н 2 О
ОКСИДЫ МЕТАЛЛОВ II ГРУППЫ общая формула оксидов — Me. O и пероксидов — Me. O 2 Оксиды металлов IIA группы являются основными оксидами, Ве. О проявляет амфотерные свойства.
СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Оксиды щелочноземельных металлов Общая МО формула Тип и класс Основный оксид веществ Физические Твердые кристаллические свойства вещества белого цвета Химические МО + Н 2 О = свойства МО + кислотный оксид = МО + кислота =
ПОЛУЧЕНИЕ Окисление металлов (кроме Ba, который образует пероксид) • Ca + O 2 = Ca. O Термическое разложение нитрата магния или нерастворимых карбонатов • Ca. CO 3 → Ca. O + CO 2 t˚C 2 Mg(NO 3)2 → 2 Mg. O + 4 NO 2 + O 2 t˚C
ХИМИЧЕСКИЕ СВОЙСТВА • 1. С кислотным оксидом • 3 Ca. O + P 2 O 5 = Ca 3(PO 4)2 • 2. С водой • Ca. O + H 2 O = Ca(OH)2 (кроме Ве. О) • 3. С кислотой • Ca. O + HCl = Ca. Cl 2 + H 2 O • 4. С амфотерным оксидом • Ca. O + Zn. O = Ca. Zn. O 2
ОСОБЫЕ СВОЙСТВА ОКСИДОВ • 2 Ba. O + O 2 = 2 Ba. O 2 пероксид, только для бария • Ве. О проявляет амфотерные св-ва взаимодействует со щелочами: Be. O + 2 Na. OH = Na 2 Be. O 2 + H 2 O сплав Be. O + 2 Na. OH + H 2 O = Na 2[Be(OH)4] раствор Be. O + Na 2 CO 3 = Na 2 Be. O 2 + CO 2 сплав
Соединения щелочноземельных металлов ГИДРОКСИДЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Общая формула М(ОН)2 Тип и класс веществ Щелочи Физические свойства Химические свойства Твердые кристаллические вещества, белого цвета с ионной кристаллической решеткой М(ОН)2 + соль = М(ОН)2 + кислотный оксид =
ГИДРОКСИДЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ — ЩЕЛОЧИ • .
• Гидроксиды R(OH)2 — белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах).
Основность R(OH)2 увеличивается с увеличением атомного номера: Be(OH)2 – амфотерный гидроксид • Mg(OH)2 – слабое основание • Са(OH)2 — щелочь • остальные гидроксиды — сильные основания (щелочи).
ПОЛУЧЕНИЕ ГИДРОКСИДОВ 1. Реакции щелочноземельных металлов или их оксидов с водой: • Ba + 2 H 2 O Ba(OH)2 + H 2 • Ca. O + H 2 O Ca(OH)2 2. Электролиз растворов солей • Ca. Cl 2 + H 2 O Ca(OH)2 + Cl 2 + H 2 эл. ток 3. Be(OH)2 и Mg(OH)2 получают с помощью обменных реакций • Be. Cl 2 + 2 Na. OH = 2 Na. Cl + Be(OH)2
ХИМИЧЕСКИЕ СВОЙСТВА • 1. изменяют цвет индикатора • Лакмус – синий • Метилоранж – желтый • Фенолфталеин — малиновый • Гидроксиды щелочноземельных металлов в воде диссоциируют на
ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции с кислотными оксидами: • Ca(OH)2 + SO 2 Ca. SO 3 + H 2 O • Ba(OH)2 + CO 2 Ba. CO 3 + H 2 O • Ca(OH)2 +2 CO 2 CA(HCO 3)2 • Ca(OH)2 + CO 2 = Ca. CO 3 + H 2 O Качественная реакция на углекислый газ 3. Реакции с кислотами (нейтрализация) • Ba(OH)2 + 2 HNO 3 Ba(NO 3)2 + 2 H 2 O 4. Реакции обмена с солями: • Ba(OH)2 + K 2 SO 4 Ba. SO 4+ 2 KOH
ХИМИЧЕСКИЕ СВОЙСТВА 5. C амфотерными металлами, оксидами, гидроксидами • Ca(OH)2 + Bе(OH)2 Ca[Be(OH)4] ( раствор) • Ca(OH)2 + Be(OH)2 Ca. Be. O 2 + H 2 O (сплав) • Ca(OH)2 + Be. O + H 2 O Ca[Be(OH)4] (раствор) • Ca(OH)2 + Be. O Ca. Be. O 2 + H 2 O (сплав) • Ca(OH)2 + Be Ca[Be(OH)4] + H 2 тетрагидроксобериллиат кальция
ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ • Сa. O – негашеная известь • Ca(OH)2 –гашенная известь (известковая вода, молоко) • Ca. CO 3 – мел, мрамор, известняк • Ca. SO 4 * 2 H 2 O — гипс • Ca(Cl. O)Cl – хлорная известь
СОЛИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ • Растворимые соли Be и Ba – токсичны, ядовиты! • Катион Ba 2+ обычно открывают обменной реакцией с серной кислотой или ее солями: • Сульфат бария – белый осадок, нерастворимый в минеральных кислотами
КАЛЬЦИЙ В ПРИРОДЕ Кальциевые горные породы – известняк, мрамор, мел. • Вспомните формулу этих горных пород. • В чем их отличие?
МЕЛ, ИЗВЕСТНЯК, МРАМОР НЕ РАСТВОРЯЮТСЯ В ЧИСТОЙ ВОДЕ, НО РАСТВОРИМЫ В КИСЛЫХ РАСТВОРАХ, ДАЖЕ ТАКИХ СЛАБЫХ, КАК ПРИРОДНАЯ ВОДА. При просачивании воды с поверхности земли через залежи известняка происходят процессы: 1. образуются провалы, если порода залегает под тонким слоем почвы
2. Если породы залегают на большой глубине – возникают подземные карстовые пещеры. • Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры? А растущие навстречу им со дна пещеры колонны? Какие химические реакции при этом происходят?
ИЗВЕСТНЯК И МРАМОР ИСПОЛЬЗУЮТ В АРХИТЕКТУРЕ И СКУЛЬПТУРЕ При воздействии кислотных дождей строения разрушаются. • Какие реакции при этом происходят?
КАЛЬЦИЙ В ОРГАНИЗМЕ ЧЕЛОВЕКА • • Минерал, содержащий фосфат кальция, играет важную роль в человеческом организме. Он строительным материалом костей человека, входит в состав эмали.
• В сочетании с другими минералами поддерживает работу сердечно-сосудистой системы, предотвращает возникновение рака толстой кишки, регулирует функции нервов, способствует снижению холестерина.
• В организме взрослого человека содержатся более 1 кг кальция в виде соединения Ca 3(PO 4)2.
• Ca. SO 4 -сульфат кальция, встречается в природе в виде минерала гипса Ca. SO 4*2 H 2 O, представляющего собой кристаллогидрат. • Используется в строительстве, медицине для наложения неподвижных гипсовых повязок, для получения слепков. Для этого применяют полуводный гипс 2 Ca. SO 4 -алебастр.
ПРОИСХОЖДЕНИЕ ЖЕМЧУГА • Жемчуг — продукт жизнедеятельности жемчугоносных моллюсков. • Жемчуг образуется в раковине моллюска, причем для зарождения этого камешка, моллюску обязательно должна быть причинена боль или неудобство.
• В раковину внедряется чужеродное тело — песчинка, кусочек раковины или живой паразит. • Сопротивляясь вторжению, моллюск выделяет особое вещество — перламутр. Слой за слоем перламутр обволакивает «оккупанта».
• Перламутровая защита постепенно становится все больше, и через
БЕРИЛЛИЙ Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится в минерале берилле. Металл называют также глицием от греческого слова «сладкий» , потому что соли его имеют сладковатый вкус. Д. И. Менделеев
СОЕДИНЕНИЯ БЕРИЛЛИЯ В ПРИРОДЕ • Хризоберилл Be. Al 2 O 4 • Изумруд • Аквамарин • Александрит
«Изумруд капризный, как женщина встречается совсем не там, где его ищут» Благодаря насыщенному зелёному цвету и твёрдости очень популярен у ювелиров, чудесная окраска вызвана наличием ионов хрома или ванадия. «Кажется, что если вглядеться в аквамарин, то увидишь тихое море с водой цвета звёзд» К. Г. Паустовский Такой цвет ему придаёт небольшая примесь двухвалентного железа
МАГНИЙ В ПРИРОДЕ • Магний входит в состав активного центра зелёного пигмента растений -хлорофилла • Автомобильная , авиационная и ракетная промышленность Магналий -твёрдый и прочный сплав с алюминием — 30 % Mg с добавками цинка,
МАГНИЙ В МЕДИЦИНЕ • В медицине карбонат магния и окись магния применяют • в качестве средств нейтрализующих соляную кислоту желудка и как легкие слабительные (Гастал, Ренни, Алмагель). • Сульфат магния ( «английская соль» ) применяется в качестве слабительного, желчегонного и болеутоляющего средства при спазмах желчного пузыря.
• Раствор сернокислой магнезии вводят в качестве противосудорожного средства при эпилепсии и в качестве антиспастического лекарства при задержке мочеиспускания, бронхиальной астме, гипертонической болезни.
• органические соли магния используют при изготовлении БАД и лекарственных препаратов с широким спектром лечебно-профилактического действия, таких как
ЖЕСТКОСТЬ ВОДЫ • Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости» ).
• Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.
Вкус природной
ЖЕСТКОСТЬ ВОДЫ • Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п.
В то же время, использование слишком мягкой воды может приводить к коррозии труб. • Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна.
Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
ЖЕСТКОСТЬ ВОДЫ Виды жесткости воды Присутствующие ионы Способы устранения жесткости воды Временная (карбонатная) Ca(2+), Mg(2+) HCO 3(-) 1. Кипячение 2. Добавление соды или Са(ОН)2 Постоянная Ca(2+), Mg(2+) SO 4(2 -) 1. Добавление соды. 2. Использование катионообменников Общая Ca(2+), Mg(2+), HCO 3(-), Cl(-) SO 4(2 -) Сочетание всех вышеуказанных способов.
СТРОНЦИЙ В ПРИРОДЕ • Класс Саркодовые – радиолярии, обладают радикально расположенными псевдоподиями. Минеральный скелет, состоящий из кремнезёма или сульфата стронция , принимает форму правильных геометрических фигур (шаров, многогранников, колец), состоящих из отдельных игл.
ПРИМЕНЕНИЕ СОЛЕЙ СТРОНЦИЯ • Как коллекционный минерал целестин ценится высоко, но практически не используется в ювелирном деле из-за своей низкой твердости и высокой хрупкости.
Характерны образцы целестина голубого, светло-голубого, серо-голубого и чуть голубоватого цветов; целестин может быть и бесцветным, а также белым, желтоватым, синеватозеленым, красноватым, коричневым, порой еле просвечивающим, иногда – с зональной окраской.
ПРИМЕНЕНИЕ СОЛЕЙ СТРОНЦИЯ • Соединения стронция использовались в пиротехнике; стоит бросить щепотку соли стронция в пламя – и оно окрасится в красный цвет. Все красные фейерверки и огни сигнальных ракет – все это благодаря стронцию. • Соединения стронция используются в стекольной, керамической промышленности для получения глазированных поверхностей,
ТАЙНЫ ЦЕЛЕСТИНА • Герр Хайнеман был доволен своей жизнью. Дела его шли хорошо, даже очень хорошо, если сравнить со многими другими эмигрантами, переехавшими в Соединенные Штаты. Его винный заводик на красивом озерном острове процветал, и вот, понадобилось сделать небольшой колодец для нужд производства.
Со вчерашнего дня этим занимались его помощники, долбили породу. А сегодня один из них прибежал, мол, лучше ему взглянуть самому. Эх, все приходится делать самому. Герр Хайнеман спустился в подвал, где шли работы. • — Ну, что тут у вас? • — Вот, смотрите, мистер, долбили камень да наткнулись на пустоту… • — Дайте фонарь.
• Герр Хайнеман спустился в яму в породе – результат работы целого дня. На дне ее и вправду зияла дыра. Он наклонился и посветил фонарем внутрь. И не поверил своим глазам: свет фонаря выхватил стенки обширной пещеры, покрытые огромными голубовато-белыми кристаллами.
Герр Хайнеман уже было решил, что это подземная сокровищница троллей из сказок его родины, но ведь в США нет немецких троллей. Герр Хайнеман захихикал, поражаясь своей логике.
ГЕНЕТИЧЕСКИЙ РЯД КАЛЬЦИЯ Са. О Са(ОН) 2 Са. СО 3 Са(НСО 3)2 Напишите уравнения реакций, при помощи которых можно осуществить превращения веществ.
ЦЕПОЧКА ПРЕВРАЩЕНИЙ • Ca → Ca. O→ Ca. Cl 2→ Ca(OH)2 →Ca. CO 3 →Ca. O • Для реакций составить ионные уравнения и ок-восстановительные балансы.
Бериллий, магний и щёлочноземельные металлы
В главную подгруппу II группы входят бериллий (Be), магний (Mg), кальций (Са), стронций (Sr), барий (Ва) и радий (Ra). Кальций, стронций, барий и радий относятся к щёлочноземельным металлам.
Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит.
Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств
Атомы элементов II группы имеют на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.
В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства возрастают.
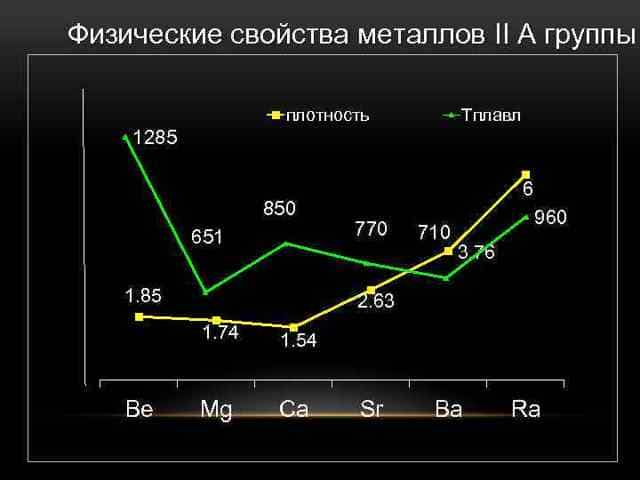
Бериллий, магний и щелочноземельные металлы — это простые вещества. Лёгкие серебристо-белые металлы, исключение составляет только стронций, который имеет золотистый оттенок.
Например, кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Поскольку у кальция на энергетическом уровне находится 2 электрона, то его степень окисления во всех соединениях всегда равна +2. На воздухе кальций окисляется, поэтому его хранят в закрытых сосудах, обычно в керосине.
Химические свойства данной группы металлов рассмотрим на примере кальция.
С биологической точки зрения, кальций играет немаловажную роль для растений, животных и человека. В нашем организме он входит в состав костей. Кальций придает костям твердость. Например, при обычных условиях кальций реагирует с
галогенами, а с серой, азотом и углеродом – при нагревании. При взаимодействии кальция с хлором образуется хлорид кальция.
- Ca + CI2 =CaCI2 (кальций плюс хлор два равно кальций хлор два)
- При взаимодействии кальция с серой образуется сульфид кальция.
- Сa + S = CaS
- (кальций плюс сера равно кальций эс)
- При взаимодействии кальция с азотом образуется нитрид кальция.
- (три кальций плюс эн два стрелочка кальций три эн два)
- Данные реакции происходят при нагревании.
- Кальций (Ca) являясь активным металлом вытесняет водород из воды:
- Сa + 2Н2О = Ca(ОН)2+Н2
- (кальций плюс два аш два о стрелочка кальций о аш дважды плюс аш два стрелочка вверх)
При этом не все металлы главной подгруппы II группы Периодической системы одинаково реагируют с водой: бериллий практически не взаимодействует с водой, т.к. взаимодействию препятствует защитная пленка на его поверхности, реакция магния с водой протекает довольно медленно, остальные же металлы взаимодействуют с водой аналогично кальцию.
- При нагревании на воздухе кальций сгорает, образуя оксид кальция:
- 2Сa + О2 = 2CaО
- (два кальций плюс о два равно два кальций о)
- При взаимодействии кальций с углеродом образует карбид кальция СaC2
- Сa + 2С = CaС2
- (кальций плюс два це стрелочка кальций це два)
- Вследствие своей высокой химической активности в природе щёлочноземельные металлы находятся только в форме соединений.
Оксиды данных металлов твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства. Исключение составляет оксид бериллия, который имеет амфотерный характер.
- Рассмотрим оксиды на примере кальция.
- Оксид кальция (техническое название: негашеная известь, жженая известь) – это порошок белого цвета.
- Оксид кальция энергично взаимодействует с водой с образованием гидроксида кальция:
- CaO + H2O = Ca(OH)2 +Q
- (кальций о плюс аш два о равно кальций о аш дважды плюс ку)
- Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашение извести, а образующийся Ca(OH)2 — гашёной известью.
Гашеная известь – твердое вещество белого цвета, растворимое в воде. Раствор гашеной извести в воде называется известковой водой. Раствор обладает щелочными свойствами.
- Рассмотрим щелочные свойства на примере:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
- (кальций о аш дважды плюс це о два стрелочка кальций це о три стрелочка вниз плюс аш два о)
- При пропускании через известковую воду оксида углерода (IV) раствор мутнеет
- (кальций це о три плюс це о два плюс аш два о две стрелочки направленны противоположно друг другу кальций аш це о три дважды)
- При дальнейшем пропускании замечаем, что муть исчезает.
- Соли бериллия, магния и щёлочноземельных металлов получают при взаимодействии их с кислотами.
- К солям кальция относится карбонат кальция. Карбонат кальция имеет следующую формулу — CaCO3(кальций це о три)
Он содержится в известняке, меле и мраморе. Мрамор широко применяется в скульптуре и архитектуре, без известняка не обходится ни одно строительство, т.к.
он сам является прекрасным строительным камнем и используется для получения таких материалов как стекло, цемент, гашеная и негашеная известь.
В природе мел представляет собой остатки раковин древних животных, его можно увидеть в школе (школьные мелки), его используют в зубной пасте, при производстве бумаги, при побелке.
- Сульфат кальция встречается в природе в виде минерала гипса — CaSO4*2H2О (кальций эс о четыре умножить два аш два о).
- Обжигом гипса при 150-180С0 получают белый порошок – жженый гипс или алебастр
- CaSO4*0,5H2О(кальций эс о четыре умножить ноль целых пять десятых аш два о).
- Если алебастр смешать с водой, то он быстро затвердевает, снова превращается в гипс.
- Например,
- CaSO4*0,5H2О +1,5 H2О = CaSO4* 2H2О
- (кальций эс о четыре умножить ноль целых пять десятых аш два о плюс одна целая пять десятых аш два о равно кальций эс о четыре умножить два аш два о)
- Сульфат кальция широко используют в строительстве для изготовления скульптур и скульптурных элементов, для облицовочных и отделочных работ, в медицине для изготовления гипсовых повязок.
Характерные химические свойства бериллия, магния и щелочноземельных металлов
IIA группа содержит только металлы – Be (бериллий), Mg (магний), Ca (кальций), Sr (стронций), Ba (барий) и Ra (радий). Химические свойства первого представителя этой группы — бериллия — наиболее сильно отличаются от химических свойств остальных элементов данной группы.
Его химические свойства во многом даже более схожи с алюминием, чем с остальными металлами IIA группы (так называемое «диагональное сходство»). Магний же по химическим свойствами тоже заметно отличается от Ca, Sr, Ba и Ra, но все же имеет с ними намного больше сходных химических свойств, чем с бериллием.
В связи со значительным сходством химических свойств кальция, стронция, бария и радия их объединяют в одно семейство, называемое щелочноземельными металлами.
Все элементы IIA группы относятся к s-элементам, т.е. содержат все свои валентные электроны на s-подуровне. Таким образом, электронная конфигурация внешнего электронного слоя всех химических элементов данной группы имеет вид ns2 , где n – номер периода, в котором находится элемент.
Вследствие особенностей электронного строения металлов IIA группы, данные элементы, помимо нуля, способны иметь только одну единственную степень окисления, равную +2. Простые вещества, образованные элементами IIA группы, при участии в любых химических реакциях способны только окисляться, т.е. отдавать электроны:
Ме0 – 2e— → Ме+2
Кальций, стронций, барий и радий обладают крайне высокой химической активностью. Простые вещества, образованные ими, являются очень сильными восстановителями. Также сильным восстановителем является магний. Восстановительная активность металлов подчиняется общим закономерностям периодического закона Д.И. Менделеева и увеличивается вниз по подгруппе.
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO.
Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
- Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
- 2Mg + O2 = 2MgO
- 2Ca + O2 = 2CaO
- 2Ba + O2 = 2BaO
- Ba + O2 = BaO2
- Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
- Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
- Мg + I2 = MgI2 – иодид магния
- Са + Br2 = СаBr2 – бромид кальция
- Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл.
Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена.
Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла.
С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Взаимодействие со сложными веществами
с водой
Все щелочноземельные металлы активно реагируют с водой с образованием щелочей (растворимых гидроксидов металлов) и водорода.
Магний реагирует с водой лишь при кипячении вследствие того, что при нагревании в воде растворяется защитная оксидная пленка MgO.
В случае бериллия защитная оксидная пленка очень стойкая: с ним вода не реагирует ни при кипячении, ни даже при температуре красного каления:
c кислотами-неокислителями
Все металлы главной подгруппы II группы реагируют с кислотами-неокислителями, поскольку находятся в ряду активности левее водорода. При этом образуются соль соответствующей кислоты и водород. Примеры реакций:
- Ве + Н2SO4(разб.) = BeSO4 + H2↑
- Mg + 2HBr = MgBr2 + H2↑
- Ca + 2CH3COOH = (CH3COO)2Ca + H2↑
c кислотами-окислителями
− разбавленной азотной кислотой
- С разбавленной азотной кислотой реагируют все металлы IIA группы.
При этом продуктами восстановления вместо водорода (как в случае кислот-неокислителей) являются оксиды азота, преимущественно оксид азота (I) (N2O), а в случае сильно разбавленной азотной кислоты – нитрат аммония (NH4NO3):
- 4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + N2O↑ + 5H2O
- 4Mg + 10HNO3(сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
− концентрированной азотной кислотой
Концентрированная азотная кислота при обычной (или низкой) температуре пассивирует бериллий, т.е. в реакцию с ним не вступает. При кипячении реакция возможна и протекает преимущественно в соответствии с уравнением:
Магний и щелочноземельные металлы реагируют с концентрированной азотной кислотой с образованием большого спектра различных продуктов восстановления азота.
− концентрированной серной кислотой
Бериллий пассивируется концентрированной серной кислотой, т.е. не реагирует с ней в обычных условиях, однако реакция протекает при кипячении и приводит к образованию сульфата бериллия, диоксида серы и воды:
- Be + 2H2SO4 → BeSO4 + SO2↑+ 2H2O
- Барий также пассивируется концентрированной серной кислотой вследствие образования нерастворимого сульфата бария, но реагирует с ней при нагревании, сульфат бария растворяется при нагревании в концентрированной серной кислоте благодаря его превращению в гидросульфат бария.
- Остальные металлы главной IIA группы реагируют с концентрированной серной кислотой при любых условиях, в том числе на холоду. Восстановление серы происходит преимущественно до сероводорода:
- 4Mg + 5H2SO4(конц.) = 4MgSO4 + H2S↑ + 4H2O
с щелочами
- Магний и щелочноземельные металлы со щелочами не взаимодействуют, а бериллий легко реагирует как растворами щелочей, так и с безводными щелочами при сплавлении.
При этом при осуществлении реакции в водном растворе в реакции участвует также и вода, а продуктами являются тетрагидроксобериллаты щелочных или щелочноземельных металлов и газообразный водород:
- Be + 2KOH + 2H2O = H2↑ + K2[Be(OH)4] — тетрагидроксобериллат калия
- При осуществлении реакции с твердой щелочью при сплавлении образуются бериллаты щелочных или щелочноземельных металлов и водород
- Be + 2KOH = H2↑+ K2BeO2 — бериллат калия
с оксидами
Щелочноземельные металлы, а также магний могут восстанавливать менее активные металлы и некоторые неметаллы из их оксидов при нагревании, например:
Метод восстановления металлов из их оксидов магнием называют магниетермией.
С.И. Широкопояс https://scienceforyou.ru/






