- Кислород.
- Углекислый газ.
- Хлориды.
- Солевой состав воды.
- Значение pH.
- Температура.
- Скорость среды.
- Механические и термические деформации.
- Ионизирующее излучение.
- Агрессивность подземных вод к строительным конструкциям
- Оценка агрессивности подземных вод
- Расчет и оценка агрессивности подземных вод
- Почвенная коррозия
- Влияние различных факторов на почвенную коррозию
- Влияние влажности грунта на почвенную коррозию металла
- Пористость (воздухопроницаемость) грунта
- Кислотность грунта
- Электропроводность грунта
- Минералогический состав и неоднородность грунта
- Влияние микроорганизмов на почвенную коррозию металлов
- Механизм и особенности почвенной коррозии металлов
- Особенности почвенной коррозии металлов:
- Методы защиты от почвенной коррозии
- Нанесение защитных покрытий. Изоляция
- Создание искусственной атмосферы
- Электрохимическая защита металла от почвенной коррозии
- Специальные методы укладки
- Оценка агрессивности подземных вод по отношению к бетону и металлам
Подробности Категория: Генерация
ГЛАВА ВТОРАЯ КОРРОЗИЯ ПАРОКОНДЕНСАТНОГО ТРАКТА АЭС § 2.1. УСЛОВИЯ ПРОТЕКАНИЯ КОРРОЗИИ Сущность и формы проявления коррозии металлов в достаточной мере изложены в других учебниках.
Отметим только, что для ядерных энергетических установок помимо всех видов коррозии, протекающей на оборудовании ТЭС. характерны межкристаллитная коррозия аустенитных нержавеющих сталей и коррозия циркониевых сплавов. Межкристаллитная коррозия является наиболее опасным видом коррозионного повреждения.
Коррозия развивается по границам зерен кристаллов в виде трещин, интенсивное развитие которых может вызвать разрушение металлоконструкций. Очень часто под действием межкристаллитной коррозии разрушаются сварные соединения.
Развитие межкристаллитной коррозии протекает с некоторым ускорением: в начальный период разрушение металла происходит медленнее, затем скорость разрушения возрастает и может принять катастрофический характер. Так как межкристаллитная коррозия протекает в напряженных участках металла, ее принято называть коррозией под напряжением..
Коррозия сплавов циркония проявляется в виде образования на его поверхности пленок двуокиси циркония черного, серого и белого цветов с различными защитными свойствами. Коррозия аустенитной нержавеющей стали и сплавов циркония рассмотрена в § 2.3.
Критерием оценки общей коррозии является глубина ее проникновения (мм/год) или массовый показатель [г/(м2Х Хсут)]. При коррозии под напряжением в качестве критерия принимается время до разрушения металла, а в случае сплавов циркония — увеличение массы металла за счет кислорода, входящего в состав окисной пленки.
По коррозионной стойкости материалы делятся на совершенно стойкие, весьма стойкие, стойкие, пониженностойкие, малостойкие и нестойкие. Реакторные материалы должны соответствовать третьей группе — стойкие, скорость коррозии 0,01—0,05 мм/год или 0,25—1,2 г/(м2-сут). На протекание коррозии оказывают влияние наличие и концентрация агрессивных агентов (кислорода, углекислоты, хлор-иона и т. д.), солевой состав полы, значение pH, температура и скорость движения воды, наличие механических и термических деформаций, ионизирующее излучение и т. д. Ниже рассмотрено влияние отдельных факторов на различные виды коррозии.
Кислород.
Основная роль кислорода при коррозии теплосилового оборудования сводится к деполяризации катодных участков. Скорость кислородной деполяризации зависит от содержания кислорода и интенсивности перемешивания воды.
С увеличением этих факторов скорость деполяризации возрастает, что связано с увеличением скорости доставки кислорода к корродирующей поверхности. В процессе коррозии углеродистой стали в условиях работы теплоэнергетического оборудования кислород играет двоякую роль.
При низком содержании кислорода (примерно 20 мкг/л) коррозия не наблюдается независимо от солевого состава и температуры воды.
При температуре воды около 20 °C и повышенном содержании кислорода скорость коррозии возрастает и становится максимальной при содержании О2, равном 8—10 мг/кг. При дальнейшем росте концентрации кислорода скорость коррозии снижается.
Самые низкие скорости коррозии зафиксированы при содержании кислорода в воде 40 мг/л. Такая концентрация кислорода в воде получается за счет разложения перекиси водорода П2О2 на поверхности металла. Ионы железа являются катализаторами разложения Н2О2, следовательно, высокая концентрация кислорода будет возникать в дефектах окисной пленки. При концентрации перекиси водорода 40 мкг/л и полном ее разложении локальная концентрация кислорода может достичь 100 мг/л.
Таким образом, кислород в процессе коррозии углеродистой стали играет роль как агрессивного агента, так и пассиватора в зависимости от его концентрации и солевого состава воды.
Углекислый газ.
Влияние углекислого газа на коррозию углеродистой стали сводится не только к понижению pH и повышению содержания ионов водорода.
Углекислый газ является слабым электролитом, тем не менее низкие значения pH, создаваемые углекислотой, в коррозионном отношении более опасны, чем те же значения pH, создаваемые минеральными кислотами (НС1, H2SO4).
Минеральные кислоты в процессе коррозии образуют с железом устойчивые соединения и при этом «срабатываются». Углекислый газ же вследствие гидролиза его солей FeCO3 + 2Н2О = Fe(ОН)2 + Н2СО3 (2.2) в процессе коррозии практически нс расходуется.
Наибольшая агрессивность углекислого газа проявляется при повышенной температуре на участке от деаэраторов до парогенераторов, в основном в местах с повышенной скоростью воды (регулирующих и обратных клапанах, трубных пучках подогревателей высокого давления и т. д.).
На АЭС с турбинами, работающими на насыщенном паре, коррозионно-эрозионные разрушения появляются на роторе и статоре турбин, корпусах обратных и регулирующих клапанов отборов, дренажах паропроводов.
Объясняют это явление смывом защитной окисной пленки с металла под действием углекислоты в местах с большой скоростью среды.
Хлориды.
Влияние хлоридов на коррозию хромоникелевых нержавеющих сталей основано на разрушении защитной пассивной пленки, которая образуется на поверхности металла, по-видимому, вследствие образования растворимого хлорида хрома. Разрушение защитной окисной пленки происходит по границам кристаллов. Это обстоятельство может привести к коррозионному растрескиванию. Процессу способствует кислород, который играет роль деполяризатора.
Хлориды являются также стимуляторами кислородной коррозии углеродистой стали, способствующими разрушению защитных окисных пленок. Ионы хлора способны адсорбироваться окисными пленками и вытеснять и I них кислород. В результате такой замены в точках адсорбции получается растворимое хлористое железо, металл при этом оголяется и подвергается дальнейшей коррозии.
Солевой состав воды.
Наличие в воде хлоридов и сульфатов препятствует образованию пассивной окисной пленки, что приводит к увеличению скорости коррозии. Механизм разрушения окисной пленки хлор-ионом описан выше.
Ввод и обессоленную воду хлоридов пли сульфатов до концентрации 0,6 мг/л повышает скорость коррозии в 40 раз даже в деаэрированной воде. Наоборот, добавление в воду фосфатов, хроматов и нитритов способствует пассивации металла и снижению скорости коррозии.
Нитрит натрия в смеси с аммиаком используется для пассивации и консервации теплоэнергетического оборудования из углеродистой стали после проведения химических промывок и в период длительной остановки оборудования, Углеродистая сталь в кислородсодержащей воде образует с нержавеющей сталью гальваническую пару, анодом в которой является углеродистая сталь. Разрушение ее идет тем эффективнее, чем выше солесодержание воды. В обессоленной воде углеродистая и нержавеющая стали образуют весьма слабую гальваническую пару.
Значение pH.
Повышенная концентрация гидроксильных ионов способствует упрочнению защитных пленок и снижению скорости коррозии. Если при рН=7 в обессоленной воде, насыщенной воздухом, углеродистая сталь находится в активном состоянии, то при рН>10-=-11 сталь пассивируется, несмотря па большое содержание кислорода. Ранее образованная на поверхности углеродистой стали пассивная пленка при температуре 20°C и рН=10 не разрушается даже в воде, насыщенной воздухом, в то время как при снижении pH до 7 разрушение пленки происходит через 1,5—2 ч.
Высокое значение pH может быть достигнуто добавлением в воду щелочи пли аммиака.
Последний предпочтительнее, так как летуч и переходит в пар при кипении воды, а главное, нс вызывает щелочной хрупкости, которая происходит при значительной концентрации щелочи в трещинах и щелевых зазорах.
Высокое значение pH, обусловленное нелетучими щелочами, несовместимо с использованием в качестве конструкционных материалов в ядерном реакторе циркониевых сплавов из-за их интенсивной коррозии.
Температура.
Температура среды (вода, пар) оказывает большое влияние на ход коррозионных процессов. С одной стороны, повышение температуры ускоряет процессы коррозии и пассивации, с другой — с ростом температуры увеличивается термическая деформация.
При температурах ниже 100 °C углеродистые стали в воде, насыщенной воздухом, подвергаются интенсивной коррозии. Пассивирующее действие кислорода с повышением температуры возрастает, при содержании кислорода 8— 10 мг/л сталь пассивируется при температуре около 120°C.
Дальнейшее повышение температуры упрочняет пассивную пленку, скорость коррозии углеродистой стали при этом мала и уменьшается со временем. В насыщенном паре при температуре 280 °C увеличение содержания кислорода до 40 мг/кг практически не оказывает влияния на коррозию углеродистой стали.
Повышение температуры среды, как указывалось выше, увеличивает скорость коррозии под действием углекислоты. Коррозионно-эрозионные поражения не наблюдаются на тракте до деаэратора при температуре до 150°C.
Аналогичная зависимость наблюдается при коррозии нержавеющей стали под действием хлор-иона. При температуре ниже 100°С аустенитные нержавеющие стали не подвергаются хлоридному растрескиванию даже в технической воде, содержащей до 30 мг/л хлор-иона. Наоборот, при увеличении температуры коррозионное растрескивание наступает уже при содержании хлоридов около 500 мкг/л.
Скорость среды.
Влияние повышенной скорости среды на коррозию теплоэнергетического оборудования обусловлено, с одной стороны, ускорением доставки коррозионных агентов к поверхности металла, с другой — увеличением эрозионного износа элементов оборудования при совместном воздействии быстро движущейся среды и коррозионных аген тов.
Скорость деаэрированной воды не влияет на коррозию углеродистой стали. С увеличением скорости движения воды, насыщенной· воздухом, интенсивность коррозии проходит через максимум при скорости воды 1—3 м/с. При дальнейшем увеличении скорости интенсивность коррозии снижается. Оптимальной является скорость 3—5 м/с.
Объясняется данное явление окислением Fe2+ до Fe3+ в порах окисной пленки за счет более интенсивного подвода кислорода при циркуляции воды. Образующийся при этом магнетит закупоривает поры, и скорость коррозии снижается.
Коррозионно-эрозионный износ латунных трубок конденсаторов турбин является результатом повреждения защитной пленки вследствие высокой турбулентности потока воды, движущейся со скоростью более 1,4 м/с. Износ трубок усиливает наличие в охлаждающей воде воздушных пузырьков и абразивных частиц.
Влияние высокой скорости среды на коррозионно-эрозионный износ при воздействии углекислоты рассмотрено выше. Отмечено, что на участках с низкой скоростью циркуляции (деаэраторы, трубопроводы и т. д.) коррозионно-эрозионного износа не наблюдается.
Механические и термические деформации.
Наличие в металле напряжений, возникших вследствие механических или термических деформаций, является непременным условием коррозии под напряжением. Напряжение может быть приложенным или остаточным, но обязательно растягивающим. Даже незначительное растягивающее напряжение вызывает коррозионное растрескивание аустенитных сталей.
По-видимому, практически отсутствует предельное напряжение, ниже которого разрушение не происходит. В то же время полное отсутствие напряжения не приводит к коррозионному растрескиванию. Остаточное напряжение в металле появляется при сварке, поэтому материал сварного шва корродирует в 1,5— 2 раза быстрее, чем основной металл.
Для снятия остаточного напряжения стали подвергают термической обработке, в частности отжигу.
Ионизирующее излучение.
При облучении воды происходит ее радиолиз (см. § 5.1). Присутствие в воде кислорода интенсифицирует процесс радиолиза, продукты которого увеличивают скорость коррозии материалов.
Увеличение скорости коррозии наблюдается в начальный период, первые 1000 ч работы, в дальнейшем это влияние становится малозаметным. При наличии в воде азота и свободного кислорода под влиянием нейтронного потока образуется азотная кислота, вследствие чего скорость коррозии увеличивается.
В то же время присутствие в воде азота и свободного водорода приводит под облучением к образованию аммиака и снижению скорости коррозии.
Таким образом, наблюдаемое увеличение скорости коррозии металлов под действием ионизирующего излучения вызывается продуктами радиолиза. В то же время излучение влияет на структуру защитной окисной пленки, вызывая в ней образование различных дефектов, что способствует развитию коррозии.
Агрессивность подземных вод к строительным конструкциям
Воды определенного химического состава могут оказывать разрушающее действие на бетонные и металлические конструкции, фильтры скважин, обсадные трубы, насосы и т. д. Подземная вода, разрушающая бетон и металл, считается агрессивной.
Агрессивное действие вод на бетон проявляется в растворении его основного компонента — карбоната кальция, а также в образовании солей CaSО4 • 2HL,0, MgSО4 • 2Н20 и сульфоалюминага кальция («цементная бацилла»), вызывающего вспучивание и крошение бетона.
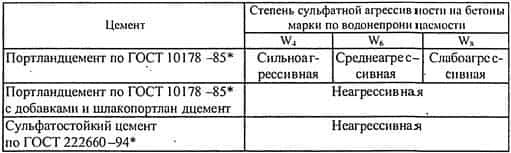
В зависимости от присутствия в воде тех или иных компонентов различают несколько видов агрессивности подземных вод к бетону (табл. 5.3).
Таблица 5.3 — Виды агрессивности подземных вод по отношению к бетону

Степень агрессивного воздействия подземных вод на арматуру железобетонных конструкций оценивается по суммарному содержанию в них сульфатов и хлоридов.
Количественные критерии оценки вида и степени агрессивности подземных вод к бетону и железобетону приводятся в СНиП 2.03.11 — 85 «Защита строительных конструкций от коррозии».
По степени воздействия на строительные конструкции подземные воды, согласно данному СНиПу разделяются на неагрессивные, слабоагрессивные, среднеагрессивные и сильноагрессивные. В нормах помимо химического состава воды учитывается также коэффициент фильтрации пород, толщина конструкций и марка бетона по водонепроницаемости.
Агрессивность подземных вод определяется сопоставлением данных химического анализа воды с требованиями СНиП 2.03.11—85.
Приведем пример оценки сульфатной агрессивности грунтовых вод по одной из скважин (табл. 5.4). Грунтовые воды имеют общую минерализацию 2986,0 мг/л, содержание сульфатов в пересчете на SО42-— 1620,5 мг/л
Меры борьбы с агрессивностью подземных вод могут быть различными: применение сульфатостойких цементов, гидроизоляция подземных частей сооружения, дренаж и др.
Агрессивное действие вод на металлы (коррозия металлов). Подземная вода с растворенными в ней солями и газами может обладать интенсивной коррозией по отношению к железу и другим металлам. Примером может служить окисление (разъедание) металлических поверхностей с образованием ржавчины под действием кислорода, растворенного в воде:
- 2Fe + О2 = 2FeO
- 4FeO + О2 = 2Fe2О3
- Fe2О3 + 3H2О = 2Fe(OH)3
Подземные воды обладают коррозионными свойствами при содержании в них также агрессивной углекислоты, минеральных и органических кислот, солей тяжелых металлов, сероводорода, хлористых и некоторых других солей.
Мягкая вода (с величиной общей жесткости менее 3,0 мг-экв/л) действует значительно агрессивнее, чем жесткая. Наибольшему разъеданию могут подвергаться металлические конструкции под влиянием сильно кислых (pH < 4,5) и сильно щелочных вод (pH > 9,0).
Коррозии способствует повышение температуры подземной воды, увеличение скорости ее движения, электрические токи.
Оценка коррозионной активности вод по отношению к некоторым металлам производится по действующему ГОСТу
Геодезические работы
Оценка агрессивности подземных вод
Агрессивность воды связана с присутствием в ней ионов водорода, свободного диоксида углерода, сульфатов и магния. Агрессивные свойства воды проявляются по отношению к бетону и металлам. Агрессивность воды по отношению к бетону выражается в разрушительном воздействии подземных вод определенного состава на бетонные сооружения. Оценка качества воды по отношению к бетону производится по нормам и техническим условиям Н 114-54 «Бетон гидротехнический. Признаки и нормы агрессивности воды-среды». Эти нормы учитывают воздействие на бетон следующих видов агрессивности: выщелачивающую, углекислую, общекислотную, сульфатную и магнезиальную. 1 Выщелачивающая агрессивность связана с выщелачиванием карбонатов, главным образом кальция. Если вода, контактирующая с бетоном, содержит низкие концентрации Са2+, а также НС03- и СО32-, то карбонат кальция бетона переходит в раствор. В зависимости от типа цемента в составе бетона вода считается агрессивной при карбонатной жесткости, меньшей 0,54—2,14 мг-экв/дм3. 2 Углекислая агрессивность обусловлена высокими концентрациями растворенной в воде углекислоты СО2. Эта агрессивность проявляется как в отношении металла (коррозия), так и бетона. Разрушение бетона, как и при выщелачивающей агрессивности, сводится к растворению карбоната кальция. Воды, обладающие карбонатной жесткостью менее 1,4 мг-экв/дм3, следует считать агрессивными, независимо от всех других показателей. 3 Общекислотная агрессивность воды связана с повышенной концентрацией иона водорода (пониженная величина рН). При этом бетон разрушается из-за растворения в кислой среде защитной карбонатной корки. Вода считается агрессивной для всех типов цементов: при рН < 7, если карбонатная жесткость меньше 8,6 мг-экв/дм3; при рН < 6,7, если карбонатная жесткость больше 8,6 мг-экв/дм3 (в пластах высокой проводимости). Для слабопроницаемых пластов вода считается агрессивной при рН < 5.
|
- В породах слабой водопроводимости вода считается агрессивной при содержании иона SO42> 1000 мг/дм3, а для бетонов на пуццолановом, шлаковом и песчано-пуццолановом портландцементе — при содержании иона SO42- > 4000 мг/дм3 независимо от содержания С1-.
- 5 Магнезиальная агрессивность вызывает разрушение и вспучивание бетонных конструкций под воздействием Mg2+.
- Для портландцемента, находящегося в сильно проницаемых породах, вода считается агрессивной при содержании иона Mg2+ > 5000 мг/дм3, для других видов цемента — при содержании ионов Mg2+ и SO42-, превышающем следующие попарные соединения ионов (в мг/дм3):
- Таблица 11 — Магнезиальная агрессивность
| SO42- | 0—1000 | 1001—2000 | 2001—3000 | 3001—4000 |
| Mg2+ | 5000 | 3001—5000 | 2001—3000 | 1000—2000 |
Агрессивность воды по отношению к металлу связана с корродирующей способностью вод. Агрессивными по отношению к металлу являются воды: углекислые; сероводородные кислые; обогащенные кислородом. Корродирующая способность воды может быть определена при помощи коэффициента коррозии:
- — для вод с кислой реакцией
- Кк = rH+ + rAl3+ + rFe2+ + rMg2+ — rCO32- — rHC03- ;
- — для щелочных вод
- Кк = rMg2+ — гНС03- .
- По величине коэффициента коррозии различают следующие группы вод (содержание Са2+ в мг/дм3):
- — коррозирующие, Кк > 0;
- — полукоррозирующие, Кк < 0, но Кк + 0,05 Са2+ > 0;
- — некоррозирующие, Кк + 0,05 Са2+ < 0.
Расчет и оценка агрессивности подземных вод
Оценка качества воды по отношению к бетону производится по нормам и техническим условиям Н 114-54 «Бетон гидротехнический. Признаки и нормы агрессивности воды-среды».
- 1 Выщелачивающая агрессивность
- r Са+2 = 4,28 мг-экв/дм3
- r HC03- = 6,000 мг-экв/дм3
- Вода является агрессивной по отношению к бетону, при карбонатной жесткости меньше 0,54-2,14 мг-экв/ дм3, следовательно, вода неагрессивная;
- 2 Углекислая агрессивность
- Данная вода имеет карбонатную жесткость более 1,4 мг-экв/дм3 , значит в ней нет признаков агрессивности в отношение Me(коррозия) и бетона
- 3 Общекислотная агрессивность
- Показатели исследуемой воды:
- pH = 7,1
- r Са+2 = 4,28 мг-экв/дм3
- r HC03- = 6,000 мг-экв/дм3
- Вывод: вода не агрессивная для всех видов цементов.
- 4 Сульфатная агрессивность
- SO42-= 73 мг/ дм3
- вода является неагрессивной, так как содержание иона SO42- меньше 250 мг/ дм3.
- 5 Магнезиальная агрессивность
- Mg2+= 37 мг/ дм3
вода является неагрессивной, т.к. содержание ионов Mg2+ меньше 5000 мг/ дм3.
- Корродирующая способность воды:
- Для щелочных вод
- r Mg2+ = 3,03 мг-экв/ дм3
- r HC03- = 6,00 мг-экв/ дм3
- Коэффициент коррозии:
- Кк = r Mg2+ — r HC03- = 3,03 — 6,00 = — 2,97
- Кк + 0,05 Са2+ = -2,97+0,05*90 = 1,53
- Так как Кк + 0,05 Са2+ > 0, следовательно, исследуемая вода относится к полукоррозирующей группе вод.
- Исследование пробы по формуле Курлова
Исходя из полученных данных, можно сделать вывод, что данная вода пресная, сульфатная, магниево — кальциевая, слабокислая. Температура равна 10oC, вода холодная.

Почвенная коррозия
Почвенная коррозия – разрушение металла в почве. Ежегодные потери металла вследствии протекания почвенной коррозии достигают 4%.
Почвенной коррозии подвергаются различного назначения трубопроводы, резервуары, сваи, опоры, кабеля, обсадные трубы скважин, всякого рода металлоконструкции, эксплуатируемые в почве.
Почва – очень агрессивная среда. Она состоит из множества химических соединений и элементов, многие из них только ускоряют коррозионный процесс. Агрессивность почвы (грунта) зависит от некоторых факторов: влажность, аэрация, пористость, рН, наличие растворенных солей, электропроводность.
- Классификация грунтов по коррозионной активности:
- — высококоррозионные грунты (тяжелые глинистые, которые длительное время удерживают влагу);
- — среднекоррозионные грунты;
- — практически инертные грунты в коррозионном отношении (песчаные почвы).
Влияние различных факторов на почвенную коррозию
Влияние влажности грунта на почвенную коррозию металла
Влага в почве присутствует почти везде. Где-то ее больше, а где-то меньше. Именно влажность грунта очень сильно влияет на скорость почвенной коррозии, превращая почву в электролит.
Она же вызывает электрохимическую коррозию находящихся в грунте металлоконструкций. Вода в грунте может быть: капиллярной, гравитационной, связанной. Капиллярная влага собирается в порах грунта. Высота подъема ее по капилляру зависит от диаметра пор.
Капиллярная влага сильно влияет на скорость почвенной коррозии. Связанная влага на скорость почвенной коррозии не влияет, т.к. находится в виде гидратированных химических соединений.
Под действием силы тяжести в грунтах и почвах постоянно перемещается вода, которая оказывает, как и капиллярная, значительное влияние на скорость почвенной коррозии.
Максимальная скорость почвенной коррозии наблюдается при влажности грунта 15 – 25%. Это объясняется уменьшением омического сопротивления коррозионных элементов.
С повышением влажности почвы анодный процесс проходит легче (за счет затруднения пассивации поверхности металла), а катодный – труднее (грунт насыщается влагой, затрудняется его аэрация).
Влажность, при которой наблюдается наибольшая скорость коррозии, называют критическим показателем влаги для грунта. Для глинистых грунтов он составляет около 12 – 25%, для песчаных 10 – 20%.
Пористость (воздухопроницаемость) грунта
Пористость (воздухопроницаемость) грунта влияет на способность длительное время сохранять влагу и аэрацию. Воздухопроницаемость зависит от состава грунта, его плотности, влажности.
Грунты, хорошо пропускающие воздух (песчаные), более агрессивны. В песчаных грунтах катодный процесс протекает с облегчением.
На практике бывают случаи, когда подземный трубопровод большой протяженности проходит через разного вида грунты.
Если он проходит последовательно в песчаной, а потом глинистой почве, где условия аэрации металлической поверхности очень различаются, то возникают аэрационные микрогальванические коррозионные зоны.
Поверхность трубопровода в песчаной зоне будет играть роль катода, а глинистой – анода. Разрушение металла будет происходить на анодных участках, где затруднен доступ кислорода к поверхности. Интересно, что катодная и анодная зоны могут находится на расстоянии больше сотни метров.
При этом коррозионный процесс будет отличаться омическим торможением.
Кислотность грунта
Для большинства грунтов значение рН составляет 6,0 – 7,5. Высококоррозионными являются почвы, рН которых сильно отличается от данного значения.
К ним относятся торфяные, болотистые грунты, значение рН которых составляет 3 – 6. А также щелочные солончаки и суглинки, с рН почвы 7,5 – 9,5.
Очень агрессивной средой по отношению к сталям, свинцу, меди, цинку является чернозем, содержащий органические кислоты.
Одна из самых агрессивных почв – подзол. Сталь в подзоле корродирует в 5 раз быстрее, чем в других грунтах.
Кислотность грунтов ускоряет почвенную коррозию, т.к. вторичные продукты коррозии становятся более растворимы, существует возможность дополнительной катодной деполяризации ионами водорода.
Электропроводность грунта
Электропроводность грунта зависит от его минералогического состава, количества влаги и солей в почве. Каждый вид грунта имеет свое определенное значение электропроводности, оно может колебаться от нескольких единиц до нескольких сотен Ом на метр.
Соленость грунта оказывает огромное влияние на его электропроводность. С увеличением содержания солей легче протекают анодный и катодный электродные процессы, что снижает электросопротивление.
Почти всегда определив электропроводность грунта можно судить о его степени коррозионной агрессивности (для стали, чугуна). Исключение составляют водонасыщенные почвы.
Минералогический состав и неоднородность грунта
Минералогический состав и неоднородность грунта оказывают большое влияние (как и влажность) на омическое сопротивление. В глинисто-песчаном влажном грунте удельное сопротивление почвы составляет около 900 Ом•см, а в таком же грунте, только сухом – 240000 Ом•см. С уменьшением удельного сопротивления грунта его агрессивность увеличивается.
Минерализация почвы может колебаться в пределах 10 – 300 мг/л.
Неоднородность грунта приводит к возникновению гальванопар, которые только усиливают почвенную коррозию, делают разрушение неравномерным.
Влияние температуры грунта на почвенную коррозию металлов. Температура может колебаться в очень больших пределах. Зимой, когда свободная вода, заполняющая капилляры в почве замерзает — скорость почвенной коррозии немного уменьшается. Это также связано с плохой аэрацией поверхности металла.
В летнее время, когда на улице стоит жара, скорость почвенной коррозии может замедлятся также, что объясняется высыханием почвы. Самый большой ущерб почвенная коррозия наносит в межсезонье, когда грунт достаточно влажный, созданы оптимальные условия для протекания коррозионного процесса.
Температура грунта зависит от времени года, географической широты, времени суток, погоды.
Значительное различие температур на конструкции, имеющей большую протяженность (подземный трубопровод) может быть причиной образования термогальванических коррозионных пар, которые обеспечивают усиление местной почвенной коррозии.
Влияние микроорганизмов на почвенную коррозию металлов
В почве живут и развиваются два вида микроорганизмов: аэробные (могут существовать только при наличии кислорода), анаэробные (для обеспечения их жизнедеятельности кислород не требуется).
Они оказывают огромное влияние на почвенную коррозию металлов.
Почвенная коррозия металлических сооружений, вызванная жизнедеятельностью живых микроорганизмов носит название биологическая (биокоррозия) либо биохимическая.
Аэробные микроорганизмы (почвенные) существуют двух видов: одни принимают непосредственное участие в осаждении железа, другие – окисляют серу. Оптимальными условиями для существования анаэробных серобактерий является кислая среда (3 – 6 рН). Серобактерии окисляют сероводород в серу, а потом — серную кислоту по следующим уравнениям:
2H2S + O2 = 2H2O + S2;
S2 + 2H2O + 3O2 = 2H2SO4.
В местах наибольшего количества серобактерий концентрация серной кислоты может достигать 10%. Это очень сильно ускоряет почвенную коррозию, особенно стали.
При рН грунта около 4 – 10 развиваются бактерии, перерабатывающие железо. Эти бактерии в процессе своей жизнедеятельности поглощают ионы железа, а выделяют нерастворимые соединения, содержащие Fe.
В местах скопления железобактерий наблюдается большое количество нерастворимых железистых соединений, которые увеличивают гетерогенность поверхности.
Это явление также оказывает большое влияние на скорость почвенной коррозии.
Анаэробные микроорганизмы могут вырабатывать углеводороды, сероводород, угольную кислоту и множество других химических соединений. Они могут разрушать защитные покрытия, воздействовать на ход анодной и катодной реакции, менять характеристики почвы.
Среди анаэробных микроорганизмов самыми опасными можно считать сульфатредуцирующие бактерии. Оптимальные условия для их существования, почва со значением рН 5,5 – 8 (болотные, глинистые, илистые грунты). Бактерии восстанавливают сульфаты, содержащиеся в почве. Этот процесс можно описать следующим уравнением:
MgSO4 + 4H = Mg(OH)2 + H2S + O2.
Выделившийся кислород обеспечивает протекание реакции на катоде. Сероводород и сульфиды в почве являются причиной появления на поверхности эксплуатируемой конструкции рыхлого слоя сульфида железа.
Коррозия носит питтинговый характер.
Механизм и особенности почвенной коррозии металлов
Почвенная коррозия почти всегда протекает по электрохимическому механизму (исключения составляют лишь очень сухие грунты).
Анодный процесс при почвенной коррозии – разрушение металла. На катоде же проходит кислородная деполяризация.
Чаще всего кислородная деполяризация проходит с затрудненным доступом кислорода к поверхности корродирующего изделия.
Подвод кислорода может осуществятся несколькими способами: диффузией в жидкой или газообразной среде или направленным течением этих фаз, перемешиванием фаз при помощи конвекции.
Во влажном грунте процесс проходит с преимущественно катодным контролем, а сухих рыхлых почвах — анодным. Иногда, при работе протяженных микропар может наблюдаться катодно-омический контроль.
На катоде также может проходить и водородная деполяризация (только в условиях кислых грунтов). Существенно изменить ход коррозионного процесса могут и микроорганизмы.
Подземную коррозию делят на грунтовую коррозию и электрокоррозию (коррозию блуждающими токами). Подземная коррозия менее опасна, чем разрушение под воздействием блуждающих токов.
Особенности почвенной коррозии металлов:
- — значительное влияние омического сопротивления грунта;
- — возникновение коррозионных микро и макропар;
- — язвенный характер разрушения.
Методы защиты от почвенной коррозии
Защиту от почвенной коррозии можно разделить на активную (электрохимическую) и пассивную (изоляция изделия от воздействия окружающей среды, специальные способы укладки и т.д.).
Для защиты металлоизделий от почвенной коррозии применяются самые разнообразные методы. Очень часто, особенно в высококоррозионых грунтах, применяют комплексную защиту от подземной коррозии.
Основные методы защиты металлоконструкций от почвенной коррозии: нанесение защитных покрытий и изоляция изделий, создание искусственной среды, электрохимическая защита, применение специальных методов укладки.
Нанесение защитных покрытий. Изоляция
Для защиты от почвенной (грунтовой) коррозии наиболее эффективным и широко используемым является нанесение защитных изоляционных покрытий.
К таким покрытиям предъявляются следующие требования: оно должно быть сплошным, без трещин, царапин; иметь хорошую адгезию с металлоподложкой; быть химически стойким; отличаться высокими диэлектрическими свойствами; сохранять свои защитные свойства при воздействии положительных и отрицательных температур (от -50 до +50 °С); не содержать коррозионно-активных по отношению к основному металлу агентов; обладать высокой биостойкостью, механической прочностью.
Защитные покрытия могут быть полимерными и мастичные. К мастичным относятся каменноугольное, битумное. К полимерным – покрытия из липких изоляционных лент, расплавы, накатываемые эмали и т.д.
Покрытие, применяемое для защиты от почвенной коррозии, должно полностью изолировать готовую конструкцию от воздействия окружающей среды. Для изоляции подземных трубопроводов очень часто используют битумные покрытия различной толщины (6 мм – усиленное, 3 мм – обычное, 9 мм – очень усиленное).
Широкое распространение получили петролатумные, цементные, каменноугольно-пековые, полиэтиленовые, поливинилхлоридные защитные покрытия. Последние отличаются отличными защитными и изолирующими способностями, долгим сроком службы, но не из самых дешевых.
Самыми слабыми защитными свойствами обладает цементное покрытие.
Создание искусственной атмосферы
Этот метод применяют достаточно редко, в основном для трубопроводов большой протяженности. Это связано с большими транспортными затратами, трудностью его реализации (необходимо большое количество работников, техники, достаточно много времени).
Протяженные подземные сооружения могут проходит через разные виды почв, что интенсифицирует коррозионный процесс. Суть метода заключается в том, чтоб создать однородный грунт по всей протяженности конструкции (засыпая, например, весь трубопровод песчаным грунтом) либо уменьшить агрессивность почвы на определенных участках. Для этого кислые грунты могут известковать.
Электрохимическая защита металла от почвенной коррозии
Электрохимическая защита заключается в принудительном создании катодной либо анодной поляризации. При совместном применении электрохимический защиты и защитных покрытий, затраты на первую весьма невелики.
В практике защиты металлов от почвенной коррозии очень часто применяется катодная защита. Металлоконструкции сообщают определенный отрицательный электрический потенциал, который затрудняет термодинамику окисления металла. Это существенно снижает (сводит к минимуму) скорость почвенной коррозии. Осуществить катодную поляризацию можно используя специальные установки: протекторные, катодные.
Протекторная защита заключается в подсоединении к изделию электродов из металла, который в данной среде более электроотрицателен. Для защиты стали от подземной коррозии протекторами могут служить алюминий, его сплавы, цинк, магний.
Катодная защита – создание катодной поляризации при помощи внешнего источника тока (генераторы постоянного тока, батареи, выпрямители). По всей протяженности трубопровода ставят специальные станции катодной защиты.
Специальные методы укладки
Очень часто при прокладке трубопровода, а также других сооружений для защиты их от воздействия грунтовых вод, самого грунта используют специальные способы укладки. Трубопровод или кабель может быть помещен в специальный коллектор (при этом кабель укладывают на неметаллическую подкладку), защитный кожух (часто из железобетонных плит или металла).
Вышеописанные методы применимы только для защиты изделий от влияния грунта и подземных вод.
Оценка агрессивности подземных вод по отношению к бетону и металлам
Агрессивность воды связана с присутствием в ней ионов водорода, свободного диоксида углерода, сульфатов и магния. Агрессивные свойства воды проявляются по отношению к бетону и металлам.
- По отн ошени ю к бето ну различают следующие виды агрессивности: выщелачивающую, углекислую, общекислотную, сульфатную и магнезиальную.
- Выщелачивающая агрессивность связана с выщелачиванием карбонатов, главным образом кальция.
- Если вода, контактирующая с бетоном, содержит низкие концен
- трации Са2+, а также НСО ‾
- и СО3
- 2-, то карбонат кальция бетона переходит в раствор. В зависимости от типа цемента в составе бетона вода считается агрессивной при карбонатной жесткости меньшей
- 0,54…2,14 мг∙экв/дм3.
- Углекислотная агрессивность обусловлена высокими концентрациями растворенного в воде углекислого газа СО2, что приводит к образованию угольной кислоты.
Эта агрессивность проявляется как в отношении металла (коррозия), так и к бетону. Разрушение бетона, как и при выщелачивающей агрессивности, сводится к растворению карбоната кальция.
При карбонатной жесткости менее 1,4 мг∙экв/дм3 воды следует
считать агрессивными, независимо от всех других показателей.
Общекислотная агрессивность воды связана с повышенной концентрацией водорода (пониженная величина рН). При этом бетон разрушается из-за растворения в кислой среде защитной карбонатной корки.
- Вода считается агрессивной для всех типов цементов при рН4000 мг/дм3
- независимо от содержания Cl-.
- Магнезиальная агрессивность вызывает разрушение и вспучивание бетонных конструкций.
- Для портландцемента, находящегося в сильно проницаемых породах, вода считается агрессивной при содержании иона Mg2+ более
- 5000 мг/дм3, для других видов цемента – при содержании ионов Mg2+ и
- 2SO4
- , превышающем следующие попарные соединения ионов (в
- мг/дм3):
- K k rH
- rAl 3
- rFe 2
- rMg 2
- rCO 2
- rHCO3 ;
- для щелочных вод:
- K k
- rMg 2 rHCO .
- По величине коэффициента коррозии различают следующие группы вод (содержание Са2+ в мг/дм3):
- коррозирующие, Кк>0;
- полукоррозирующие, Кк0;
- некоррозирующие, Кк + 0,05Са2+
| 2SО4 | 0 – 1000 | 1001 2000 | 2001 3000 | 3001 – 4000 |
| Mg2+ | 5000 | 3001 5000 | 2001 3000 | 1000 2000 |
Агрес сивнос ть воды по отн оше нию к метал лу связана с коррозирующей способностью вод. Агрессивными водами по отношению к металлу являются: углекислые, сероводородные кислые, обогащенные кислородом.
Коррозирующая способность воды может быть определена при помощи коэффициента коррозии (Кк):
для вод с кислой реакцией:






