- Типы и классификация
- Соединения с ионным типом связи
- Когда связь ковалентна
- Свойства, типы, номенклатура и примеры гидридов / химия
- Как образуются гидриды?
- Физико-химические свойства гидридов
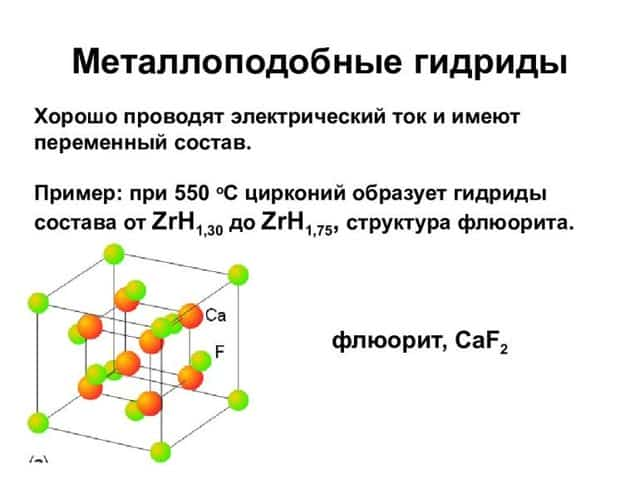
- Гидриды металлов
- Неметаллические гидриды
- Номенклатура, как они названы?
- примеров
- Гидриды металлов
- Неметаллические гидриды
- ссылки
- Гидриды | это… Что такое Гидриды?
- II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- Взаимодействие со сложными веществами
- ГИДРИ́ДЫ
- Большая Рнциклопедия Нефти Рё Газа
Время на чтение: 21 минута 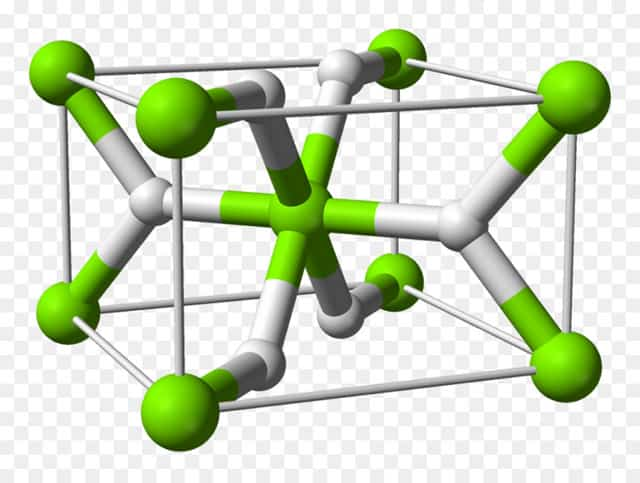
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:

- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
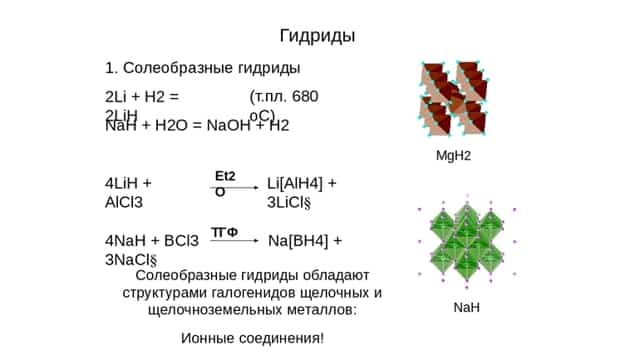
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:

- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Свойства, типы, номенклатура и примеры гидридов / химия
гидрид водород в своей анионной форме (H-) или соединения, которые образуются из комбинации химического элемента (металлического или неметаллического) с водородным анионом. Из известных химических элементов водород является самой простой структурой, потому что когда он находится в атомном состоянии, в его ядре есть протон и электрон.
Несмотря на это, водород обнаруживается только в его атомной форме в условиях довольно высоких температур. Другой способ распознавания гидридов состоит в том, когда наблюдается, что один или несколько центральных атомов водорода в молекуле имеют нуклеофильное поведение в качестве восстановителя или даже в качестве основания..
Таким образом, водород обладает способностью объединяться с большинством элементов таблицы Менделеева с образованием различных веществ..
индекс
- 1 Как образуются гидриды?
- 2 Физико-химические свойства гидридов
- 3 Гидрида металла
- 4 неметаллических гидрида
- 5 Номенклатура как они названы?
- 6 примеров
- 6.1 Гидриды металлов
- 6.2 Неметаллические гидриды
- 7 ссылок
Как образуются гидриды?
Гидриды образуются, когда водород в его молекулярной форме связан с другим элементом — либо металлического, либо неметаллического происхождения — непосредственно путем диссоциации молекулы с образованием нового соединения..
Таким образом, водород образует связи ковалентного или ионного типа, в зависимости от типа элемента, с которым он соединен. В случае ассоциации с переходными металлами образуются межузельные гидриды с физическими и химическими свойствами, которые могут сильно варьироваться от одного металла к другому..
Существование гидридных анионов в свободной форме ограничено применением экстремальных условий, которые не возникают легко, поэтому в некоторых молекулах правило октета не соблюдается.
Возможно, что другие правила, связанные с распределением электронов, не приводятся, поскольку для объяснения образования этих соединений необходимо применять выражения связей нескольких центров..
Физико-химические свойства гидридов
С точки зрения физических и химических свойств можно сказать, что характеристики каждого гидрида зависят от типа связи, которая осуществляется.
Например, когда гидридный анион связан с электрофильным центром (обычно это ненасыщенный атом углерода), образующееся соединение ведет себя как восстановитель, применение которого очень широко распространено в химическом синтезе..
Напротив, в сочетании с такими элементами, как щелочные металлы, эти молекулы реагируют со слабой кислотой (кислотой Бренстеда) и ведут себя как сильные основания, выделяя газообразный водород. Эти гидриды очень полезны в органическом синтезе.
Затем наблюдается, что природа гидридов очень разнообразна, способна образовывать дискретные молекулы, твердые вещества ионного типа, полимеры и многие другие вещества..
По этой причине они могут быть использованы в качестве осушителей, растворителей, катализаторов или промежуточных соединений в каталитических реакциях. У них также есть многократное использование в лабораториях или отраслях промышленности для различных целей.
Гидриды металлов
Существует два типа гидридов: металлический и неметаллический..
Металлические гидриды — это те бинарные вещества, которые образуются в результате сочетания металлического элемента с водородом, обычно электроположительного, такого как щелочная или щелочно-земельная, но также включают промежуточные гидриды..
Это единственный тип реакции, в котором водород (степень окисления которого обычно равна +1) имеет дополнительный электрон на своем внешнем уровне; то есть его валентное число преобразуется в -1, хотя природа связей в этих гидридах не была полностью определена несоответствием ученых предмета.
Гидриды металлов обладают некоторыми свойствами металлов, такими как их твердость, проводимость и яркость; но в отличие от металлов гидриды обладают определенной хрупкостью, и их стехиометрия не всегда соответствует весовым законам химии.
Неметаллические гидриды
Этот тип гидрида возникает в результате ковалентной связи между неметаллическим элементом и водородом, так что неметаллический элемент всегда имеет самую низкую степень окисления, чтобы генерировать один гидрид с каждым.
Также установлено, что соединения этого типа по большей части газообразны в стандартных условиях окружающей среды (25 ° С и 1 атм). По этой причине многие неметаллические гидриды имеют низкие точки кипения из-за сил Ван-дер-Ваальса, которые считаются слабыми.
Некоторые гидриды этого класса представляют собой дискретные молекулы, другие принадлежат к группе полимеров или олигомеров, и даже водород, который прошел процесс хемосорбции на поверхности, может быть включен в этот список..
Номенклатура, как они названы?
- Чтобы написать формулу гидридов металлов, начните с написания металла (символ металлического элемента), за которым следует водород (MH, где М — металл).
- Называть их начинается со слова гидрид, за которым следует название металла («М гидрид»), поэтому LiH читается как «гидрид лития», CaH2 на нем написано «гидрид кальция» и так далее.
- В случае неметаллических гидридов, противоположное написано для металлических гидридов; то есть начинается с записи водорода (его символа), полученного неметаллом (НХ, где Х — неметалл).
- Чтобы назвать их, начните с названия неметаллического элемента и добавьте суффикс «уро», заканчивающийся словами «водород» («X-uro de водород»), поэтому HBr читается как «бромистый водород», H2S читает «сероводород» и так далее.
примеров
Существует много примеров гидридов металлов и неметаллов с различными характеристиками. Вот некоторые из упомянутых:
Гидриды металлов
- — LiH (гидрид лития).
- — NaH (гидрид натрия).
- — KH (гидрид калия).
- — CsH (гидрид цезия).
- — RbH (гидрид рубидия).
- — Бех2 (Гидрид бериллия).
- — MgH2 (гидрид магния).
- — CaH2 (гидрид кальция).
- — WRS2 (гидрид стронция).
- — ба2 (гидрид бария).
- — AlH3 (гидрид алюминия).
- — SrH2 (гидрид стронция).
- — MgH2 (гидрид магния).
- — CaH2 (гидрид кальция).
Неметаллические гидриды
- — HBr (бромистый водород).
- — HF (фтористый водород).
- — HI (йодистый водород).
- — HCl (хлористый водород).
- — H2S (сероводород).
- — H2Те (теллурид водорода).
- — H2Se (селенид водорода).
ссылки
- Wikipedia. (2017). Wikipedia. Получено с en.wikipedia.org
- Чанг, Р. (2007). Химия. (9-е изд). McGraw-Hill.
Гидриды | это… Что такое Гидриды?
- гидриды — Соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) г.; комплексные, напр. алюминогидриды У(АlН4), Са(АlH4)2 и т.п., борогидриды Аl(ВН4), Zr(BH4), Са(ВН4) и др. и г. интерметаллидов … Справочник технического переводчика
- ГИДРИДЫ — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Большой Энциклопедический словарь
- Гидриды — [hydrides] соединения водорода с металлами и менее электроотрицательными элементами (неметаллами). Различают простые (бинарные) гидриды; комплексные, например, алюминогидриды Li(АlH4), Са(АlH4)2 и т. п., борогидриды Al(ВH4), Zr(ВH4), Са(ВH4) и др … Энциклопедический словарь по металлургии
- ГИДРИДЫ — соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Иногда к Г. относят соед. всех хим. элементов с водородом. Различают простые, или бинарные, Г., комплексные (см., напр., Алюмогидриды, Борогидриды металлов … Химическая энциклопедия
- гидриды — химические соединения водорода с другими элементами. Восстановители. Некоторые гидриды промежуточные продукты при получении особо чистых элементов (кремния, германия). См., например, Алюмогидриды, Борогидриды металлов. * * * ГИДРИДЫ ГИДРИДЫ,… … Энциклопедический словарь
- гидриды — (гидр(огениум) гр. eidos вид) хим. соединения водорода с другими элементами; примен. во многих областях техники. Новый словарь иностранных слов. by EdwART, , 2009. гидриды [гр. вода + вид] – хим. водородистые металлы; соединения водорода с… … Словарь иностранных слов русского языка
- Гидриды — соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные. К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это… … Большая советская энциклопедия
- гидриды — мн. Химические соединения водорода с каким либо другим элементом. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
- ГИДРИДЫ — соединение водорода с металлами и нек рыми неметаллами. Г. применяют для получения особо чистых элементов (напр., кремния, германия), как восстановители и катализаторы в органич. синтезе (Г. лития и натрия), для хранения и транспортирования… … Большой энциклопедический политехнический словарь
- ГИДРИДЫ — хим. соединения водорода с др. элементами. Восстановители. Нек рые Г. промежуточные продукты при получении особо чистых элементов (кремния, германия). См., напр., Алюмогидриды, Борогидриды металлов … Естествознание. Энциклопедический словарь
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
- К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу:
- Бериллий Be
- магний Mg
- кальций Ca,
- стронций Sr,
- барий Ba и
- радий Ra.
- Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них.
- Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 2 электрона на внешнем уровне ns2:
- Be — 2s2
- Mg —3s2
- Ca — 4s2
- Sr — 5s2
- Ba — 6s2
- Ra — 7s2
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др.
Основные минералы, в которых присутствуют щелочноземельные металлы:
Магний
- Магний получают электролизом солей, чаще всего хлоридов: расплавленного карналлита (KCl·MgCl26H2O) или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
- восстановлением прокаленного доломита в электропечах при 1200–1300°С:
- 2(CaO · MgO) + Si → 2Mg + Ca2SiO4
- Кальций
- Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
- CaCl2 → Ca + Cl2
- Барий
- Барий получают алюмотермическим способом — восстановление оксида бария алюминием в вакууме при 1200 °C:
- 4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
- Окрашивание пламени солями щелочных металлов
Цвет пламени:
- Ca — кирпично-красный
- Sr — карминово-красный (алый)
- Ba — яблочно-зеленый
- Взаимодействие с веществами:
- С кислородом
- С кислородом взаимодействуют при нагревании с образованием оксидов
- 2Сa + O2 → 2CaO
- Видео Горение кальция
- С галогенами
- (F, Cl, Br, I)
- Щелочноземельные металлы реагируют с галогенамипри нагревании с образованием галогенидов .
- Сa + Cl2→ 2СaCl2
- С водородом
- Щелочноземельные металлы реагируют с водородом при нагревании с образованием гидридов:
- Сa + H2 СaH2
- Бериллий с водородом не взаимодействует.
- Магний реагирует только при повышенном давлении:
- Mg + H2 → MgH2
- С серой
- Щелочноземельные металлы при нагревании взаимодействуют с серой с образованием сульфидов сульфидов:
- Сa + S СaS
- Ca + 2C → CaC2 (карбиды)
- С азотом
- При комнатной температуре с азотом взаимодействует только магний с образованием нитрида:
- 6Mg + 2N2 → 2Mg3N2
- Остальные щелочноземельные металлы реагируют с азотом при нагревании.
- С углеродом
- Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
- Ca + 2C → CaC2
- Бериллий при нагревании с углеродом с образует карбид — метанид:
- 2Be + C → Be2C
- С фосфором
- Щелочноземельные металлы при нагревании взаимодействуют с фосфором с образованием фосфидов:
- 3Сa + 2P Сa3 P2
Взаимодействие со сложными веществами
- С водой
- Кальций, стронций и барий взаимодействуют с водой при комнатной температуре с образованием щелочи и водорода:
- Sr + 2H2O → Sr(OH)2 + H2↑,
- Магний реагирует с водой при кипячении, а бериллий с водой не реагирует.
- С кислотами
- С растворами HCl, H2SO4, H3PO4 щелочноземельные металлы взаимодействуют с образованием соли и выделением водорода:Са + H2SO4(разб)= СаSO4 + H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 4Ca + 10H2SO4(конц) → 4CaSO4 + H2S↑ + 5H2O;
- с разбавленной и концентрированной азотной:
- 4Sr + 10HNO3(конц) → 4Sr(NO3)2 + N2O +5H2O
- С водными растворами щелочей
- В водных растворах щелочей растворяется только бериллий:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- С солями
- В расплаве щелочноземельные металлы могут взаимодействовать с некоторыми солями:
- Ca + CuCl2 → CaCl2 + Cu
Запомните! В растворе щелочноземельные металлы взаимодействуют с водой, а не с солями других металлов.
- С оксидами
- Щелочноземельные металлы могут восстанавливать из оксидов такие неметаллы как кремний, бор, углерод:
- 2Ca + SiO2 → 2CaO + Si
- Магний сгорает в атмосфере углекислого газа с образованием оксида магния и сажи (С):
- 2Mg + CO2 → 2MgO + C
ГИДРИ́ДЫ
Авторы: А. И. Жиров
ГИДРИ́ДЫ, химич. соединения водорода с менее электроотрицательными элементами. Наиболее распространённые бинарные Г. по типу химич. связи разделяют на ионные, ковалентные и металлоподобные.
Ионные Г. образуют щелочные и щёлочноземельные металлы (напр., NaH, CaH2); представляют собой твёрдые вещества с кристаллич. решёткой, содержащей катион металла и гидрид-анион Н–. Термически неустойчивы, обладают высокой химич.
активностью, сильные восстановители; реагируют с галогенидами или гидридами Al и В, образуя комплексные Г. (см. Алюмогидриды металлов, Борогидриды металлов). Ионные Г.
получают взаимодействием расплавленных металлов с водородом. Применяют в качестве восстановителей (напр.
, для получения металлов из их оксидов или галогенидов, удаления окалины с поверхности изделий из стали или из тугоплавких металлов), в качестве источника водорода, как ракетное топливо.
Ковалентные молекулярные Г. образуют неметаллы, а также Al, Be, Sn, Sb, As, Te, Ge; могут быть газами или летучими жидкостями; электронодефицитные Г. (напр., AlH3, BeH2) образуют полимерные структуры и являются твёрдыми веществами.
Некоторые элементы (напр., В, Si, Р) образуют значит. число соединений с водородом, содержащих связь элемент – элемент (см. Бороводороды, Силаны, Фосфины). Ковалентные Г.
термически неустойчивы, обладают высокой реакционной способностью, сильные восстановители, мн. токсичны. Их получают обменными реакциями между галогенидами соответствующих элементов и ионными (гл. обр. LiH) или комплексными Г.
SiH4, GeH4, AsH3 используют для получения полупроводниковых плёночных покрытий, РН3, В2Н6 – защитных покрытий на поверхности металлов.
К металлоподобным относят Г. переходных металлов и РЗЭ; представляют собой кристаллич. вещества с металлич. блеском. Имеют нестехиометрический состав и могут рассматриваться как твёрдые растворы внедрения водорода в металл. Обладают высокими тепло- и электропроводностью.
Их получают взаимодействием металлов с водородом (как правило, при значит. повышении давления). Механизм образования металлоподобных Г. включает адсорбцию молекулярного водорода на поверхности металла, диссоциацию Н2 на атомы и диффузию атомов Н в кристаллич. решётку металла. Металлоподобные Г.
широко используют в качестве катализаторов процессов гидрирования – дегидрирования (гл. обр. Г. Ni, Pd, Pt). При взаимодействии водорода с интерметаллич. соединениями (напр., TiFe, LaNi5) можно получить Г. интерметаллидов (напр., TiFeH2, LaNi5H6,7), которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
Г. металлов и интерметаллидов применяют как гидридные аккумуляторы водорода.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 2
Рто соли, РЅРµ растворимые РІ органических растворителях, реагирующие СЃ РІРѕРґРѕР№ СЃ образованием газообразного РІРѕРґРѕСЂРѕРґР°.
Однако гидриды щелочноземельных металлов менее активны, чем гидриды щелочных металлов.
С ростом атомного веса металла реакционная способность гидридов щелочноземельных металлов увеличивается. [16]
Наиболее устойчивым среди гидридов щелочных металлов является гидрид лития LiH.
В этом отношении он близок гидридам щелочноземельных металлов, которые значительно более устойчивы, чем гидриды щелочных металлов.
Гидрид лития легко получается при пропускании водорода над слабо нагретым литием, находящимся в железной лодочке. [17]
В отсутствие избытка водорода все они разлагаются на элементы еще до достижения температур плавления. Напротив, LiH по устойчивости превосходит даже гидриды щелочноземельных металлов ( XII § 3 доп. [18]
Химическая активность ионных РіРёРґСЂРёРґРѕРІ растет РІ том же направлении, что Рё активность соответствующих металлов — РѕС‚ легких элементов Рє тяжелым.
Гидриды рубидия и цезия даже воспламеняются во влажном воздухе; гидриды щелочноземельных металлов несколько менее активны, чем гидриды щелочных металлов. [19]
Mgth и ВеНа твердые и нелетучие соединения, как и гидриды щелочноземельных металлов, но в отличие от последних они не обладают ярко выраженным солеобразным характером. [20]
MgHa и ВеШ твердые и нелетучие соединения, как и гидриды щелочноземельных металлов, но в отличие от последних они не обладают ярко выраженным солеобразным характером. [21]
Восстановительные свойства щелочных металлов выражены настолько сильно, что при их нагревании в атмосфере водорода образуются гидриды МеШ, в которых водород электроотрицателен и одновалентен. �з гидридов щелочных металлов гидрид лития самый устойчивый, остальные заметно уступают гидридам щелочноземельных металлов. При растворении гидридов щелочных металлов в жидком аммиаке образуются растворы, хорошо проводящие электрический ток. [22]
Все элементы IA группы непосредственно взаимодействуют с водородом.
Наибольшей прочностью характеризуется LiH ( 7 л 953 К), который похож на гидриды щелочноземельных металлов.
С азотом, углеродом и кремнием непосредственно соединяется только литий. Для остальных элементов эти соединение получают косвенным путем. [23]
РџСЂРё нагревании РІСЃРµ солеобразные РіРёРґСЂРёРґС‹ ( РєСЂРѕРјРµ LiH, плавящегося РїСЂРё 668 РЎ без разложения) начинают разлагаться РЅР° металл Рё РІРѕРґРѕСЂРѕРґ еще РґРѕ достижения точек плавления. Для производных Na-Cs начало заметного распада лежит РїСЂРё 300 — 350 РЎ, для РіРёРґСЂРёРґРѕРІ щелочноземельных металлов — около 600 РЎ. Термическая диссоциация последних сопровождается образованием растворов РІРѕРґРѕСЂРѕРґР° РІ выделяю -, щемся металле, что сближает РёС… СЃ гидридами переходного типа. [24]
Елицуром этанола являются устаревшими, относящимися к 1940 г. С 1944 г. автор пользуется в разработанном им методе определения воды пиридином.
Метод основан РЅР° извлечении РІРѕРґС‹ РёР· содержащих ее соединений РїРёСЂРёРґРёРЅРѕРј Рё ее химическом взаимодействии СЃ гидридами щелочноземельных металлов СЃ выделением РІРѕРґРѕСЂРѕРґР°, РїРѕ объему которого Рё определяется содержание РІРѕРґС‹ РІ соединении. Ртот метод позволяет определять РІРѕРґСѓ РїСЂРё РЅРёР·РєРѕР№, часто комнатной температуре, Рё РІ СЂСЏРґРµ случаев без РіСЂСѓР±РѕРіРѕ ( как РїСЂРё термическом методе) разрушения внутренней структуры соединений Рё без СЂРёСЃРєР° отделения РґСЂСѓРіРёС…, легколетучих или легкоразлагающихся структурных составляющих. [25]
РџСЂРё нагревании РІСЃРµ солеобразные РіРёРґСЂРёРґС‹ ( РєСЂРѕРјРµ LiH, плавящегося РїСЂРё 668 РЎ без разложения) начинают разлагаться РЅР° металл Рё РІРѕРґРѕСЂРѕРґ еще РґРѕ достижения точек плавления. Для производных Na — Cs начало заметного распада лежит РїСЂРё 300 — 350 РЎ, для РіРёРґСЂРёРґРѕРІ щелочноземельных металлов — около 600 РЎ.
Термическая диссоциация последних сопровождается образованием растворов водорода в выделяющемся металле, что сближает их с гидридами переходного типа. [26]
При нагревании все солеобразные гидриды ( кроме LiH плавящегося при 668 С без разложения) начинают разлагаться на металл и водород еще до температуры плавления.
Для производных Na — Cs начало заметного распада лежит РїСЂРё 300 — 350 РЎ, для РіРёРґСЂРёРґРѕРІ щелочноземельных металлов — около 600 РЎ.
Термическая диссоциация последних сопровождается образованием растворов водорода в металле, что сближает их с гидридами переходного типа. [27]
Для РіРёРґСЂРёРґРѕРІ наблюдается такое же постепенное изменение РїСЂРёСЂРѕРґС‹ химической СЃРІСЏР·Рё Рё характера соединения, как Рё Сѓ РґСЂСѓРіРёС… соединении РІ каком-либо данном периоде, как, например, Сѓ метальных производных элементов этого периода. Гидриды щелочных металлов, РїРѕРґРѕР±РЅРѕ метальным производным щелочных металлов, — кристаллические твердые соединения РёРѕРЅРЅРѕРіРѕ характера; РіРёРґСЂРёРґС‹ бериллия Рё магния представляют СЃРѕР±РѕР№ твердые полимерные вещества, которые, РїРѕ-РІРёРґРёРјРѕРјСѓ, РїРѕ своей РїСЂРёСЂРѕРґРµ являются промежуточными между ионными Рё ковалентны-РјРё соединениями, РІ то время как РіРёРґСЂРёРґС‹ щелочноземельных металлов — РёРѕРЅС‹. Р� хотя РіРёРґСЂРёРґС‹ Р’, РЎ, N, Рћ Рё F преимущественно ковалентны, увеличение кислотности атомов РІРѕРґРѕСЂРѕРґР° РІ СЂСЏРґСѓ Р’, РЎ, Рћ, N Рё F заметно сказывается РЅР° свойствах этих РіРёРґСЂРёРґРѕРІ. РњРЅРѕРіРёРµ реакции РіРёРґСЂРёРґРѕРІ, Р° также методы РёС… получения аналогичны реакциям соответствующих металлоорганических соединений, Рё Рє гидридам, РїРѕ-РІРёРґРёРјРѕРјСѓ, применимо Рё правило замещения ( СЃРј. РіР». [28]
Рто соли, РЅРµ растворимые РІ органических растворителях, реагирующие СЃ РІРѕРґРѕР№ СЃ образованием газообразного РІРѕРґРѕСЂРѕРґР°.
Однако гидриды щелочноземельных металлов менее активны, чем гидриды щелочных металлов.
С ростом атомного веса металла реакционная способность гидридов щелочноземельных металлов увеличивается. [29]
Вероятно, электронная пара смещена сильнее к атому металла в гидридах тех металлов, которые менее склонны отдавать электроны, например в гидридах палладия или никеля.
А вот в гидридах скандия и урана, по-видимому, электронная пара сильно смещена в сторону водорода.
Пожалуй, именно поэтому гидриды лантаноидов и актиноидов во многом похожи на гидриды щелочноземельных металлов.
Действительно, ионные гидриды, например СаНо, это, в сущности, предельный случай смещения электронной пары к атому водорода. [30]
Страницы: 1 2 3






