- Атом и молекула индия. Формула индия. Строение атома индия:
- Изотопы и модификации индия:
- Свойства индия (таблица): температура, плотность, давление и пр.:
- Физические свойства индия:
- Химические свойства индия. Взаимодействие индия. Химические реакции с индием:
- Получение индия:
- Применение индия:
- Индий – уникум планеты
- Что представляет собой
- Как был открыт и назван
- Физико-химические характеристики
- Нахождение в природе
- Месторождения, добыча
- Технология производства
- Где используется
- Атом, космос, наука
- Другие отрасли
- Стоимость
- Индий
- Геохимия и минералогия
- СВОЙСТВА
- Запасы и добыча
- Индий In
- Степень окисления индия
- Ионы индия
- Валентность In
- Квантовые числа In
- Индий
- Индий: открытие, структура, свойства, изотопы, использование, риски
- Видео: Индий: открытие, структура, свойства, изотопы, использование, риски
- Содержание:
- Открытие
- Структура индийского
- Свойства
- Внешность
- Молярная масса
- Температура плавления
- Точка кипения
- Плотность
- Электроотрицательность
- Энергии ионизации
- Теплопроводность
- Удельное электрическое сопротивление
- Твердость по Моосу
- Реактивность
- Электронная конфигурация
- Числа окисления
- Изотопы
- Приложения
- Сплавы
- электроника
- Риски
- Ссылки
Индий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 49. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), пятом периоде периодической системы.
Атом и молекула индия. Формула индия. Строение атома индия
- Изотопы и модификации индия
- Свойства индия (таблица): температура, плотность, давление и пр.
- Физические свойства индия
Химические свойства индия. Взаимодействие индия. Химические реакции с индием
Получение индия
Применение индия
Таблица химических элементов Д.И. Менделеева
Атом и молекула индия. Формула индия. Строение атома индия:
Индий (лат. Indium, назван по синей (цвета индиго) линии спектра) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением In и атомным номером 49. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), пятом периоде периодической системы.
Индий – металл. Относится к группе лёгких металлов.
Индий обозначается символом In.
Как простое вещество индий при нормальных условиях представляет собой ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Сходен по внешнему виду с цинком.
Молекула индия одноатомна.
Химическая формула индия In.
Электронная конфигурация атома индия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p1. Потенциал ионизации (первый электрон) атома индия равен 558,3 кДж/моль (5,7863556(7) эВ).
Строение атома индия. Атом индия состоит из положительно заряженного ядра (+49), вокруг которого по пяти оболочкам движутся 49 электронов. При этом 46 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем.
Поскольку индий расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями.
Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома индия на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали – один неспаренный электрон. В свою очередь ядро атома индия состоит из 49 протонов и 66 нейтронов.
Индий относится к элементам p-семейства.
Радиус атома индия (вычисленный) составляет 156 пм.
Атомная масса атома индия составляет 114,818(1) а. е. м.
Индий, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Индий, свойства атома, химические и физические свойства
Изотопы и модификации индия:
Свойства индия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Индий |
| 102 | Прежнее название | |
| 103 | Латинское название | Indium |
| 104 | Английское название | Indium |
| 105 | Символ | In |
| 106 | Атомный номер (номер в таблице) | 49 |
| 107 | Тип | Металл |
| 108 | Группа | Лёгкий металл |
| 109 | Открыт | Фердинанд Райх и Иероним Теодор Рихтер, Германия, 1863 г. |
| 110 | Год открытия | 1863 г. |
| 111 | Внешний вид и пр. | Ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,000016 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 3,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 4,4·10-6 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 114,818(1) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O3 P0 Q0 R0  |
| 204 | Радиус атома (вычисленный) | 156 пм |
| 205 | Эмпирический радиус атома* | 155 пм |
| 206 | Ковалентный радиус* | 144 пм |
| 207 | Радиус иона (кристаллический) | In3+
|
| 208 | Радиус Ван-дер-Ваальса | 193 пм |
| 209 | Электроны, Протоны, Нейтроны | 49 электронов, 49 протонов, 66 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 13-я группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -5, -2, -1, +1, +2, +3 |
| 302 | Валентность | I, II, III |
| 303 | Электроотрицательность | 1,78 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 558,3 кДж/моль (5,7863556(7) эВ) |
| 305 | Электродный потенциал | In+ + e– → In, Eo = -0,25 В, In3+ + 2e– → In+, Eo = -0,45 В, In3+ + 3e– → In, Eo = -0,34 В |
| 306 | Энергия сродства атома к электрону | 37,043(6) кДж/моль (0,38392(6) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 7,31 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 7,02 г/см3 (при температуре плавления 156,5985 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 156,5985 °C (429,7485 K, 313,8773 °F) |
| 403 | Температура кипения* | 2072 °C (2345 K, 3762 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 3,281 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 231,8 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,238 Дж/г·K (при 0-150 °C) |
| 410 | Молярная теплоёмкость* | 26,74 Дж/(K·моль) |
| 411 | Молярный объём | 15,7 см³/моль |
| 412 | Теплопроводность | 81,8 Вт/(м·К) (при стандартных условиях), 81,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Тетрагональная объёмно-центрированная 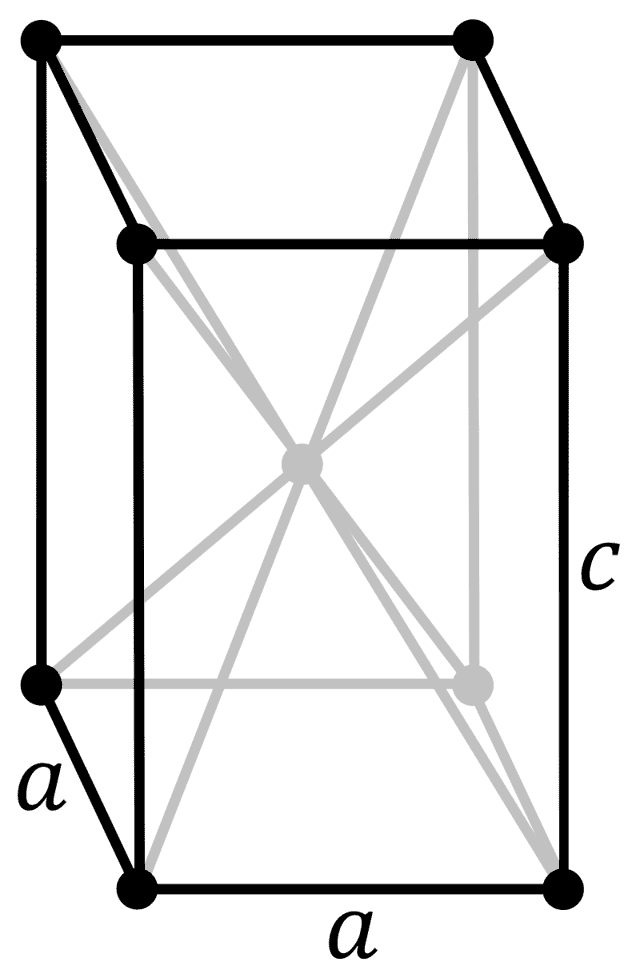 |
| 513 | Параметры решётки | a = 3,252 Å, c = 4,946 Å |
| 514 | Отношение c/a | 1,52 |
| 515 | Температура Дебая | 129 K |
| 516 | Название пространственной группы симметрии | I4/mmm |
| 517 | Номер пространственной группы симметрии | 139 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-74-6 |
- Примечание:
- 205* Эмпирический радиус атома индия согласно [1] и [3] составляет 167 пм и 166 пм соответственно.
- 206* Ковалентный радиус индия согласно [1] составляет 142±5 пм.
- 401* Плотность индия согласно [4] составляет 7,362 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) и 7,023 г/см3 (при 157 °C и иных стандартных условиях, состояние вещества – жидкость).
- 402* Температура плавления индия согласно [4] составляет 156,6 °С (429,75 K, 313,88 °F).
- 403* Температура кипения индия согласно [4] составляет 2109 °C (2382,15 K, 3828,2 °F).
- 407* Удельная теплота плавления (энтальпия плавления ΔHпл) индия согласно [3] и [4] составляет 3,24 кДж/моль и 3,26 кДж/моль соответственно.
- 408* Удельная теплота испарения (энтальпия кипения ΔHкип) индия согласно [3] и [4] составляет 225,1 кДж/моль и 227,6 кДж/моль соответственно.
- 410* Молярная теплоёмкость индия согласно [3] составляет 26,7 Дж/(K·моль).
Физические свойства индия:
Химические свойства индия. Взаимодействие индия. Химические реакции с индием:
Получение индия:
Применение индия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Источники:
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
индий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле индия индий
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
- Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
- Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
- Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
- Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Индий – уникум планеты
Название этого металла созвучно, но не связано с Индией. Его значение будет возрастать с развитием технологий. Сегодня главная область применения индия – гаджеты с жидкокристаллическими экранами. Завтра, не исключено, металл потребуется Илону Маску для марсианского проекта.

Что представляет собой
Индий – элемент таблицы Менделеева №49.
Красивое серебристое вещество относится к легким металлам.
По составу это дуэт изотопов 113 и 115. Первый стабилен, второй распадается за 6 триллионов лет. Синтезировано два десятка радиоактивных единиц, полураспад самого долгоживущего – полтора месяца.
Редкий, дорогой металл.
Международное обозначение – In (Indium).
Как был открыт и назван
История открытия вещества связана с Германией:
- В 1863 году Фердинанд Райх и его помощник Теодор Рихтер изучали местную цинковую руду на предмет наличия таллия. Применяли новый метод – спектральный анализ.
- Исследуя спектральные линии образцов, обнаружили ослепительную синеву. Такого варианта химией зарегистрировано не было.
Сходство цвета спектральной полосы с оттенком индиго обусловило название элемента – индий.
- Результатом серии опытов стали два стержня размером с карандаш из чистого металла. Французские академики определили стоимость материала (чуть более 100 граммов) в $80 тысяч.
- На Всемирной парижской выставке 1867 года сенсацией стал слиток индия массой 500 г.
В Европе индий как металл интересовал только ученых: из-за редкости добыча промышленных масштабов не рассматривалась.
Ситуацию изменили предприимчивые американцы. В 1924 году инженер Эндрю Маррей начал обследовать недра родной страны в поисках индиевых руд. И нашел. Руды в штате Аризона оказались богатыми, что сподвигло построить завод. Здесь получили первую продукцию – один грамм вещества.
Физико-химические характеристики
Одна из характеристик индия – хруст при сгибании металлического стержня. Так разрушается структура кристаллической решетки.

У металла есть и другие интересные физические и химические свойства:
- Температура плавления определяется размерами частиц металла: мелкодисперсный порошок плавится при 40°С. Данному свойству объяснений не найдено.
- На воздухе не окисляется, сохраняя блеск.
- В воздушно-водной среде медленно ржавеет.
- Нагревшись до 810°С, воспламеняется, создавая пламя фиолетовых оттенков.
- Неохотно реагирует со щелочами, растворяется кислотами.
- Растворяет олово, ртуть, свинец, других «соседей» по таблице.
Мягкостью (1,2 по Моосу) превосходит только тальк.
Свойства атомаНазвание, символ, номерАтомная масса(молярная масса)Электронная конфигурацияРадиус атомаХимические свойстваКовалентный радиусРадиус ионаЭлектроотрицательностьЭлектродный потенциалСтепени окисленияЭнергия ионизации(первый электрон)Термодинамические свойства простого веществаПлотность (при н. у.)Температура плавленияТемпература кипенияУд. теплота плавленияУд. теплота испаренияМолярная теплоёмкостьМолярный объёмКристаллическая решётка простого веществаСтруктура решёткиПараметры решёткиОтношение c/aТемпература ДебаяПрочие характеристикиТеплопроводностьНомер CAS
| И́ндий / Indium (In), 49 |
| 114,818(1) а. е. м. (г/моль) |
| [Kr] 4d10 5s2 5p1 |
| 166 пм |
| 144 пм |
| (+3e) 81 пм |
| 1,78 (шкала Полинга) |
| −0,34 В |
| +1, +3 |
| 558,0 (5,78) кДж/моль (эВ) |
| 7,31 г/см³ |
| 429,7485 K (156,5985 °C) |
| 2345 K (2072 °C) |
| 3,24 кДж/моль |
| 225,1 кДж/моль |
| 26,7 Дж/(K·моль) |
| 15,7 см³/моль |
| Тетрагональная |
| a=3,252 c=4,946 |
| 1,52 |
| 129 K |
| (300 K) 81,8 Вт/(м·К) |
| 7440-74-6 |
Режется ножом, на бумаге оставляет серую черту. По этим признакам плюс синеватость на срезе индий можно отличить от других металлов.
Нахождение в природе
Самородный индий в природе – уникум. Находка случилась в России (Восточная Сибирь).
Чаще он рассеян в виде десятка собственных минералов. Они также редки, бедны (в большинстве индий представлен тысячными долями процента), поэтому не рассматриваются как объект добычи.
Интерес представляют породы с минимум 0,1% металла в составе:
- Ими могли бы стать собственные минералы – франкеит, цинковая обманка, халькопирит, борнит. Доля индия здесь – 0,049-0,99%, но такие руды еще более редки.
- Три четверти сырья дают свинцово-цинковые месторождения, 12-16% – оловянные. Другие источники получения металла – медные, железные рудники.
 Халькопирит
Халькопирит
Тонна земной коры содержит четверть грамма индия, литр морской воды – 0,018 мг.
Месторождения, добыча
Запасы индия на планете аккумулированы в двух локациях:
- Северная Америка – Канада, США.
- Юго-Восточная Азия – КНР, Южная Корея, Япония.
Глобальный годовой объем производства – 500-600 тонн (добыча плюс вторичная переработка).
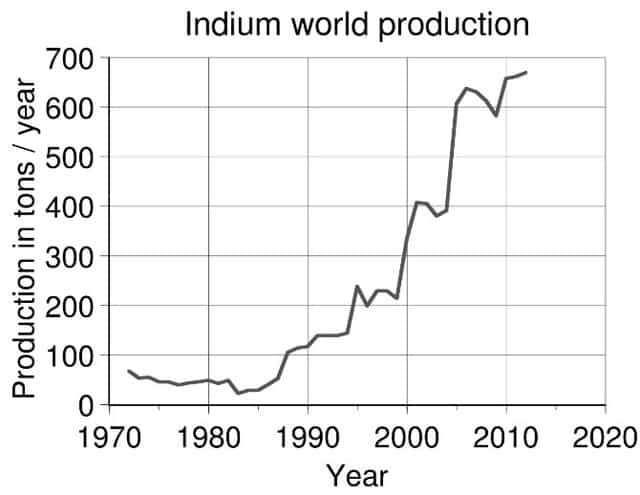 Динамика планетарной добычи индия, по данным USGS
Динамика планетарной добычи индия, по данным USGS
По приблизительным оценкам американских геологов разведанный мировой резерв металлического индия – 25 тысяч, потенциал – 60 тысяч тонн.
Редкость в природе – главный недостаток индия. Запасы исчерпаются через пару десятилетий. Задачей номер один становится повторное эффективное использование материалов.
Технология производства
- Сырьем служат отходы, полуфабрикаты производства цинка, олова, свинца.

- Этапы получения металла традиционны:
- Сырье обогащают. То есть воздействуют серной кислотой, получая растворенный индий. Методом гидролиза осаждают концентрат.
- Концентрат превращают в черновой металл, цементируя на цинке и алюминии.
- Способ получения рафинированного продукта – сегментированная плавка.
Мировой производитель номер один – Китай (80%).
Где используется
Утилитарные достоинства – ковкость, легкоплавкость, прочность – обусловили сферы применения металла.
Первыми покупателями стали стоматологи и авиастроители.
Атом, космос, наука
С середины 1940-х годов характеристики металла начали использовать ядерщики и создатели космической техники:
- Уплотнитель-герметизатор космических аппаратов, ускорителей элементарных частиц.
- Оксид вещества – компонент стекла, поглощающего тепловые нейтроны.
- Связка оксид ртути-индий – материал долговечных энергоемких аккумуляторов специального назначения.
Изотопом «вычисляют» присутствие нейтрино.
 Слитки индия
Слитки индия
Другие отрасли
Еще шире ассортимент продукции гражданского сектора экономики:
- Зеркала, осветительные приборы (рефлекторы, прожекторы). Использовано свойство металла отражать предмет либо световой пучок без искажений.
- Полупроводники. Чистый (примесей не более 0,0001%) индий «превращает» в проводники другие материалы.
- Термоэлементы.
Оловянно-индиевый оксид признан незаменимым для электроники с жидкокристаллическими экранами: планшетов, мониторов, ноутбуков, смартфонов, телевизоров.
- Изотопы вещества используют фармацевты.
- Прочные нержавеющие сплавы «индий + металл» востребованы ювелирами и стоматологами.
Эстеты ценят «синее золото» – сплав благородного металла с индием (46:54, формула AuIn2).
Стоимость
Увеличение объемов добычи идет кратно, но цена не падает, а увеличивается в разы: со $110 (2002) до $990 (2019) за кг.
Проверить совместимость мужчины и женщины по Знаку Зодиака
Индий

Слиток индия
Индий – серебристо-белый металл c сильным блеском, по внешнему виду напоминающий свежий срез цинка. Его относят к группе лёгких металлов. Он довольно мягкий, к тому же ковкий и легкоплавкий (плавится при температуре 156,5 °C).
Индий без труда режется ножом, он почти в 5 раз мягче свинца. На бумаге оставляет след. Это довольно редкий, ценный и дорогой метал. По химическим свойствам индий сходен с галлием и алюминием. Его атомная масса 114,818 г/моль.
Элемент состоит из двух изотопов, один из которых обладает довольно слабой β-радиоактивностью.
Геохимия и минералогия
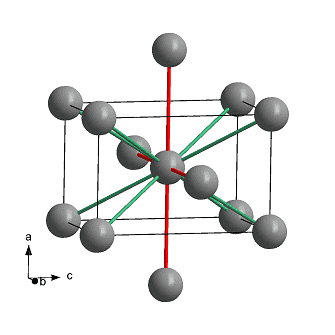
Кристаллическая структура индия
Учитывая электронную структуру атома индия, он относится к халькофильным элементам (18 электронов в предпоследнем слое).
В настоящее время известно менее 10 индиевых минералов: самородный индий, рокезит CuInS2, индит FeIn2S4, кадмоиндит CdIn2S4, джалиндит In(OH)3, сакуранит (CuZnFe)3InS4 и патрукит (Cu,Fe,Zn)2(Sn,In)S4.
В основном индий находится в виде изоморфной примеси в раннем высокожелезистом сфалерите, где его содержание достигает десятых долей процента.
В некоторых разновидностях халькопирита и станнина содержание индия составляет сотые-десятые процента, а в касситерите и пирротине — тысячные доли процента. В пирите, арсенопирите, вольфрамите и некоторых других минералах концентрация индия — граммы на тонну. Промышленное значение для получения металла пока имеют сфалерит и другие минералы, содержащие не менее 0,1 % индия.
СВОЙСТВА

Чистый индий
Индий – металл серебристо-белого цвета, не тускнеющий на воздухе при длительном хранении и даже в расплавленном состоянии. Плотность кристаллического индия 7310 кг/м3, а расплавленного – 7030 кг/м3. Металл плавится при 156,7° С, кипит при 2072° С. Индий очень мягок и пластичен.
Его твердость по шкале Мооса чуть больше 1 (мягче только тальк), поэтому индиевый стержень, если им водить по листу бумаги, оставляет на нем серый след. Индий в 20 раз мягче чистого золота и легко царапается ногтем, а его сопротивление растяжению в 6 раз меньше, чем у свинца.
Палочки из индия легко сгибаются и при этом заметно хрустят (громче, чем оловянные). Индий – диамагнетик, магнитное поле в нем ослабевает.
Индий, так же как и галлий, не образует ни с одним из металлов непрерывных твердых растворов. В индии хорошо растворяются металлы-соседи по периодической системе – галлий, таллий, олово, свинец, висмут, кадмий, ртуть, в меньшей мере цинк. Выше 800° С индий горит на воздухе сине-фиолетовым пламенем с образованием оксида индия(III).
Запасы и добыча

Чистый индий
На сегодняшний день нет достоверных сведений о мировых ресурсах индия, так как его извлечение всегда привязано к переработке цинковых руд.
По приблизительным оценкам United States Geological Surveys (по состоянию на июнь 2004) суммарный мировой запас разведанных месторождений индия составляет 2,5·103 тонн в пересчете на металл, а объемы резервной базы (с учетом неразведанных ресурсов) – 6·103 тонн металла.
Мировыми лидерами по запасам индия являются Канада (30% мировых запасов), Китай и США (10% мировых запасов)
Получают индий из отходов и промежуточных продуктов производства цинка, и в меньшей степени, свинца и олова. Это сырьё содержит от 0,001 % до 0,1 % индия.
Из исходного сырья производят концентрат индия, из концентрата — черновой металл, который затем рафинируют. Исходное сырьё обрабатывают серной кислотой и переводят индий в раствор, из которого гидролитическим осаждением выделяют концентрат. Из концентрата черновой металл извлекают цементацией на цинке и алюминии.
Для рафинирования используются различные методы, например, зонная плавка.
Основным производителем индия является Китай (390 тонн в 2012 году), также производится Канадой, Японией и Южной Кореей (примерно по 70 тонн).
В последние годы мировое потребление индия быстро растёт и в 2005 достигло 850 тонн.
Количество используемого индия сильно зависит от мирового производства ЖК-экранов. В 2007 году в мире было добыто 475 тонн и ещё 650 тонн было получено путём переработки. На производство ЖК экранов для компьютерных дисплеев и телевизоров уходило 50-70 % доступного индия.
Стоимость индия в 2002 году составила около 100$ за кг, но рост потребности в металле привел к повышению и флуктуациям цен. В 2006—2009 годах они колебались в пределах 400—900 долларов за кг.
По современным оценкам, запасы индия будут исчерпаны в ближайшие 20 лет, если не будет повышена степень вторичного использования металла
Индий In
Индий в таблице менделеева занимает 49 место, в 5 периоде.
| Символ | In |
| Номер | 49 |
| Атомный вес | 114.8180000 |
| Латинское название | Indium |
| Русское название | Индий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь In: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 Короткая запись:
In: [Kr]5s2 4d10 5p1
- Порядок заполнения оболочек атома индия (In) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Индий имеет 49 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
- 2 электрона на 4s-подуровне
- 10 электронов на 3d-подуровне
- 6 электронов на 4p-подуровне
- 2 электрона на 5s-подуровне
- 10 электронов на 4d-подуровне
- 1 электрон на 5p-подуровне
Степень окисления индия
Атомы индия в соединениях имеют степени окисления 3, 2, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы индия
Валентность In
Атомы индия в соединениях проявляют валентность III, II, I.
Валентность индия характеризует способность атома In к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа In
Квантовые числа определяются последним электроном в конфигурации, для атома In эти числа имеют значение N = 5, L = 1, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif): 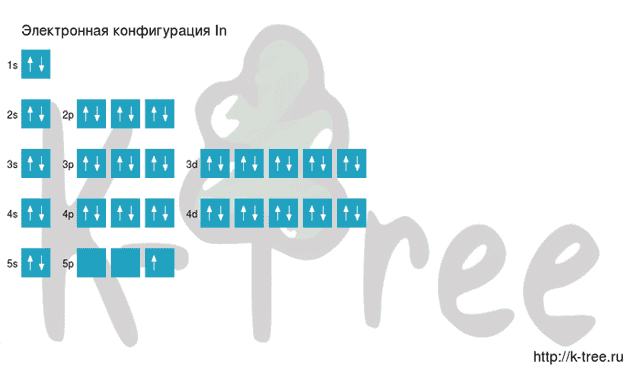
Индий
- Главная
- Справочник
- Химия
- Химические элементы
- Индий
(Indium) In – химический элемент 13-й (IIIa) группы периодической системы, атомный номер 49, атомная масса 114,82.
Строение внешней электронной оболочки 5s25p1. Известно 37 изотопов индия с 98In по 134In. Среди них лишь один стабильный 113In. В природе два изотопа: 113In (4,29%) и 115 In (95,71%) с периодом полураспада 4,41·1014 лет.
Наиболее устойчивая степень окисления в соединениях: +3.
Открытие индия произошло в эпоху бурного развития спектрального анализа – принципиально нового (в те времена) метода исследования, открытого Кирхгоффом и Бунзеном. Французский философ О.Конт писал, что у человечества нет никакой надежды узнать, из чего состоят Солнце и звезды.
Прошло несколько лет, и в 1860 спектроскоп Кирхгоффа опроверг это пессимистичное предсказание. Последующие пятьдесят лет были временем наиболее крупных успехов нового метода.
После того как было установлено, что у каждого химического элемента есть свой спектр, являющийся столь же характерным для него свойством, как дактилоскопический отпечаток – признаком человека, началась «погоня» за спектрами.
Помимо выдающихся исследований Кирхгоффа (едва не приведших его к полной слепоте) элементного состава Солнца, не менее триумфальными были наблюдения спектров земных объектов: в 1861 были открыты цезий, рубидий и таллий.
В 1863 профессор Фрейбергской минералогической школы (Германия) Фердинанд Рейх (1799–1882) и его ассистент Теодор Рихтер (1824–1898) спектроскопически исследовали образцы цинковой обманки (минерала сфалерита, ZnS), чтобы обнаружить в них таллий.
Из образца сфалерита действием соляной кислоты Рейх и Рихтер выделили хлорид цинка и поместили его в спектрограф с надеждой зарегистрировать появление ярко-зеленой линии, характерной для таллия. Профессор Ф.Рейх страдал дальтонизмом и не мог различать цвета спектральных линий, поэтому все наблюдения регистрировал его ассистент Рихтер.
Обнаружить присутствие таллия в образцах сфалерита не удалось, но каково же было удивление Рейха, когда Рихтер сообщил ему о появлении в спектре ярко-синей линии (4511Å). Было установлено, что линия не принадлежала ни одному из известных до этого элементов и отличалась даже от ярко-синей линии спектра цезия.
В силу сходства цвета характеристической полосы в эмиссионном спектре с цветом красителя индиго (латинское «indicum» – индийская краска) открытый элемент был назван индием.
Так как новый элемент был обнаружен в сфалерите, первооткрыватели сочли его аналогом цинка и приписали ему неверную валентность, равную двум. Они определили и атомный вес эквивалента индия, который оказался 37,8.
Исходя из валентности 2, был неверно установлен атомный вес элемента (37,8 × 2 = 75,6). Только в 1870 Д.И.
Менделеев на основании периодического закона установил, что индий имеет валентность, равную трем, и является, таким образом, аналогом алюминия, а не цинка.
Таким образом, в 1871 индий стал 49-ым элементом периодической системы.
Химические элементыТеория Химия 8 класс Химический элемент
Если материал понравился Вам и оказался для Вас полезным, поделитесь им со своими друзьями!
- Rh
- Pd
- Ag
- Cd
- Sn
- Sb
- Te
- I
Индий: открытие, структура, свойства, изотопы, использование, риски
Видео: Индий: открытие, структура, свойства, изотопы, использование, риски
Видео: Уран — САМЫЙ ОПАСНЫЙ МЕТАЛЛ НА ЗЕМЛЕ!
Содержание:
В Индийский Это металл, который принадлежит к группе 13 периодической таблицы и имеет химический символ In. Его атомный номер 49, 49В, и встречается в природе в виде двух изотопов:113В и 115В, причем последний является наиболее распространенным. Атомы индия находятся на Земле в виде примесей в цинковых и свинцовых рудах.
Это особый металл, так как он самый мягкий, к которому можно прикасаться без особого риска для здоровья; в отличие от лития и рубидия, которые ужасно обжигают кожу, реагируя с их влагой. Кусок индия можно разрезать ножом и сломать силой пальцев, издав характерный хруст.
Любой, кто слышит это название металла, наверняка вспомнит Индию, но ее название происходит от цвета индиго, который наблюдается при проведении испытания на пламя. В этом смысле он очень похож на калий, горящий его металл или его соединения очень характерным пламенем, через которое индий был впервые обнаружен в минералах сфалерита.
Индий разделяет многие химические качества с алюминием и галлием, присутствуя в большинстве его соединений со степенью окисления +3 (In3+). Он превосходно сочетается с галлиевыми сплавами с низкой температурой плавления, одним из которых является галинстан.
Применение индия основано на покрытии материалов из их сплавов, что делает их электропроводными и гибкими. Индеец закрывает некоторые очки, чтобы придать им блеск, заменяя серебро. В мире технологий индийцы используют сенсорные экраны и ЖК-дисплеи.
Открытие
В 1863 году немецкий химик Фердинанд Райх искал следы элемента таллия по зеленой линии его спектра излучения в цинковых минералах; в частности, образцы сфалерита (ZnS) вокруг Саксонии. После обжига минералов, удаления в них серы, переваривания их в соляной кислоте и отгонки хлорида цинка он получил осадок соломенного цвета.
Перед открытием Райх решил провести спектроскопический анализ; но поскольку у него не было хороших глаз, чтобы наблюдать цвета, он обратился к своему коллеге Иерониму Теодору Рихтеру за помощью в этой задаче. Именно Рихтер наблюдал голубоватую спектральную линию, не совпадающую со спектром любого другого элемента.
Два немецких химика столкнулись с новым элементом, который был назван индийским из-за цвета индиго пламени при сгорании его соединений; и, в свою очередь, название этого цвета происходит от латинского слова индика, что означает Индию.
Год спустя, в 1864 году, возбужденные и после продолжительной серии осаждений и очисток они выделили образец металлического индия путем электролиза его растворенных солей в воде.
Структура индийского
Атомы индия, In, объединяются, используя свои валентные электроны, чтобы установить металлическую связь. Таким образом, они попадают в объемноцентрированный кристалл с искаженной тетрагональной структурой. Взаимодействия между соседними атомами In-In в кристалле относительно слабые, что объясняет, почему индий имеет низкую температуру плавления (156 ºC).
С другой стороны, силы, соединяющие два или более кристаллов индия, также не являются сильными, иначе они не перемещались бы друг над другом, придавая металлу характерную мягкость.
Свойства
Внешность
Это удивительно мягкий серебристый металл. Его можно разорвать ногтем, разрезать ножом или поцарапать блестящими линиями на листе бумаги. Его даже можно жевать и деформировать зубами, если только он сплющен. Кроме того, он очень пластичен и пластичен.
Когда индейца нагревают паяльной лампой, он излучает пламя цвета индиго, даже более яркое и красочное, чем у калия.
Молярная масса
114,81 г / моль
Температура плавления
156.60 ºC
Точка кипения
2072 ° С.
Как и галлий, индий имеет широкий температурный диапазон от точки плавления до точки кипения. Это отражает тот факт, что взаимодействия In-In в жидкости сильнее, чем те, которые преобладают в стекле; и поэтому каплю индия получить легче, чем его пары.
Плотность
При комнатной температуре: 7,31 г / см3
Прямо в точке плавления: 7,02 г / см3
Электроотрицательность
1,78 по шкале Полинга
Энергии ионизации
- Первая: 558,3 кДж / моль
- Второй: 1820,7 кДж / моль
- Третий: 2704 кДж / моль
Теплопроводность
81,8 Вт / (м · К)
Удельное электрическое сопротивление
83,7 нОм
Твердость по Моосу
1,2. Он лишь немного тверже талька (не путайте прочность с прочностью).
Реактивность
Индий растворяется в кислотах с образованием солей, но не растворяется в щелочных растворах, даже с горячим гидроксидом калия. Реагирует при прямом контакте с серой, кислородом и галогенами.
Индий является относительно амфотерным, но он ведет себя больше как основание, чем кислота, его водные растворы слегка щелочные. В (ОН)3 он повторно растворяется с добавлением большего количества щелочей, что приводит к образованию комплексов индатов, In (OH)4–, как это происходит с алюминатами.
Электронная конфигурация
Электронная конфигурация индия следующая:
[Kr] 4d10 5 с2 5 шт.1
Из этих тринадцати электронов последние три из 5s и 5p-орбиталей являются валентными электронами. С помощью этих трех электронов атомы индия устанавливают свою металлическую связь, как алюминий и галлий, и образуют ковалентные связи с другими атомами.
Числа окисления
Вышеупомянутое сразу же подразумевает, что индий способен потерять свои три валентных электрона или получить пять, чтобы стать изоэлектронным благородному газу ксенону.
Если в соединении мы предположим, что оно потеряло свои три электрона, оно останется в виде трехвалентного катиона In.3+ (по аналогии с Al3+ и Ga3+) и, следовательно, его степень окисления будет +3. Большинство соединений индия — это In (III).
Среди других найденных степеней окисления индия мы имеем: -5 (In5-), -2 (В2-), -1 (В–), +1 (В+) и +2 (В2+).
Некоторые примеры соединений In (I): InF, InCl, InBr, InI и In2О. Все они являются относительно редкими соединениями, в то время как соединения In (III) являются преобладающими: In (OH)3, В2ИЛИ3, InCl3, InF3, так далее.
Соединения In (I) являются мощными восстановителями, в которых In+ жертвует два электрона другим видам, чтобы стать In3+.
Изотопы
Индий встречается в природе в виде двух изотопов: 113В и 115В, численность которого на суше составляет 4,28% и 95,72% соответственно. Следовательно, на Земле у нас гораздо больше атомов 115В каком из 113В. В 115In имеет период полураспада 4,41 · 1014 лет, настолько большой, что практически считается стабильным, несмотря на то, что он является радиоизотопом.
В настоящее время создано 37 искусственных изотопов индия, все радиоактивные и крайне нестабильные. Из них наиболее стабильным является 111In, период полувыведения которого составляет 2,8 дня.
Приложения
Сплавы
Индиец очень хорошо ладит с галлием. Оба металла образуют сплавы, плавящиеся при низких температурах, похожие на серебряные жидкости, которыми ртуть вытесняется в некоторых областях ее применения. Точно так же индий также легко амальгамируется, имея растворимость в ртути 57%.
Сплавы индия используются для создания серебряных зеркал без серебра. При наливании на поверхность любого материала он действует как клей, так что стекло, металл, кварц и керамические пластины могут соединяться друг с другом.
электроника
Индий также хорошо ладит с германием, поэтому его соединения добавляют в качестве присадок к нитриду германия в светодиодах, воспроизводя синий, фиолетовый и зеленый свет из этих смесей. Он также входит в состав транзисторов, термисторов и фотоэлементов.
Наиболее важным из его соединений является оксид индия и олова, который используется в качестве покрытия на стеклах для отражения некоторых длин волн.Это позволяет использовать его в сварочных очках и в стекле небоскреба, чтобы они не нагревались внутри.
Стекла, покрытые этим оксидом, являются хорошими проводниками электричества; как это исходит от наших пальцев. И именно поэтому он предназначен для производства сенсорных экранов, что стало еще более актуальной сегодня в связи с появлением все большего количества смартфонов.
Риски
Индий в первую очередь не представляет опасности для окружающей среды, поскольку его ионы In3+ они не распространяются в заметных количествах. Нет информации о том, как он будет воздействовать на почвы, растения, а также на фауну или моря.
В организме не известно, есть ли в3+ они играют важную роль в метаболизме в следовых количествах. Однако, когда его соединения попадают в организм, они вредны для различных органов, поэтому считаются высокотоксичными веществами.
- Фактически, частицы ITO (оксид индия и олова, аббревиатура на английском языке: Оксид индия и олова), необходимая для производства экранов для компьютеров и смартфонов, может негативно сказаться на здоровье рабочих, вызывая у них болезнь, называемую индийскими легкими.
- Проглатывание этих частиц происходит главным образом при вдыхании и контакте через кожу и глаза.
- С другой стороны, мелкие частицы металлического индия склонны гореть и вызывать пожар, если они находятся рядом с источником тепла.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2020). Индий. Получено с: en.wikipedia.org
- Доктор Дуг Стюарт. (2020). Факты об элементе индия. Получено с: chemicool.com
- Редакторы Энциклопедии Британника. (20 января 2020 г.). Индий. Encyclopdia Britannica. Получено с: britannica.com
- Хабаши Ф. (2013) Индий, физические и химические свойства. В кн .: Крецингер Р.Х., Уверский В.Н., Пермяков Е.А. (ред.) Энциклопедия металлопротеинов. Спрингер, Нью-Йорк, Нью-Йорк
- Национальный центр биотехнологической информации. (2020). Индий. База данных PubChem., CID = 5359967. Получено с: pubchem.ncbi.nlm.nih.gov
- Кимберли Аптмор. (2020). Для чего индий используется в повседневной жизни? Исследование. Получено с: study.com
- Хайнс, К. Дж., Робертс, Дж. Л., Эндрюс, Р. Н., Джексон, М. В., и Дедденс, Дж. А. (2013). Использование индия и профессиональное воздействие на него в США. Журнал гигиены труда и окружающей среды, 10 (12), 723–733. DOI: 10.1080 / 15459624.2013.836279






