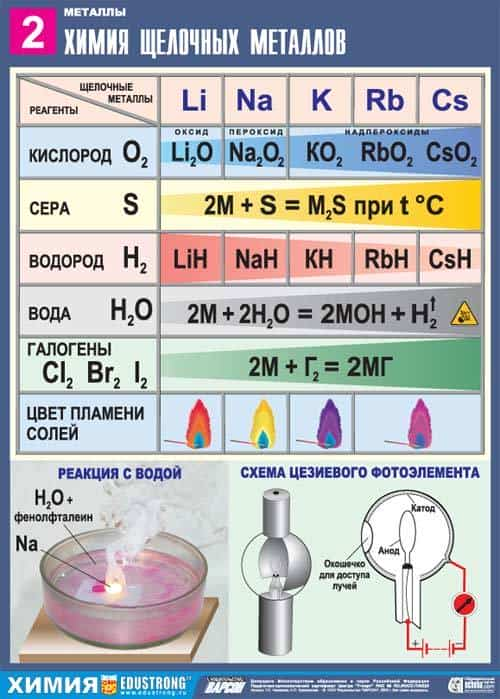
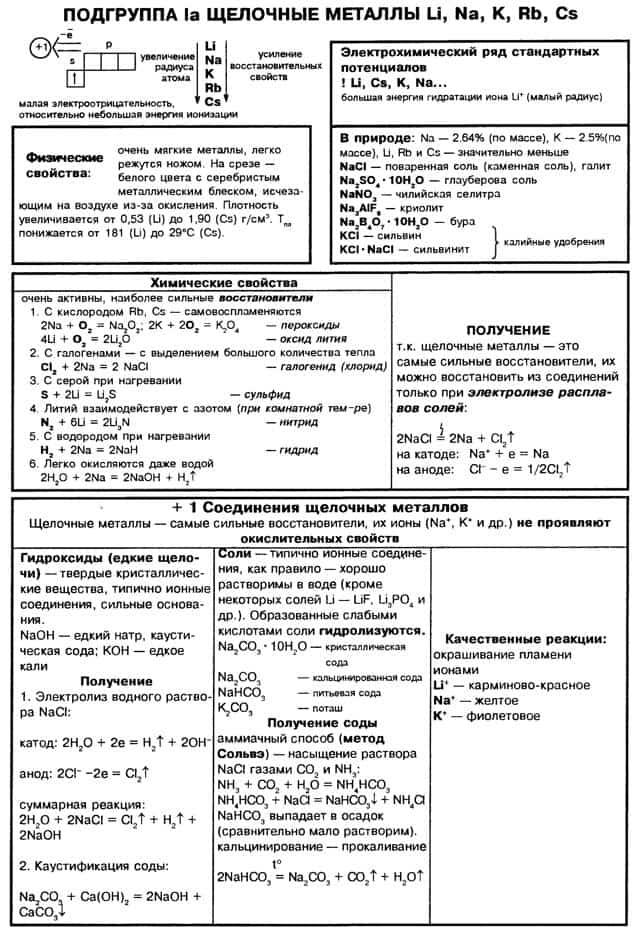
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Получение щелочных металлов
- Особенности химических свойств s-элементов I группы и их физиологическое действие
- Щелочные металлы
- Химические свойства щелочных металлов
- 2. Реакция щелочных металлов с кислородом:
- 3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 4. Реакция щелочных металлов с кислотами
- 5. Взаимодействие щелочных металлов с аммиаком
- 6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
- 7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- 2.2.1. Характерные химические свойства щелочных металлов
- Взаимодействие щелочных металлов с неметаллами
- с кислородом
- с галогенами
- с азотом
- с фосфором
- с водородом
- с серой
- с водой
- с галогенпроизводными углеводородов (реакция Вюрца):
- со спиртами и фенолами
- ПОИСК
- Окислительно восстановительные свойства воды
- •Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
- •Все соединения щелочных металлов имеют ионный характер.
- •Практически все соли растворимы в воде.
- •Низкие температуры плавления,
- •Малые значения плотностей,
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги.
Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
-

- 2Na + 2H 2 O → 2NaOH + H 2
- 2Li + 2H 2 O → 2LiOH + H 2
2. Реакция щелочных металлов с кислородом:
- 4Li + O 2 → 2Li 2 O (оксид лития)
- 2Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl 2 → 2LiCl (галогениды)
- 2Na + S → Na 2 S (сульфиды)
- 2Na + H 2 → 2NaH (гидриды)
- 6Li + N 2 → 2Li 3 N (нитриды)
- 2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH 3 = 2LiNH 2 + H 2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2 ;
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2 ;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
- Li + – карминово-красный

- Na + – желтый
- K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
- Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2 В небольших масштабах используется также вакуум-термическое получение натрия и калия:
- 2NaCl+CaC 2 =2Na+CaCl 2 +2C; 4KCl+4CaO+Si=4K+2CaCl 2 +Ca 2 SiO 4 .
- Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
-
Особенности химических свойств s-элементов I группы и их физиологическое действие
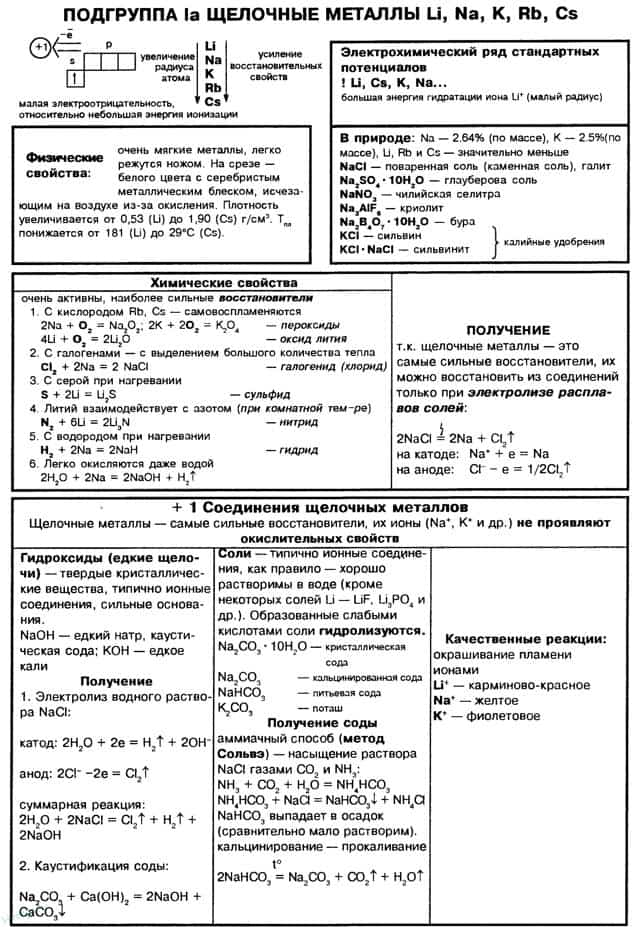
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия).
Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл.
От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды.
Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1.
Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика.
Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами.
Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток.
Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния.
Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв.
Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте.
При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов.
В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа.
Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали.
Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р.
Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей.
Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации.
Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах.
Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно.
Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах.
В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
- Перечисленные вещества реагируют с водой:
- Li 3 N + 3 H 2 O = 3 LiOH + NH 3 ;
- Na 2 O 2 + 2 H 2 O = 2 NaOH + H 2 O 2 ;
- K 2 O 4 + 2 H 2 O = 2 KOH + H 2 O 2 + O 2 .
- Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
- Na 2 O 2 +CO 2 =Na 2 CO 3 +0,5O 2 ;
- K 2 O 4 + CO 2 = K 2 CO 3 + 1,5 O 2 .
- В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных. Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
- 2Li+H 2 =2LiH.
- Гидрид лития используется как сильный восстановитель.
- Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
- SiO 2 +2NaOH=Na 2 SiO 3 +H 2 O.
- Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ; б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O; в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ; г) гидроксид натрия NaOH называют каустической содой или каустиком.
Щелочные металлы
Чтобы поделиться, нажимайте
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1.
Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т. е. химическая активность.
В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.
Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов – твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды – твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
- 4Li + O2 → 2Li2O (оксид лития)
- 2Na + O2 → Na2O2 ( пероксид натрия)
- K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
- 2Li + Cl2 → 2LiCl (галогениды)
- 2Na + S → Na2S (сульфиды)
- 2Na + H2 → 2NaH (гидриды)
- 6Li + N2 → 2Li3N (нитриды)
- 2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов – окрашивание пламени в следующие цвета:
- Li+ – карминово-красный
- Na+ – желтый
- K+, Rb+ и Cs+ – фиолетовый
2.2.1. Характерные химические свойства щелочных металлов
Щелочными металлами (ЩМ) называют все элементы IA группы таблицы Менделеева, т.е. литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr.
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
М0 – 1 e → М+1
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
- Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
- Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
- 4Li + O2 = 2Li2O
- Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
- 2Na + O2 = Na2O2,
- а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
- K + O2 = KO2
- Rb + O2 = RbO2
с галогенами
- Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
- 2Li + Br2 = 2LiBr бромид лития
- 2Na + I2 = 2NaI иодид натрия
- 2K + Cl2 = 2KCl хлорид калия
с азотом
- Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
- 6Li + N2 = 2Li3N нитрид лития
- 6K + N2 = 2K3N нитрид калия
с фосфором
- Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
- 3Na + P = Na3Р фосфид натрия
- 3K + P = K3Р фосфид калия
с водородом
- Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
- Н2 + 2K = 2KН-1 гидрид калия
- Н2 + 2Rb = 2RbН гидрид рубидия
с серой
- Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
- S + 2K = K2S сульфид калия
- S + 2Na = Na2S сульфид натрия
- Взаимодействие щелочных металлов со сложными веществами
с водой
- Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
- 2HOH + 2Na = 2NaOH + H2↑
- 2K + 2HOH = 2KOH + H2↑
- Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
2Na + 2C2H5Cl → 2NaCl + C4H10
2Na + 2C6H5Br → 2NaBr + C6H5–C6H5
со спиртами и фенолами
- ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
- 2CH3OH + 2К = 2CH3OК + H2↑
- метилат калия
- 2C6H5OH + 2Na = 2C6H5ONa + H2
- фенолят натрия
ПОИСК
Объясните причину изменения характера взаимодействия щелочных металлов с водой. Изменение энтальпии в реакции с водой, а также величины некоторых свойств металлов даны в табл. 72. [c.173]
Одинаково ли активно протекают реакции взаимодействия щелочных металлов с водой [c.268]
Как относятся щелочные металлы к воде, кислороду и кислотам соляной, серной и азотной Написать уравнения соответствующих реакций. [c.228]
При проведении реакции щелочных металлов с водой следует работать только в вытяжном шкафу с прикрытыми дверцами и не наклоняться над реакционным сосудом во избежание попадания брызг на лицо. [c.229]
Быть может объяснение различного характера прохождения реакции щелочного металла с водой следует искать в стандартных восстановительных потенциалах Стандартные восстановительные потенциалы щелочных металлов собраны в табл. 7.6. Постройте график зависимости Е° от номера периода щелочного элемента. [c.340]
Проверим, можно ли различные реакционные способности взаимодействия щелочных металлов с водой объяснить различиями в энтальпиях растворения их кристаллических гидроокисей. Для этого определим энтальпию реакции [c.362]
Химические реакции протекают с различной скоростью. Некоторые реакции протекают быстро (например, реакции нейтрализации, реакции взаимодействия щелочных металлов с водой и др.), некоторые медленно (например, коррозия металлов). [c.136]
Так как гетерогенная химическая реакция амальгамы щелочного металла с водой протекает сравнительно медленно, ее катализируют, помещая в разлагатель графитовую насадку, имеющую электрический контакт с амальгамой. При этом образуется короткозамкнутый (без внещнего электрического сопротивления) гальванический элемент, в котором на графитовом катоде идет образование Нг. [c.88]
Химические свойства Все щелочные металлы — очень сильные восстановители Реакционная способность возрастает в ряду Li — s Щелочные металлы энергично реагируют с большинством неметаллов, разлагают воду, на холоде бурно реагируют с разбавленными растворами кислот Комплексообразование для ионов щелочных металлов нехарактерно Li существенно отличается от остальных элементов группы По ряду свойств он ближе к Mg, чем к щелочным металлам Реакции с простыми веществами [c.178]
Скорость реакций восстановления ионов щелочных металлов закономерно увеличивается от Li+ к s+ в большинстве изученных органических растворителей. Например, в ДМСО [925] восстановление иона Li+ происходит медленно (необратимо), восстановление иона Na+ быстрее (квазиобратимо), а К+, Rb+, s+ восстанавливаются быстро и обратимо.
Количественные данные немногочисленны (табл. 7, 11 приложения) и относятся в основном к литию и натрию. Для сравнительной характеристики водных и неводных растворов следует отметить, что гетерогенная константа скорости восстановления ионов щелочных металлов в воде находится в пределах (от 2 до 9)-10 з см/с, а коэффициенты диффузии имеют порядок 10-5 (-м/с.
[c.79]
Аналогичные соотношения наблюдаются и при реакциях щелочных металлов с водой литий реагирует наиболее спокойно наиболее бурно (с самовоспламенением) реагирует с водой цезий. [c.349]
Соли карбоновых кислот. Естественным следствием рассмотренных свойств кислот является способность к образованию солей, которые в случае щелочных металлов в воде гидролизуются и имеют щелочную реакцию [c.161]
При растворении оксидов щелочных металлов в воде образуются щелочи. Гидроксиды щелочных металлов (едкие щелочи) — очень гигроскопические вещества. Они медленно разъедают стекло и даже фарфор по реакции [c.315]
Гидролиз нитрита щелочного металла вызывается водой, образующейся при пиролизе органического вещества, содержащего водород и кислород. На примере приведенной неорганической реакции видно, какое действие оказывает гидролиз, происходящий при пиролизе органического соединения в присутствии веществ, отдающих воду.
На этом принципе основан ряд новых реакций органического капельного анализа, которые будут описаны позже. Все эти реакции разработаны недавно. Их прототипом является давно известная известковая проба на азот, основанная на том, что многие органические азотсодержащие соединения образуют аммиак при нагревании с известью. [c.
34]
При взаимодействии некоторых реактивов с водой могут образовываться горючие газы. Эти реакции, как правило, экзотер-мичны, т. е. протекают с выделением большого количества тепла. В одних случаях, например, при контакте щелочных металлов с водой, реакция проходит настолько бурно, что выделившийся водород самовоспламеняется со взрывом.
В других случаях, например, при взаимодействии гидрида кальция с водой, реакция протекает более спокойно и выделившегося тепла бывает недостаточно для самовоспламенения образовавшегося водорода. Однако и в последнем случае образующиеся газы представляют собой большую опасность, так как они могут воспламениться от воздействия внешнего источника зажигания.
[c.73]
Трудности в применении этого метода возникают при попытках изучения систем, содержащих компоненты, электродные потенциалы которых в данном электролите близки.
При этом, помимо основной токообразующей реакции, возможна реакция между солью компонента А в электролите и компонентом В в сплаве, приводящая к изменению концентрации в поверхностном слое электрода и к его концентрационной поляризации.
В этом случае определение термодинамической активности по уравнению (1) будет тем более ошибочным, чем меньше разница в электродных потенциалах компонентов и исходная концентрация компонента А в сплаве. Аналогичные трудности в равной степени возникают и при исследовании термодинамических свойств водных растворов смесей электролитов.
Кроме того, при исследовании термодинамических свойств растворов солей щелочных металлов в воде с помощью цепей без переноса возникают осложнения, связанные с взаимодействием амальгамы щелочного металла с водой. Применение сложной техники проточного амальгамного электрода не устраняет до конца этих осложнений, в связи с чем измерения, проведенные при концентрациях растворов[c.84]
Галогены обладают способностью взаимодействовать с водой, в результате чего образуются кислоты и атомарный кислород однако эти реакции идут менее активно, чем взаимодействие щелочных металлов с водой. [c.181]
Общим свойством элементов обеих групп является способность взаимодействовать с водой, но продукты этих реакций и сам характер взаимодействия — прямо противоположны щелочные металлы разлагают воду как сильные восстановители, образуя при этом щелочи и свободный водород, а галогены — как сильные окислители, образуя кислоты свободный (атомарный) кислород [c.182]
Именно таким путем были получены наиболее надежные данные для энтальпий образования гидроокисей щелочных металлов [61, 62]. В табл. 14 приведены результаты измерений энтальпий реакций щелочных металлов с водой, полученные в наиболее надежных работах, выполненных в последние годы.
Все величины приведены для бесконечного разбавления растворов щелочей (подробнее об этом см. гл. 10).
Это необходимо, потому что сравнивать величины энтальпий таких реакций имеет смысл только при одинаковых конечных концентрациях растворов, поскольку энтальпии образования веществ в состоянии раствора, а следовательно и энтальпии реакций, зависят от концентрации растворов. [c.172]
Энтальпии реакций щелочных металлов с водой с образованием растворов щелочей бесконечного разбавления [c.172]
После окончания опыта полиэтилен для удаления гидроокисей щелочных металлов промывали водой до отрицательной реакции с фенолфталеином, сушили и определяли характеристическую вязкость при 85° в декалине. Средневязкостный молекулярный вес рассчитывали по следующему уравнению [c.122]
Наиболее полно и достаточно селективно (свыше 95%) реакции гидродеалкилирования протекают в нс нсутствии окисных катализаторов, содержащих молибден, кобальт, хром иа окиси алюминия. Для предотвращения коксообразования, протекающего преимущественно на кислотных активных центрах, в катализатор вводят соединения щелочных металлов или воду. Вода обладает иовы-шепной способностью к хемосорбцни на окислах типа АЬОз и, [c.311]
Полисульфиды щелочных металлов в воде гидролитически расщепляются а KHSa и КОН KHS2 со ртутью дает HgS и KHS, которые вступают тотчас в реакцию с образовавшеюся едкой щелочью HgS -f KHS -f -f K0H-> H2O + Ka HgSa). Ред. [c.125]
Для Сочетания в кислой среде растворяют азосоставляюшую в виде ее соли со щелочным металлом в воде и добавляют соляной кислоты до кислой реакции на конго.
Образующуюся в большинстве случаев суспензию добавляют к диазораствору н перемешивают прн охлаждеинн до окончания образоваьшя красителя. Если реакция протекает очень вяло,.
то ее можно ускорить, нейтрализуя избыточную минеральную кислоту уксуснокислым натрием настолько, чтобы еще оставалась слабокислая реакция на конго. [c.231]
Электрохимические реакции щелочноземельных металлов во многом сходны с реакциями щелочных металлов. Полярографические данные приведены в табл. 14.3.
Магний, кальций, стронций и барий, принимая два электрона, при весьма отрицательных потенциалах восстанавливаются до металлов с образованием амальгам, как и щелочные металлы. Реакции более тяжелых элементов этой группы обратимы в большей степени, чем реакции более легких.
Поведение щелочноземельных элементов в диметилацет-амиде необычно в том смысле, что реакция не наблюдается, если не введено малое количество воды. В присутствии воды, как и ожидалось, происходит двухэлектронное восстановление [31].
Это объясняется тем, что в безводном растворителе образуются сольваты, восстановление которых на ртути идет с очень высоким перенапряжением. При введении воды образуются гидраты, восстановление которых требует малого перенапряжения, что и позволяет наблюдать эту реакцию. [c.414]
Все щелочные металлы разлагают воду (стр. 177). Литий реагирует с водой без плавления, натрий при этом плавится, калий воспламеняется. Еще более активно реагируют рубидий и цезий.
Они тотчас воспламеняются при доступе кислорода, даже в отсутствие воды, в то время как остальные щелочные металлы на сухом воздухе или в токе кислорода воспламеняются только при умеренном нагревании. Литии, сгорая, образует окись Li20, которая загрязнена только небольшими примесями перекиси. Натрий сгорает с образованием перекиси NajOg.
Остальные щелочные металлы дают при сгорании надперекиси (ср. стр. 202). Реакция щелочных металлов со спиртом с образованием алкоголятов уже была упомянута. [c.193]
Например, реакция взаимодействия гидрида щелочного металла с водой, как известно, протекает с образованием малораствори- [c.150]
Для промышленного получения гексафторсоединений циркония или гафния и щелочного металла предложено несколько методов.
По Уэйнеру [44], их получают по реакции между сульфатом циркония или гафния, фторсодержащим веществом (СаРг или фторсиликат щелочного металла), солью щелочноземельного металла (СаСОз) и солью соответствующего щелочного металла (сульфат, карбонат, фторид).
Смесь составляется таким образом, чтобы в ее состав входили все необходимые компоненты. В случае применения СаРз отпадает необходимость добавки СаСОд, а при введении гексафторси-ликата щелочного металла не требуется добавление других солей щелочного металла.
Реакцию можно проводить как мокрым, таки сухим путем. Среда должна быть слабокислая. В первом случае к водному раствору или суспензии добавляют при перемешивании тонко-измельченные (—325 меш) компоненты и смесь выдерживают в течение 1—2 ч при температуре кипения.
Сульфатный осадок щелочноземельного металла отделяют, а из раствора выкристаллизовывают двойной фторид. По второму способу сухую или пастообразную шихту, содержащую необходимые вещества, прокаливают в течение 1 ч при 500—600° С, затем обрабатывают водой и из очищенного водного раствора выделяют конечный продукт. [c.173]
Взаимодействие щелочных металлов с водой. Натрий бурно реагирует с водой. В результате реакции образуются газообразный водород и водный раствор гидроокиси натрия (едкого натра) NaOH [c.143]
Методика прессования таблеток имеет и некоторые недостатки по сравнению с методикой суспензий область валентных колебаний О—Н и N—Н перекрывается полосами поглощения О—Н-связей воды, обычно присутствующей в гигроскопичных галогенидах щелочных металлов поглощение воды в области 6,1 мк частично накладывается на область валентных колебаний С = С и = N. В процессе приготовления таблеток полиморфные изменения происходят чаще, чем при изготовлении суспензий. Галогениды щелочных металлов химически более реакционноспособны по сравнению с эмульгаторами, и в случае их применения возможны обмен галогенами и другие нежелательные реакции. Приготовление суспенизии можно контролировать на любой стадии кроме того, можно изменить толщину слоя, записав лишь часть спектра, тогда как правильность приготовления таблетки нельзя проверить до тех пор, пока она не вынута из пресс-формы или пока не записан весь спектр. Однако если площадь приготовленной таблетки по крайней мере вдвое больше сечения пучка ИК-излучения, то ее можно разрезать и записать спектр удвоенной толщины. Это позволяет избежать приготовления новой таблетки в тех случаях, когда первоначальный спектр оказывается недостаточно интенсивным. [c.81]
Среди веществ, энтальпии реакций которых с водой наиболее часто определяют, можно назвать щелочные металлы, окислы ще-лочнь х металлов и окислы некоторых неметаллов. Измерение энтальпий реакций щелочных металлов с водой является одним из наиболее целесообразных путей определения энтальпий образования гидроокисей щелочных металлов [c.171]
Измерение энтальпий реакций окислов (и перекисей) щелочных металлов с водой позволяет айти энтальпии образования этих окислов. Для расчетов необходимы также энтальпии реакций щелочных металлов с водой. Расчет в этом случае производится [c.172]
При использовании фенолятов щелочных металлов реакцию проводят в водной среде, иногда с добавкой гидрофобного органического растворителя, а при проведении процесса в присутствии третичных аминов — в органическом растворителе. Выделяющийся гидрохлорид третичного амина удаляют фильтрованием или промыванием водой.
Реакцию получения арилхлоркарбонатов осуществляют при возможно более низкой температуре с избытком фосгена для подавления образования диарилкарбоната, а также для уменьшения скорости гидролиза арилхлоркарбоната (если реакция ведется в водной среде).
Выходы арилхлоркарбонатов обычно не превышают 75—85% от теоретического, считая на фенол, и лишь в отдельных случаях достигают 90% и более. [c.309]
Окислительно восстановительные свойства воды
В окислительно-восстановительных процессах, как и в кислотно-основных, вода, а также ионы водорода и гидроксид-ионы могут быть активными участниками процесса, выступая в роли восстановителя или окислителя.
Как восстановитель вода может окисляться до кислорода. В кислой среде (pH = 0) для полуреакции 02 + 4Н+ + 4е~ = 2Н20 Е° составляет 1,23 В, в щелочной, при pH = 14, для полуреакции 02 + 2Н20 + 4е» = = 40Н» Е° = 0,40 В. Очевидно, что эти потенциалы связаны между собой уравнением Нернста.
Как окислитель вода характеризуется потенциалом полуреакций ее восстановления с образованием водорода. В щелочной среде (pH = 14) для соответствующей полуреакции 2Н20 + 2е~ = 20Н» + Н2 Е° = -0,83 В. По мере уменьшения pH концентрация ионов ОН» падает, а ЕГ растет.
В соответствии с уравнением Нернста увеличивается и потенциал полуреакции восстановления воды. При pH = 0 реализуется знакомая нам полу- реакция 2Н* + 2е» = Н2 с Е° = 0,00 В. На рис. 18.
3 приведена зависимость от pH потенциалов, характеризующих процессы восстановления и окисления воды.
Очевидно, что с точки зрения термодинамики все восстановители, имеющие потенциалы ниже потенциала восстановления воды, могут выделять водород из водных растворов. Практически из-за кинетических затруднений выделения молекулярного водорода граница восстановительной устойчивости водных растворов на несколько десятых вольта ниже. Эта
дополнительная разность потенциалов, называемая перенапряжением выделения водорода, определяется механизмом реакции и зависит, в частности,от природы и характера поверхности восстановителя. Например, перенапряжение выделения водорода на ртутном электроде составляет около 0,8 В, а на черненой платине, катализирующей этот процесс, равно нулю.
На рис. 18.3 пунктирной линией показан средний эффективный потенциал выделения водорода с учетом перенапряжения в 0,5 В. Практически это означает, например, что большинство металлов растворяется в кислотах с выделением водорода, а наиболее активные — щелочные, щелочноземельные, лантаноиды и актиноиды — в воде и даже в щелочных растворах.
Рис. 18.3. Зависимость потенциалов окисления и восстановления воды от pH
Средняя граница практической устойчивости окислителей в водных растворах (пунктирная линия на рис. 18.3) также превышает линию потенциала окисления воды примерно на 0,5 В — среднее значение перенапряжения выделения кислорода.
Таким образом, область между пунктирными линиями приближенно отражает диапазон устойчивости окислителей и восстановителей в водных растворах; окислители, имеющие более высокий потенциал, могут разлагать воду с выделением кислорода, а восстановители с более низким потенциалом — с выделением водорода.
Отметим, что в отдельных случаях эти процессы идут довольно медленно, что объясняет, например, при обычных условиях устойчивость в течение продолжительного времени водных растворов КМп04 (^мпО'/Мп1* = = 1,51 В) или солей церия(IV) (?>се4УСе9* = 1*61 В).






