- Общая характеристика
- Состав и структура кремния
- Физические свойства
- Химические свойства
- Восстановительные процессы
- Окислительные процессы
- Получение кремния
- В лаборатории
- в промышленности
- области применения
- Плюсы и минусы кремния
- Заключение
- Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ — свойства периодической системы
- Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
- Структура Периодической системы элементов
- Свойства Периодической системы элементов
- Элементы Периодической таблицы Менделеева
- Щелочные металлы
- Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
- Щелочноземельные металлы
- Лантаноиды и актиноиды
- Переходные металлы
- Неметаллы
- Подгруппа углерода
- Подгруппа азота
- Подгруппа кислорода
- Галогены
- Инертные газы
- Оксиды — что это такое? Химические свойства и классификация
- Виды оксидов
- Номенклатура оксидов
- Названия некоторых оксидов: таблица
- 2. Взаимодействие с кислотными оксидами и кислотами
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- 3. Взаимодействие с амфотерными оксидами и гидроксидами
- 2. Окисление простых веществ — неметаллов
- 3. Разложение гидроксидов
- 4. Окисление сложных веществ
- Сера. Примеры заданий с обьяснениями
- Ответы к упражнениям § 18. Химия 8 класс

Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Какова его природа, общая характеристика и свойства не только в физике, но и в химии? Как реагирует с другими веществами? Какие соединения образуют? Каковы области применения этого элемента?
Общая характеристика
Обозначение этого элемента в таблице Менделеева – Si (silicium – «силициум»). В таблице он стоит в четвертой группе третьего периода. Является неметаллом.

Первое название этого элемента силиций. В середине 19 века его стали называть «кремнием».
Основные особенности:
- Второй по распространенности элемент таблицы Менделеева.
- Аналог углерода – это элемент (а также его генетический ряд) со своими специфическими особенностями.
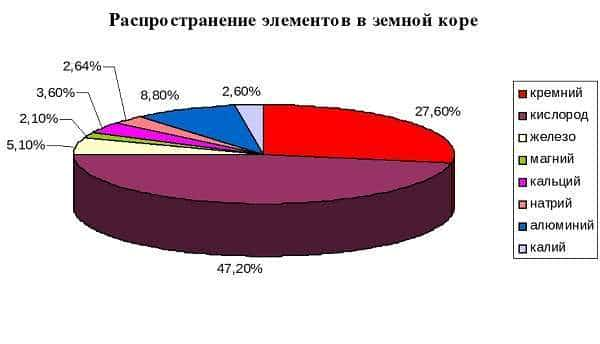
Где можно взять кремний? В основном, в природе он находится в земле в виде оксидов и других структур горных пород (кварц, силикат и т. д.).
Состав и структура кремния
Рассмотрим основные параметры этого элемента в таблице.
| Признак | Характеристика |
| Атомная масса | 28,086 а. е. м. |
| Молекулярная (молярная) масса | 28,086 г/моль |
| Размер атома / заряд ядра | 14 |
| Валентность | 2,4 |
| Степень окисления | ±4, -2 |
| Плотность | 2,33 г/см3 |
| Температура плавления | 1688 К |
| Химическая связь | ковалентная неполярная |
| Кристаллическая решетка | атомная |
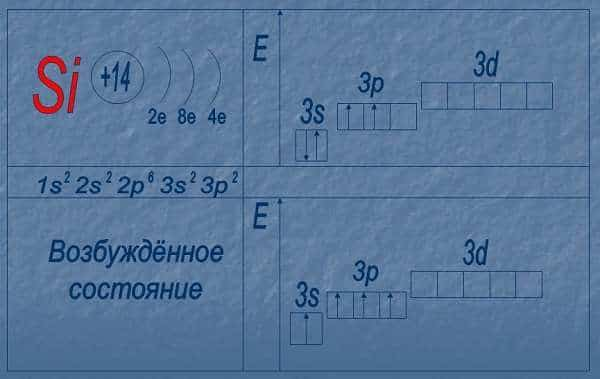
У кремния есть 3 изотопа: Si (28), Si (29), Si (30).
Электронное строение атома кремния показано на картинке:
Физические свойства
Строение атома кремния, из которого состоит большинство материалов, позволяет доказать ученым наличие аллотропии у этого элемента.
Выделяют 2 модификации:
- аморфный,
- кристаллический.

Первый представляет собой порошок коричневого цвета, который плавится при температуре свыше 1400 градусов Цельсия.
Второй – кристаллизованный кремний темно-серого оттенка с блестящей поверхностью.

По сравнению с предыдущим, обладает высокими показателями тепло- и электропроводности.
Химические свойства
Поскольку он находится в четвертой группе главной подгруппе таблицы Менделеева, то может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы
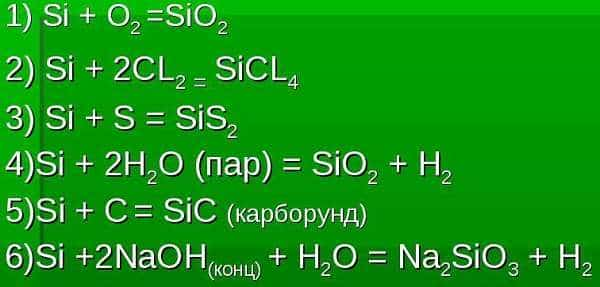
- С простыми веществами:
- Si + 2Br2 = SiBr4,
- Si + O2 = SiO2.
- Со сложными веществами:
- Кислоты
- 3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O.
- Гидроксиды
- Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
Что это такое и чем отличается циклон от антициклона
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Получение кремния
Различают два способа получения кремния: лабораторный и промышленный. Рассмотрим подробно оба.
В лаборатории
его восстанавливают с помощью магния или алюминия при нагревании.
в промышленности
получение этим способом требует больших усилий:
- в печах под действием кокса идет разложение диоксида кремния при температуре свыше 1790 градусов по цельсию.
- очищают полученный кремний от примесей. как правило, получают соль, а затем обрабатывают кислотами.
- очистку проводят до тех пор, пока массовая доля в образце не будет ниже 95%.
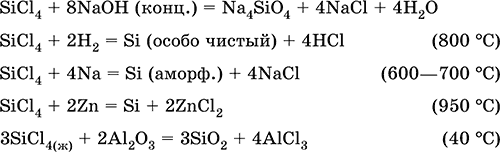
кроме того, в промышленности в последние годы популярным способом очистки стало хлорирование. оно используется чаще, поскольку этот метод экономически выгоден и дает большую степень очистки.
в россии существует всего два завода по производству технического кремния: каменск-уральский и усолье-сибирский.
области применения
Кремний имеет широкую область применения:
- Он является хорошим сырьем для получения его аллотропных модификаций и различных соединений на его основе.
- Это главный компонент при получении различных сплавов. EuroEscortBabes Как правило, в металлургии это главный окислитель и модифицирующий элемент.
- Кремний часто используется для получения стекла и цемента.
- Он является незаменимым компонентом в производстве батарей.
- Кремний чаще всего используется как подручное средство для получения других простых веществ в лаборатории.
Плюсы и минусы кремния
Попробуем разобраться, в чем же заключаются преимущества и недостатки этого элемента? Как он вообще влияет на жизнь различных организмов?
- Кремний необходим растениям для питания и роста, некоторым простейшим организмам для правильного протекания процессов жизнедеятельности.
- В организмах высших существ он играет важную роль (является одним из незаменимых микроэлементов), но помимо этого может вредить им (вызывать силикоз – отравление солями этого неметалла).
Незаменима его роль в промышленности и технике, металлургии. А вот медицинские показатели еще до конца не изучены, поэтому применять его для лечения различных заболеваний можно с осторожностью и только по рекомендациям врача.
Заключение
Кремний незаменим в химии и физике. Он играет важнейшую роль в биохимических реакциях организма человека. Правда избыток этого элемента может привести к хроническим болезням.
Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ — свойства периодической системы
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде.
Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов.
Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему.
Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».

Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
- Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
- Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
 Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий.
Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку.
Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил.
Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
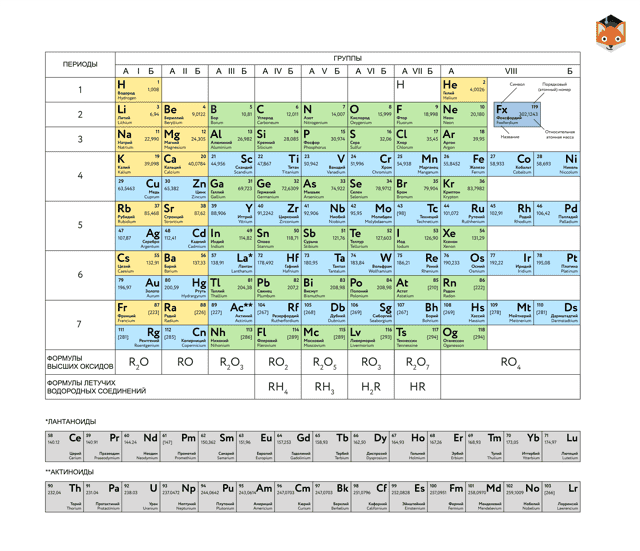 Периодическая таблица химических элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов.
В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.

Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу.
Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов).
Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
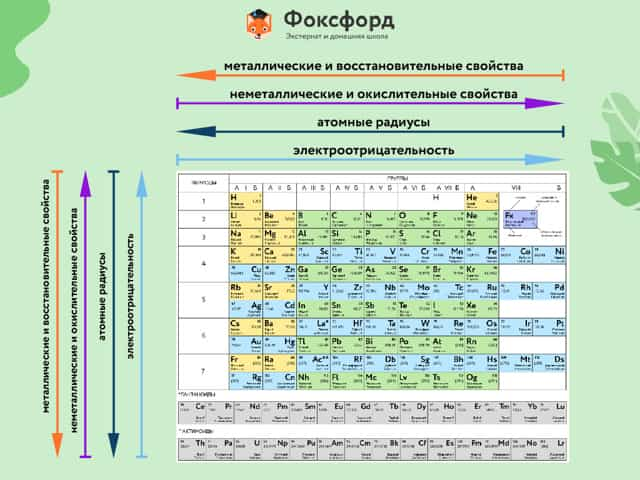
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы

Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс
Щелочноземельные металлы
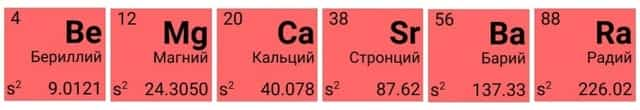
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.

Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы

Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот).
Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
https://www.youtube.com/watch?v=AFsNHdJoilMu0026t=132s
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Оксиды — что это такое? Химические свойства и классификация
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
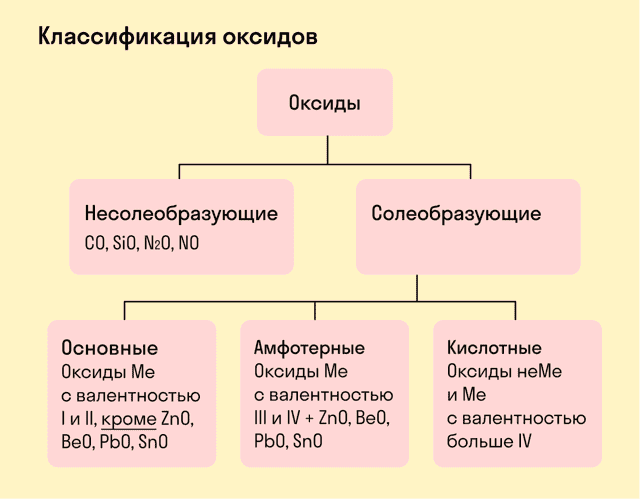
Виды оксидов
- Все оксиды делятся на солеобразующие и несолеобразующие.
- Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
- К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
- Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
- Солеобразующие оксиды делятся на три группы:
-
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
-
- Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
- К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
- Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
- Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.
-
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
- CrO (оксид хрома (II)) — проявляет основные свойства;
- Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
- CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
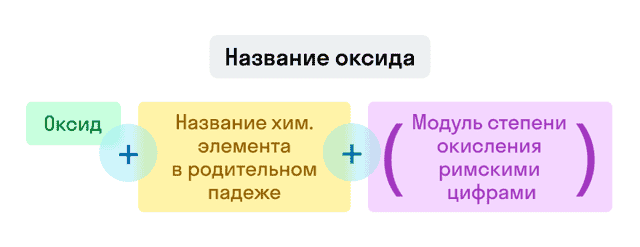
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «оксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три.
- Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Не взаимодействуют с кислородом: платина, золото и палладий.
- Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
- 4Cr + 3O2 = 2Cr2O3
- При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
- При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
- 4P + 5O2 (избыток) = 2P2O5
- При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
- 4P + 3O2 (недостаток) = 2P2O3
- Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
- S + O2 = SO2
- Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
- N2 + O2 = 2NO
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
- Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
- Гидроксид (кислота) = оксид + вода
- Например:
- H2SO3 = SO2↑ + H2O
- H2CO3 = CO2↑ + H2O
- Ag(OH) = Ag2O + H2O
- NH4OH = NH3↑ + H2O
- Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
- Например:
4. Окисление сложных веществ
- Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
- Например:
- 2H2S + 3O2 = 2SO2 + 2H2O
- 4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Сера. Примеры заданий с обьяснениями

- Сера является не только важным компонентом множества химических соединений, но и непосредственно экзамена ОГЭ.
- Она часто встречается в заданиях разного типа и уровня, и все возможные задания, в которых рассматриваются особенности серы, мы и пройдем в рамках этого урока.
- Задание 1:
- Выберите два высказывания, в которых говорится о сере как о простом веществе:
- 1) При горении серы на воздухе образуется сернистый газ;
- 2) Сера в природных водах встречается в основном в виде сульфат — иона;
- 3) Сера входит в состав некоторых аминокислот;
- 4) В состав ядра атома серы входит 16 протонов;
- 5) Серный цвет — это мелкий порошок серы, применяющийся в качестве средства защиты растений.
- Решение:
- Для начала, нужно понять само определение «простое вещество».
Простое вещество — это вещество, которое состоит из атомов одного химического элемента. В противовес простому веществу обычно указывают понятие «химический элемент».
- Химический элемент — это определенный вид атомов.
- Соответственно, для решения этого задания необходимо выбрать те варианты ответа, где указаны физические и химические свойства серы.
- 1) При горении серы на воздухе образуется SO2 (сернистый газ) — подходит, так как здесь сера обладает химическими свойствами и показана как простое вещество. Кстати, вот эта реакция:
S + O2 = SO2
- 2) Сера в природных водах встречается в виде сульфат — ионов — не подходит, так как ионы не обладают свойствами простых веществ;
- 3) Сера входит в состав некоторых аминокислот — не подходит, почему? Дело в том, что в данном варианте ответа сера не обладает самостоятельными свойствами, а только входит в состав аминокислот в виде иона;
- 4) В состав ядра серы входит 16 протонов — не подходит, здесь речь идет о химическом элементе серы;
- 5) Серный цвет — это мелкий порошок серы, применяющийся в качестве средства защиты растений — подходит, в этом варианте ответа сера представлена как простое вещество.
- Ответ: 15
- Задание 2:
- Степень окисления серы в высшем оксиде равна степени окисления серы в веществе:
- 1) H2SO3;
- 2) (NH4)2SO4;
- 3) K2S;
- 4) SCl2.
- Решение:
- Сера расположена в 6А группе, поэтому имеет высшую степень окисления равной номеру своей группы, ее высший оксид — SO3, в котором она проявляет степень окисления +6.
- Поэтому, для решения этого задания необходимо выбрать вещество со степенью окисления +6.
- 1) H2SO3 (сернистая кислота) — здесь у серы +4, не подходит;
- 2) (NH4)2SO4 (сульфат аммония) — когда ты видишь в формуле сложного вещества остаток SO4 (это кислотный остаток — сульфат), то запомни, что в сульфат — ионе степень окисления серы равна +6, подходит;
- 3) K2S — это вещество называется сульфид калия, нужно помнить, что у калия в классической химии нет отрицательной степени окисления, а так как в молекуле сложного вещества должно быть равное количество катионов и анионов, значит, отрицательную степень будет проявлять сера, в данном случае, -2, ответ не подходит;
- 4) SCl2 (дихлорид серы) — сера и хлор это два неметалла, причем оба достаточно активные, однако, хлор сильнее проявляет электроотрицательность,поэтому в бескислородных солях у хлора степень окисления равна -1, значит, у серы будет +2; не подходит.
- Ответ: 2
- Задание 3:
- Железо при обычных условиях реагирует с
- 1) водой;
- 2) оксидом углерода (4);
- 3) сульфатом меди (2);
- 4) серой.
- Решение:
Как понять, при каких условиях элемент реагирует с различными веществами? На самом деле, не так и сложно.
- Например, в данном задании у нас железо, мы знаем, как выглядит этот элемент в природе, он не так активен, как калий или литий, из -за пленки с кислородом при окислении на воздухе.
- Однако, и железо при обычных условиях может взаимодействовать с теми веществами, с которыми возможна реакция замещения.
- А этот тип реакций возможен
- Иными словами, смотрим на ряд активности:
K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Cu Hg Ag Pt Au
Итак, анализируем каждый вариант ответа:
1) с водой — если кинуть железную арматуру в воду, ничего не произойдет, только постепенно железо начнет покрываться ржавчиной.
P.S. Ржавчина не имеет четкой химической формулы, это смесь оксидов и гидроксидов железа.
- Поэтому, данный вариант ответа нам не подходит.
- 2) с углекислым газом (CO2) — этот газ всегда присутствует в воздухе, так как является его непосредственным компонентом.
- Углекислый газ выделяют большинство органических существ в реакциях энергетического обмена.
- Но, с железом реакции нет, ответ не подходит.
3) с сульфатом меди (2) — это как раз тот случай, когда нам нужно воспользоваться рядом активности металлов (РАМ) (смотри выше).
- Медь находится в РАМ после железа, поэтому Fe с легкостью вытеснит его из сульфата, причем, без нагревания; ответ подходит.
- 4) с серой — железо взаимодействует с S, но определенно не при обычных условиях; ответ не подходит.
- Итак, верный ответ в этом вопросе — 3.
- Задание 4:
- Какие два утверждения верны для характеристики как углерода, так и серы?
- 1) на внешнем слое находится шесть электронов;
- 2) соответствующее простое вещество существует в твердом агрегатном состоянии;
- 3) химический элемент образует простое вещество — металл;
- 4) значение электроотрицательности меньше, чем у фосфора;
- 5) химический элемент образует оксид с общей формулой ЭО2.
- Решение:
- В этом вопросе нужно найти общие черты углерода и серы; хотя эти два элемента совершено разные по своим химическим свойствам и другим критериям, все же, они имеют схожие данные.
- Смотрим на первый вариант ответа: на внешнем слое находится шесть электронов — количество электронов на внешнем подуровне численно равно номеру группы, в которой находится элемент (это правило касается элементов главных подгрупп!)
В ПСЭ сера находится в 6А группе, у нее шесть электронов на внешнем подуровне, а углерод — в 4А, и у него четыре электрона, значит, этот вариант ответа не подходит.
- Второй вариант: соответствующее простое вещество существует в твердом агрегатном состоянии — да, это именно так.
И сера, и углерод в природе являются твердыми веществами (несмотря на то, что оба образуют газообразные оксиды при взаимодействии с кислородом) — ответ подходит.
- В третьем варианте ответа — химический элемент образует простое вещество — металл, ты наверняка понимаешь, что это неверное утверждение.
Сера и углерод — это типичные Неметаллы, ответ не подходит.
Значение электроотрицательности меньше, чем у фосфора — четвертый ответ требует наличия ряда электроотрицательности неметаллов (РЭН):
H As I Si P Se C S Br Cl N O F
Здесь хорошо видно, что и углерод, и сера стоят после фосфора (P), значит, их показатели электроотрицательности выше, чем у элемента, входящего в состав АТФ. Ответ не подходит.
- Пятый пункт: химический элемент образует оксид с общей формулой ЭО2 — для этого необходимо вспомнить степени окисления углерода и серы, а также оксиды, которые они образуют.
- Углерод в имеет много степеней окисления (особенно в органической химии), но оксиды образует только в двух вариациях — CO и CO2.
- Сера также как углерод имеет не одну степень окисления, и ее оксиды — SO2 и SO3.
- Этот вариант нам подходит, так как и сера, и углерод образуют оксиды с общей формулой ЭО2.
- Ответ: 25.
- На сегодня все)
Ответы к упражнениям § 18. Химия 8 класс
Упражнение: 1
Выпишите из приведенного ниже перечня формул в два столбика формулы оксидов металлов и оксидов неметаллов и назовите их: Na2O, N2O5, NaOH, HNO3, CuO, SO2, SCl2, Cl2O7, FeS, Fe2O3, Cu2O, CuF2, P2O5.
| Оксиды металлов | Оксиды неметаллов |
|
Na2O – оксид натрия CuO – оксид меди (II) Fe2O3 – оксид железа (III) Cu2O – оксид меди (I) |
N2O5 – оксид азота (V) SO2 – оксид серы (IV) Cl2O7 – оксид хлора (VII) P2O5 – оксид фосфора (V) |
Упражнение: 3
Найдите плотность (массу 1 л) аммиака, хлороводорода и углекислого газа при н.у.
|
Дано: NH3 HCl CO 2 V= 1 л m(NH3) — ? m(HCl) — ? m(CO 2) — ? |
Решение: m = n • M, n = V / Vm = 1 / 22,4 = 0,045 моль M(NH3) = 14 + 1 • 3 = 17 г/моль m(NH3) = 0,045 • 17 = 0,765 г, M(HCl) = 1 + 35,5 = 36,5 г/моль m(HCl) = 0,045 • 36,5 = 1,623 г, M(CO 2) = 12 + 16 • 2 = 44 г/моль m(CO 2) = 0,045 • 44 = 1,98 г, Ответ: плотность веществ составляет — ρ( NH3) = 0,765 г/л ρ(HCl) = 1,623 г/л ρ( CO 2) = 1,98 г/л |
Упражнение: 5
Выпишите из текста параграфа все приведенные в нем формулы веществ и дайте их названия по международной номенклатуре.
|
SiO2 – оксид кремния (IV) H2O – оксид водорода CO2 – оксид углерода (IV) Fe2O3 – оксид железа (III) CO — оксид углерода (II) |
CaO – оксид кальция Al2O3 – оксид алюминия NaH – гидрид натрия CaH2 – гидрид кальция HCl — хлорид водорода NH3 — нитрид водорода |
Упражнение: 2
Какие из перечисленных ниже названий соответствуют формуле H2O: оксид водорода, гидрид кислорода, пероксид водорода, водород, вода, кислородный водород?
H2O – оксид водорода, вода, (кислородный водород?!)
Упражнение: 4
Сколько молекул каждого вещества содержится в 1 г CO 2, HCl, NH3.
|
Дано: CO 2 HCl NH3 m= 1 г N(CO 2) — ? N(HCl) -? N(NH3) — ? |
Решение: N = n • NA n = m / M
n = 1 : 44 = 0,023 моль |
Упражнение: 6
Как должен располагаться сосуд для собирания аммиака и угрлекислого газа – вверх или вниз дном? Почему?
Так как аммиак легче воздуха, то сосуд для его собирания должен располагаться вверх дном.
Углекислый газ тяжелее воздуха, поэтому сосуд для его собирания должен располагаться вниз дном.






