Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
Теперь рассмотрим строение и свойства атомов элементов I A группы.
Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.
Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
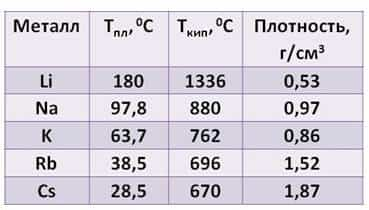
- Из таблицы видно:
- · плотность их увеличивается от лития к цезию
- · температура плавления, в отличие от плотности, уменьшается от лития к цезию
- · температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.
В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.
В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.
С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.
- Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
- Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.
- Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.
- Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.
Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.
- Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
- Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами.
Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе.
Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты.
Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода.
В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода.
В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.
Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.
Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
- Рассмотрим наиболее значимые соли.
- Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
- Питьевую соду – NaHCO3используют в быту и пищевой промышленности, а также в медицине.
- Поташ, или карбонат калия – K2CO3используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
- Кристаллогидрат сульфата натрия, или глауберова соль –
- Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.
Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия.
В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны.
Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги.
Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г.
Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.
Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
- · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
- · отмиранию листьев растений
- · повышению восприимчивости к грибковых и бактериальным заболеваниям
- · снижению всхожести семян.
- Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.
- Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.
Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.
Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.
Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1.
Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами .
Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Химические свойства s-металлов и их соединений
Химические свойства 5-металлов 1-й и 2-й групп, обусловленные их высокой восстановительной активностью, во многом схожи, однако каждая группа и каждый отдельный металл проявляют и специфические свойства.
Химические свойства щелочных металлов
В связи с уменьшением энергии связи валентного электрона в ряду 1л — Ыа — К — Ш) — С$ химическая активность элементов этого ряда возрастает.
Взаимодействие с водой. Все щелочные металлы реагируют с водой, образуя раствор щелочи с выделением водорода по одной схеме:
Литий реагирует с водой спокойно, а цезий — со взрывом.
В чистом виде гидроксиды щелочных металлов — белые гигроскопичные («расплывающиеся» на воздухе за счет поглощения водяных паров) вещества, растворы которых являются сильными основаниями.
Взаимодействие с кислородом. Кислород настолько легко окисляет щелочные металлы, что они способны гореть (более того, цезий самовоспламеняется при контакте с воздухом). При горении на воздухе щелочных металлов образуются разные продукты: основный оксид лития, пероксид натрия и надпероксиды калия рубидия и цезия:
Пероксиды — химические соединения, содержащие в своем составе анион о-~.
Пероксид натрия имеет важное практическое применение. В реакции пероксида натрия с углекислым газом выделяется кислород:
Эта реакция используется для получения кислорода в дыхательных аппаратах для подводников и пожарных.
- Надпероксиды — химические соединения, содержащие в своем составе анион О“.
- Возможность существования анионов объясняет теория МО
- ЛКАО.
- Продуктами взаимодействия кислородных соединений щелочных металлов с водой являются хорошо растворимые основания, называемые щелочами (типичнейшие — ЫаОН (едкий натр) и КОН (едкое кали)).
- Взаимодействие с водородом. При слабом нагревании в токе водорода все щелочные металлы образуют твердые кристаллические гидриды:
Устойчивость гидридов возрастает от цезия к литию.
Взаимодействие с галогенами. В реакции с галогенами все щелочные металлы вступают легко. Их интенсивность зависит от активности как металла, так и галогена. Литий с иодом реагирует только при нагревании, а уже натрий самовоспламеняется в хлоре. Во всех случаях образуются соли:
Щелочные металлы и их соединения можно обнаружить по окраске пламени: Ы — карминно-красный, Ыа — желтый, К — фиолетовый, Ш) — бурокрасный, Сэ — розово-фиолетовый.
Неорганическая химия
Общая характеристика
К щелочным металлам относятся s-элементы I-ой группы Периодической системы — литий, натрий, калий, рубидий,цезий и франций. .
Литий имеет два стабильных изотопа -6Li (мольная доля в естественном элементе 0,073) и 7Li (0,927), натрий — один изотоп 23Na, калий — 39К (0,931) и 41К (0,069).
Изотоп калия с массовым числом 40 (40К, мольная доля 0,0002) — радиоактивный, -распад. У рубидия два стабильных изотопа — 85Rb (0,7215) и 87Rb (0,2785), у цезия — один 133Cs.
Франций стабильных изотопов не имеет, массовое число наиболее долгоживущего — 223.
Все щелочные металлы — электронные аналоги, внешний уровень имеет строение ns1. По сравнению с элементами других подгрупп соответствующего периода щелочные металлы имеют наиболее низкие энергии ионизации и наибольшие радиусы атомов и ионов.
В группе энергия ионизации уменьшается от лития к цезию, а радиус атома наоборот, возрастает. В соединениях проявляют степень окисления +1 и в свободном виде на Земле не встречаются.
Мольная доля лития в земной коре 0,0002, натрия — 0,024 (один из наиболее распространенных элементов), калия 0,014, рубидия — 0,00007. Содержание цезия около 10-10, франций получен только искусственно.
Важнейшие минералы щелочных металлов — NaCl -каменная соль, или галит, Na2SO4*10H2O — глауберова соль или мирабилит, Na2B2O7*10H2O — бура, Na3AlF6 -криолит, KCl — сильвин, NaCl*KCl — сильвинит, KCl*MgCl2*6H2O — карналлит, KCl*MgSO4*3H20 — каинит.
Простые вещества.
Все щелочные металлы не имеют аллотропных и полиморфных модификаций и образуют по одному простому веществу.
Физические свойства.
В виде простых веществ — мягкие, серебристо белые металлы, цезий имеет золотисто-желтый цвет. Плотности лития, натрия и калия меньше плотности воды ( 1 г/см3), температура плавления плавно уменьшается от лития (180оС) к цезию (28оС). Так же изменятся и температура кипения — от 1337оС у лития до 668оС у цезия. Твердость щелочных металлов мала — они легко режутся ножом.
В видимой области спектра в парах щелочные металлы имеют интенсивные линии излучения: натрий — желтую, литий — карминово-красную, калий — фиолетовую, рубидий — красную, цезий — голубую. Это позволяет распозновать эти металлы с помощью пламенной фотометрии.
Щелочные металлы исключительно реакционноспособны и проявляют сильные восстановительные свойства. Уже при комнатной температуре они реагируют со многими неметаллами. С кислородом литий образует оксид:
4Li + O2 = 2Li2O
Остальные щелочные металлы образуют пероксиды и надпероксиды (супероксиды), например:
2Na + O2 = Na2O2 2K + 2O2 = K2O4
В атмосфере фтора и хлора щелочные металлы самовоспламеняются, образуя галогениды:
Na + Cl2 = 2NaCl
С жидким бромом литий и натрий реагируют замедленно, остальные — о взрывом. С иодом взаимодействие протекает спокойно.
С водородом щелочные металлы реагируют при нагревании (200-400oC), при этом образуютсяионные гидриды:
2Na + Н2 = 2NaН
разлагающиеся водой с выделением водорода:
2NaН + 2Н2О = 2NaОН + Н2
С азотом щелочные металлы реагируют при нагревании, образуя нитриды состава Ме3N. Литий реагирует с азотом воздуха уже при комнатной температуре, покрываясь слоем красноватого нитрида:
6Li + N2 = 2Li3N
Щелочные металлы реагируют с водой:
2Ме + 2Н2О = 2МеОН + Н2
литий — спокойно, натрий — энергично, калий и остальные — со взрывом — воспламеняется выделяющийся водород. Рубидий и цезий реагируют не только с жидкой водой, но и со льдом.
С кислотами щелочные металлы образуют соли, часто эти реакции сопровождаются взрывами.
Со спиртами щелочные металлы реагируют спокойно, часто для завершения реакции необходимо нагревание:
2Ме + С2Н5ОН = 2С2Н5ОМе + Н2
При взаимодействии лития и натрия с алюминие, оловом, ртутью образуются интерметаллические соединения. Широко распространена амальгама натрия NanHgm. Между собой щелочные металлы образуют сплавы, широкое применение имеет сплав натрия и калия, обладающий высокой теплоемкостью.
Получение щелочных металлов
Основным способом получения щелочных металлов является электролиз расплавов их соединений. Для получения лития электролизу подвергают расплав эвтектическуй смеси хлоридов лития и калия.
Натрий получают электролизом расплава хлорида или гидроксида, калий — электролизом расплава смеси хлоридов натрия и калия. Смеси солей используют для понижения температуры электролиза.
Реакции электролиза хлоридов и гидроксидов в общем виде выглядят так:
2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2
Кромe электролиза щелочные металлы можно получить и восстановлением оксидов и гидроксидов, например оксид лития восстанавливают кремнием при нагревании:
2Li2O + Si = Li + SiO2
Расплавленный гидроксид калия восстанавливают жидким натрием:
KOH + Na = NаOH + K
Гидроксиды рубидия и цезия восстанавливают металлическим кальцием в вакууме при нагревании:
RbOH + Ca = Rb + CaO CsOH + Ca = Cs + CaO
Хранят щелочные металлы в атмосфере инертного газа, под слоем сухого керосина или обезвоженного масла. Большие количества щелочных металлов хранят в герметичной железной таре (бочке).
Применение
Щелочные металлы используют в качестве восстановителей, в качестве жидких теплоносителей, например, в ядерных реакторах, в органическом синтезе. Литий применяется производстве сплавов в качестве легирующей добавки. Пары натрия используют для наполнения газоразрядных ламп уличного освещения, которые дают свет с оранжевым оттенком.
Соединения щелочных металлов
Гидриды
Гидриды щелочных металлов — соединения с ионным типом связи, сильные восстановители. Водой разлагаются с выделением водорода
2МеН + 2Н2О = 2МеОН + Н2
При нагревании в вакууме разлагаются:
2МеН = 2Ме + Н2
пр этом устойчивость гидридов уменьшается от лития к цезию. Рaсплавы гидридов проводят электрический ток.
Гидриды лития и натрия испльзуют для получения алюмогидридов, гидрид алюминия вводится в реакцию в виде эфирного раствора:
NaН + AlН3 = Na[AlH4]
Алюмогидриды лития и натрия используются в качестве восстановителей, напримеp, в органическом синтезе.
Карбиды
Карбиды щелочных металлов имеют состав Ме2С2 . Бесцветные кристаллические вещества. Обладают высокой химической активностью. При непосредственном взаимодействии простых веществ образуется толькр карбид лития, остальные — при взаимодействии металла и ацетилена.Водой разлагаются с выделением ацетилена:
Ме2С2 + 2Н2О = 2МеОН + С2Н2 Нитриды
Из нитридов щелочных металлов наиболее устойчив гидрид лития, который медленно образуется при взаимодействии с азотом уже при комнтной температуре и быстро — при 250oC. Водой нитрид лития разлагается с выделением аммиака:
Li3N + 3Н2О = 3LiОН + NН3
Нитриды остальных щелочных металлов получают при взаимодействии паров металла с азотом в тлеющем электрическом разряде.
При взаимодействии расплавленных щелочных металлов с аммиаком образуются амиды, например:
2Na + 2NН3 = 2NaNН2 + Н2
В жидком аммиаке щелочные металлы растворяются, образуя темно-синие, хорошо проводящие электрический ток растворы.
Оксиды, пероксиды, озониды
При сгорании при атмосферном давлении литий дает только оксид Li2O , натрий — пероксид Na2O2 , остальные — надпероксиды Ме2O4 или МеO2 . Оксид натрия можно получить только косвенным путем, например:
Na2O2 + 2Na = 2Na2O 2NaОН(твердый) + 2Na = 2Na2O + Н2 5NaN3 + 2NaNО3 = 3Na2O + 8N2
Оксиды щелочных металлов обладают высокой реакионной способностью, проявляют сильно выраженные основные свойства, энергично взаимодействуют с водой, образуя гидроксиды.
Пероксиды и надпероксиды — твердые вещеста, сильные окислители. При контакте с водой разлагаются:
Na2O2 + 2Н2О = 2NaOН + Н2O2 2NaO2 + 2Н2О = 2NaOН + Н2O2 + O2
Озониды натрия, калия, рубидия и цезия получают действием озона на твердые гидроксиды:
4МеOН + 4О3 = 4МеО3 + 2Н2О + O2
Озониды еще более сильные окислители, чем пероксиды и надпероксиды. Бурно реагируют с водой и разбавленной серной кислотой:
4МеO3 + 2Н2О = 4МеOН + 5O2 4КO3 + 2Н2SО4 = 2R2SО4 + 2Н2О + 5O2 Гидроксиды
Твердые, бесцветные, гигроскопические, хорошо растворимые в воде вещества. Растворение в воде сопровождаетсявыделением большого количества теплоты. В водном растворе почти полностью диссоциированы, сильные основания. Часто гидроксиды щелочных металлов называют едкими щелочами. Термически устойчивы до температур более 1000oC
Едкие щелочи жадно поглощают из воздуха водяные пары и углекислый газ, превращаясь в сиропообразную массу.Расплавы едких щелочей разрушают стекло и платину, поэтому щелочи плавят в железных тиглях.
Получают щелочи электролизом водных растворов хлоридов:
2NaСl + 2Н2О = 2NaOН + Н2 + Cl2
или обменными реациями карбоната металла и гидроксида кальция:
Rb2CO3 + Ca(OН)2 = 2RbOН + CaCO3
Наиболее широкое применение находит гидроксид натрия — для осушения газов, в органическом синтезе, в производстве искусственного волокна.
Щелочные металлы
- ЩЕЛОЧНЫЕ МЕТАЛЛЫ Общая характеристика
- Свойства щелочных металлов
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | ПИ эВ | Степень окисления | |
| 3 | Литий Li | [He] 2s1 | 0,531 | 180,5 | 1347 | 0,97 | 5,39 | 0,157 | +1 |
| 11 | Натрий Na | [Ne]3s1 | 0,97 | 97,9 | 882,9 | 1,01 | 5,138 | 0,191 | +1 |
| 19 | Калий K | [Ar] 4s1 | 0,859 | 63,65 | 774 | 0,91 | 4,339 | 0,236 | +1 |
| 27 | Рубидий Rb | [Kr] 5s1 | 1.53 | 38,4 | 688 | 0,89 | 4,176 | 0,253 | +1 |
| 55 | Цезий Cs | [Xe] 6s1 | 1,88 | 28.4 | 678 | 0,86 | 3,893 | 0,274 | +1 |
| 87 | Франций Fr | [Rn] 7s1 | – | – | – | – | – | – | +1 |
Физические свойства Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.Низкий потенциал ионизации, который уменьшается с увеличением атомного номера. Химические свойства Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы.
Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла.Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.
Нахождение в природе LiLi2O • Al2O3 • 4SiO2 – сподумен NaNaCl – каменная сольNa2SO4 • 10H2O – глауберова соль (мирабилит)NaNO3 – чилийская селитра KKCl • NaCl – сильвинитKCl • MgCl2 • 6H2O – карналлитK2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз) Химические свойства Все щелочные металлы — очень сильные восстановители, в соединениях проявляют единственную степень окисления +1.
Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.Все соединения щелочных металлов имеют ионный характер.Практически все соли растворимы в воде. 1. Активно взаимодействуют с водой: 2Na + 2H2O ® 2NaOH + H22Li + 2H2O ® 2LiOH + H2 2. Реакция с кислотами:2Na + 2HCl ® 2NaCl + H2 3.
Реакция с кислородом:4Li + O2 ® 2Li2O(оксид лития)2Na + O2 ® Na2O2(пероксид натрия)K + O2 ® KO2(надпероксид калия) На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.). 4.
В реакциях с другими неметаллами образуются бинарные соединения: 2Li + Cl2 ® 2LiCl(галогениды)2Na + S ® Na2S(сульфиды)2Na + H2 ® 2NaH(гидриды)6Li + N2 ® 2Li3N(нитриды)2Li + 2C ® 2Li2C2(карбиды) Реагируют со спиртами и галогенопроизводными углеводородов (смотри «Органическую химию») 5.
Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета: Li+ – карминово-красныйNa+ – желтыйK+, Rb+ и Cs+ – фиолетовый Оксиды щелочных металлов – R2O Получение Окислением металла получается только оксид лития 4Li + O2 ® 2Li2O (в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла: Na2O2 + 2Na ® 2Na2OKO2 + 3K ® 2K2O Химические свойства Типичные основные оксиды.Реагируют с водой, кислотными оксидами и кислотами: Li2O + H2O ® 2LiOHNa2O + SO3 ® Na2SO4K2O + 2HNO3 ® 2KNO3 + H2O Пероксид натрия Na2O2 Получение 2Na + O2 ® Na2O2 Химические свойства 1.
Сильный окислитель: 2NaI + Na2O2 + 2H2SO4 ® I2 + 2Na2SO4 + 2H2O2Na2O2 + 2CO2 ® 2Na2CO3 + O2 2. Разлагается водой: Na2O2 + 2H2O ® 2NaOH + H2O2 Надпероксид калия KO2 Получение K + O2 ® KO2 Химические свойства 1. Сильный окислитель: 4KO2 + 2CO2 ® 2K2CO3 + 3O2 2.
Разлагается водой: 2KO2 + 2H2O ® 2KOH + H2O2 + O2 Гидроксиды щелочных металлов – ROH Белые, кристаллические вещества, гигроскопичны; хорошо растворимы в воде (с выделением тепла). В водных растворах нацело диссоциированы. Получение 1.
Электролиз растворов хлоридов: 2NaCl + 2H2O ® 2NaOH + H2 + Cl2 катод: 2H+ + 2e ® H02 анод: 2Cl- – 2e ® Cl02 2. Обменные реакции между солью и основанием: K2CO3 + Ca(OH)2 ® CaCO3¯ + 2KOH 3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой: 2Li + 2H2O ® 2LiOH + H2Li2O + H2O ® 2LiOHNa2O2 + 2H2O ® 2NaOH + H2O2 Химические свойства R–OH – сильные основания (щелочи) (основность увеличивается в ряду LiOH – NaOH – KOH – RbOH –CsOH); реагируют с кислотными оксидами и кислотами: 2NaOH + CO2 ® Na2CO3 + H2OLiOH + HCl ® LiCl + H2O При сплавлении NaOH с ацетатом натрия образуется метан:
NaOH + CH3COONa –t°® Na2CO3 + CH4
Химия элементов (щелочные металлы) ep 1
Давненько не было статеек и вот я готов начать серию работ по химии элементов. Материал я постараюсь, как в хороших учебниках делить на «базовый» и «расширенный«, как показала практика такое распределение помогает как новичкам, так и увлеченным химикам. Буду благодарен за критику, поскольку ошибок я, как начинающий писатель, пока делаю достаточно.
Начнем пожалуй с щелочных металлов: Li, Na, K, Rb, Cs, Fr. Все расположены в первой группе периодической системы, и их объединяют как общие химические так и физические свойства. Но чем обусловлено такое сходство?
В цикле «Очень легкая химия» мы разбирались в строении атомов и говорили о том, что именно электронная оболочка определяет свойства того или иного элемента, теперь настало время применить наши знания на практике.
Если вспомнить положения периодического закона, мы увидим, что у всех щелочных металлов на последнем энергетическом уровне находится по одному электрону. Из этого мы делаем логичный вывод, что они склонны отдавать его, чтобы приобрести законченный электронный уровень.
Законченный электронный уровень обладает меньшей энергией чем незаконченный, следовательно состояние, при котором энергетическая оболочка атома характеризуется наименьшей энергией, будет наиболее стабильным.
В теории это объясняется эффектами вырожденности электрона (неоднозначное определение его на орбитали) На практике же подтверждается большой разницей между энергиями первой и второй ступени ионизации (что говорит о менее прочной связи с ядром внешнего электрона, по сравнению с электроном с заполненной оболочки)
Именно поэтому щелочные металлы очень активны, способны легко отдавать электрон, проявляя свойства восстановителей, а также обладают самыми низкими электрохимическими потенциалами
- Высокая активность щелочных металлов не позволяет им находится в природе в самородном виде, поэтому металлы первой группы образуют множество минералов, с некоторыми из которых, например с поваренной солью, мы сталкиваемся каждый день.
- Известно огромное количество минералов, образуемых щелочными металлами, вот некоторые из них:
- LiAl(SiO3)2- сподумен
- KCl * MCl2* 6H2O- карналит
- KCl- сильвин
- NaCl- галит
- (Cs, Na)[AlSi2O6] — поллуцит
- (K,Na,Rb)AlSi3O8- амазонит
- Выделение металлов из их соединений, ввиду их высокой химической активности, является сложной задачей, в основном используют либо электрохимический метод, либо восстановление алюминием, кальцием или цирконием.
Резонные вопросы вызывает последний метод, ведь мы знаем, что металл, стоящий в электрохимическом ряду напряжений после например натрия, не может восстановить его из соли, однако на помощь нам приходят уже физические свойства щелочных металлов, а именно низкая температура плавления и кипения, в условиях атмосферного давления, небольшие количества натрия, получающиеся в реакции хлорида натрия и алюминия, опять взаимодействуют с хлоридом алюминия и реакция в общем не идет. Но если поместить реакционную смесь в вакуум и нагреть, образующийся в ходе реакции натрий начнет испаряться, не реагируя с твердым даже при высокой температуре хлоридом алюминия. Также внимание заслуживает метод Грейсхейма, взаимодействие ацетиленида (карбида) кальция с фторидом калия (реакция).Рубидий и цезий получают разложением азидов (солей HN3) вакууме.
- Химические свойства
- Все щелочные металлы реагируют с кислородом, водородом, неметаллами, кислотами, водой и многими другими классами соединений, в том числе и органическими молекулами.
- Соединения с кислородом.
- Щелочные металлы образуют 4 типа соединений с кислородом: оксиды, пероксиды, надпероксиды, озониды. На примере натрия соответственно:
- Na2O, Na2O2, NaO2, NaO3.
- Такое многообразие обусловлено высокой активностью щелочных металлов, а также незначительной разницей между энергиями связи кислородных атомов друг с другом и атомами металлов.
Все кислородные соединения реагируют с водой. Оксиды при взаимодействии дают щелочи, а остальные соединения: щелочь и пероксид водорода на холоде, щелочь воду и кислород при нагревании, или в присутствии катализатора (MnO2 Pt каталаза).
Интересно, что прямым взаимодействием кислорода нельзя получить оксид щелочного металла, исключением является оксид лития, в этом литий проявляет диагональное сходство с магнием. В случае с остальными металлами образуется адская смесь оксидов, пероксидов и надпероксидов.
https://www.youtube.com/watch?v=_JzTjsMKv_A
Чистые оксиды получают взаимодействием например калия с нитратом калия, или пероксида с металлом, азида с металлом, гидроксида с металлом, эти способы не эффективны для цезия и рубидия, ввиду их высочайшей активности. Остальные кислородные соединения получают прямым окислением или, как в случае озонидов, взаимодействием с озоном.
Интересными соединениями щелочных металлов являются интерметаллиды, соединения двух металлов.
Особенностью сплавов (интерметаллидов) щелочных металлов является их невероятно низкая температура плавления, например у сплава натрия, калия и цезия она равна -78 °C.
А например сплав ртути и натрия (амальгама натрия) используется в органическом синтезе как восстановитель, благодаря своей способности реагировать с водой без опасности взрыва, как это бывает в случае с натрием.
При взаимодействии щелочных металлов получаются солеобразные гидриды, соединения в которых водород принимает степень окисления -1.
Гидриды выглядят как белые порошки, взаимодействуют с кислотами и водой, обладают сильными восстановительными свойствами, что активно используется в органической химии.
Смешанный гидрид алюминия лития, или аланат лития используют для восстановления кетонов, альдегидов и нитросоединений.
Соединения щелочных металлов с неметаллами получают прямым взаимодействием. Сульфиды и фосфиды образуют все щелочные металлы, а карбиды (ацетилениды) при прямом взаимодействии образует только литий, он же реагирует с азотом при комнатной температуре, образуя нитрид.
В следующей части речь пойдет о наиболее важных соединениях щелочных металлов- солях, являющихся основными компонентами удобрений, без которых наша жизнь была бы не возможна.
1. Общая характеристика и химические свойства щелочных металлов
- Особенности
соединений лития по сравнению с
соединениями других щелочных металлов.
- Гидриды,
оксиды, пероксиды, гидроксиды щелочных
металлов : химическая связь в соединениях,
получение и свойства. - Получение
натрия, гидроксида натрия и карбоната
натрия в промышленности. - Взаимодействие
с растворами щелочей: а)амфотерных
металлов; б)неметаллов; в)кислотных
оксидов; г)амфотерных оксидов.
Металлы подгруппы IA
периодической системы элементов I.
И. Менделеева Li,
Na,
К, Rb,
Cs
и Fr
называются щелочными.
Щелочные, щелочноземельные
металлы, Be
и Mg
относятся к наиболее электроположительным,
элементам. В соединениях с другими
элементами для металлов подгруппы IA
типична степень окисления + 1, а для
металлов подгруппы ПА +2. С ростом
числа электронных слоев и увеличением
радиусов энергия ионизации атомов
уменьшается.
Вследствие этого химическая
активность элементов в подгруппах
увеличивается с ростом их порядкового
номера. С малой энергией ионизации
связан характерный для них фотоэффект,
а также окрашивание их солями пламени»
газовой горелки.
Благодаря легкой отдаче
наружных электронов щелочные и
щелочноземельные металлы образуют
соединения преимущественно с ионной
связью.
- Щелочные и щелочноземельные металлы проявляют высокую
-
химическую активность. При
нагревании в водороде они образуют -
гидриды — солеподобные
соединения, в которых водород находится - а виде отрицательно заряженного иона. На воздухе щелочные
-
металлы быстро окисляются,
образуя в зависимости от их активности - оксиды,
пероксиды, надпероксиды или озониды. -
При этом Ci,
Na
и К'загораются на воздухе или в атмосфере сухого кислорода
только -
при нагревании, a,
Rb и Cs
самовоспламеняются без нагревания. -
Образование при горении
оксида состава М2О
характерно только -
для лития. Натрий образует
пероксид состава М2O2,
калий, рубидий -
и цезий — надпероксиды
состава МО2.
Щелочные металлы энергично
взаимодействуют с водой, вытес-из нее водород и образуя соответствующие гидроксиды. Активность взаимодействия
этих металлов с водой возрастает по
мере увеличения порядкового номера элемента.
Так,- литий реагирует с
водой без плавления, натрий — плавится,
калий — самовозгорает-ся , взаимодействие
рубидия и цезия протекает еще более
энергично.
Щелочные металлы энергично взаимодействуют с галогенами, а при
нагревании — с серой.
-
Гидроксиды щелочных металлов
— соединения с преимуществен- -
но ионной связью. В водных
растворах они нацело диссоциируют -
ным характером связи
объясняется и их высокая термическая
устойчнвость:они не, отщепляют воду дажепри нагревании до
температуры кипения (выше 1300 °С) Исключение составляет, гидроксид
лития, который при нагревании разлагается
с отщепле-нием ,воды. Поведение лития отличается и в других отношениях
от поведения остальных щелочных
металлов. Это объясняется его неполной
электронной аналогией с остальными
элементами группы.
Из щелочных металлов только литий при сравнительно небольшом
нагревании
взаимодействует с азотом, углеродом и
крем-нием, образуя соответственно нитрид
Li3N,
карбид Li2С2
и силицид Li6Si2.
В присутствии влаги образование нитрида
идёт уже при комнатной температуре.
В отличие от щелочных
металлов, почти все соли которых хорошо
растворимы в воде, литий образует
малорастворимый фторид LiF
карбонат Li2CO3
и фосфат Li3PO4.
Кальций, стронций и барий
по отношению к кислороду и воде ведут
себя подобно щелочным металлам. Они
разлагают воду с выделением водорода
и образованием гидроксидов М(ОН)2.
Взаимодействуя с кислородом, образуют
оксиды (СаО) и пероксиды (SrO2,
ВаО2),
которые реагируют с водой подобно
аналогичным соединениям щелочных
металлов.
Магний также существенно
отличается от щелочноземельных металлов.
Например, из-за малой растворимости его
гидроксида он не взаимодействует с
холодной водой. При нагревании процесс
облегчается.
В целом металлы подгруппы
ПА химически активны: при нагревании
они взаимодействуют с Галогенами и
серой с .образованием соответствующих
солей, соединяются с молекулярным
азотом.
Соли щелочноземельных
металлов, как и соли щелочных металлов,
состоят из ионов. Соли этих металлов
окрашивают пламя горелки в
характерные цвета,
для соединений Be
и Mg
этого не наблюдается.
В
отличие от солей щелочных металлов
многие соли металлов подгруппы ПА
малорастворимы, в частности фториды
(кроме BeF2).
сульфаты (кроме BeSО4
и MgSO4),
карбонаты. Из водных раствороэ Ве2+
осаждается в виде основных карбонатов
перемен-.ного состава, Mg2+—
в виде 4MgCO3-Mg(OH)2-5H2O,
а Са2+,
Sr2
+
и Ва2+
осаждаются в виде средних карбонатов
МСОз.
- А)
Be+2NaOH=
Na2BeO2+H2 - Al+NaOH+H2O=NaAlO2+H2
- Б)
Неметаллы,
за исключением галогенов, не реагируют
с растворами щелочей - Cl2+NaOH=NaClO3+NaCl+H2O
- В)
кислотные оксиды растворяются только
в щелочах с образование соли и воды - SO3+2NaOH=Na2So4+H2o
- Г) Амф ме реагируют с сильными щелочами,
проявляя этим свои кислотные свойства,
например: - ZnO
+ 2NaOH → Na2ZnO2 +
H2O
Амфотерные оксиды могут реагировать с
щелочами двояко: в растворе и в расплаве. - При
реакции с щёлочью в расплаве образуется
обычная средняя соль(как показано на
примере выше). - При
реакции с щёлочью в растворе образуется
комплексная соль. - Al2O3 +
2NaOH + 3H2O
→ 2Na[Al(OH)4]
(В данном случае образуется
тетрагидроксоаллюминат натрия)






