
Тяжелые металлы — отдельная группа химических элементов с большой плотностью и атомной массой. Основное отрицательное их свойство — накапливание в организме, приводящее к отравлениям и заболеваниям.
Некоторые металлы в небольших количествах необходимы человеку (железо, цинк, медь и др.). Но повышенное содержание их в организме принесет немалый вред, такой же, как и при оседании особо вредных, ненужных организму кадмия, свинца, ртути и пр.
Применяются тяжелые металлы в производстве, сельском хозяйстве, а с отходами промышленности попадают в окружающую среду. Проживание в загрязненной местности приводит к проблемам со здоровьем, в частности — к отравлениям различными тяжелыми металлами и их солями.
Где и как можно отравиться
Отравления тяжелыми металлами и их солями происходят двумя путями: через вдыхание паров или при употреблении внутрь. Это может случиться как при производстве продукции, содержащей опасные элементы, так и в быту:

- при несоблюдении правил использования металлов на предприятии,
- из-за невнимательности при работе с вредными элементами,
- в результате вдыхания отравленного воздуха при проживании около заводов, фабрик и т. п.,
- при вдыхании выхлопных газов, табачного дыма,
- при работе с пестицидами и употреблении в пищу насыщенных ими растительных продуктов,
- при контактах с растворителями и красками,
- через грязную воду из зараженных тяжелыми металлами водоемов,
- после неправильного применения препаратов, в состав которых входят вредные металлы,
- в результате вдыхания паров после случайного разбития термометра.
Иными словами — опасность интоксикации тяжелыми металлами подстерегает человека и на улице, и дома, а некоторых — и на работе.
Особо токсичными считаются кадмий, ртуть, хром, свинец и другие, а также полуметалл мышьяк. Они даже в малейших дозах способны привести к тяжелейшим отравлениям и смерти человека.
Как проявляется отравление
При отравлении тяжелыми металлами различают острую и хроническую форму. Острая интоксикация наступает после разового получения превышенной дозы элемента (например, внутрь с целью совершения самоубийства, или если с веществом, содержащим металлы, контактировал ребенок).
Хроническое отравление развивается в течение длительного времени, при постоянном столкновении с вредными металлами. Чаще всего это происходит на производстве, где рабочие вынуждены ежедневно находиться около источника опасности или при проживании в загрязненном районе.
Симптомы отравления при обеих формах могут быть общими или специфическими (подсказывающими, каким конкретно металлом отравился пострадавший).
Общие
Общие симптомы чем-то напоминают признаки, проявляющиеся при пищевом отравлении:
- колики, сильные боли в животе,
- тошнота и рвота,
- повышение температуры,
- понос или запор, иногда с кровью.
Сюда же можно отнести и такие признаки отравления солями и металлами, как снижение обоняния, вкусовых ощущений, апатия, сменяющая перевозбуждение, привкус металла во рту. В тяжелом случае возможны галлюцинации и бред, потеря сознания и кома.
Прочтите также: Отравление у человека фреоном
Специфические
По этим признакам можно понять, что за металл стал причиной интоксикации:

- Кадмий, сурьма. У человека, отравившегося этими металлами, наблюдаются очень сильные боли в голове и в ногах, падает аппетит, воспаляются слизистые, теряется вес, трескается кожа. Если помощь не поступает, из-за воздействия кадмия развивается хрупкость и ломкость костей, сопровождающаяся сильными болями (заболевание итай-итай).
- Медь. Страдает печень, развивается ее недостаточность и желтуха. Отравившегося этим металлом мучают приступы рвоты голубого цвета.
- Свинец. Во рту появляется серо-лиловая каемка, десны начинают кровоточить, а зубы — шататься. Кожа приобретает серовато-землистый оттенок. Появляются специфические «свинцовые колики» (очень сильные схваткообразные боли в области живота). У детей наблюдается отсталость умственного и физического развития.
- Ртуть. Отравившийся испытывает сильное слюнотечение и привкус металла во рту. Лимфоузлы увеличиваются так, что это видно невооруженным глазом. Становится обильным потоотделение, ритм сердца ускоряется, подскакивает давление. Нарушается подвижность суставов, наступает перевозбуждение, трясутся конечности (причем дрожь иногда доходит до судорог).
- Мышьяк. Этот полуметалл вызывает кровохарканье, слезоточивость. Со временем волосы начинают выпадать, а ногти покрываются пятнами, слоятся и ломаются. На коже тоже появляются характерные пятна, развиваются экземы и дерматиты. Если не лечить — наступает некроз тонкого кишечника и желудка.
Тяжелые металлы отличаются высокой проницаемостью и способностью всасываться в кровь, разносясь после этого по органам, тканям и оседая в них. Основной удар принимают на себя печень и почки, отфильтровывающие токсины и выводящие их.
И если эти органы успели сильно пострадать, их функции нарушились — вывод соединений металлов из организма с этого момента невозможен.
В итоге интоксикация не уменьшается, и токсины без помех поражают нервную, сердечно-сосудистую и дыхательную системы.
Первая помощь
Нет необходимости говорить, что вылечить пострадавшего на дому невозможно, но, тем не менее первая помощь при отравлении должна быть оказана. Поэтому, поняв, что плохое состояние пострадавшего стало следствием отравляющих воздействий опасного металла, нужно сразу вызывать скорую. После этого следует немедленно приступить к вспомогательным мерам:
- вывести больного из зараженного помещения (если известно, что именно там он надышался парами),
- если соли металлов попали на кожу — хорошо промыть пораженный участок проточной водой,
- при попадании металла в ЖКТ промыть желудок лучше зондом, т. к. некоторые соли обладают прижигающим действием и пить воду при этом запрещено,
- дать пострадавшему энтеросорбенты (Полисорб, Энтеросгель, активированный уголь),
- дать касторовое масло, чтобы обеспечить слабительный эффект,
- если отравившийся без сознания — уложить его горизонтально набок, прочистить дыхательные пути от остатков рвотной массы и зафиксировать язык во избежание вероятного западания.
Лечение отравления солями тяжелых металлов народными методами недопустимо. Единственное, что можно сделать — несколько уменьшить интенсивность некоторых симптомов (прополоскать ромашкой воспаленную слизистую рта и т. п.).
Прочтите также: Отравление у человека таллием
Стационарная терапия
После того как неотложная помощь при отравлении солями тяжелых металлов была оказана, приехавшие медики проведут установку точного диагноза для выявления элемента, из-за которого произошла интоксикация.
Для этого сначала нужно в подробностях описать докторам все симптомы, после чего диагностика в стационаре будет проводиться более целенаправленно.
Когда металл, ставший причиной отравления, будет выявлен, наступит время для оказания профессиональной помощи:

- профессиональное промывание желудка зондом,
- снотворное или успокоительное (если пациент перевозбужден),
- антибиотики и обволакивающие препараты в случаях ожогов кожи,
- мочегонные препараты и введение большого количества жидкости для нормализации диуреза и выведения токсинов с мочой (эти же процедуры важны и для профилактики почечной недостаточности),
- лечение токсического шока,
- гепатопротекторы и витаминотерапия при поражении печени,
- гемодиализ (если потребуется).
Терапия при отравлениях солями металлов обязательно включает в себя нейтрализацию токсинов противоядием. Но не к каждому элементу антидот будет одним и тем же:
- к мышьяку — Унитиол или липоевая кислота,
- к ртути — антидот Унитиол,
- к кадмию — специфический антидот отсутствует, используют тетацин кальция,
- к свинцу — Унитиол, тиосульфат натрия, ЭДТА или Купримин,
- к сурьме — антидот ЭДТА и Унитиол.
Каждый антидот вводится определенное количество раз в течение назначенного времени (от 3 до 7 суток).
Отравление солями тяжелых металлов в легкой или средней форме лечится в стационаре 1,5–3 недели, в тяжелой — до полутора месяцев.
Диета
Особый рацион — тоже важный момент в лечении интоксикации. Без этого невозможно быстро восстановить функции ЖКТ, если в него попали соли тяжелых металлов.
При поражениях пищеварительной системы предписывается специальная диета:

- рыба или мясо разрешены только отварными или приготовленными на пару, причем их лучше измельчить на небольшие кусочки,
- овощи и фрукты должны быть, причем в сыром виде (без термообработки в них сохраняется пектин — природный абсорбент, помогающий вывести солевые соединения из организма),
- обязательна молочная продукция, причем неважно, каким металлом отравился человек (разрешено, если нет диареи),
- чаи (шиповниковый, облепиховый) для укрепления стенок сосудов и предотвращения дальнейшего всасывание солей металлов в кровь,
- рис (славится свойством выводить токсины),
- компоты, свежевыжатые соки, морсы из свежих фруктов будут полезны в любом количестве (это поможет почкам вывести токсины).
Острая пища, а также жирная и жареная, кофе, крепкий чай и алкоголь запрещены категорически!
Реабилитация
Лечение отравлений солями металлов не заканчивается выпиской из стационара. Отравившемуся предстоит еще долгий восстановительный курс, так как пораженные органы и системы возвращаются к нормальному функционированию очень нескоро.
Что нужно делать во время реабилитационного периода:

- продолжать придерживаться диеты, пока доктор не разрешит переходить к привычной пище,
- полезна будет фитотерапия (например, при отравлениях медью и цинком используются травы манжетка или кровохлебка обыкновенная, а для восстановления кишечника — кора дуба, ягоды черемухи, чага, тмин обыкновенный и мн. др.),
- ходить в баню, чтобы с обильным выделением пота токсины выходили через поры (особенно полезно при отравлениях мышьяком, ртутью, кадмием и свинцом),
- санаторно-курортное лечение, где будет сделан упор на продолжение восстановления особо пострадавших органов,
- посещать врача и обследоваться не реже 1 раза в полгода, чтобы перехватить поздно проявляющиеся симптомы.
Прочтите также: Молоко во время и после отравления
Суть реабилитации — плавное завершение общего курса лечения. Если ее проигнорировать, возможно повторное появление симптомов отравления из-за того, что соли металла не полностью выведены из организма.
Но как бы своевременно ни было проведено лечение, тяжелые отравления все равно оставляют свой отпечаток на здоровье человека.
Последствия
Вследствие хронического отравления страдает большинство органов и систем. Это не удивительно, ведь организм месяцами (а иногда даже годами) накапливал в себе понемногу опасные соединения. За это время органы успели накопить в себе большое количество отравляющих веществ, и полностью избавиться от таких проблем будет невозможно даже после 1–1,5 месяцев стационарного лечения.
Какие могут быть осложнения:
- токсический гепатит (печень поражена, увеличена, ее функции не выполняются, мучают боли под нижним ребром справа, развивается желтуха),
- острая анемия в результате распада эритроцитов при отравлении металлами,
- почечная недостаточность как наиболее часто встречающееся последствие (диурез или отсутствует, или значительно превышен),
- необратимые изменения в головном мозге и нервной системы (пропадает память, появляются психические расстройства, сохраняются судороги, нарушается или приостанавливается развитие у детей).
Все последствия очень тяжелые, поэтому нужно приложить максимум усилий, чтобы избежать отравления.
Было ли у Вас отравление тяжелыми металлам?
- Да, было
- Нет, не было
- Сейчас есть симптомы интоксикации
РезультатыPoll Options are limited because JavaScript is disabled in your browser.
9. Соли тяжелых металлов [1986 Майский В.В., Муратов В.К. — Фармакология с рецептурой]
НОВОСТИ БИБЛИОТЕКА ССЫЛКИ О САЙТЕ
Соли тяжелых металлов оказывают противомикробный эффект, инактивируя ферменты, необходимые для жизнедеятельности микроорганизмов. Инактивация ферментов происходит путем взаимодействия ионов тяжелых металлов с сульфгидрильными группами (SH-группы) ферментов.
На кожу и слизистые оболочки соли тяжелых металлов оказывают выраженное местное действие. В зависимости от ряда условий местное действие этих веществ может быть вяжущим, раздражающим или прижигающим.
Механизм местного действия солей тяжелых металлов обусловлен их способностью реагировать с белками тканей. В результате такого взаимодействия белки свертываются и образуют с ионами металлов альбуминаты (соединения типа белковых солей металлов).
При этом, если происходит частичное свертывание белков только в самых поверхностных слоях тканей, наблюдается вяжущий или раздражающий эффект, имеющий обратимый характер.
В случае свертывания белков, охватывающего значительную массу тканевых клеток и вызывающего их гибель, возникает прижигающий эффект, при котором происходят необратимые изменения тканей в виде некроза.
По силе противомикробного и местного действия тяжелые металлы могут быть расположены в следующем порядке: Hg, Ag, Fe, Cu, Zn, Bi, Pb, где наиболее активными являются ионы ртути, а наименее активными — ионы свинца.
При применении солей тяжелых металлов для антисептики и дезинфекции необходимо учитывать, что сила их противомикробного действия значительно уменьшается в средах с высоким содержанием белка (например, в присутствии гноя, крови и т. п.), в связи с чем эти вещества непригодны для обеззараживания выделений.
В качестве антисептических средств применяют препараты ртути (ртути дихлорид), серебра (серебра нитрат, протаргол), цинка (цинка сульфат) и висмута (дерматол, ксероформ).
Ртути дихлорид (сулема) оказывает сильное противомикробное и местное раздражающее действие. Применяется для дезинфекции белья, предметов ухода за больными и т. п. Обладает высокой токсичностью для человека. Легко всасываясь через кожу и слизистые оболочки, может вызывать тяжелые отравления. В связи с этим при работе с препаратом следует соблюдать большую осторожность.
Другие соли ртути (ртути оксицианид, ртути окись желтая и т. д.), отличающиеся от ртути дихлорида меньшей токсичностью и менее выраженным раздражающим действием на кожу, применяются в качестве антисептических средств для лечения гнойно-воспалительных поражений кожи и слизистых оболочек при конъюнктивитах, кератитах, блефаритах и т. п.
Серебра нитрат (ляпис) наряду с противомикробными свойствами обладает в малых концентрациях (до 2%) вяжущим, а в больших (5% и более) прижигающим действием.
Применяется для лечения кожных язв, эрозий, а также при поражениях слизистых оболочек глаза (трахома, конъюнктивит) и гортани (ларингит). В акушерской практике серебра нитрат применяют для профилактики бленнореи у новорожденных.
В качестве прижигающего средства серебра нитрат используют для прижигания избыточных грануляций и бородавок.
Протаргол — недиссоциирующее органическое соединение серебра, обладающее антисептическими, вяжущими и противовоспалительными свойствами. Прижигающего действия на ткани не оказывает.
Растворы протаргола применяют для промывания мочевого пузыря и уретры, лечения гнойных конъюнктивитов и бленнореи, а также для смазывания слизистых оболочек верхних дыхательных путей при их воспалительных поражениях.
В качестве заменителя протаргола в практике часто используется колларгол, также являющийся недиссоциирующим соединением серебра. По основным свойствам и применению колларгол соответствует протарголу.
Цинка сульфат как антисептическое и вяжущее средство применяется в виде растворов главным образом при воспалительных поражениях слизистых оболочек глаза (конъюнктивит), гортани (ларингит) и мочеиспускательного канала (уретрит).
Дерматол и ксероформ относятся к органическим соединениям висмута. По сравнению с соединениями других тяжелых металлов они обладают относительно слабыми антисептическими и вяжущими свойствами.
Дерматол и ксероформ применяют наружно в виде присыпок и мазей для лечения воспалительных заболеваний кожи и слизистых оболочек.
Особенно благоприятный эффект указанные препараты дают при мокнущих поражениях кожи (в частности, при экземе, дерматитах), так как наряду с противомикробным и вяжущим одни оказывают подсушивающее действие, которое объясняется их адсорбирующими свойствами.
Отравления солями тяжелых металлов. Соединения большинства тяжелых металлов, за исключением солей ртути, плохо всасываются через кожу, слизистые оболочки и из желудочно-кишечного тракта.
Поэтому с практической точки зрения наибольший интерес представляют отравления соединениями ртути.
Особенно высокой токсичностью отличаются легкодиссоциирующие неорганические соли ртути, например ртути дихлорид.
Острые отравления, возникающие после приема препаратов ртути внутрь, характеризуются симптомами, которые обусловлены: а) раздражающим и прижигающим действием соединений ртути на желудочно-кишечный тракт; б) резорбтивным действием ионов ртути; в) действием ртути на путях выделения
Раздражающее и прижигающее действие препаратов ртути на слизистые оболочки желудочно-кишечного тракта развивается вскоре после приема препаратов внутрь.
При этом появляются металлический вкус и чувство жжения во рту, боли в животе, тошнота и рвота (нередко с примесью крови), усиление слюноотделения.
В первые часы отравления в связи с резким раздражением желудочно-кишечного тракта и возникновением в нем острых болей возможно развитие шока.
Резорбтивное действие ионов ртути развивается уже в первые часы отравления и проявляется признаками токсического влияния ионов ртути на ЦНС (вначале возбуждение ЦНС, судороги, затем ее угнетение), нарушениями деятельности сердечно-сосудистой системы (сердечная слабость, падение артериального давления, слабый и частый пульс) и функции почек (вначале усиление, затем уменьшение мочеотделения).
Действие ионов ртути на путях выделения развивается на 2-3-й сутки от момента приема яда. Ионы ртути выделяются преимущественно слизистыми оболочками пищеварительного тракта и почками, в связи с чем у пострадавших развивается стоматит, язвенный колит и поражение почек.
Помощь при острых отравлениях препаратами ртути сводится к следующему. Вначале предпринимают меры к удалению и предупреждению всасывания яда из желудочно-кишечного тракта.
С этой целью пострадавшему дают внутрь молоко, яичный белок (для связывания ртути белком), осторожно промывают желудок водой с активированным углем.
Затем назначают внутрь активированный уголь и солевое слабительное (магния сульфат).
Для предупреждения и купирования резорбтивного действия ионов ртути рекомендуется как можно раньше начать парентеральное введение антидотов. В качестве антидотов при отравлении ртутью используют унитиол и натрия тиосульфат.
Принцип действия унитиола заключается в том, что этот антидот, являясь веществом, содержащим SH-группы (сульфгидрильные группы), связывает ионы ртути и тем самым предупреждает блокирование ртутью SH-групп белков и ферментов организма (рис.
28).
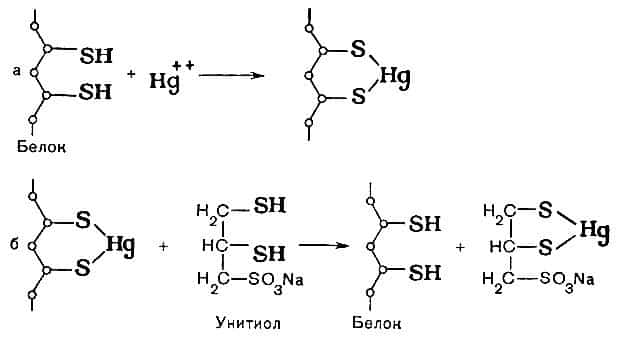 Рис. 28. Схема антитоксического действия унитиола при отравлениях солями тяжелых металлов. а — взаимодействие белка (фермента) с ионами ртути; б — защитное действие унитиола
Рис. 28. Схема антитоксического действия унитиола при отравлениях солями тяжелых металлов. а — взаимодействие белка (фермента) с ионами ртути; б — защитное действие унитиола
Действие натрия тиосульфата сводится к тому, что ионы ртути образуют с этим веществом неядовитые соли (сульфиты). Натрия тиосульфат при отравлениях препаратами ртути вводят внутривенно в виде 30% раствора по 5-10 мл. Наряду с указанными антидотами рекомендуется внутривенное введение растворов глюкозы.
Кроме того, при терапии отравлений препаратами ртути используют средства симптоматической терапии. Так, при сильных болях и шоке вводят анальгетики (морфин, промедол), при падении артериального давления — сосудосуживающие средства (эфедрин и др.) и т. д.
Отравления солями других тяжелых металлов (серебро, цинк, медь) проявляются теми же симптомами, что и отравления солями ртути.
Общие принципы помощи при отравлениях солями цинка и меди в основном аналогичны принципам терапии отравлений соединениями ртути.
Так как ионы серебра образуют с ионами хлора плохо растворимые соединения, при отравлениях солями серебра желудок промывают 1-2% раствором натрия хлорида, после чего в качестве слабительного назначают касторовое масло.
- Ионы серебра образуют с тиосульфатом натрия растворимые комплексы, в связи с чем тиосульфат натрия нельзя использовать в качестве антидота при отравлении солями серебра, так как в подобных случаях он почти неэффективен.
- Препараты
- Ртути дихлорид, Hydrargyri dichloridum — тяжелый белый порошок или белые кристаллы, растворимые в воде и спирте.
Применяют только наружно для дезинфекции в виде 0,1% (1:1000) или 0,2% (1:500) раствора. В связи с высокой токсичностью растворы препарата подкрашивают эозином в розовый цвет, чтобы отличать их от других применяемых растворов, а посуду, содержащую растворы, маркируют этикетками: «Яд», «Только для наружного применения», «Обращаться с осторожностью».
Формы выпуска: порошок; таблетки по 0,5 и 1 г, окрашенные эозином в розовый или красно-розовый цвет. Таблетки предназначены только для наружного Применения (для приготовления растворов).
Хранение: список А.
Серебра нитрат, Argenti nitras — бесцветные, прозрачные кристаллы в виде пластинок или белых кристаллических палочек. Легко растворим в воде. На свету темнеет. С галогенами (хлориды, йодиды, бромиды) выпадает в осадок.
Наружно в качестве антисептического и вяжущего средства применяют в виде 0,25-2% растворов и 1-2% мазей.
Как прижигающее средство используют в виде 5-10% растворов или per se в виде ляписных карандашей (Stillius Lapidis).
При хронических гастритах и язвенной болезни желудка серебра нитрат иногда назначают внутрь в виде 0,05-0,06% раствора по 1 столовой ложке 3 раза в день как вяжущее и противовоспалительное средство.
- Высшие дозы (для взрослых): внутрь — разовая 0,03 г, суточная 0,1 г.
- Хранение: список А; в защищенном от света месте.
- Протаргол, Protargolum — коричнево-желтый или коричневый порошок без запаха, слабогорького и слегка вяжущего вкуса, легко растворимый в воде.
- Применяют в виде растворов: для смазывания слизистых оболочек верхних дыхательных путей (1-5% раствор), промывания мочеиспускательного канала и мочевого пузыря (1-3% раствор) и в глазных каплях (1-3% раствор).
- Форма выпуска: порошок.
- Хранение: в защищенном от света месте.
Цинка сульфат, Zinci sulfas — бесцветные, прозрачные кристаллы или мелкокристаллический порошок вяжущего вкуса. Легко растворим в воде.
- Применяют наружно в виде 0,1-0,5% раствора (глазные капли, спринцевания).
- Формы выпуска: порошок; глазные капли (0,25% или 0,5% раствор цинка сульфата и борной кислоты 2%); тюбики-капельницы по 1,5 мл.
- Хранение: список Б.
Дерматол, Dermatolum — см. главу 1, 2 (препараты).
Ксероформ, Xeroformium — см. главу 1, 2 (препараты).
Примеры рецептов
Rp.: Solutionis Hydrargyri dichloridi 1:1000-1000 ml
D.S. Для дезинфекции.
Rp.: Solutionis Argenti nitratis 10% — 10 ml
D. in vitro nigro
S. Для прижигания грануляций.
Rp.: Dermatoli 0,2
Olei Cacao q.s.
ut f. suppositorium rectale
D.t.d.N. 10
S. По 1 свече 2 раза в день.
Rp.: Dermatoli 10,0
Zinci oxydi
Talci āā 25,0
M.f. pulvis
D.S. Присыпка.
девочки москвы
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- Растворы солей тяжелых металлов также сильно поглощают рентгеновские лучи. [2]
- Растворы солей тяжелых металлов, как, например, сульфата меди, сульфата цинка, ацетата свинца, хлорного железа, хлорной ртути и нитрата серебра, вызывают в водном растворе протаргола образование осадков. [3]
| Термограмма разложения СеНз. [4] |
- �з растворов солей тяжелых металлов гидрид церия осаждает металл; с азотнокислыми и хлорнокислыми солями дает взрывчатые смеси. [5]
- Взаимодействует с растворами солей тяжелых металлов. [6]
- Жирнокислотные сиккативы представляют собой раствор солей тяжелых металлов различных жирных кислот и их смесей с нафтеновыми кислотами в органических растворителях. [7]
Процесс приготовления ионитов несложен: сливают растворы соли тяжелого металла и ферроцианида щелочного металла ( или ферроциановодсродной кислоты), осадок отфильтровывают, промывают, высушивают, измельчают и отсеивают нужную фракцию. Если катионит получают в водородной форме, материал дополнительно обрабатывают ( для увеличения ионообменной емкости) минеральной кислотой. [8]
Описанный способ вычислений пригоден и для нахождения рН растворов солей тяжелых металлов, гидратированные катионы которых имеют характер слабых кислот. [9]
Оно заключается в том, что срез образца обрабатывают растворами солей тяжелых металлов; соли подбирают таким образом, чтобы они не присоединялись к исследуемым элементам структуры, а создавали темный фон. На этом фоне располагаются более светлые частицы исследуемого объекта, что позволяет четче выявить структурные особенности. Метод негативного контрастирования применяют для изучения синтетических полимеров и биополимеров. [10]
H SO4, HCI, NH4OH; 9) 5 % — ные растворы солей тяжелых металлов: PbNO3, HgNO3, FeCI3, ZnSO4, CuSO4, CoSO4, 10) средне — Рё слабоокрашенные лепестки цветков, содержащих ан-тоцианы или РёС… предшественники: РїРёРѕРЅР°, мака, СЂРѕР·С‹, герани ( можно высушенные); 11) цветущие комнатные растения СЃРѕ средне-или слабоокрашенными цветками, содержащими антоцианы или РёС… предшественники; 12) кусочки лука Рё капусты фиолетовых сортов. [11]
Резинаты представляют СЃРѕР±РѕР№ различные соли смоляных кислот, получаемые обменным разложением щелочных солей СЃРјРѕ — — ляных кислот СЃ растворами солей тяжелых металлов либо нагреванием окислов тяжелых металлов СЃРѕ смоляными кислотами, либо сплавлением окислов металлов ( кальция, цинка, свинца, кобальта, марганца Рё РґСЂ.) СЃ канифолью. [12]
В перспективе этот способ предполагается использовать для эксплуатации глубоких и сверхглубоких скважин, применяя в качестве утяжелителя не растворимые в нефти растворы солей тяжелых металлов или тяжелые суспензии. [13]
Резинаты представляют СЃРѕР±РѕР№ различные соли смоляных РєРёСЃ — — лот, получаемые обменным разложением щелочных солей СЃРјРѕ — — ляньч кислот СЃ растворами солей тяжелых металлов либо нагреванием окислов тяжелых металлов СЃРѕ смоляными кислота — — РјРё, либо сплавлением окислов металлов ( кальция, цинка, свинца, кобальта, марганца Рё РґСЂ.) СЃ канифолью. [14]
Мы здесь рассмотрим свойства только наиболее употребительных индикаторов и оставим в стороне такие редко применяемые в объемном анализе индикаторы, как аммиачный раствор меди, который обесцвечивается кислотой, или раствор соли тяжелого металла, выделяющий осадок при добавлении избытка щелочи. [15]
Страницы: 1 2
ПОИСК
Активный ил богат азотом, фосфором, микроэлементами (медь, молибден, цинк). После термической обработки его можно использовать как удобрение. Но необходимо учитывать и возможные отрицательные последствия его применения в связи с наличием солей тяжелых металлов и т. п.
Извлечение ионов тяжелых металлов и других вредных веществ из сточных вод гарантирует получение безвредной биомассы, которую можно использовать в качестве кормовой добавки или удобрения. В случае образования больших объемов осадков сточных вод, содержащих соли тяжелых металлов, целесообразно сжигание осадков.
В ФРГ предложен способ получения заменителей нефти и каменного угля на основе активного ила. Подсчитано, что количество тепла, получаемое при сжигании 350 тыс. т активного ила, эквивалентно его количеству, получаемому при сжигании 350 тыс. баррелей нефти и 175 тыс. т угля.
Ведутся поиски и других путей утилизации осадков и активного ила, образующихся при очистке сточных вод. [c.110] Перекись водорода смешивается в любых отношениях с водой, этиловым и метиловым спиртами.
Одним из недостатков концентрированной перекиси водорода является высокая (—0,89° С), температура замерзания, что затрудняет ее эксплуатацию в зимних условиях. Маловодная перекись водорода термически нестабильна и очень чувствительна к различного рода загрязнениям.
Попадание в перекись различных примесей (пыли, ржавчины, солей тяжелых металлов и др.) приводит к резкому увеличению скорости разложения перекиси водорода и ее сильному разогреву. Лучшей гарантией стабильности перекиси водорода является обеспечение ее чистоты как при производстве, так и в процессе хранения, транспортировки и перекачек.
[c.126]
В щелочной среде кислород воздуха вызывает постепенное превращение меркаптанов в соответствующие дисульфиды [6,7,13,15]. С солями тяжелых металлов меркаптаны количественно реагируют с образованием меркаптидов. На этом основана методика анализа меркаптанов в жидких углеводородах методом потенциометрического титрования аммиакатом серебра [7. [c.9]
Наиболее простым окислителем является кислород воздуха. Отверждение легко протекает в присутствии щелочных активаторов, например дифенилгуанидина или солей тяжелых металлов.
Широкое применение в качестве вулканизующих агентов нашли двуокиси свинца, марганца и теллура. Для обеспечения полноты вулканизации обычно применяют избыток отвердителя [10, с. 477].
Все неорганические окислители требуют присутствия следов влаги для инициирования этого процесса. [c.562]
Слишком сильные изменения окружающей среды, однако, могут привести к потере белком его свойств из-за чрезмерного изменения формы молекулы. Тепло, спирт или другие растворители, соли тяжелых металлов или изменение кислотности могут изменить форму белка из-за разрушения связей между цепями (рис. VII.11). В некоторых случаях изменения, называемые дена- [c.455]
Вещества, снижающие активность катализатора вследствие его отравления , называют каталитическими (контактными) ядами. Незначительное количество контактного яда может сильно замедлить или полностью подавить действие катализатора.
Для никелевых и платиновых каталпзаторов ядами служат сероводород, соединения мышьяка, окись углерода, галогены для алюмосиликатных — вода и водяной пар, сернистые и азотистые соединения, мышьяк и соли тяжелых металлов, содержащиеся в крекируемом сырье и в применяемых реагентах.
Действие каталитических ядов заключается в химической адсорбции их на поверхности катализатора, особенно на его активных центрах они как бы. обволакивают катализатор, затрудняя доступ молекул реагирующих веществ к его поверхности. [c.18]
Окисление парафина воздухом при повышенных температурах значительно ускоряется в присутствии катализаторов [58, 59]. В качестве катализаторов применяют соли тяжелых металлов высших жирных кислот, а также высокомолекулярные спирты и кетоны, выделенные из продуктов окисления парафина. В этом случае окисление идет более глубоко, и в качестве основных продуктов реакции образуются карбоновые кислоты и нейтральные карбонильные соединения. [c.60]
Соли тяжелых металлов. Катализаторы, как синтетические, так и природные, существенно изменяют избирательность при переработке сырья с высоким содержанием тяжелых металлов, главным образом никеля, меди и ванадия.
Эти металлы, отлагаясь на поверхности катализатора, превращаются в каталитически активные окислы и ведут себя как катализаторы дегидрирования увеличивается выход кокса и малополезных газов, снижается выход бензина и легкого крекинг-газойля.
Снижение активности является результатом спекания катализатора вследствие огромного выделения тепла в зоне вокруг адсорбированного металла во время регенерации и уменьшения удельной поверхности по мере закрытия пор. [c.21]
Для всех природных асфальтов характерна способность переходить в раствор при обработке некоторыми органическими растворителями и образовать по удалении его черные хрупкие вещества различной (до 2) твердости.» Хорошая растворимость в одних веществах и весьма ограниченная в других не раз являлась базисом неточных аналитических приемов.
Асфальты плавятся при различных температурах Б зависимости от содержания маслообразных примесей. Выше других (около 80°) плавятся естественные и много ниже дешевые искусственные продукты. При перегонке они образуют непредельные дестиллаты, дающие разнообразные красочные реакции и осадки с Солями тяжелых металлов. [c.
355]
Большое влияние на процесс алкилирования оказывают примеси, имеющиеся в сырье. Обычно в применяемых промышленных бутан-бутиленовых фракциях присутствуют диолефины (0,2—1,5%). Опыт работы промышленных установок алкилирования показал, что при таком сырье дополнительно расходуется кислоты 20 г/г диолефина [106].
Для снижения расхода кислоты необходима очистка сырья от диолефинов. Известно много методов их выделения [129] химические, основанные на способности диолефинов образовывать комплексы с солями тяжелых металлов (Си, Ag и др.
), физико-химические (избирательная адсорбция и экстракция растворителями —диметилформамидом, N-метилпирролидоном, азеотропная и экстрактивная перегонка и др.). [c.150]
В растворе углеводородов соли тяжелых металлов находятся в недиссоциированной форме. В отсутствие полярных молекул молекулы солей ассоциируются в мицеллы [29]. Средний размер мицелл тем больше, чем выше концентрация соли в растворе.
Например, степень ассоциации стеариновокислой меди в толуоле при комнатной температуре 6,4 при ее концентрации ОД г/кг раствора и 7,1 при концентрации 0,26 г/кг. Мицеллы образуются из-за диполь-дипольного притяжения частиц, и чем выше дипольный момент соли, тем выше степень ассоциации [29].
В результате образования полярных продуктов в окисляющемся углеводороде степень ассоциации молекул соли снижается, поскольку появляются комплексы типа соль — продукт.
Вместе с тем эти продукты конкурируют с ROOH как лигандом в координационной сфере металла, поэтому при накоплении продуктов окисления скорость каталитического распада ROOH на радикалы снижается. [c.193]
Реагирует с растворами солей тяжелых металлов с образованием труднорастворимых солей — сульфидов-, горит на воздухе голубоватым пламенем [c.161]
Полученный ацетальдегид окисляется в уксусную кислоту в жидкой фазе кислородом в присутствии солей тяжелых металлов (Мп, Со, Ре, V и др.) [c.323]
Как известно, при действии щелочей на соли тяжелых металлов в водном растворе выпадают осадки нерастворимых гидроксидов например [c.237]
Окисление о-ксилола проводится кислородом воздуха в каскаде реакторов в присутствии органической кислоты и соли тяжелого металла, напри.мер ацетата кобальта. [c.182]
В г. Барнауле внедрен электрокоагулятор для очистки сточных вод, содержащих взвешенные частицы, нефтепродукты и незначительные примеси солей тяжелых металлов.
Очистные сооружения состоят из электрокоагулятора, горизонтального отстойника, скребковой тележки. Производительность 250 м /ч, напряжение на электродах 12 В, удельный расход электроэнергии 0,78 кВт ч/м , время отстаивания 1 ч.
Условно-экономический эффект 209 тыс. рублей. [c.66]
Действие на диазосоединение солей тяжелых металлов также ведет к выделению азота и, кроме того, к осаждению тяжелого металла. Природа других продуктов этой реакции не установлена. [c.181]
Присоединение идет более полно и легко в присутствии солей тяжелых металлов железо, висмут), нанесенных на пемзу или асбест. [c.144]
Извлечение меркаптанов окислами и солями тяжелых металлов [c.112]
В зависимости от того, какие продукты хотят получать. Окисление ведут воздухом в периодически действующих реакторах из нержавеющей стали при 100—180° и 10—20 ama.
В качестве катализаторов, инициирующих реакцию окисления, применяют соли тяжелых металлов и высших кислот, а также спирты и кетоны высокого молекулярного веса, полученные в результате предыдущей операции.
При этих условиях кислород воздуха полностью вступает в реакцию. [c.74]
Нормальные жирные кислоты с длинной цепью получают из сырья нефтяного происхождения, а именно из твердого парафина окислением воздухом (гл. 4, стр. 74).
Такие кислоты можно использовать для производства высших жирных спиртов нормального строения при этом либо каталитически гидрируют сложные эфиры, либо соли тяжелых металлов этих кислот подвергают действию водорода при высоких температуре и давлении [19].
Этерификацией синтетических высших кислот с глицерином, полученным из пропилена (гл. 10, стр. 179), можно изготовить жир полностью искусственного происхождения. В Германии, исходя из синтетических Си—С12-кислот, производили этим способом синтетическое масло.
Последнее в некоторых отношениях имеет преимущество перед натуральным маслом, например синтетическое масло рекомендуют в пищу диабетикам [20]. [c.341]
КИСЛОТНОСТЬ среды или присутствие солей тяжелых металлов, которые образуют нерастворимые осадки с моющими средствами обычного типа. [c.362]
Особенно чувствительным становится ускоряющее действие поверхности на разложение перекиси водорода тогда, когда стенки сосудов, в которых она хранится, являются шероховатыми. Например, 38%-ная Н2О2 может быть нагрета в полированной платиновой чашке до 60 °С, тогда как в исцарапанной разложение уже наступает при обычной температуре.
Ускоряющее влияние твердой ловерхности на разложение перекиси возрастает при прибавлении солей тяжелых металлов, например сульфатов марганца или меди. Особенно активными являются азотнокислое серебро, сернокислая медь и уксуснокислый свинец. Уголь также действует разлагающе на перекись водорода.
Прп этом каталитическая актив-юность его зависит от пористости п величины его поверхности. [c.122]
Керосиновые кислоты при обыкновенном давлении и при температуре 360° С почти полностью пёрегонДются. Отделенные от фенолов и смолистых веществ и перегнаннрхе нафтеновые кислоты представляют собой слегка желтоватые я идкости с неприятным запахом.
Очищенные таким образом йизщие нафтеновые кислоты дают щелочные и щелочноземельные соли.
Соли щелочных металлов и серебряные хорошо растворимы в вОДе, щелочноземельные — плохо соли тяжелых металлов в воде не растворимы, но растворяются в углеводородах соли щелочных металлов растворимы в спирте и обладают моющей способностью. [c.96]
Эта реакция может быть объясняет, почему для докторского раствора нужно меньше серы, чем этого треброт уро внеиия (10) и (П).. но да ке временное образование перекиси водорода в присутствии соли тяжелого металла неправдоподобно. Конечно проще выглядит вся сумма последних реакций в присутствии таких окислителей как гипохлориты. [c.184]
Продажные сульфокислоты имеют вид густой, почти черной, вязкой жидкости или почти твердого вещества. Они легко омеши-ваются с водой во всех пропорциях, но из растворов выделяюггся обратно минеральными кислотами (крепкими).
Щелочные соли сульфокислот в воде растворимы и способны высаливаться щелочами или концентрированными растворами солей. Щелочноземельные соли и соли тяжелых металлов мало растворимы в воде, но растворимы в некоторых органических веществах.
[c.325]
Селективность стеклянных мембран может быть повышена изменением pH раствора или добавлением в раствор солей тяжелых металлов [87]. Так, при увеличении pH от 6 до 10 селективность мембраны по 0,03 М раствору МаС1 увеличилась от 10 до 35%. Добавка 0,051 М раствора ТЬСи в 0,03 М раствор КаС1 повысила селективность пористой стеклянной пластины с 6 до 63%. [c.74]
Однако некоторые экспериментальные данные прямо свидетельствуют об отсутствии в нефтях сколько-нибудь заметных количеств солей тяжелых металлов, в частности ванадия и никеля.
Так обработка нефтей кислотами и щелочами в условиях, полностью гарантирующая разложение солей органических кислот, как правило, не приводит к изменению содержания ванадия и никеля [830, 890].
Однако описаны и случаи необычно легкой гид-ролизуемости ванадийсодержащих нефтяных соединений [891], что авторы прямо связывают с солевой формой нахождения ванадия. [c.163]
Металлорганические катализаторы общей формулы МК (К — алкильная группа) применяют обычно в комплексе с солями тяжелых металлов, например Т1С1з и ИСЬ. [c.28]
В отсутствие кислородя и солей тяжелых металлов п растворах кислоты золото, платина, палладий обладают высокой коррозионной стойкостью. [c.842]
Окисление жидких углеводородов воздухом. В промышленности органического синтеза широко применяют жидкофазное окисление углеводородов воздухом, которое катализируется растворенными солями тяжелых металлов.
Эти процессы часто проводятся под давлением в несколько десятков атмосфер.
В определенных условиях возникает опасность обраговапия взрывчатых воздушных смесей, однако при соответствующем выборе регламента на всем протяжении технологического цикла газовая фаза может оставаться невзрывчатой. [c.70]
Сероводород может быть осажден в виде сернистого кадмия в кислой среде. Тиосульфат натрия (гипосульфит) разрушается в кислой среде. Выпадающая при этом сера должна бьсть отфильтрована. Меркаптаны могут быть осаждены солями тяжелых металлов, в частности меди. [c.796]
Некоторые соли тяжелых металлов нафтеновых кислот, в частности нафтенаты меди, растворимы в неполярных растворителях и поэтому могут применяться в виде растворов. Качественная реакция Харичкова на нафтеновые кислоты [20] основана на свойстве нафтенатов меди при растворении в петролейном эфире давать зеленое окрашивание.
Нафтенаты тяжелых металлов способны растворяться в нашатырном спирте в виде комплексных аммиачных солей. Этим свойством пользуются, чтобы высадить в виде пленки нерастворимые нафтенаты путем нейтрализации или упаривания их аммиачных растворов. Особенно большое и важное применение получили нафтенаты алюминия.
Раствор их в скипидаре используется в качестве лака для покрытия поверхности дерева и металлов. Способность нафтената алюминия диспергировать в углеводородах обеспечила ему успешное применение в качестве наполнителя резины, а затем и в качестве одного из компонентов рецептур напалма (вязких зажигающих композиций) [21].
[c.313]
В растворах окислительных солей тяжелых металлов, например, РеС1з и Реа(504)з. [c.330]
Тиофаны представляют собой жидкости с неприятным запахом, они довольно устойчивы при перегонке и не обладают корродирующим действием на металлы. Тиофаны впервые открыты были Мебери и Кайлем в 1905 г. в канадской нефти нри разложении водой кислого гудрона, в котором тиофаны находились в растворе.
Низшие представители, подобно ациклическим сульфидам, дают комплексные соединения с солями тяжелых металлов. Тиофаны, выделенные Мебери, обладают несколько отличными физическими свойствами по сравнению с синтетическими веществами и вероятно не являются индивидуальными веществами.
Затем были выделены из разных нефтей низшие тиофаны, в структуре которых не может быть сомнений (табл. 67). [c.175]
Установлено, что образование оксикислот растет с глубиной окисления, поэтому в настоящее время окисление углеводородов проводят лишь на 20—30%, в результате чего образуются почти исключительно жирные карбоновые кислоты.
По одному из многочисленных методов рекомендуется проводить окисление воздухом при 100° в течение 24 час. в присутствии солей тяжелых металлов, что дает смесь из 30% жирных карбоновых кислот и 70% неокислен-ных углеводородов.
Повышение температуры выше 100° нежелательно, так как в этом случае полученный продукт представляет смесь жидких и твердых карбоновых кислот с оксикислотами и их производными—лактидами, лактонами и эстолидами.
Эту смесь необходимо обрабатывать едким натром и содой при 300—400° под давлением в результате конверсии оксикислот и их производных повышается выход монокарбоновых кислот. [c.219]
Пропаргиловый спирт кипит при 14—115 будучи производным ацетилена, он обра.зует труднорастворимые соли тяжелых металлов, из которых характерны. и являются белая взрывчатая чувствительная к действию света серебряная соль и желтая соль одновалентной меди. [c.144]






