- Простые вещества — неметаллы. Аллотропия
- Явление аллотропии для неметаллов более характерно, чем для металлов
- Презентация на тему: Неметаллы. Аллотропия
- Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии 343 Невского района Санкт — Петербурга. — презентация
- Урок химии по теме "Неметаллы. Общая характеристика неметаллов". 9-й класс
- Ход работы:
- I. Организационный момент
- II. Актуализация знаний.
- III. Изучение
- IV. Закрепление изученного. Рефлексия
- V. Читаем по учебнику состав воздуха стр. 74
- VI. Решаем упражнения 1–4 стр.75
- VII. Оценки и домашнее задание
Главная › 8 класс › Химия › Рабочая тетрадь по химии Габриелян Сладков 8 класс › ГДЗ Рабочая тетрадь по химии Габриелян Сладков 8 класс
Часть I
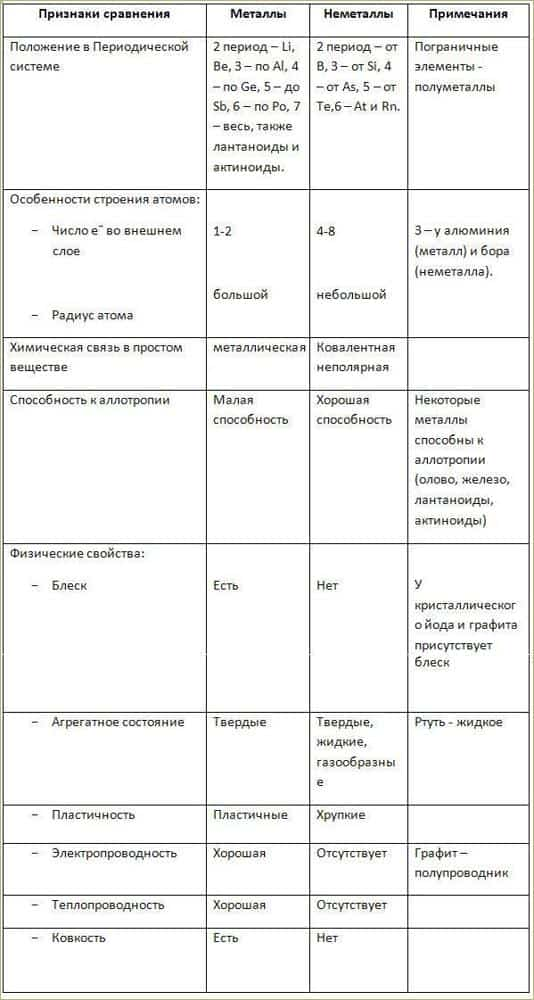
1. Неметаллы (НМ) располагаются в III-VII группах.Только из НМ состоит группа галогенов. По физическим свойствам к НМ следует отнести также VIIIА группу, или группу благородных газов.
2. У атомов неметаллов 4 и более электрона во внешнем слое, небольшой радиус атома, например С, у атома которого 4 внешних е. Поэтому атомы НМ стремятся довести недостающие до 8е. Это свойство атомов характеризуется электроотрицательностью. В соответствии с ним НМ образуют особый ряд:
3. Молекулы простых веществ НМ образованы за счёт ковалентной неполярной связи. Двухатомные молекулы имеют, например, следующие простые вещества: О₂, Сl₂, N₂, галогены; трехатомная молекула О₃ — у озона.
4. Аллотропия для неметаллов более характерна, чем для металлов. Заполните таблицу «Аллотропные модификации неметаллов» . Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.

5. Заполните таблицу «Сравнение свойств металлов и неметаллов».
Часть II
1. Выберите названия простых веществ — неметаллов. Из букв, соответствующих правильным ответам, вы составите название неметалла, которое в переводе с греческого означает «гибель, разрушение»: фтор.1) бром Ф2) магний Т 6) неон О
 йод Р
йод Р
2. Распределите вещества Na, Br2, Ne, I2, Li, Не, Сl2 на три группы. Вычислите и запишите относительные молекулярные массы галогенов.

3. Неверны следующие утверждения, характеризующие неметаллы:2) при обычных условиях фтор, хлор и бром — газы.
4) атомы этих элементов стремятся отдать электроны с внешнего энергетического слоя.
4. Установите соответствие между названием вещества и его свойствами.

А – 1,3,6Б – 2,4,5
5. Заполните таблицу «Неметаллы». Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.


6. Расположите следующие простые вещества — неметаллы в порядке возрастания их плотности.6) кремний 7) красный фосфор1) йод 2) бром4) хлор3) азот
5) водород
7. Расположите следующие простые вещества — неметаллы в порядке возрастания интенсивности их окраски.6) йод4) бром1) хлор3) озон2) кислород
5) азот
Сохраните или поделитесь с одноклассниками:
Простые вещества — неметаллы. Аллотропия
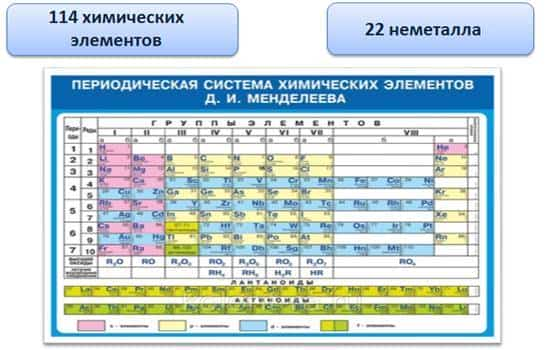
Из 114 химических элементов 22 элемента являются неметаллами. Они располагаются в правом верхнем углу от линии от бора к астату.
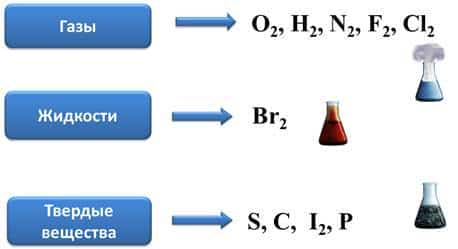
Неметаллы, в отличие от металлов, могут быть газами, жидкостями и твёрдыми веществами.
Газами являются элементы VIIIA группы. Их ещё называют благородными, или инертными газами. Их молекулы одноатомны. Благородные газы не вступают в реакции друг с другом и другими соединениями. Однако сейчас известно более 150 соединений с инертными газами.
Благородные газы широко используются человеком: гелий используется для заполнения аэростатов и дирижаблей, потому что он легкий и негорючий; неон используют для изготовления световой рекламы.
Газами ещё являются такие вещества, как N2, O2, H2, N2, F2, Cl2.
Единственная жидкость среди неметаллов – это бром (Br2). Это тяжелая бурая жидкость с неприятным запахом.
В твёрдом состоянии находятся сера, углерод, йод, фосфор.
Многие молекулы неметаллов состоят из двух атомов, поэтому в их химической формуле пишется индекс два. К таким молекулам относятся: H2, N2, O2, F2, Cl2, Br2, I2.
Их относительная молекулярная масса равна произведению относительной атомной массы на число атомов в молекуле.
Например, для того, чтобы найти относительную молекулярную массу брома, мы его относительную атомную массу умножаем на два и получаем результат – 160.
Mr(Br2) = Ar(Br) · 2 = 80 · 2 = 160
Кислород существует не только в виде молекулы О2, но и в виде молекулы О3. Посмотрите, атом один и тот же, а простые веществ различны. Т.е. способность атомов данного химического соединения образовывать несколько простых веществ называют аллотропией. А сами простые вещества – аллотропные видоизменения или модификации.
Сравнение свойств кислорода и озона
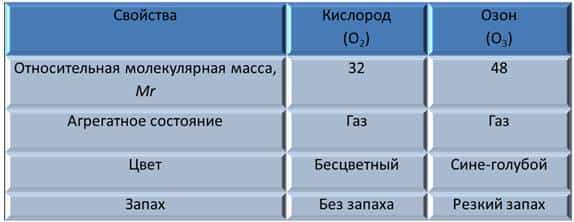
Из таблицы видно, что у кислорода и озона различные относительные молекулярные массы, т.к. число атомов различно, оба находятся в газообразном состоянии, однако кислород не имеет цвета, а озон имеет сине-голубую окраску, кислород не имеет запаха, а озон имеет резкий запах. Из этого, можно сделать вывод, что аллотропные модификации отличаются по своим свойствам.
Аллотропные модификации имеет и углерод. Сравним две его аллотропные модификации – это графит и алмаз. Различие в их свойствах связано с кристаллической решёткой этих соединений.
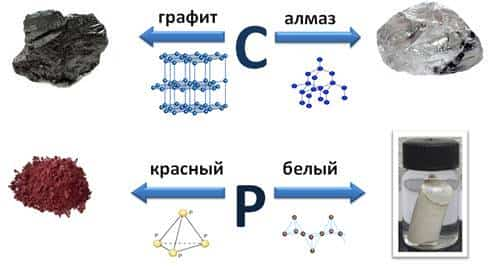
Фосфор тоже имеет аллотропные модификации – красный и белый фосфор. В составе белого фосфора 4 атома, поэтому его молекулярную формулу можно записать, как Р4.
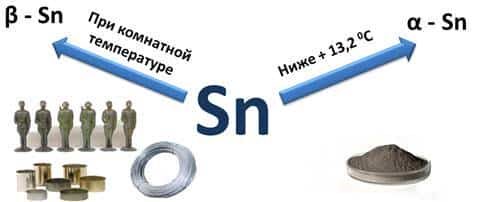
Все неметаллы, за исключением йода и графита не имеют металлического блеска, однако деление элементов на металлы и неметаллы является относительным. Сравним, например, аллотропию олова (Sn). При комнатной температуре существует бета-олово (β-Sn).
Из этого белого олова – металла изготавливали оловянных солдатиков, изнутри покрывали консервные банки, это олово входит в состав припоя и других сплавов. Но при температуре ниже +13,2 0С более устойчиво альфа-олово (α-Sn). Оно напоминает неметалл, т.к. представляет собой серый мелкокристаллический порошок.
Белое олово может превратиться в серое при температуре – 33 0С, это явление получило название «оловянная чума».
Явление аллотропии для неметаллов более характерно, чем для металлов
Аллотропия является причиной того, что неметаллических простых веществ намного больше, чем самих неметаллических химических элементов.
Например, химический элемент кислород O образует простое вещество кислород O2, молекула которого состоит из двух атомов, и простое вещество озон O3, молекула которого состоит из трёх атомов данного элемента. Эти простые вещества, имеющие одинаковый качественный состав, но различающиеся по числу атомов в молекуле, имеют различные свойства.
Так, кислород запаха не имеет, в то время как озон обладает резким запахом, который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый).
Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой.
Химический элемент фосфор P образует множество аллотропных видоизменений, важнейшими из которых являются красный фосфор и белый фосфор.
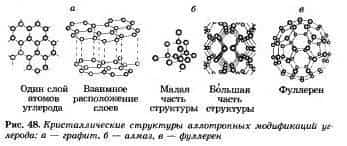
Аллотропными модификациями элемента углерода являются графит, алмаз, карбин, фуллерен (рис. 48).
Аллотропия присуща не всем неметаллических химическим элементам. Например, водород, азот, элементы VIIA и VIIIA групп не имеют аллотропных модификаций, т.е. каждый из упомянутых элементов образует только одно простое вещество.
5. Физические свойства неметаллов − простых веществ.
Свойства неметаллических простых веществ отличаются большим разнообразием. Собственно говоря, большинство их объединяет только то, что они, как правило, не обладают теми физическими свойствами, которые типичны для металлов.
- Агрегатное состояние
- Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
- Кислород O2, озон O3, азот N2, водород H2, фтор F2, хлор Cl2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn) — это всё газообразные вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов как бы выполняющих роль молекул).
- При комнатной температуре бром – жидкость.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Твёрдыми являются все аллотропные модификации углерода C, кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2, мышьяк As, кремний Si, бор B, кристаллическая сера S8, йод I2 и др.
Модель молекулы серы (слева) и кристалл серы. Кристалл серы состоит из отдельных молекул S8.
Цвет и блеск
Если для подавляющего большинства металлов характерен серебристо-серый или серебристо-белый цвет, то окраска неметаллов очень разнообразна.
Белый цвет имеет белый фосфор, красный − красный фосфор, жёлтый − сера и фтор, красно-бурый − жидкий бром, жёлто-зелёный − хлор, фиолетовый цвет имеют пары иода, синий − жидкий кислород, серый − графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород. Причем в подгруппах сверху вниз окраска усиливается: фтор − светло-зеленый газ, хлор − желто-зеленый газ, бром − красно-бурая жидкость, йод − темно-фиолетовые кристаллы.
| Красный фосфор | Белый фосфор |
| Бром | Хлор |
| Йод | Алмаз |
Большинство неметаллов не обладают металлическим блеском и не отражают свет. Блеском, несколько напоминающий блеск металлов, обладают активированный уголь, кристаллический йод и кремний и графит (т.е. это говорит об относительности деления элементов и простых веществ на металлы и неметаллы не только элементов, но и простых веществ).
Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеет озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2.
Пластичность
Неметаллы в твёрдом агрегатном состоянии очень хрупкие, не обладают пластичностью и практически не присуще изгибание, ковкость и любые другие деформации − любая деформация вызывает разрушение ковалентных связей.
Презентация на тему: Неметаллы. Аллотропия
Описание слайда:
Неметаллы. Аллотропия Куцапкина Людмила Васильевнаучитель химии ГБОУ гимназии № 343Невского района Санкт- Петербурга
Описание слайда:
Положение неметаллов в ПС Д.И.Менделеева.Неметаллы расположены в правом верхнем углу ПС (вдоль и над диагональю B-At). Всего 22 элемента- неметалла в Периодической системеЭлементы-неметаллы располагаются только в главных подгруппах ПС.
Описание слайда:
Особенности атомного строения элементов-неметаллов.Для атомов-неметаллов характерно:Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов одного с ними периода).
Большее число электронов на внешнем уровне (4-8), исключения Н, Не, В.Происходит заполнение электронами только внешнего энергетического уровня.
Для элементов-неметаллов характерны высокие значения электроотрицательности.
Описание слайда:
Для неметаллов — простых веществ более характерно различие свойствах (физических и химических), чем их общность.
Разнообразие свойств неметаллов объясняется, тем, что неметаллы могут иметь два типа кристаллической решетки: молекулярную (все газы, белый фосфор, сера, йод) и атомную (бор, кристаллический кремний, алмаз, графит). Для сравнения – металлы имеют металлическую кристаллическую решетку.
Описание слайда:
Для неметаллов (простых веществ) характерны все 3 агрегатных состояния при обычных условиях (сравнить – все металлы, кроме ртути, в обычных условиях твердые вещества)Твердые вещества: различные модификации серы, йод кристаллический, графит, фосфор, уголь активированный, кристаллический или аморфный кремний, бор (единственное жидкое при обычных условиях простое вещество – это бром). Газообразные вещества – неметаллы – это О2, N2, H2, Cl2, F2.
Описание слайда:
Для неметаллов характерна разнообразная цветовая гамма: белый ,черный ,красный фосфор, красно-бурый бром, желтая сера, фиолетовый йод, черный графит, алмазы разного цвета, бесцветный – кислород, азот, водород (тогда как абсолютное большинство металлов имеют серебристо-белый цвет).
Температуры плавления: от 38000 С (графит) до -2100 С (азот). Для сравнения – металлы: от 33800 С (вольфрам) до -38,90 С (ртуть).Некоторые неметаллы электропроводны (графит, кремний), имеют металлический блеск (йод, графит, кремний).
По этим признакам напоминают металлы, но все они – хрупкие вещества.
Описание слайда:
Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ.Причины аллотропии:Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная).Разная структура кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая).Разный состав молекул аллотропных модификаций (О2 и О3).
Описание слайда:
Кислород- газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло-голубой, в твердом – синий. Озон- светло-синий газ, темно-голубая жидкость, в твердом состоянии темно-фиолетовый, имеет сильный запах, в 10 раз лучше, чем кислород, растворим в воде.
Описание слайда:
Физические свойства: Сера- твердое кристаллическое вещество желтого цвета. В воде нерастворима, водой не смачивается (на поверхности воды плавает — «флотация»), t°кип = 445°С
Описание слайда:
Ромбическая (a — сера) — S8t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация. Моноклинная (b — сера) — S8темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3.
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую. Пластическая Snкоричневая резиноподобная (аморфная) масса.
Неустойчива, при затвердевании превращается в ромбическую.
Описание слайда:
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор.
Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма.
Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Описание слайда:
Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2.
В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг.
При недостатке фосфора в организме развиваются различные заболевания костей.
Описание слайда:
Белый, красный, чёрный и металлический фосфор
Описание слайда:
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4.Химически белый фосфор чрезвычайно активен, медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение) ; ядовит.
Открыт гамбургским алхимиком Хеннигом Брандом в 1669 году
Описание слайда:
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. Имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск.
Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Ядовитость его в тысячи раз меньше, чем у белого. Получен в 1847 году в Швеции австрийским химиком А.
Шрёттером
Описание слайда:
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях.Проводит электрический ток и имеет свойства полупроводника. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом
Описание слайда:
При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·1011 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Описание слайда:
В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне редко фуллерены. В лабораториях также были синтезированы многие другие модификации: новые фуллерены, нанотрубки, наночастицы и др.
Описание слайда:
Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при этом довольно хрупок. Он настолько тверд, что оставляет царапины на большинстве материалов.
Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из графита при p > 50 тыс. атм.
и tо = 1200оC В алмазе каждый 4-х валентный атом углерода связан с другим атомом углерода ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико.
Описание слайда:
Куллинан (алмаз)- 621,35 грамма, размеры: 100х65х50 мм Бриллианты: Куллинан-1, Куллинан-2, Куллинан-3 и 4
Описание слайда:
Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск, кажется жирным на ощупь, очень мягок и оставляет черные следы на бумаге. Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников.
Каждый атом углерода на плоскости окружен тремя соседними, расположенными вокруг него в виде правильного треугольника. Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей.
В пределах шестиугольников возникает склонность к металлизации, что объясняет хорошую тепло- и электропроводность графита, а также его металлический блеск.
Описание слайда:
Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно, от 32 и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти- и шестиугольников.
Третья форма чистого углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода, представляющая собой замкнутую поверхность, которая имеет форму сферы.
В фуллерене плоская сетка шестиугольников (графитовая сетка) свернута и сшита в замкнутую сферу. При этом часть шестиугольников преобразуется в пятиугольники. Образуется структура – усеченный икосаэдр. Каждая вершина этой фигуры имеет трех ближайших соседей.
Каждый шестиугольник граничит с тремя шестиугольниками и тремя пятиугольниками, а каждый пятиугольник граничит только с шестиугольниками.
Описание слайда:
Фуллерены могут найти применение в качестве присадок для ракетных топлив, смазочного материала, для создания фотоприемников и оптоэлектронных устройств, катализаторов роста, алмазных и алмазоподобных пленок, сверхпроводящих материалов, а также в качестве красителей для копировальных машин. Фуллерены применяются для синтеза металлов и сплавов с новыми свойствами.
Описание слайда:
Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света. Кристаллическая форма карбина состоит из параллельно ориентированных цепочек углеродных атомов с sp-гибридизацией валентных электронов в виде прямолинейных макромолекул полиинового ( -С= С-С= С-… ) или кумуленового (=С=С=С=…) типов.
Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии 343 Невского района Санкт — Петербурга. — презентация
1 Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии 343 Невского района Санкт — Петербурга
2 Положение неметаллов в ПС Д. И. Менделеева. Неметаллы расположены в правом верхнем углу ПС ( вдоль и над диагональю B-At). Всего 22 элемента — неметалла в Периодической системе Элементы — неметаллы располагаются только в главных подгруппах ПС.
3 Особенности атомного строения элементов — неметаллов. Для атомов — неметаллов характерно : 1. Небольшой атомный радиус ( в сравнении с радиусами атомов — металлов одного с ними периода ). 2.
Большее число электронов на внешнем уровне (4-8), исключения Н, Не, В. 3. Происходит заполнение электронами только внешнего энергетического уровня. 4.
Для элементов — неметаллов характерны высокие значения электроотрицательности.
4 Характеристика простых веществ — неметаллов. Для неметаллов — простых веществ более характерно различие свойствах ( физических и химических ), чем их общность.
Разнообразие свойств неметаллов объясняется, тем, что неметаллы могут иметь два типа кристаллической решетки : молекулярную ( все газы, белый фосфор, сера, йод ) и атомную ( бор, кристаллический кремний, алмаз, графит ).
Для сравнения – металлы имеют металлическую кристаллическую решетку.
5 Физические свойства простых веществ – неметаллов.
Для неметаллов ( простых веществ ) характерны все 3 агрегатных состояния при обычных условиях ( сравнить – все металлы, кроме ртути, в обычных условиях твердые вещества ) Твердые вещества : различные модификации серы, йод кристаллический, графит, фосфор, уголь активированный, кристаллический или аморфный кремний, бор ( единственное жидкое при обычных условиях простое вещество – это бром ). Газообразные вещества – неметаллы – это О 2, N 2, H 2, Cl 2, F 2.
6 Для неметаллов характерна разнообразная цветовая гамма : белый, черный, красный фосфор, красно — бурый бром, желтая сера, фиолетовый йод, черный графит, алмазы разного цвета, бесцветный – кислород, азот, водород ( тогда как абсолютное большинство металлов имеют серебристо — белый цвет ).
Температуры плавления : от С ( графит ) до С ( азот ). Для сравнения – металлы : от С ( вольфрам ) до -38,9 0 С ( ртуть ). Некоторые неметаллы электропроводны ( графит, кремний ), имеют металлический блеск ( йод, графит, кремний ). По этим признакам напоминают металлы, но все они – хрупкие вещества.
7 Аллотропия. Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ.
Причины аллотропии : Разные типы кристаллических решеток ( белый фосфор Р 4 – молекулярная, красный фосфор Р – атомная ).
Разная структура кристаллической решетки ( алмаз – тетраэдрическая, графит – слоистая ). Разный состав молекул аллотропных модификаций ( О 2 и О 3 ).
8 Кислород О 2 и озон О 3 Кислород — газ, без цвета, вкуса и запаха, плохо растворим в воде, в жидком состоянии светло — голубой, в твердом – синий. Озон — светло — синий газ, темно — голубая жидкость, в твердом состоянии темно — фиолетовый, имеет сильный запах, в 10 раз лучше, чем кислород, растворим в воде.
9 Сера Физические свойства : Сера — твердое кристаллическое вещество желтого цвета. желтого цвета В воде нерастворима, водой не смачивается ( на поверхности воды плавает — « флотация »), t° кип = 445° С
10 Ромбическая (a — сера ) — S 8 t° пл. = 113°C; ρ = 2,07 г / см 3. Наиболее устойчивая модификация. Моноклинная (b — сера ) — S 8 темно — желтые иглы, t° пл. = 119°C; ρ = 1,96 г / см 3.
Устойчивая при температуре более 96° С ; при обычных условиях превращается в ромбическую. Пластическая S n коричневая резиноподобная ( аморфная ) масса.
Неустойчива, при затвердевании превращается в ромбическую.
11 Фосфор Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций ; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества белый, красный, чёрный и металлический фосфор.
Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх.
В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений также металлическая форма.
Все модификации различаются по цвету, плотности и другим физическим характеристикам ; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств. аллотропии металлическая цвету плотности
12 Биологическая роль соединений фосфора Фосфор присутствует в живых клетках в виде орто — и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3 Са 3 ( РО 4 ) 3 ·Ca(OH) 2.
В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре мг.
При недостатке фосфора в организме развиваются различные заболевания костей.
13 Белый, красный, чёрный и металлический фосфор
14 Белый фосфор Белый фосфор представляет собой белое вещество ( из — за примесей может иметь желтоватый оттенок ). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
оттенок парафин Белый фосфор имеет молекулярное строение ; формула P 4. Химически белый фосфор чрезвычайно активен, медленно окисляется кислородом воздуха уже при комнатной температуре и светится ( бледно — зелёное свечение ) ; ядовит.
Открыт гамбургским алхимиком Хеннигом Брандом в 1669 году алхимиком Хеннигом Брандом1669 году
15 Красный фосфор Красный фосфор имеет формулу Р n и представляет собой полимер со сложной структурой. полимер Имеет оттенки от пурпурно — красного до фиолетового, а в литом состоянии — тёмно — фиолетовый с медным оттенком, имеет металлический блеск.
Химическая активность красного фосфора значительно ниже, чем у белого ; ему присуща исключительно малая растворимость. Ядовитость его в тысячи раз меньше, чем у белого. Получен в 1847 году в Швеции австрийским химиком А. Шрёттером1847 году А.
Шрёттером
16 Чёрный фосфор Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Проводит электрический ток и имеет свойства полупроводника. полупроводника Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом 1914 году П. У. Бриджменом
17 Металлический фосфор При 8,3·10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г / см ³, а при дальнейшем повышении давления до 1,25·10 11 Па ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г / см ³. Металлический фосфор очень хорошо проводит электрический ток.
18 Свободный углерод В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне редко фуллерены. В лабораториях также были синтезированы многие другие модификации : новые фуллерены, нанотрубки, наночастицы и др.
19 Алмаз Бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но при этом довольно хрупок. Он настолько тверд, что оставляет царапины на большинстве материалов.
Плотность алмаза – 3,5 г / см 3, t плав =3730 С, t кип =4830 оС. Алмаз можно получить из графита при p > 50 тыс. атм.
и t о = 1200 о C В алмазе каждый 4- х валентный атом углерода связан с другим атомом углерода ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико.
20 Куллинан ( алмаз )- 621,35 грамма, размеры : 100 х 65 х 50 мм Куллинан ( алмаз )- 621,35 грамма, размеры : 100 х 65 х 50 мм Бриллианты : Куллинан -1, Куллинан -2, Куллинан -3 и 4
21 Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо — черный цвет и металлический блеск, кажется жирным на ощупь, очень мягок и оставляет черные следы на бумаге. Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников.
Каждый атом углерода на плоскости окружен тремя соседними, расположенными вокруг него в виде правильного треугольника. Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей.
В пределах шестиугольников возникает склонность к металлизации, что объясняет хорошую тепло — и электропроводность графита, а также его металлический блеск.
22 Графит
23 Фуллерены Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно, от 32 и более 500, они представляют по структуре выпуклые многогранники, построенные из правильных пяти — и шестиугольников.
Третья форма чистого углерода является молекулярной. Это означает, что минимальным элементом ее структуры является не атом, а молекула углерода, представляющая собой замкнутую поверхность, которая имеет форму сферы.
В фуллерене плоская сетка шестиугольников ( графитовая сетка ) свернута и сшита в замкнутую сферу. При этом часть шестиугольников преобразуется в пятиугольники. Образуется структура – усеченный икосаэдр. Каждая вершина этой фигуры имеет трех ближайших соседей.
Каждый шестиугольник граничит с тремя шестиугольниками и тремя пятиугольниками, а каждый пятиугольник граничит только с шестиугольниками.
24 Фуллерены могут найти применение в качестве присадок для ракетных топлив, смазочного материала, для создания фотоприемников и оптоэлектронных устройств, катализаторов роста, алмазных и алмазоподобных пленок, сверхпроводящих материалов, а также в качестве красителей для копировальных машин. Фуллерены применяются для синтеза металлов и сплавов с новыми свойствами.
25 Карбин Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света. Кристаллическая форма карбина состоит из параллельно ориентированных цепочек углеродных атомов с sp- гибридизацией валентных электронов в виде прямолинейных макромолекул полиинового ( — С = С — С = С -… ) или кумуленового (= С = С = С =…) типов.
26
Урок химии по теме "Неметаллы. Общая характеристика неметаллов". 9-й класс
Класс: 9
Тема: Неметаллы. Общая характеристика неметаллов.
Цели:
- изучить положение неметаллов в ПС;
- изучить особенности строения атомов неметаллов;
- изучить явление аллотропии на примере неметаллов;
- изучить физические свойства неметаллов;
- рассмотреть ЭО как меру «неметалличности»;
- рассмотреть относительность понятий «металл-неметалл»;
- изучить водородные соединения неметаллов.
- развивать когнитивную сферу учащихся;
- развивать общеучебные умения и навыки: умение, работать по плану, умение работать с книгой;
- развивать умение делать самостоятельные выводы.
- воспитывать культуру умственного труда;
- воспитывать дисциплинированность и чувство ответственности.
- Оборудование и реактивы: образцы неметаллов — простых веществ H2, O2, Cl2 (в пробирках с пробками); Br2 (в ампуле); S, J2, P (красный), активированный уголь, пьезо-зажигалка, йодкрахмальная бумажка.
- Тип урока: урок усвоения новых знаний.
- Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (мультимедийное наглядное пособие); проблемно-поисковый.
- ФОПД: фронтальная, индивидуально-обособленная, групповая (динамические группы).
Технологии: элементы технологии «Сотрудничества», личностно-ориентированного обучения. Информационно-коммуникационные технологии.
Ход работы:
I. Организационный момент
II. Актуализация знаний.
Ответьте на вопросы:
- на какие 2 большие группы условно делятся все Х.Э.?
- каково положение в ПС металлов?
III. Изучение
1. Положение неметаллов в ПС
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
2. Особенности строения атомов неметаллов.
Во внешнем электронном слое атомов неметаллов находится от трёх до восьми электронов.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
- меньший атомный радиус;
- четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т.е. окислительные свойства. Качественной характеристикой атомов неметаллов, т.е. своеобразной мерой их неметалличности, может служить электроотрицательность, т.е.
свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т.е.
чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
- газы – H2, O2, O3, N2, F2, Cl2;
- жидкость – Br2;
- твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
4. Сообщения.
5. Физические свойства неметаллов.
- Ковкость отсутствует
- Блеска нет
- Теплопроводность (только графит)
- Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
- Электропроводность (только графит и черный Фосфор.)
- Агрегатное состояние:
- газообразное(H2, O2, Cl2 ,F2, O3)
- твердое (Р, С)
- жидкое (Br2)
6. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
7. Водородные соединения неметаллов.
В отличие от металлов неметаллы образуют газообразные водородные соединения. Их состав зависит от степени окисления неметаллов.
| -4 | -3 | -2 | -1 |
| RH4 → | RH3 → | H2R → | HR |
Летучие водородные соединения неметаллов можно разделить на три группы:
1) Хорошо растворимые в воде (HCl, HBr, HJ, H2S, H2Se, NH3), которые диссоциируют на ионы, проявляя кислотные и основные свойства.
2) Соединения, разлагаемые водой:
BH3 + 3H2O = H3BO3 + 3H2↑
3) Летучие водородные соединения
CH4, PH3, которые не взаимодействуют с водой.
По периоду в ПС химических элементов с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения.
SiH4 → PH3 → H2S → HCl
Выводы:
- Элементы-неметаллы расположены в главных подгруппах III–VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
- На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
- Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
- Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
- Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
IV. Закрепление изученного. Рефлексия
- 1) Вставьте слова, пропущенные в тексте. Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
- 2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах ____
- В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F.
6) Какую высшую степень окисления имеют следующие элементы?
| Азот | +6 |
| Хлор | +5 |
| Сера | +4 |
| Кремний | +7 |
- 7) Определите, окислителем или восстановителем является сера в следующих реакциях:
- H2+S=H2S S —
- 2SO2 + O2 → 2SO3 S —
 Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.
Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно____.- • 4 • 5 • 6 • 7
9) Наиболее электроотрицательными являются атомы…..
- • серы • фосфора • кремния • хлора
- 10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
- Поменяйтесь тестом с соседом и проверьте тест вместе со мной.
V. Читаем по учебнику состав воздуха стр. 74
VI. Решаем упражнения 1–4 стр.75
VII. Оценки и домашнее задание
Д/З § 15 Неметаллы.
Условные обозначения: ПС – периодическая система е – электрон Э.О. – электроотрицательность А. – аллотропия
Х.р. – химическая реакция
Приложение: Маршрутный лист
12.01.2009






