- Диссоциация
- Разложение
- Взаимодействие кислот с металлами
- Таблица: химические свойства кислот-окислителей
- Взаимодействие кислот с солями
- Взаимодействие кислот с основными и амфотерными оксидами
- Восстановительные свойства бескислородных кислот
- Способность окрашивать индикаторы
- Вопросы для самоконтроля
- Химические свойства кислот, их классификация и реакции
- Химические свойства кислот
- 1. Диссоциация
- 2. Разложение
- 3. Реакция с металлами
- 4. Реакции с основаниями
- 5. Реакции кислот с солями
- 6. Реакция кислот с основными и амфотерными оксидами
- 7. Восстановительные свойства бескислородных кислот
- Физические свойства кислот
- Химический сайт — Общие схемы реакций
- 2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- Взаимодействие средних солей с гидроксидами металлов
- Реакции средних солей с кислотами
- Реакции средних солей с другими средними солями
- Реакции термического разложения солей
- Разложение карбонатов
- Разложение нитратов
- Разложение солей аммония
- Разложение хлората калия
- Химические свойства кислых солей
- Отношение кислых солей к щелочам и кислотам
- Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
- Термическое разложение кислых солей
- Химические свойства основных солей
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- Характерные химические свойства кислот
- Общая характеристика
- Классификация:
- Физические свойства
- Химические свойства
- Изменение цвета индикаторов
- Взаимодействие кислот с металлами
- Взаимодействие кислот с основными и амфотерными оксидами
- Взаимодействие кислот с основными и амфотерными гидроксидами
- Взаимодействие кислот с солями
- Разложение кислородсодержащих кислот
- ПОИСК
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами. Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
-
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
-
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

- Mg + 2HCl = MgCl2 + H2
- Zn + H2SO4 = ZnSO4 + Н2
- При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
| HNO3(разб) | NaNO3 + NH4NO3 +H2O | Mg(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Al(NO3)3 + в зависимости от разбавления кислоты N2O, NH4NO3 + H2O | Zn(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Fe(NO3)3 + NO + H2O | Cu(NO3)2 + NO + H2O |
| HNO3(конц) | NaNO3 + N2O + H2O | На холоду — пассивация | На холоду — пассивация | Cu(NO3)2 + NO2 + H2O | ||
| H2SO4(разб) | Na2SO4 + H2 | MgSO4 + H2 | При нагревании Al2(SO4)3 + H2 | ZnSO4 + H2 | При нагревании FeSO4 +H2 | Реакция не проходит |
| H2SO4(конц) | Na2SO4 + H2S + H2O | MgSO4 + H2S + H2O | На холоду — пассивация | ZnSO4 + SO2 + H2O | На холоду — пассивация | CuSO4 + SO2 + H2O |
| При нагревании Al2(SO4)3 + SO2 + H2O | При нагревании ZnSO4 +H2S + H2O | При нагревании Fe2(SO4)3 + SO2 + H2O |
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
- Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
- Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
- Результат этих реакций — образование свободных галогенов.
- 4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
- 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
- 16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной.
Ее могут окислять оксид железа (III) и соль трехвалентного железа.
- 6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
- Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
- 2H2S + SO2 = 3S + 2H2O
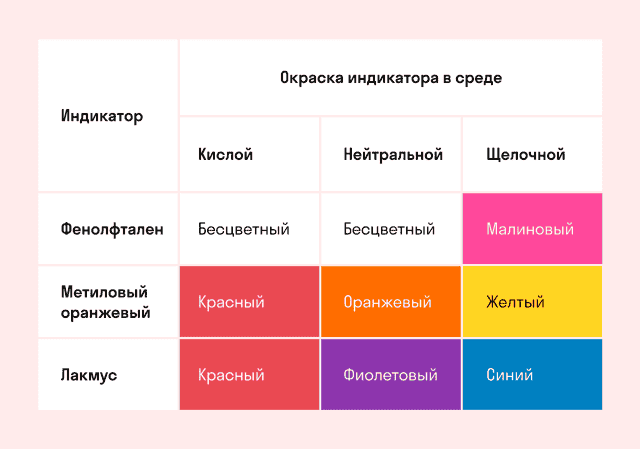
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
-
С чем реагируют кислоты?
-
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
-
- Составьте уравнения реакций и назовите продукты реакций:
- Ca + HCl
- Na + H2SO4
- CaO + HNO3
- Fe2O3 + H2SO4
- KOH + HNO3
- Al(OH)3 + HF
- HNO3 + CaCO3
-
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
-
- Соляная кислота вступает в реакцию с каждым из двух веществ:
- а. водой и цинком;
- б. магнием и оксидом серы (IV);
- в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Химические свойства кислот, их классификация и реакции
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
- бескислородные
- кислородсодержащие.
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
- сильные
- слабые электролиты.

Химические свойства кислот
1. Диссоциация
- При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
- HNO3 → H+ + NO-3
- HCl → H+ + Cl-
- Многоосновные кислоты диссоциируют ступенчато.
- Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень)
- Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень)
- НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень)
2. Разложение
- Кислородсодержащие кислоты разлагаются на оксиды и воду.
- H2CO3 → H2O + CO2↑
- Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Mg + 2HCl → MgCl2 + H2↑
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
Au + HNO3 + 4HCl → HAuCl4 + NO + 2H2O.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Na2CO3 + 2CH3 — COOH → 2CH3 — COONa + H2O + CO2↑.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl↑
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
K2O + 2HNO3 → 2KNO3 + H2O
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
4HCl + MnO2 → MnCl2 + Cl2↑ + 2H2O
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
- Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
- Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
- Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
- Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
- Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
- Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный Кислоту укажет ясно. Индикатор лакмус — синий, Щёлочь здесь — не будь разиней, Когда ж нейтральная среда, Он фиолетовый всегда. Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Что ещё почитать? Неметаллы Биография Д.И. Менделеева. Интересные факты из жизни великого химика Карбоновые кислоты Массовая доля вещества
18HBr + 2KMnO4 →2KBr + 2MnBr2 + 8H2O + 5Br2
14НI + K2Cr2O7 →3I2↓ + 2Crl3 + 2KI + 7H2O
#ADVERTISING_INSERT#
Химический сайт — Общие схемы реакций
Что такое Химия? На древнеегипетском слово chemi означало темный, таинственный. И действительно, в те времена химия являлась чем-то таинственным, необъяснимым. Все реакции, которые удавалось воспроизвести алхимикам приписывали к действию темных сил.
В настоящее время химия разделилась на несколько поднаук: неорганическая химия, органическая, биохимия, физическая химия, коллоидная химия, квантовая химия.
Из них выделяют два важнейшие раздела – органическую и неорганическую химию. Неорганическая химия (если выразиться по-простому) – химия неживой природы. Изучает минеральные вещества, созданные неживой природой.
Выделяют несколько классов веществ в неорганической химии: Кислоты (минеральные), основания, соли, оксиды, пероксиды, металлы и неметаллы.
Все эти классы между собой вступают в реакции, которые можно отобразить в следующих схемах:
- Кислота + основание = соль + вода (Реакция нейтрализации)
- HCl + NaOH = NaCl + H2O
- Причем кислоты реагируют как и с растворимыми основаниями (щелочами), так и с нерастворимыми, при условии, что образуется растворимая соль
- H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
- Кислота + основный оксид = соль + вода
- 2HNO3 + CuO = Cu(NO3)2 + H2O
- (В этом правиле существует исключение: плавиковая кислота реагирует с диоксидом кремния (кислотным оксидом))6HF + SiO2 = H2[SiF6]+2H2O
- Кислота + металл = соль + водород
- 2HCl + Zn = ZnCl2 + H2 (газ)
- На это правило распространяется ограничение:
- 1) Кислоты реагируют с металлами, стоящими в ряду напряжений металлов до водорода (Исключение составляют концентрированная серная и азотная кислота любой концентрации)
- 2) При реакции метала с кислотой должна получиться растворимая соль
- 3) На щелочные металлы правило распространяется частично т.к эта реакция проходит в растворе (щелочные металлы взаимодействуют с водой)
- Исключения: Cu + 2H2SO4 (конц.) = CuSO4 + SO2 (газ) + 2H2O
- 4Zn + 5H2SO4 (конц.) = 4ZnSO4 + H2S(газ) + 4H2O
8HNO3 (разб) + 3Cu = 3Cu(NO3)2 + 2NO (газ) + 4H2O
- Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 (газ) + 2H2O
- Zn + 4HNO3 (конц.) =(t) Zn(NO3)2 + 2NO2 (газ) + 2H2O
- 4Zn + 10HNO3 (разб.) =(t) 4Zn(NO3)2 + N2O (газ) + 5H2O
- 4Zn + 10HNO3 (сильно разб) =(t) 4Zn(NO3)2 + NH4NO3 + 3H2O
- 12HNO3 (сильно разб) + 5Fe = 5Fe(NO3)2 + N2 (газ) + 6H2O
- Кислота + соль = новая кислота + новая соль
- H2SO4 + BaCl2 = BaSO4 (осадок) + 2HCl
- Для осуществления этой реакции необходимо, чтобы кислота, получающаяся в итоге, была либо летуча (или нерастворима например кремниевая). Или соль, получающаяся в итоге выпадала в осадок
- Соль1 + Соль2 = Соль3 + Соль4
- Na2CO3 + Ca(NO3)2 = 2NaNO3 + CaCO3
- (Следует напомнить, что при составлении таких реакций следует руководствоваться правилом протекания реакций. В данном случае исходные соли должны быть хорошо растворимы, а одна из образующихся должна выпадать в осадок)
- Основание + кислота = соль + вода (см. выше)
- Основание + кислотный оксид = соль + вода
- 2NaOH + CO2 = Na 2CO3 +H2O
- В эту реакцию вступают только растворимые основания
- Основание + соль = новое основание + новая соль
- KOH + CuSO4 = K2SO 4 + Cu(OH)2 (осадок)
- Правило распространяется только на реакцию с растворимыми основаниями
- Кислотный оксид + вода = кислота
- SO3 + H2O = H2SO4
На диоксид кремния (SiO2 ) правило не распространяется т.к. этот оксид водой не гидратируется
- Кислотный оксид + основный оксид = соль
- SO2 + Li2O = Li2SO3
- Кислотный оксид + основание = соль + вода (см. выше)
- Основный оксид + вода = основание
- K2O + H2O = 2KOH
- Правило распространяется только на те реакции, в результате которых получается растворимое основание (т.е щелочь)
- Основный оксид + кислота = соль + вода (см. выше)
- Основный оксид + кислотный оксид = соль (см. выше)
- Металл + кислота = соль + водород (см. выше)
- Металл + неметалл = соединение ( соль, оксид, пероксид)
- 2Na + Cl2 = 2NaCl (соль)
- 2Mg + O2 = 2MgO (оксид)
- 2Na + O2 = Na2O2 (пероксид)
- При составлении некоторых уравнений химических реакций следует руководствоваться следующим правилом: Реакция практически осуществима, если в результате реакции образуется газ, осадок или вода (малодиссоциирующее соединение)
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
- Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
- Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Характерные химические свойства кислот
Характерные химические свойства кислот добавить в закладки
Кислоты – это химические соединения, содержащие в себе положительный атом водорода (катион H+) и кислотный остаток (анион A-). Является сложным веществом.
Общая характеристика
В первую очередь кислоты различают по растворимости. Есть нерастворимые, растворимые и полурастворимые кислоты. Эти различия прописаны в таблице растворимости, так что наизусть запоминать не требуется.
Классификация:
- Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице. Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная. Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
- Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).
| Основность кислоты — это число активных атомов водорода в молекуле кислоты | |
| Одноосновные | HClO4, HCl |
| Двухосновные | H2SO4, H2CO3 |
| Трехосновные | H3PO4 |
- Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.
Физические свойства
Кислоты, в зависимости от условий, могут быть в трёх агрегатных состояниях: в жидком, твёрдом и газообразном состоянии. Кислоты могут обладать цветом и запахом.
Химические свойства
Изменение цвета индикаторов
Кислота в водной среде способна изменить цвет разных индикаторов. Кислоты окрашивают в красных цвет лакмус, метилоранж и универсальный индикатор. Фенолфталеин не окрашивается.
Взаимодействие кислот с металлами
- Кислота способна реагировать только с металлами, находящимися левее водорода в ряду активности металлов.
- Mg + 2HCl → MgCl2 + H2↑
- Из приведенного выше химического уравнения нужно отметить, что при взаимодействии кислоты и металла происходит реакция замещения, образуется соль и выделяется H2.
Взаимодействие кислот с основными и амфотерными оксидами
- При взаимодействии кислоты с основным или амфотерным оксидами происходит реакция обмена в результате которой образуются соль и H2O.
- В качестве примера приведены следующие реакции:
- K2O + 2HNO3 → 2KNO3 + H2O Al2O3 + 6HCl → 2AlCl3 + 3H2O
- Из приведённого выше химического уравнения нужно отметить, что в реакциях основного оксида калия и амфотерного оксида алюминия (III) с кислотами, образуется соль и H2O.
Взаимодействие кислот с основными и амфотерными гидроксидами
При взаимодействии кислоты с основным и амфотерным гидроксидами образуются H2O и новая соль, как и в случае с оксидами, происходит реакция обмена. Второе название этой реакции — реакция нейтрализации.
KOH + HNO3 → KNO3 + H2O Al(OH)3 + 3HCl → AlCl3 + 3H2O
Из приведённой выше химического уравнения нужно отметить, что при реакции основного гидроксида калия и амфотерного гидроксида алюминия (III) с кислотами образуются соль и H2O.
Взаимодействие кислот с солями
Реакция кислоты с солью является реакцией обмена, так же ее называют реакцией нейтрализации. Она возможно только в случае выпадения соли в осадок, выделения газа, слабые электролиты или вода. Рассмотрим все случаи более подробно.
- Реакции, в результате которых выпадает осадок. H2SO4 + BaCl2 → BaSO4↓ + 2HCl Na2SiO3 + 2HNO3 → H2SiO3↓ + 2NaNO3 Из приведённого выше химического уравнения можно увидеть, что при взаимодействии кислоты и соли образуются новые кислота и нерастворимая соль, которые выпадают в осадок. Осадок может иметь различную окраску, плотность и консистенцию.
- Реакции, в результате которых при нагревании или обычных условиях выделяется газ. NaCl(тв.) + H2SO4 (конц.) → Na2SO4 + 2HCl↑ FeS + 2HCl → FeCl2 + H2S↑ Из приведённых выше химических уравнений нужно отметить, что при реакции соли с кислотой образуется новая соль и выделяется газ. Разберём одну из реакций: при взаимодействии твёрдого хлорида натрия с концентрированной хлороводородной кислотой образовалась натриевая соль серной кислоты и выделился летучий газ хлороводород.
- Реакции, в результате которых образуется слабый электролит. Такие реакции возможны только при условии, когда одним из реагентов сильный электролит. Для того, чтобы убедиться, что реакция будет протекать используют вытеснительный ряд: В этом ряду кислоты расположены так, что в растворах кислот и их солей могут в результате реакции вытесняют из раствора те, что стоят левее в ряду. Азотная и фосфорная кислоты находятся на одном месте в ряду, т.к. имеют одинаковые вытеснительные способности. Из приведённого выше химического уравнения нужно отметить, что хлороводородная кислота, которая находится в данном ряду левее, способна вытеснять кислотный остаток карбоновой кислоты, стоящей в ряду правее. Нужно учитывать, что карбоновая кислота слабая и при стандартных условиях она распадется на углекислый газ и воду. Углекислый газ выделяется из раствора, а вода остаётся.
Разложение кислородсодержащих кислот
В результате реакции разложения кислородсодержащих кислот всегда образуется вода и оксид.
Из приведённых выше реакций можно увидеть, что карбоновая легко разлагается при обычных условиях, так как является одной из самых слабой кислотой. Для разложения сернистой и кремниевой кислоты их растворы необходимо нагреть. Во всех трёх реакция в результате образуется вода и оксиды кислотных остатков.
Смотри также:
- Номенклатура неорганических веществ
- Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов (меди, цинка, хрома, железа)
- Характерные химические свойства простых веществ – неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных
- Характерные химические свойства оснований и амфотерных гидроксидов
- Характерные химические свойства солей: средних, кислых, оснóвных; комплексных ( на примере соединений алюминия и цинка)
- Взаимосвязь различных классов неорганических веществ
ПОИСК
Н. Н. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при этом водород, так же как и некоторые металлы, вытесняет ртуть и серебро из их солей. Располагая металлы, а также водород по их способности вытеснять друг друга из растворов солей (по их убывающей химической активности), Н.
Н. Бекетов составил ряд, который он назвал вытеснительным рядом металлов . В этом ряду каждый металл, стоящий слева, может вытеснять из растворов солей каждый металл, стоящий справа. Металлы, расположенные левее водорода вытесняют водород из кислот металлы, расположенные правее водорода, не вытесняют водород из кислот. [c.
69] Водород, получаемый при действии кислот на металлы (например, цинк). [c.77]
В 1887 г. Аррениусом была предложена теория электролитической диссоциации (см. гл. IV), которая по-новому решила вопрос о природе кислот и оснований.
Согласно этой теории кислота — это вещество, диссоциирующее в растворе с образованием ионов Н . Все общие свойства кислот — кислый вкус, действие на металлы, индикаторы и т. п. являются свойствами ионов водорода. Основание—это вещество, диссоциирующее с образованием ионов ОН .
Реакция нейтрализации сводится к взаимодействию водородных и гидроксид-ионов, приводящему к образованию недиссоциированных молекул воды. [c.232]
По аналогии с соляной и серной кислотами можно было бы ожидать, что при действии активных металлов на разбавленную азотную кислоту будет выделяться водород. Однако окислителем в разбавленной азотной кислоте могут быть не только ионы водс рода, но и азотная кислота. Поэтому выделяющийся в первоначальный момент водород [c.214]
В лабораторной практике водород обычно получают действием металлов на разбавленные кислоты, воду и растворы щелочей. Составить уравнения реакций получения водорода иа кислот, воды и растворов щелочей. [c.227]
Почему для получения углекислого газа пригодны все приборы, описанные для получения водорода действием кислоты на металл [c.173]
Для получения, сушки, очистки и хранения газов пользуются специальным приборами. В лабораторной практике наиболее часто имеют дело с аппаратом Киппа.
В нем получают газы взаимодействием твердых веществ с жидкостями (например, получают водород действием кислоты на цинк, диоксид углерода действием кислоты на мрамор, сероводород действием кислоты на сульфиды металлов и т. п.). Опишем приемы работы с аппаратом Киппа при получении водорода (рис. 152).
При этом кроме аппарата Киппа применяются следующие оборудование и материалы предохранительная воронка резиновая прокладка стеклянная воронка диаметром 10—12 см фарфоровый стакан на 2—3 л защитные очки резиновые перчатки резиновая пробка к верхней горловине [c.313]
Катодная реакция с выделением водорода относится к наиболее частым случаям коррозии большинства металлов и сплавов под действием кислот, а также некоторых металлов с весьма отрицательными потенциалами (например, магния и его сплавов) н нейтральных растворах электролитов. [c.39]
Таким образом, металл взаимодействует с кислотой, если энергия его ионизации иоп.ме меньше энергии ионизации водорода иоы.тс. Однако ход этих реакций осложняется гидратацией как иона водорода, так и образующегося иона металла. Казалось бы, вода должна действовать на металлы подобно кислотам. Однако, поскольку концентрация ионов водорода в чистой воде чрезвычайно мала, с ней могут реагировать по приведенной схеме лишь наиболее активные металлы. Сравнительно мало активные металлы могут, однако, взаимодействовать с водой по следующей схеме [c.118]
Пероксид водорода окисляет многие металлы. Присутствие пероксида водорода в растворах кислот усиливает действие последних на металлы. [c.224]
Изучение скорости растворения в кислоте металла в зависимости от его природы. Приготовьте цинковую, алюминиевую, железную, оловянную и свинцовую пластинки размером примерно 2×2 см и точно измерьте площадь их поверхности. Определите время выделения 5 мл водорода при действии на [c.388]
Концентрированная серная кислота — сильный окислитель, При нагревании действует на многие металлы. В зависимости от активности металла восстанавливается до ЗОг, 5, НзЗ. Металлы, стоящие в ряду напряжений после водорода, и малоактивные металлы до водорода восстанавливают ее до ЗОг. Энергичными восстановителями (2п, М ) восстанавливается до 5 и НгЗ. [c.112]
Вода не действует на олово. Разбавленные соляная и серная кислоты действуют на него очень медленно, что объясняется большим перенапряжением выделения водорода на этом металле. [c.422]
Фенол СбНзОН — бесцветные кристаллы (темп, плавл. 41 °С). Обладает характерным запахом и антисептическими (обеззараживающими — подавляющими развитие вредных микроорганизмов) свойствами.
Как уже указывалось, кислотные свойства гидроксильного водорода выражены у фенола значительно сильнее, чем у спиртов замещение этого водорода металлом может происходить не только при действии щелочных металлов, но и при действии щелочей.
Поэтому фенол называют также карболовой кислотой. [c.573]
Восстановление озонидов проводят водородом, образующимся при действии уксусной кислоты на цинковую пыль, или водородом в присутствии металлов VUI группы —Pt и Pd. Обе реакции протекают на холоду при атмосферном давлении. Основными продуктами являются альдегиды [c.95]
Получение. В лабораторных условиях водород получают, действуя на металлы (чаще всего цинк) кислотой [c.162]
Сернистый водород. Сульфиды. Сера при высокой температуре может непосредственно соединяться с водородом с образованием газообразного сернистого водорода, или сероводорода Нг . Обычно сероводород получают действием кислот на сернистые металлы (главным образом на сернистое железо Ре5) [c.503]
Опыт 10. Обнаружение серы в чугуне или стали. В чугунах и сталях сера содержится в виде сульфидов металлов (FeS, MnS и т. п.). Поэтому при действии кислот на чугун и сталь, содержащие серу, выделяются водород и сероводород. [c.230]
Химическая активность НР сильно зависит от присутствия воды. Сухой НР не действует на металлы и оксиды. В последнем случае образуюш,аяся в результате реакции вода резко увеличивает скорость процесса, т. е.
фтористый водород подвержен реакциям автокатализа . Специфической особенностью плавиковой кислоты является ее способность химически взаимодействовать с материалами, содержащими диоксид кремния [c.
354]
Закон постоянства состава. Состав молекулярного соединения остается постоянным независимо от способа его получения. В отсутствие молекулярной структуры в данном агрегатном состоянии его состав зависит от условий получения и предыдущей обработки. Возьмем, к примеру, аммиак.
Независимо от способов получения (прямой синтез из элементов, разложение аммонийных солей, действие кислот на нитриды активных металлов и т. п.) состав молекулы аммиака всегда постоянен и неизменен на атом азота приходится 3 атома водорода.
А для оксида титана (2-[-) состав соединения зависит от условий получения температуры и давления пара кислорода. В молекуле аммиака, состоящей лишь из четырех атомов, исключается изменчивость состава.
Оксид же титана (2-f) представляет собой фазу, состоящую из огромного числа атомов (порядка постоянной Авогадро), которая и определяет свойства этого соединения. Это— ярчайший пример перехода количества в качество коллектив из колоссального числа частиц обладает уже новым качеством — непостоянством состава. [c.24]
Серебро на воздухе не окисляется даже при нагревании. При действии сероводорода серебро чернеет (образуется пленка Ag S). Разбавленные кислоты не действуют на серебро.
В азотной кислоте серебро растворяется с образованием нитрата серебра AgNO (ляписа). Оно растворяется и в горячей серной кислоте. Эти реакции не являются обычным вытеснением водорода из кислот металлами.
Серебро, как и медь, в электрохимическом ряду [c.407]
Первая из опубликованных Г. Кавендишем работ была посвящена различным видам искусственного воздуха . Под искусственным воздухом Г. Кавендиш понимал всякий вид воздуха, который содержится в веществах в неупругом (связанном) состоянии и может быть из них выделен , апример водород. Г.
Кавендиш получил водород действием кислот на металлы и объяснил образование водорода разложением металла, т. е. принял водород в качестве флогистона. За 20 лет до этого М. В. Ломоносов пришел к такому же выводу. Необычайная легкость водорода казалась вполне соответствующей концепции об отрицательной массе флогистона. Изучая свойства горючего воздуха , Г.
Кавендиш обнаружил, что он имеет вес. Взвесив колбу, содержащую кислоту и металл, до и после выделения водорода и определив объем выделившегося газа, ученый нашел его плотность, оказавшуюся равной 0,09. Поэтому ему пришлось отказаться от заключения, что флогистон — это чистый водород, и принять, что водород выделяется при реакции в сочетании с водяным паром.
Все же этот вывод был встречен с восторгом химиками-флогистиками, давно стремившимися получить свободный флогистон. [c.52]
Бы убедились, что при действии цинка на серную кислоту наблюдались явления, сходные с теми, которые со вершались при реакции соляной кислоты с металлами выделялся водород, и появлялось новое твердое вещество. Происходила реакция замещения водорода кислоты металлом. В е щ е с в о, образующееся при замещении водорода кислоты металлом, называется солью. При замещении водорода соляной кислоты метал- лом, образуются соли соляной кис л о т ы, или х л о р и-стые соли (хлористый цинк, хлористое железо и т. д.). При замещении водорода серной кислоты металлом образуются соли серной кислоты (сериоцинковая соль, серноалюминиевая соль, и т. д.). [c.51]
Будучи убежденным флогистиком, Кавендиш считал, что водород выделяется при действии кислоты на металлы не в результате разложения кислоты, а в результате разложения под действием кислоты металлов, считавшихся флогистиками сложными телами. Этой же точки зрения придерживался в середине XVIII в. и Ломоносов. По мнению Кавендиша, различные металлы содержат различные количества воспламеняемого воздуха . [c.300]
Этерификация—процесс замещения иона водорода в органической кислоте алкильной или арильной группой. Водородный ион действует каталитически на реакцию.
Применяются сильные кислоты или соли сильных кислот и слабых оснований. Хлористый цинк усиливает каталитическое действие кислот.
Используются и другие катализаторы фториды бора и кремния хлориды алкминия, трехвалентного железа и магния металлы в тонко- [c.328]
Соединения шестивалентного хрома в кислой среде обладают высокой окислительной активностью и, восстанавливаясь, переходят в соединения Сг » (оранжевая окраска изменяется на зеленую). Раствор К2СГ2О7, содержащий серную кислоту, называется хромовой смесью и является сильным окислителем.
При-действии перекиси водорода или перекиси металлов на соединения шестивалентного хрома в кислой среде образуется синяя перекись хрома, неустойчивая в водном растворе, но устойчивая в эфирном растворе. Образование перекиси хрома можно выразить следующим уравнением [c.
294]
Соединения. С водородом Аз, Sb, Bi не реагируют. Арсин, стибин, висмутин ЭНз получают действием кислот на соединения As, Sb, Bi с металлами, например, СазЭг [c.427]
В отличие от алкильных эфиров, арильные эфиры, синтезированные из фенолов и хлорангидрида кислоты, являются очень устойчивыми соединениями [4506]. Они легко растворяются в разбавленной щелочи, выпадая из раствора в неизмененном виде при действии кислот.
Гидролиз их происходит только при нагревании с 50%-ным раствором едкого натра, тогда как алкильные эфиры полностью гидролизуются горячей водой, в которой метиловый эфир легко растворим.
Арильные эфиры вследствие наличия достаточно подвижного водорода дают соли щелочных металлов в водном растворе, но алкильные эфиры образуют металлические соли только в безводном растворителе, например в бензоле при действии металла, причем получающиеся соли разлагаются спиртом или водой.
Так, дифенилметионат содержит, очевидно, более подвижный водород, чем диэтилмалонат, кислотные свойства которого в свою очередь выражены сильнее, чем у диэтилме-тионата. Натриевые и калиевые производные алкильных и арильных эфиров легко алкилируются иодистыми алкилами или диметилсульфатом.
На этой реакции основан метод синтеза гомологов метионовой кислоты, получение которых другими путями затруднительно. Представляется довольно интересным, что натрийалкил-эфиры, повидимому, не претерпевают внутримолекулярного алкилирования, которое, как можно было бы ожидать, будет происходить по схеме [c.177]
Модифицирующие примеси оказывают также большое влияние на хемосорбционные явления. Приведем лишь один пример. Хорошо известно, что растворение водорода в железе представляет собой эндотермический процесс (раздел VII, 7).
Однако атомы водорода, полученные либо в ] азовой фазе, либо в растворе в результате действия кислот на металлы, легко проникают внутрь железа. Этот процесс облегчается присутствием на поверхности железа сульфидных ионов [170].
Можно предположить,, что сульфид-ионы образуют дипольный слой, ориентированный отрицательными зарядами наружу. Тогда этот дипольный слой. [c.162]
Несмотря на чрезвычайно высокую устойчивость к действию кислот и окислителей, а также термическую стабильность карборана (до 600 °С), атомы водорода в его молекуле при действии литийалканов и алкилмагнийгалогенидов замещаются иа металл. Далее могут образовываться ряды производных (спиртов, кислот и т. д.). [c.340]
В самом деле, если действовать расплавленными металлами па углеводороды, они проявляют кислотные свойства, выделяют водород и образуют соли. Некоторые углеводороды могут металлизироваться уже при действии водных щелочей.
Эти реакции проходят как кислотно-основные реакции.
Если на бензол действовать натрийэтилом СаНдКа, то бензол, как более сильная кислота, вытесняет этан из металлоорганического соединеиия, в результате чего происходит реакция замещения [c.290]
В этом уравкеини реакции четыре молекулы НгЗО затрачиваются на образование сульфата цинка. Таким образом, действуя любыми металлами на концентрированную серную кислоту, водород получить нельзя. [c.195]
Соединенна. Непосредственно с водородом As, Sb, Bi не реагируют. Их водородные соединения — арсин, стибин, висмутин ЭНз получают действием кислот на соединения As, Sb, Bi с металлами, например [c.423]
Фосфорноватая кислота окисляется до фосфорной лишь. при действии самых сильных окислителей (КМПО4 и т. п.). С Другой стороны, сама она окислителем не является.
Все четыре водорода фосфорноватой кислоты могут быть замещены на металл, причем образующиеся соли (г и п о ф о с ф а т ы), как правило, бесцветны и труднорастворимы в воде. Хорошо растворяются лишь производные наиболее активных одновалентных металлов. Растворы их вполне устойчивы.
JKaK у самой Н4Р2О6, так и у ее солей сильно выражена склонность к реакциям присоединения. [c.447]
Действие кислот на металлы.
Соляная кислота может окислять вещества только ионами Н , поэтому ею окисляются лишь активные (А1, Zn) и умеренно активные (Fe, Sn) металлы с образованием их хлоридов и выделением свободного водорода.
Невысокая окисляющая способность ионов H» » проявляется и в том, что при этом образуются ионы металлов не с максимальным, а с промежуточным зарядом r l2, Fe b, Sn b. [c.177]
Но выделить горючий воздух и изучить его свойства никто до Г. Кавендиша не пытался. В химическом трактате Три работы, содержащие опыты с искусственными видами воздуха (1766) он показал, что существуют газы, которые отличаются от воздуха, а именно с одной стороны, лесной, или свнзаппый, воздух , который, как установил Г.
Кавендиш, оказался в 1,57 раза тяжелее обычного воздуха, с другой стороны, горючий воздух — водород. Г. Кавендиш получал его действием разбавленных серной и соляной кислот па различные металлы. Тот факт, что при действии кислот на металлы (цинк, железо) выделялся один и тот же газ (водород), окончательно убедил Г.
Кавендиша в том, что все металлы содержат флогистон, который выделяется ири превращении металлов в земли . Английский ученый принимал водород за чистый флогистон, поскольку газ горит, не оставляя остатка, и оксиды металлов, обрабатываемые этим гааом, при нагревании восстанавливаются в соответствующие металлы. [c.
69]
Напншите уравнение реакции получения водорода и его горения. Можно ли получить водород действием на соляную кислоту любого другого металла Действием на медь разбавленной серной кислоты Действием на медь концентрированной серной кислоты [c.115]






