- История открытия
- Калий в природе
- Способы получения
- Физические свойства
- Химические характеристики
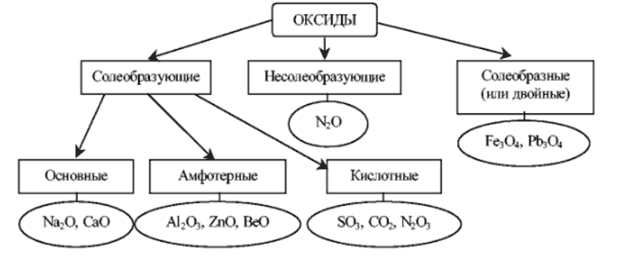
- Оксиды или пероксиды
- Гидроксиды калия
- Сфера применения
- Особые соединения калия
- Калий, свойства атома, химические и физические свойства
- Общие сведения:
- Свойства атома калия:
- Химические свойства калия:
- Физические свойства калия:
- Кристаллическая решётка калия:
- Дополнительные сведения:
- Примечание:
- Источники:
- Калий | это… Что такое Калий?
- История и происхождение названия
- Нахождение в природе
- Месторождения
- Получение
- Физические свойства
- Химические свойства
- Взаимодействие с простыми веществами
- Взаимодействие со сложными веществами
- Соединения с кислородом
- Гидроксид
- Применение
- Важные соединения
- Биологическая роль
- Калий в организме человека
- Изотопы
- См. также
- Примечания
- Свойства калия и его взаимодействие с водой
- Химические свойства калия
- Взаимодействие калия со сложными веществами
- Строение калия

История открытия
- Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
- Примерная молярная масса 39,1 г/моль.
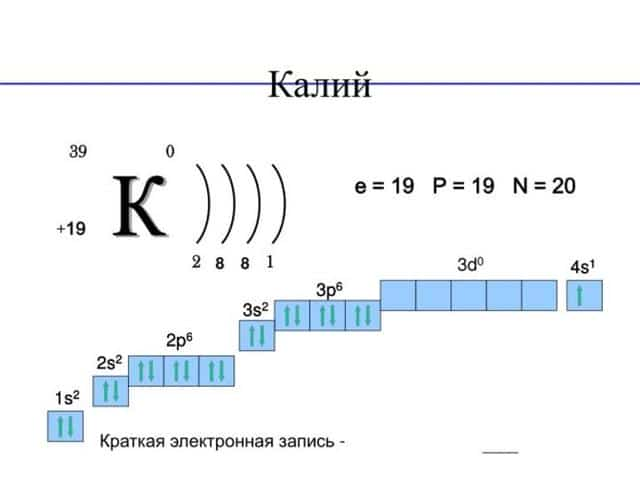
- Электронная конфигурация калия 1s22s22p63s23p64s1

Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений».
И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И.
Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Калий в природе

После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде. Минералы, формулы которых могут «похвастаться» большим содержанием этого элемента:
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Способы получения
- Современные условия позволяют учёным получать калий несколькими способами.
- Уравнение взаимодействия с жидким натрием расплавленного основания при 380−450°C или хлорида при 760- 890 °C: Na + KOH = NaOH + K
- Электролиз расплава хлорида в смеси с карбонатом калия при температуре около 700 °C:
- 2KCl = 2K + Cl 2.
Физические свойства
Легкоплавкий металл серебристого цвета. При надрезе быстро образует оксидную плёнку после нескольких секунд контакта с кислородом, что объясняет требования особых условий содержания в помещениях. Хранится только в посуде с керосином, силиконами или бензином. Обладает хорошей растворимостью при соединении со ртутью. Образует амальгамы.
На соединение с водой реагирует взрывом. При поднесении горелки окрашивает пламя в розово-фиолетовый цвет.
Химические характеристики
Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
- При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
- Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними.
Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C.
Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Особые соединения калия

- Бромид используется в фармацевтике для изготовления успокоительных лекарств.
- Карбонат, хлорид и нитрат пользуются популярностью у садоводов, так как представляют собой удобрения, обогащённые большим количеством полезных микроэлементов.
- Перманганат применяется в химических лабораториях для получения кислорода, а также ранее широко применялся в быту благодаря своим антисептическим свойствам.
- Пероксид и супероксид обеспечивают регенерацию воздуха на подводных лодках и противогазах, благодаря своей способности поглощать углекислый газ и выделять кислород.

Из описания характеристик калия с другими элементами становится понятно, что это крайне важная составляющая организма, которая должны взаимодействовать с другими металлами и неметаллами, чтобы обеспечить гармоничный рост и развитие организма. Норма потребления этого элемента для человека — 2040 мг в сутки.
Роль этого металла и реакций организма, в которых он принимает участие, имеют большое значение для строения клеток, из которых состоит любой живой организм. Благодаря образованию различных химических связей, калий помог человечеству добиться новых вершин в кораблестроении, садоводстве, фармацевтической промышленности.
Повсеместное нахождение в природе позволяет добывать металл и его соединения беспрерывно, а благодаря успехам учёных в области химии возможно регулировать плотность содержания калия в препаратах. При соблюдении правильных пропорций и составлении схем алгоритмов можно предугадать пользу или вред.
Калий может быть полезным, но также он способен обрекать людей на тяжкие мучения, такие как: ожоги рук, раздражение слизистых оболочек. Об этом следует помнить всем, кто стремится узнать больше о свойствах этого металла. Прежде чем начинать работу с опасными веществами, лучше узнать всё о многолетнем опыте предшественников, чтобы избежать печальных и необратимых последствий.
Калий, свойства атома, химические и физические свойства
K 19 Калий
39,0983(1) 1s2 2s2 2p6 3s2 3p6 4s1
Калий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 19. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), четвертом периоде периодической системы.
- Общие сведения
- Свойства атома калия
- Химические свойства калия
- Физические свойства калия
- Кристаллическая решётка калия
- Дополнительные сведения
Таблица химических элементов Д.И. Менделеева
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Калий |
| 102 | Прежнее название | |
| 103 | Латинское название | Kalium |
| 104 | Английское название | Potassium |
| 105 | Символ | K |
| 106 | Атомный номер (номер в таблице) | 19 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной металл |
| 109 | Открыт | Хемфри Дэви, Великобритания, 1807 г. |
| 110 | Год открытия | 1807 г. |
| 111 | Внешний вид и пр. | Мягкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 39K, 41K |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 1,5 % |
| 120 | Содержание в морях и океанах (по массе) | 0,042 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0003 % |
| 122 | Содержание в Солнце (по массе) | 0,0004 % |
| 123 | Содержание в метеоритах (по массе) | 0,07 % |
| 124 | Содержание в организме человека (по массе) | 0,2 % |
Свойства атома калия:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,0983(1) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 4s1 |
| 203 | Электронная оболочка | K2 L8 M8 N1 O0 P0 Q0 R0 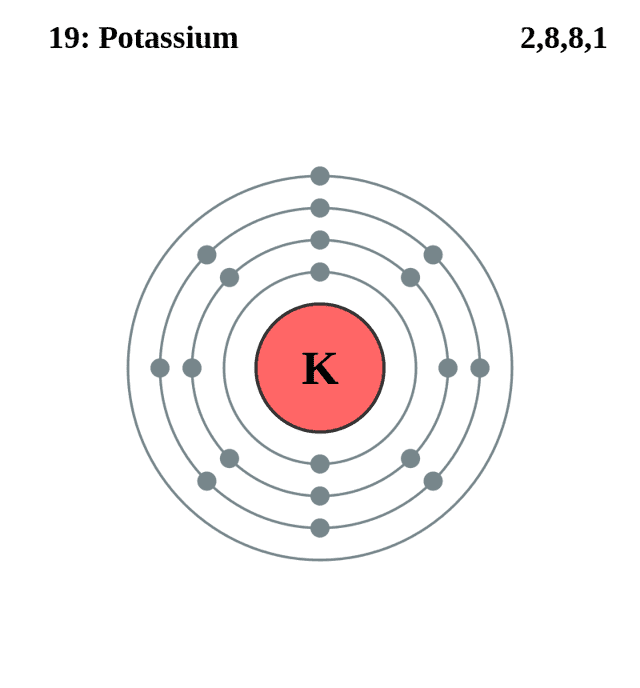 |
| 204 | Радиус атома (вычисленный) | 243 пм |
| 205 | Эмпирический радиус атома* | 220 пм |
| 206 | Ковалентный радиус* | 203 пм |
| 207 | Радиус иона (кристаллический) | K+
|
| 208 | Радиус Ван-дер-Ваальса | 275 пм |
| 209 | Электроны, Протоны, Нейтроны | 19 электронов, 19 протонов, 20 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |
Химические свойства калия:
Физические свойства калия:
| 400 | Физические свойства | |
| 401 | Плотность* | 0,862 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,828 г/см3 (при температуре плавления 63,5 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 63,5 °C (336,7 K, 146,3 °F) |
| 403 | Температура кипения* | 759 °C (1032 K, 1398 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,33 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 76,9 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| 411 | Молярный объём | 45,675584 см³/моль |
| 412 | Теплопроводность | 102,5 Вт/(м·К) (при стандартных условиях), 79,0 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | 83,3 мкм/(М·К) (при 25 °С) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Кристаллическая решётка калия:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная 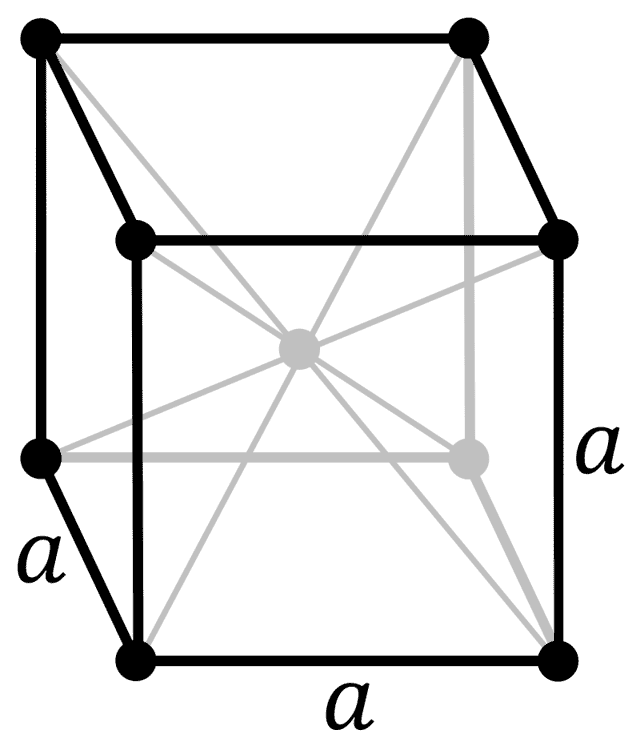 |
| 513 | Параметры решётки | 5,332 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 100 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-09-7 |
Примечание:
* — доступно в платной версии.
Источники:
[know]
Таблица химических элементов Д.И. Менделеева
Калий | это… Что такое Калий?
| 19 | Калий |
| [Ar]4s1 |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках).
В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д.
Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФ
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[8].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат).
При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью.
С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
с халькогенами (100—200 °C, E = S, Se, Te):
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
- Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
- Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
- При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
- При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
- Металлический калий реагирует со спиртами с образованием алкоголятов:
- Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
- При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
- Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия.
Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
- В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
- Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
- Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
- Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
- Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Основная статья: Гидроксид калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Кристаллы перманганата калия
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
| В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Основная статья: Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.
) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт).
В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
- Натрий
- Щелочные металлы
- Банановый эквивалент
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011. Проверено 26 января 2010.
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др.
Свойства калия и его взаимодействие с водой
[Deposit Photos]
Калий — девятнадцатый элемент периодической таблицы Менделеева, относится к щелочным металлам. Это простое вещество, которое при нормальных условиях пребывает в твердом агрегатном состоянии. Закипает калий при температуре 761 °С. Температура плавления элемента — 63 °С. Калий имеет серебристо-белую окраску с металлическим блеском.
Химические свойства калия
Калий — элемент, обладающий высокой химической активностью, поэтому его нельзя хранить на открытом воздухе: щелочной металл моментально вступает в реакцию с окружающими веществами. Этот химический элемент относится к I группе и IV периоду таблицы Менделеева. Калий обладает всеми характерными для металлов свойствами.
Он взаимодействует с простыми веществами, к которым относятся галогены (бром, хлор, фтор, иод) и фосфор, сера, азот и кислород. Взаимодействие калия с кислородом называется окислением.
В течение этой химической реакции кислород и калий расходуются в молярном соотношении 4:1, в результате чего образуется оксид калия в количестве двух частей.
Такое взаимодействие можно выразить уравнением реакции:
4К + О₂ = 2К₂О
Во время горения калия наблюдается пламя ярко-фиолетового цвета.
Такое взаимодействие считается качественной реакцией на определение калия. Реакции калия с галогенами называются в соответствии с названиями химических элементов: это фторирование, иодирование, бромирование, хлорирование.
Такие взаимодействия являются реакциями присоединения. Пример — реакция между калием и хлором, в результате которой образуется хлорид калия. Для проведения такого взаимодействия берут два моля калия и один моль хлора.
В результате образуется два моля калия:
2К + СІ₂ = 2КСІ
Молекулярное строение хлорида калия [Wikimedia]
При горении на открытом воздухе калий и азот расходуются в молярном соотношении 6:1. В результате такого взаимодействия образуется нитрид калия в количестве двух частей:
6К + N₂ = 2K₃N
Соединение представляет собой кристаллы зелено-черного цвета.
С фосфором калий реагирует по такому же принципу. Если взять 3 моля калия и 1 моль фосфора, получится 1 моль фосфида:
- 3К + Р = К₃Р
- Калий реагирует с водородом, образуя гидрид:
- 2К + Н₂ = 2КН
- Все реакции присоединения происходят при высоких температурах
Взаимодействие калия со сложными веществами
К сложным веществам, с которыми вступает в реакцию калий, относятся вода, соли, кислоты и оксиды. Так как калий — активный металл, он вытесняет атомы водорода из их соединений. Пример — реакция, происходящая между калием и соляной кислотой. Для ее проведения берется по 2 моля калия и кислоты. В результате реакции образуется 2 моля хлорида калия и 1 моль водорода:
2К + 2НСІ = 2КСІ + Н₂
Более детально стоит рассмотреть процесс взаимодействия калия с водой. Калий бурно взаимодействует с водой. Он движется по поверхности воды, его подталкивает выделяющийся водород:
2K + 2H₂O = 2KOH + H₂↑
В ходе реакции в единицу времени выделяется много тепла, что приводит к воспламенению калия и выделяющегося водорода. Это очень интересный процесс: при контакте с водой калий мгновенно воспламеняется, фиолетовое пламя потрескивает и быстро передвигается по поверхности воды. В конце реакции происходит вспышка с разбрызгиванием капель горящего калия и продуктов реакции.
Реакция калия с водой [Wikimedia]
Основной конечный продукт реакции калия с водой — гидроксид калия (щелочь). Уравнение реакции калия с водой:
4K + 2H₂O + O₂ = 4KOH
Внимание! Не пытайтесь повторить этот опыт самостоятельно!
При неправильном проведении эксперимента можно получить ожог щелочью. Для реакции обычно используют кристаллизатор с водой, в который помещают кусочек калия. Как только водород прекращает горение, многие хотят заглянуть в кристаллизатор.
В этот момент происходит завершающая стадия реакции калия с водой, сопровождающаяся слабым взрывом и разбрызгиванием образовавшейся горячей щелочи. Поэтому в целях безопасности стоит держаться на некотором расстоянии от лабораторного стола, пока реакция не завершится полностью.
Здесь вы найдете самые зрелищные опыты, которые можно проводить с детьми дома.
Строение калия
[Deposit Photos]
Атом калия состоит из ядра, в котором содержатся протоны и нейтроны, и электронов, вращающихся вокруг него. Количество электронов всегда равно количеству протонов, находящихся внутри ядра. При отсоединении электрона или при присоединении к атому он перестает быть нейтральным и превращается в ион. Ионы делятся на катионы и анионы. Катионы обладают положительным зарядом, анионы — отрицательным. При присоединении к атому электрона он превращается в анион; если же один из электронов покидает свою орбиту, нейтральный атом превращается в катион.
Порядковый номер калия в периодической таблице Менделеева — 19. Значит, протонов в ядре химического элемента находится тоже 19. Вывод: электронов вокруг ядра расположено 19.
Количество протонов в структуре атома определяется так: от атомной массы отнять порядковый номер химического элемента. Вывод: в ядре калия находится 20 протонов.
Калий принадлежит к IV периоду, имеет 4 «орбиты», на которых равномерно располагаются электроны, пребывающие в постоянном движении. На первой «орбите» расположены 2 электрона, на второй — 8; на третьей и на последней, четвертой «орбите», вращается 1 электрон.
Этим объясняется высокий уровень химической активности калия: его последняя «орбита» не заполнена полностью, поэтому элемент стремится соединиться с другими атомами. В результате электроны последних орбит двух элементов станут общими.






