- Диссоциация
- Разложение
- Взаимодействие кислот с металлами
- Таблица: химические свойства кислот-окислителей
- Взаимодействие кислот с солями
- Взаимодействие кислот с основными и амфотерными оксидами
- Восстановительные свойства бескислородных кислот
- Способность окрашивать индикаторы
- Вопросы для самоконтроля
- Комбинированный урок по химии в 8 классе с использованием презентации "Кислоты, их состав. Взаимодействие кислот с металлами. Реакции замещения. Понятие о солях"
- Взаимодействие кислоты с металлом
- 2.6. Характерные химические свойства кислот
- 1) Наличие атомов кислорода в кислоте
- 2) Основность кислоты
- 3) Летучесть
- 4) Растворимость
- 5) Устойчивость
- 6) Способность к диссоциации
- 7) Окисляющие свойства
- Химические свойства кислот
- 1. Способность к диссоциации
- 2. Взаимодействие кислот с металлами
- 3. Взаимодействие кислот с основными и амфотерными оксидами
- 4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
- 5. Взаимодействие кислот с солями
- 6. Специфические окислительные свойства азотной и концентрированной серной кислот
- 7. Восстановительные свойства бескислородных кислот
- Взаимодействие кислот с металлами
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами. Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
-
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
-
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

- Mg + 2HCl = MgCl2 + H2
- Zn + H2SO4 = ZnSO4 + Н2
- При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
| HNO3(разб) | NaNO3 + NH4NO3 +H2O | Mg(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Al(NO3)3 + в зависимости от разбавления кислоты N2O, NH4NO3 + H2O | Zn(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O | Fe(NO3)3 + NO + H2O | Cu(NO3)2 + NO + H2O |
| HNO3(конц) | NaNO3 + N2O + H2O | На холоду — пассивация | На холоду — пассивация | Cu(NO3)2 + NO2 + H2O | ||
| H2SO4(разб) | Na2SO4 + H2 | MgSO4 + H2 | При нагревании Al2(SO4)3 + H2 | ZnSO4 + H2 | При нагревании FeSO4 +H2 | Реакция не проходит |
| H2SO4(конц) | Na2SO4 + H2S + H2O | MgSO4 + H2S + H2O | На холоду — пассивация | ZnSO4 + SO2 + H2O | На холоду — пассивация | CuSO4 + SO2 + H2O |
| При нагревании Al2(SO4)3 + SO2 + H2O | При нагревании ZnSO4 +H2S + H2O | При нагревании Fe2(SO4)3 + SO2 + H2O |
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
- Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
- Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
- Результат этих реакций — образование свободных галогенов.
- 4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
- 14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
- 16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной.
Ее могут окислять оксид железа (III) и соль трехвалентного железа.
- 6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
- Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
- 2H2S + SO2 = 3S + 2H2O
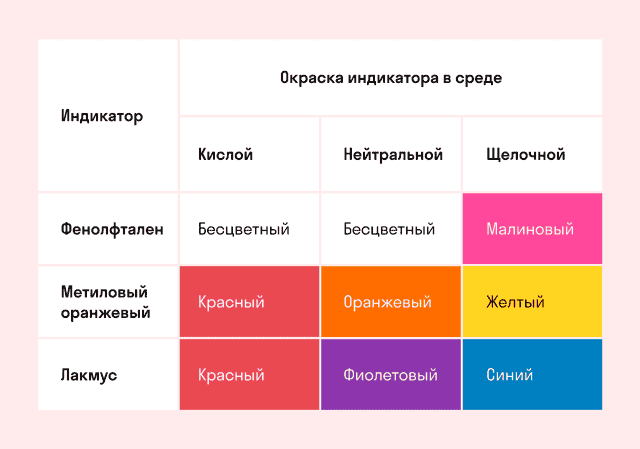
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
-
С чем реагируют кислоты?
-
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
-
- Составьте уравнения реакций и назовите продукты реакций:
- Ca + HCl
- Na + H2SO4
- CaO + HNO3
- Fe2O3 + H2SO4
- KOH + HNO3
- Al(OH)3 + HF
- HNO3 + CaCO3
-
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
-
- Соляная кислота вступает в реакцию с каждым из двух веществ:
- а. водой и цинком;
- б. магнием и оксидом серы (IV);
- в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Комбинированный урок по химии в 8 классе с использованием презентации "Кислоты, их состав. Взаимодействие кислот с металлами. Реакции замещения. Понятие о солях"
Комбинированный урок по химии в 8 классе с использованием презентации
Шустикова Ольга Валентиновна, учитель химии и биологии ГБОУ Школа 1381 г. Москва
Программа Е.Е. Минченкова. Учебник Минченков Е.Е., Зазнобина Л.С., Смирнова Т.В. ХИМИЯ: учебник для 8 класса средней общеобразовательной школы. – Смоленск: Ассоциация XXI век, 2006
Тема 2 «Важнейшие классы неорганических веществ. Типы химических реакций»
Урок 4/26 Кислоты, их состав. Взаимодействие кислот с
металлами. Реакции замещения. Понятие о солях.
Цели урока (Целеполагание):
- воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
- воспитание личностных качеств ученика – активности, самостоятельности, творчества, сотрудничества, общительности, коммуникативности.
- развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
- развитие мыслительных способностей – сопоставление, сравнение, анализ, синтез, умение делать выводы.
-
Обучающая: организовать деятельность учащихся на усвоение:
- знаний о составе, формулах, физических, химических свойствах и применении кислот;
- умений определять кислоты из ряда, характеризовать физические свойства кислот, составлять уравнения, характеризующие свойства кислот, экспериментально доказывать химические свойства кислот, определять тип химической реакции;
- применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Реактивы и оборудование: разбавленный раствор соляной кислоты, гранулы цинка, проволока меди, компьютер, проектор, презентация, индивидуальные лисы рефлексии (Приложение 1)
ЭТАПЫ УРОКА:
-
Организационный момент Слайд 1
-
Актуализация знаний (необходимо вспомнить те знания, которые потребуются на основном этапе урока)
- РЕФЛЕКСИЯ (НАЧАЛО УРОКА)
- Каждому ученику выдается индивидуальный лист рефлексии
- (Приложение 1) Сначала дети заполняют первую таблицу индивидуального листа (что знают хорошо, что вызывает затруднения), затем выполняют тест, после которого на экране сразу выводятся ответы и учащиеся сами себя оценивают.
- Слайды 2-12
- 1. Утверждение, в котором речь идет о сере как химическом элементе
- 1) кристаллическая сера желтого цвета
- 2) сера входит в состав сероводорода
- 3) сера плавится при температуре 1130С
- 4) серу используют для получения резины.
- 2. Оцените следующие суждения о свойствах кислорода:
- А) Хорошо растворим в воде;
- Б) Тяжелее воздуха.
- 1) верно только А
- 2) верно только Б
- 3) верны оба суждения
- 4) оба суждения неверны
-
Расставьте коэффициенты в уравнении реакции, схема которой
- Al + О2→Al2О3
- Коэффициент перед формулой кислорода равен
- 1) 1 2) 2 3) 3 4) 4
- 4. Реакцией соединения является
- 1) 4P + 5O2 = 2P2O5
- 2) MgCO3 = MgO + CO2
- 3) CН4 = С + 2H2
- 4) Cu(OH)2 = CuO + H2O
- 5. Химической формулой оксида алюминия является:
- 1) Al2О3
- 2) Al(ОН)3
- 3) AlН3
- 4) AlCl3
- 6. Формулы кислотного оксида и основного оксида соответственно
- 1) K2O и Mg(OH)2
- 2) HCl и H2O
- 3) SO3 и Li2O
- 4) BaO и Li2O
- 7. Оксиды, взаимодействующие между собой
- 1) K2O и Na2O
- 2) SO3 и H2O
- 3) FeO и H2O
- 4) Li2O и MgO
- 8. Реагируют с водой оба оксида пары
- 1) CuO, SiO2
- 2) Na2O, SO3
- 3) Fe2O3, CaO
- 4) Al2O3, СО2
- 9. Установите соответствие между формулой вещества и его
- относительной молекулярной массой: для каждой позиции из первого
- столбца выберите соответствующую позицию из второго столбца,
- обозначенную цифрой.
- ФОРМУЛА ОТНОСИТЕЛЬНАЯ
- МОЛЕКУЛЯРНАЯ МАССА
- А) SO2 1) 98
- Б) СuO 2) 80
- В) H3РO4 3) 64
- Г) H2SO4
- 10. На рисунке изображен прибор для получения кислорода разложением перманганата калия, который собрал Вася на практической
- Ваш взгляд, необходимо внести изменения:
- 1) закрепить пробирку вертикально
- 2) повернуть стакан донышком вниз
- 3) горелку поднять выше
- 4) закрепить пробирку горизонтально
- 5) стакан заменить пробиркой
- Ответ: ____________(Запишите цифры в порядке возрастания)
- Вопрос классу: Посмотрите на тему урока, давайте предположим, какую цель мы должны выполнить на уроке?
- Вместе с учениками формулируем основную цель урока – получение знаний о составе, формулах, физических, химических свойствах и применении кислот.
-
Изучение нового материала Слайды 14-19
Прочитайте текст и выполните задания:
Уксусная кислота. «Древесная кислота» (около 3 тыс. лет).
Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Знаете ли вы, что слово «уксус» происходит от греческого слова «оксос», означающего «кислый»? Почему уксусная кислота оказалась первой, понять нетрудно.
С древнейших времён люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его, видимо, выливали, а потом научились использовать как лекарство, приправу к пище, как растворитель красок. В России уксус, т.
е водный раствор уксусной кислоты, называли «кислая влажность» или «древесная кислота».
Серная кислота (Х в.)
С серной кислотой люди познакомились значительно позднее, примерно в Х в. Честь её открытия приписывается персидскому химику Абубекару аль Рези. Но это установлено не совсем точно.
По крайней мере серную кислоту человечество знает около 1000 лет. Серную кислоту выделили из купоросов, например из железного купороса, и соответственно назвали купоросным маслом.
Именно под таким названием серная кислота была известна в России.
Соляная и азотная кислоты были выделены и определены химиками примерно в ХV в.
Соляную кислоту называли соляным спиртом, а азотную кислоту – селитряной водкой. Получали эти кислоты с помощью серной кислоты, которую потом поэтично стали называть «матерью всех кислот».
Угольная кислота (ХVIII в.)
Угольную кислоту получил впервые в конце ХVIII века Джозеф Пристли, английский химик, он же священник. Для этого он растворял в воде углекислый газ. Раствор углекислого газа в воде назвали содовой водой, а так как она получила широкое применение как напиток, за это открытие Д. Пристли наградили золотой медалью.
К концу ХVIII в. химики уже знали более десятка кислот.
| Таксономия мыслительных умений Б. Блума | Задания на основе таксономии Б.Блума | Формируемые информационные умения |
| Знание |
Слайды 14, 15 |
Умение работать с письменными текстами, внимательное восприятие и запоминание информации, управление вниманием, умение рационально запоминать, логически осмысливать учебный материал. |
| Понимание |
Слайды 16, 17 |
Умение работать коллективно, умение ориентироваться в своей системе знаний. |
| Применение |
В чем их отличие? Слайд 18 |
Умение работать с письменными текстами, с книгой, умения самостоятельно добывать знания, осуществлять наблюдения и на основе их формулировать выводы, планировать предстоящую работу, рационально организовывать ее выполнение. |
| Анализ |
|
Умение анализировать, умение работать коллективно, умение осуществлять наблюдения и на основе их формулировать выводы. |
| Синтез Оценка |
Слайд 19 |
Умение синтезировать, планировать предстоящую работу, рационально организовывать ее выполнение, осуществлять самоконтроль и умение работать в определенном темпе, умение обобщать и делать выводы. |
Контекстная задача Слайды 20-23
Прочитайте текст и выполните задания:
Зачастую газеты публикуют сообщения о том, что кто-то был обожжен кислотой. И действительно, считается, что кислоты — это очень опасные жидкости, которые вызывают ожоги кожи, прожигают ткани.
Некоторые кислоты опасны для человека, но полезны в промышленности — применяются в производстве лекарств, красок, косметики и промышленных товаров Другие необходимы для жизнеобеспечения человека и присутствуют в пищевых продуктах.
Кислоты, которые присутствуют в продуктах питания, необходимы для здоровья. Есть кислоты, которые вырабатываются нашим организмом и необходимы для его жизнедеятельности.
Существует множество видов кислот, но все они могут быть разделены на два класса — неорганические и органические кислоты.
Соляная кислота – «дымящая» на воздухе, едкая жидкость. Получают ее растворением газообразного хлороводорода в воде, а хлороводород синтезируют обычно из простых веществ – водорода и хлора. Полученная таким способом кислота называется синтетической.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии серной кислоты на поваренную соль при слабом нагревании, образующийся при этом хлороводород так же растворяют в воде. Соляная кислота используется в производстве различных химических соединений и при очистке поверхностей металлов.
В организме человека производится незначительное количество слабой соляной кислоты, используемой при переваривании пищи.
Концентрированная серная кислота при обычных условиях тяжёлая маслянистая жидкость без цвета и запаха. Широко используется в промышленном производстве. Оказывает вредное воздействие на глаза и вызывает ожоги кожи. Азотная кислота тоже оказывает вредное воздействие на глаза и кожу.
Борная кислота используется при изготовлении керамики, цементов, косметики. Иногда ее используют для борьбы с микробами. Угольная кислота получается из углекислого газа, некоторое ее количество добавляют во фруктовые напитки.
Мышьяковая кислота используется при производстве дезинфицирующих средств.
Самыми известными органическими кислотами являются уксусная, муравьиная, лимонная, молочная. Уксусная кислота содержится в уксусе, ее можно получить при брожении яблочного сидра. При образовании сахара в молоке образуется молочная кислота. Она окисляет молоко, но также используется в производстве сыра.
Применение аминокислот способствует поддержанию крепкого здоровья, их мы получаем с белковой пищей. Апельсины, лимоны и грейпфруты содержат аскорбиновую кислоту — это химическое название витамина С. Никотиновая кислота присутствует в печени, мясе домашней птицы, говядине, она препятствует развитию кожных болезней.
Задания:
-
Прочитайте самостоятельно текст, подумайте, в чем опасность кислот для организма человека? Какие кислоты опасны, а какие полезны? В чем их польза? Приведите примеры из бытовой жизни. Слайд 20
-
Используя данный текст и дополнительную литературу, заполните таблицу: Слайды 21-23
Неорганические кислоты Органические кислоты Химическая формула Название Химическая формула Название - 1
- 2
- 3
- 1
- 2
- 3
-
В тексте описаны способы получения соляной кислоты. Запишите уравнения соответствующих реакций. Являются ли, по вашему мнению, эти способы получения кислоты оптимальными? Если да, обоснуйте свою позицию. Если нет, предложите свой способ.
-
Решите задачу: Сколько литров хлороводорода образуется при действии раствора серной кислоты на 117 г поваренной соли (по способу алхимиков)
-
Перечислите на примере соляной кислоты химические свойства кислот. Запишите уравнения реакций.
-
Где в организме человека производится небольшое количество соляной кислоты? В каких процессах жизнедеятельности человека она участвует?
-
Как вы можете помочь человеку, получившему химический ожог кислотой?
-
Совершенствование знаний и умений
Работа в парах: Слайд 24
- Дайте определение кислота.
- Состав каких кислот вы изучили?
- Что общего в формулах этих кислот?
- Какими свойствами обладают кислоты?
- Как кислоты реагируют с металлами?
- Какие реакции называются реакциями замещения?
- Почему кислоты обладают общими свойствами?
-
Рефлексия, подведение итогов урока Слайд 25
- Вспоминаем первоначальную цель, вместе с ребятами обсуждаем, выполнена ли она в ходе урока?
- Что нового вы узнали о кислотах?
- Что вызвало больший интерес?
- Что на уроке не понравилось? Давайте вместе подумаем, что надо сделать, чтобы следующий урок был интересней?
- Какой цвет больше подходит к вашему эмоциональному состоянию на уроке? Закрасьте в листе рефлексии квадрат этим цветом.
-
Домашнее задание Слайды 26, 27
-
Используя дополнительную литературу, заполните таблицу:
| Название вещества | Формула | Применение |
|
-
Найдите дополнительную информацию о свойствах кислот и разработайте презентацию на основе найденной информации.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ:
[1] Учебник Е. Е. Минченков «Химия-8»
- [2] ФГОС среднего (полного) общего образования по химии (базовый уровень)
- [3] Тексты диагностических работ МИОО
- [4] Задания курсов ХИ-10 МИОО «Проектирование педагогической деятельности учителя в свете образовательных стандартов нового поколения»
- [5] Интернет-источники информации
Взаимодействие кислоты с металлом
- Лабораторная работа 3
- Тема:Взаимодействие кислот с металлами, с оксидами металлов, с основаниями и солями.
- Цель: Овладение умениями проведения химических опытов, подтверждающих свойства кислот, с соблюдением правил техники безопасности.
- Задача:Закрепить знания по теме «Классификация неорганических соединений и их свойства».
- Реактивы и оборудование:Растворы NaOH, H2SO4, BaCl2, порошок Na2CO3, индикатор фенолфталеин; Zn; штатив с пробирками.
- Теоретические основы
- Кислоты – электролиты диссоциирующие в воде на ионы водорода и ионы кислотного остатка.
- H2SO4 ↔ 2H+ + SO42-
- рН среды кислоты стремится к 1(изменяет цвет индикаторной бумаги в малиновый); рН среды щелочи стремится к 10 (изменяет цвет индикаторной бумаги в синий); нейтральная среда дистиллированной воды рН=7цвет бумаги не меняется).
- Химические свойства:
- — разбавленные кислоты взаимодействуют с металлами, стоящими в ряду активности металлов до водорода, или имеющими меньший электродный потенциал, чем водород:
- 2HCl + Zn = ZnCl2 + H2;
- — взаимодействуют с оксидами металлов:
- 2HCl + ZnО = ZnCl2 + H2О;
- — взаимодействуют с основаниями и щелочами:
- 2HCl + Cu(OH)2 ↓ = CuCl2 + 2H2О
- HCl + NaOH = NaCl + H2О
- — взаимодействуют с солями слабых кислот
- FeS + 2HCl = H2S + FeCl2
- Выполнение работы
- Определение кислотности среды с помощью индикаторной бумаги.
Возьмите полоску индикаторной бумаги и намочите ее край исследуемой жидкостью из первых трех пробирок, стоящих в штативе. По получившейся окраске бумаги с помощью шкалы определите рН жидкости. Запишите наблюдения и выводы в таблицу: в каких из пробирок находится кислота, вода и щелочь. ( В пробирке №1….; в пробирке №2…; в пробирке №3…)
2. Взаимодействие кислоты с основаниями.
В пробирку, где определили щелочь ( NaOH), добавьте 2капли индикатора фенолфталеина (запишите изменение окраски раствора в таблицу),а затем прилейте раствора из той пробирки, где определили кислоту (H2SO4) до обесцвечивания раствора.Запишите наблюдения и химическую реакцию в таблицу.
Взаимодействие кислоты с солями.
3.1.В пробирку, содержащую хлористый барий прилейте раствор кислоты (серной) из определенной в первом опыте. Запишите наблюдения и химическую реакцию в таблицу.
3.2.В пробирку прилейте немного серной кислоты(H2SO4) и добавьте порошка карбоната натрия (Na2CO3) на кончике шпателя. Запишите наблюдения и химическую реакцию в таблицу.
Взаимодействие кислоты с металлом.
В пробирку с остатком серной кислоты после предыдущих опытов опустите гранулу цинка. Запишите наблюдения и химическую реакцию.
Отчет оформите в виде таблицы:
| Название опыта | Рисунок того, что делаете | Наблюдения и их объяснения | Наименование среды в опыте 1 Уравнения реакций в опытах 2,3,4.5 |
| 1.Испытание растворов индикаторной бумагой. | Цвет бумаги в пробирке №1 Цвет бумаги в пробирке №2 Цвет бумаги в пробирке №3 — | рН = какая среда? рН = какая среда? рН = какая среда? | |
| 2. Испытание раствора индикатором фенолфталеином. Взаимодействие кислот с основаниями | Изменения цвета жидкости | ||
| 3.Взаимодействие кислот с солями. 3.1. 3.2. | |||
| 4.Взаимодействие кислот с металлами |
Вывод:Выполнив задания лабораторной работы я (смотрим тему лабораторной работы)
2.6. Характерные химические свойства кислот
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H+, а также замещаться на атомы металла:
| одноосновные | двухосновные | трехосновные |
| HBr, HCl, HNO3, HNO2, HCOOH, CH3COOH | H2SO4, H2SO3, H2CO3, H2SiO3 | H3PO4 |
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
| Летучие | Нелетучие |
| H2S, HCl, CH3COOH, HCOOH | H3PO4, H2SO4, высшие карбоновые кислоты |
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
| хорошо диссоциирующие (сильные) | малодиссоциирующие (слабые) |
| H2SO4, HCl, HBr, HI, HNO3, HClO4 | H2CO3, H2SO3, H2SiO3 |
7) Окисляющие свойства
| слабые окислители (проявляют окислительные свойства за счет катионов водорода H+) | сильные окислители (проявляют окислительные свойства за счет кислотообразующего элемента) |
| практически все кислоты кроме HNO3 и H2SO4 (конц.) | HNO3 любой концентрации, H2SO4 (обязательно концентрированная) |
Химические свойства кислот
1. Способность к диссоциации
- либо в таком виде: HCl = H+ + Cl—
- либо в таком: HCl → H+ + Cl—
- По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
- В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
- CH3COOH CH3COO— + H+
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H+ :
- H3PO4 H+ + H2PO4—
- H2PO4— H+ + HPO42-
- HPO42- H+ + PO43-
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4— , которые, в свою очередь, диссоциируют лучше, чем ионы HPO42-. Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H+.
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
H2SO4 2H+ + SO42-
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.
) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода.
Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
H2SO4(разб.) + Zn ZnSO4 + H2
2HCl + Fe FeCl2 + H2
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после.
То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро.
Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
- Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
- H2SO4 + ZnO ZnSO4 + H2O
- 6HNO3 + Fe2O3 2Fe(NO3)3 + 3H2O
- H2SiO3 + FeO ≠
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
3H2SO4 + 2Al(OH)3 Al2(SO4)3 + 6H2O
5. Взаимодействие кислот с солями
- Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
- H2SO4 + Ba(NO3)2 BaSO4↓ + 2HNO3
- CH3COOH + Na2SO3 CH3COONa + SO2↑ + H2O
- HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть.
Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
- 4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
- 16HBr + 2KMnO4 2KBr + 2MnBr2 + 8H2O + 5Br2
- 14НI + K2Cr2O7 3I2↓ + 2Crl3 + 2KI + 7H2O
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
- 6HI + Fe2O3 2FeI2 + I2↓ + 3H2O
- 2HI + 2FeCl3 2FeCl2 + I2↓ + 2HCl
- Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
- 2H2S + SO2 3S↓+ 2H2O
Взаимодействие кислот с металлами
Учащиеся познакомились с химическим составом и классификацией кислот, выяснили их некоторые общие химические свойства. А именно: кислоты могут взаимодействовать с основаниями и основными оксидами.
Поэтому цель нашего урока — продолжить характеризовать общие химические свойства кислот в свете ионных представлений. Для этого нужно: научиться пользоваться рядом напряжений металлов для прогнозирования возможных химических реакций кислот.
В тетрадях записываем число и тему урока:
Взаимодействие кислот с металлами.
Если кислоты могут взаимодействовать с основаниями и основными оксидами, а ключевым элементом в их составе является металл, то возможно ли взаимодействие металлов с кислотами. Проверим это экспериментально.
Mg + HCl — выделяется газ. Следовательно, кислоты могут взаимодействовать с металлами. Попробуем разнообразить металлы. Возьмем Zn и Cu.
Дети демонстрационно проводят реакции взаимодействия цинка и хлороводородной кислоты при нормальных условиях (видимых изменения нет), затем при нагревании. Наблюдается выделение газа.
Другой ученик проводит реакцию взаимодействия меди с той же кислотой при обычных условиях и при нагревании. Реакция не идет. Отрицательный результат — тоже результат.
Подведем итог магний взаимодействует с кислотой при нормальных условиях, цинк — при нагревании, медь — не взаимодействует.
Почему же металлы по-разному взаимодействуют с кислотами? Разная химическая активность!
Подобные опыты проводил в прошлом веке русский химик Н.Н.Бекетов. На основании экспериментально полученных данных он составил ряд активности металлов, который называется рядом напряжения металлов. В нем металлы располагаются в порядке уменьшения химической активности. Учитель показывает активные металлы, металлы средней активности и малоактивные.
Хотелось бы мне посмотреть на вашу активность. Поднять руки вверх, выпрямить их и очень быстро сжимать и разжимать кулачки по 10 раз. (Повторить дважды) Достаточно! Теперь пальчиками потрите мочки ушей по 10 раз. (Повторить дважды). В процессе упражнения учитель быстро считает от 1 до 10. Кто успел за моим счетом, тот активный, а кто не успел — тот малоактивный.
Данный фрагмент урока объединяет физминутку и позволяет детям почувствовать понятие активности и малой активности.
Для следующего ролевого этапа урока нужны два мальчика. Один — знаменитый боксер Александр Балуев, а другой — маленький щупленький, трусливый Слабачок. Задание: сидят две подружки на стульчиках. Вам понравился стульчик под одной из подружек.
Как вы будете его освобождать для себя, находясь в сценическом образе своего героя? Дети предполагают возможные ситуации: боксер силой «вытряхнет» или попытается испугать сидящих. Слабачок же, тоже попытается выгнать, угрожать, испугать, но ему это не удается.
Нисколько не страшно.
А если это не персонажи, а химические элементы. Тогда можно увидеть суть наших химических реакций. Более активный металл замещает водород в составе кислоты. А почему же медь не взаимодействует с кислотой? Дети приходят к выводу, что медь — малоактивный металл и не может вытеснить водород из растворов кислот.
Вывод.
Мы выяснили закономерности взаимодействия кислот с металлами: водород из кислот вытесняют металлы, стоящие до водорода в ряду активности.
Пришло время закончить работу со схемами, соответствующими проведенным химическим реакциям взаимодействия металлов с кислотой:
На доске дети составляют реакции взаимодействия хлороводородной кислоты с цинком и магнием в молекулярном и ионном виде. Как видно из кратких ионных уравнений, вместо хлороводородной кислоты можно взять какую-либо другую кислоту. Конечно, есть кислоты, которые взаимодействуют с металлами по-особому, но об этом мы поговорим на уроках химии позже.
Итак, на уроке сегодня вы
- познакомились с рядом активности металлов;
- пополнили знания о химических свойствах кислот;
- выяснили, что о возможности реакции между кислотой и металлом подскажет ряд активности.
Домашнее задание, оценки за урок.
7.06.2011






