- Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
- Ионная связь
- Металлическая связь
- Водородная связь
- Донорно-акцепторный механизм — это что такое? :: SYL.ru
- Образование солей аммония
- Определения
- Образование катиона аммония
- Образование угарного газа
- Молекула азотной кислоты
- Свойства связи
- Особенности органических соединений
- Подведем некоторые итоги
- Донорно-акцепторные комплексы
- Образование донорно — акцепторных комплексов. Трансанулярный эффект
- Семиполярная связь
- 18.2. Донорно-акцепторные комплексы [1968 Маррел Дж., Кеттл С., Теддер Дж. — Теория валентности]
- Типы химической связи
- Разница между Донорными и Акцепторными примесями
- Содержание
- Что такое Донорная примесь?
- Что такое Акцепторная примесь?
- В чем разница между донорными и акцепторными примесями?
- Большая Рнциклопедия Нефти Рё Газа
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
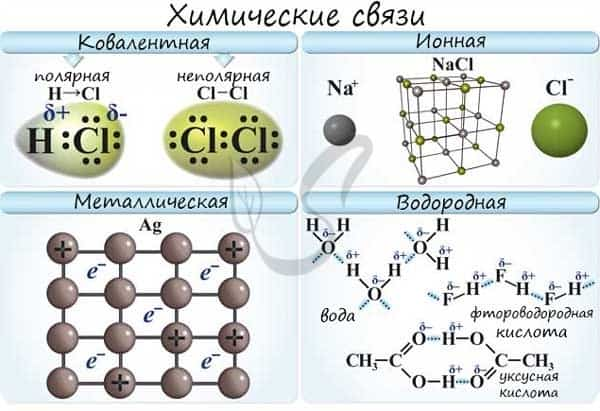
Ковалентная связь ( лат. со — совместно + valens — имеющий силу)
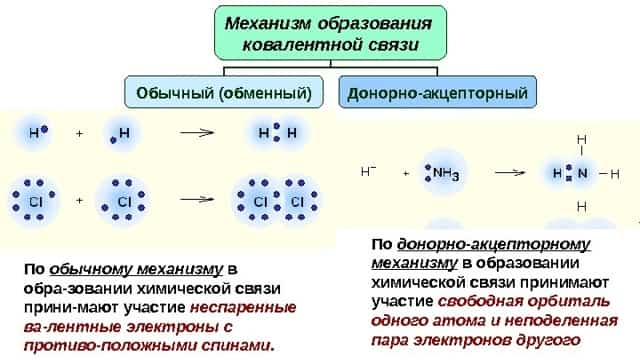
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
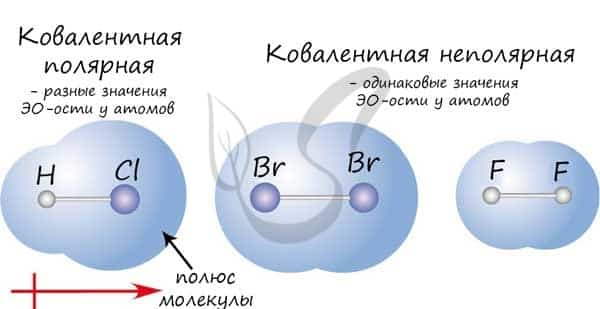
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет «полюса» — электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется «полюс» — электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
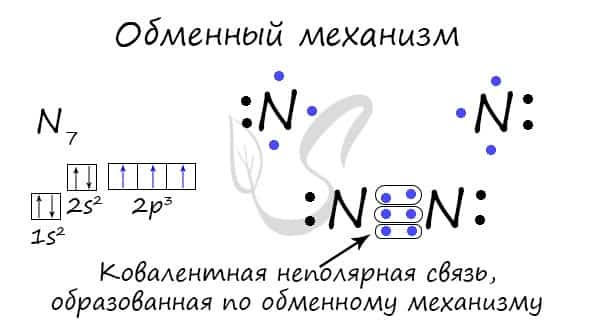
Ковалентная связь может быть образована по обменному механизму — обобществлению электронной пары. В таком случае каждый атом «одинаково» вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.
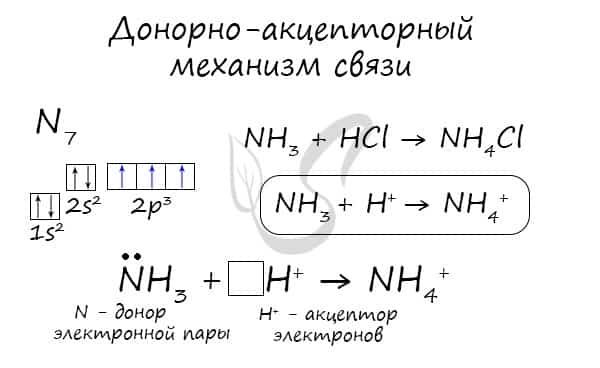
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ — в ионе аммония
- NH4+Cl, NH4+Br — внутри иона аммония во всех его солях
- NO3- — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O+ — ион гидроксония
- CO — угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
- Ионная связь — один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
- В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
- NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4.
Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
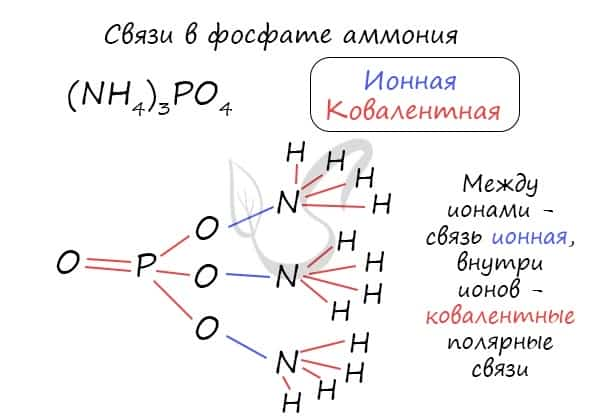
Металлическая связь
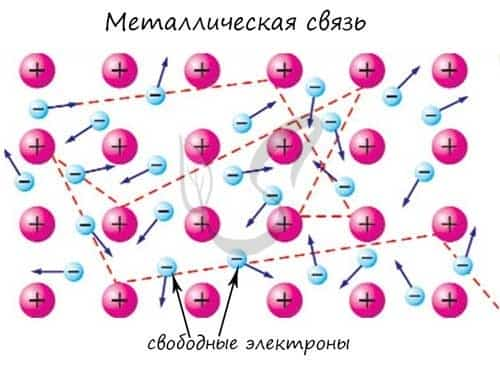
Металлическая связь — вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости — «электронного газа». По природе металлическая связь близка к ковалентной.
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородная связь — вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи — это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
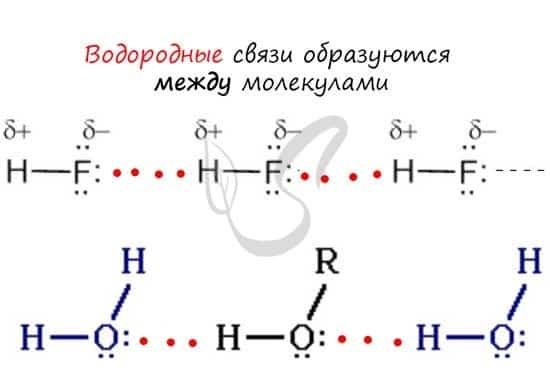
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Донорно-акцепторный механизм — это что такое? :: SYL.ru
Донорно-акцепторный механизм образования химической связи предполагает перенос заряда между акцептором и донором без создания между ними общей химической связи. Также возможна передача неподеленной пары электронов к акцептору от донора, в результате образуется связь.
Образование солей аммония
Рассмотрим донорно-акцепторный механизм на примере солей аммония. Начнем со взаимодействия аммиака (NH3) и трифторида бора (BF3). В процессе реакции происходит выделение 171,4 кДж/моль энергии. Взаимодействие протекает по уравнению:
NH3 + BF3 = NH3BF3
Из четырех орбиталей, имеющихся у атома бора, три заполнены электронами, следовательно, есть одна вакантная орбиталь.
В молекуле аммиака четыре орбитали азота укомплектованы электронами, причем три из них по обменному механизму дополнены электронами водорода. Одна орбиталь имеет электронную пару, принадлежащую только атому азота.
Ее называют неподеленной электронной парой. Именно благодаря ей возможен донорно-акцепторный механизм.
Соединение между аммиаком и трифторидом бора возможно благодаря тому, что вакантная электронная пара аммиака размещается на свободной орбитали фторида бора.
Это донорно-акцепторный механизм образования ковалентной связи. Атом азота увеличивает валентность благодаря использованию неподеленной пары электронов для дополнительной связи. Бор повышает валентность посредством расположения на орбитали дополнительных электронов.
Таким образом, валентность этих химических элементов характеризуется и неспаренными электронами, и неподеленными электронными парами, и свободными орбиталями на внешнем энергетическом уровне.
Определения
Донором в данном примере выступает атом азота, который отдает свою электронную пару на образование химической связи. Акцептором является бор, обладающий вакантной орбиталью, принимающий электронную пару.
Процесс сопровождается уменьшением потенциальной энергии данной системы, выделением эквивалентного количества энергии. Вопросы, касающиеся механизма образования данного вида ковалентной связи, включены в курс школьной программы по химии, они предлагаются в итоговых тестах выпускникам средней общеобразовательной школы.
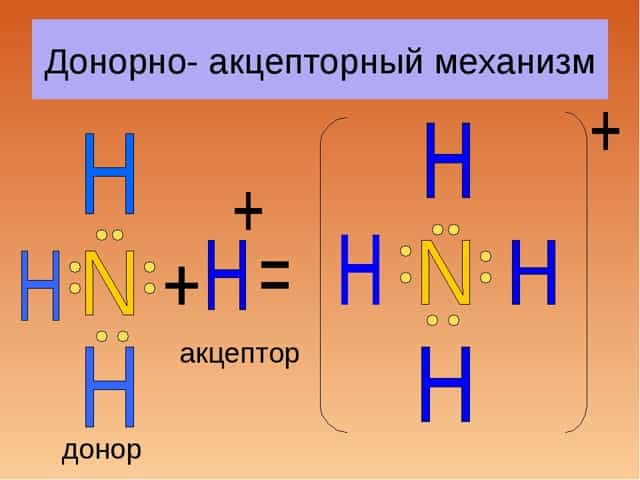
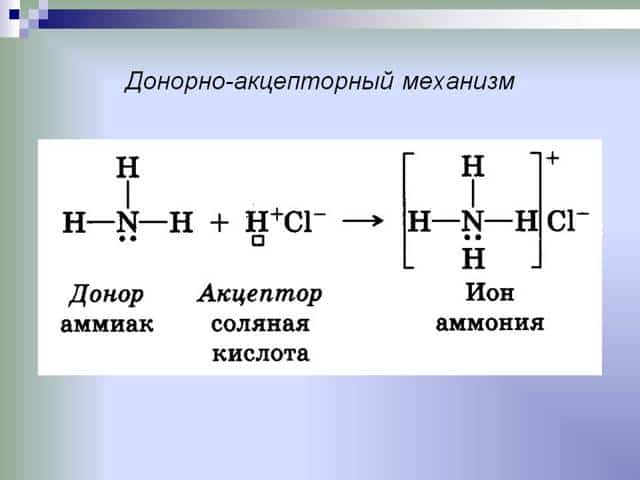
Образование катиона аммония
Ковалентная связь, образованная по донорно акцепторному механизму, характерна для солей аммония. Остановимся подробнее на ее особенностях. Итак, именно по донорно-акцепторному механизму образована связь между атомами азота и водорода в реакции:
NH3 + H+= NH4+
В качестве акцептора выступает пустая орбиталь катиона водорода. Азот в катионе аммония проявляет валентность 4. Образование связи происходит и благодаря паре электронов, которые до начала взаимодействия принадлежали азоту.
Это связь ковалентная по донорно-акцепторному механизму. В итоге взаимодействия образуется катион аммония, который по ионному механизму будет объединяться с анионами, содержащимися в кислотах.

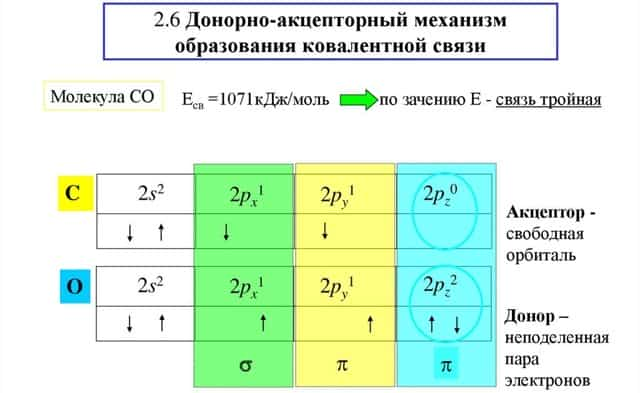
Образование угарного газа
Донорно-акцепторный механизм можно рассмотреть на примере молекулы СО. У атома углерода на внешнем энергетическом уровне располагаются два неспаренных электрона. Такое же количество неспаренных электронов есть и у атома кислорода. В результате между атомами образуется двойная связь.
За счет пары электронов кислорода и пустой орбитали углерода, для получения связи используется донорно-акцепторный механизм.
Молекула азотной кислоты
Благодаря наличию трех неспаренных электронов атом азота в данном соединении образует три варианта связей: с кислородом двойную, одинарную с кислородом гидроксильной группы. По донорно-акцепторному механизму образована связь между еще одним атомом кислорода и азота.
Неспаренные электроны размещаются на одной орбитали, при этом одна освобождается.
Также можно допустить, что атомом азота отдан кислороду электрон. Превратившись в катион аммония, имеющий 4 неспаренные электрона, он удерживает анион благодаря силам электростатического взаимодействия.
Свойства связи
В качестве донора выступают молекулы, в составе которых есть атомы N, O, F, Cl, связанные с атомами иных химических элементов. Акцептором выступает частица, имеющая вакантные электронные уровни. К примеру, это могут быть представители d-семейств, которые имеют незаполненные d-орбитали.
В молекуле аммиака для образования связи задействованы три неспаренных электрона атома азота, и по 1s-электрону у трех атомов водорода. Связи находятся вдоль трех осей р-орбиталей.
Молекула имеет вариант правильной пирамиды, в углах которой располагаются атомы водорода, а в вершине — азот азота. Угол между связями составляет 107 градусов.
Аналогичные по форме молекулы образуют с водородом следующие элементы: сурьма, мышьяк, фосфор.
Свойства ковалентной связи, которая образуется по донорно-акцепторному механизму, не отличаются от характеристик связи, сформированной по обменному механизму. В качестве доноров могут выступать атомы азота, серы, фосфора, кислорода, владеющие неподеленными электронными парами на валентных орбиталях небольшого размера.
- Функцию акцептора выполняют катионы водорода, часть р-металлов, к примеру, алюминий, образуя ион AlH4-.
- Также акцепторами выступают d-элементы, у которых есть незаполненная энергетическая ячейка во внешнем электронном слое.
- Отметим, что на данный механизм образования связи распространяются все основные характеристики: насыщаемость, длина, кратность.
Особенности органических соединений
Взаимодействие по обменному механизму возможно для органических доноров. В частности, среди них можно отметить π-доноров, типичным примером которых является тетракис(диметиламино)этилене (ТДАЭ), органические акцепторы (фуллерены), хинодиметаны с акцепторными заместителями.
При химическом взаимодействии подобных соединений создается комплекс с переносом заряда. В нем заряженный положительно донор с отрицательно заряженным акцептором взаимодействуют благодаря силам электростатической природы. Значение имеют системы, в которых перенос заряда в основном электронном состоянии происходит частично, а в случае фото возбуждения наблюдается полная его передача.
Такие системы, донорно-акцепторные диады, триады, внутри которых между акцептором и донором есть мостиковая группа, позволяющая повышать длительность состояния с переносом электрического заряда, применяются для получения устройств, преобразующих солнечную энергию. Подобное явление, связанное с переносом заряда в любых его формах, применяется во многих биологических процессах.
Именно поэтому так подробно рассматриваются особенности протекания взаимодействий по донорно-акцепторному механизму в органических соединениях, анализируются возможности ускорения (замедления) подобных процессов, варианты введения дополнительных веществ (катализаторов).
Подведем некоторые итоги
Донорно-акцепторное взаимодействие является одним из важнейших проявлений ковалентной полярной химической связи. Ему уделяется существенное внимание в неорганической, аналитической, органической химии.
К примеру, именно с точки зрения донорно-акцепторного механизма поясняется образование ковалентных локализованных связей в молекулярных ионах координационных (комплексных) соединений.
Связь в них создается благодаря неподеленной паре электронов лиганда и свободной орбитали комплексообразователя. Также донорно-акцепторный механизм поясняет формирование промежуточных продуктов.
В частности, это создание комплексов с переносом заряда.
Существует модель донорно-акцепторного механизма лишь в рамках представлений о валентности как о возможности локализации плотности электронов в процессе формирования ковалентных связей.
Именно этот механизм является основой образования разнообразных комплексных соединений.
Такое взаимодействие необходимо для кислотно-основных превращений, касающихся переноса иона водорода (акцептора), образования наноструктур.
Донорно-акцепторные комплексы
При образовании обычных ковалентных связей некоторые элементы (кислород, азот, фосфор, сера) используют не все внешние валентные электроны. У них на гибридных и негибридизованных орбиталях есть одна или более неподеленная электронная пара.
При взаимодействии заполненной двухэлектронной атомной орбитали такого гетероатома, который выступает донором пары электронов, с вакантной орбиталью атома с недостатком электронов — акцептор электронной пары, образуется новая ковалентная связь.
Определение 1
Донорно — акцепторная (координационная) связь — это ковалентная связь, образованная за счет электронной пары одного атома.
Пример 1
Донорно — акцепторная связь возникает в результате взаимодействия аминов с протонами кислот. Два электрона атома—донора в одинаковой степени относятся двум связанным атомам.
В результате атом—донор приобретает положительный заряд.
Появившаяся ковалентная связь (например, в ионе алкиламония), по свойствам будет идентична другим связям $N-H$, отличие состоит только в способе образования связи:
Рисунок 1.
В результате образуется соль алкиламмония. Подобные «ониевые» соли появляются если донором пары электронов выступают атомы фосфора, серы, кислорода. Роль катиона могут выполнять протон, карбокатион, атом углерода, имеющий дефицит электронной плотности.
Пример 2
Образующаяся по донорно — акцепторному механизму связь $C-S$ в триметилсульфонийбромиде не отличается от других ковалентных связей $C-S$:
Рисунок 2.
К донорно- акцепторному типу относятся связи в комплексных соединениях.
В таких соединениях донором пары электронов выступают:
- гетероатом с неподеленной электронной парой ($n$-доноры);
- $pi $-электроны изолированной $pi $-связи или системы $pi $-связей ,
Роль акцепторов выполняют:
- ионы металлов, содержащие вакантные оболочки;
- молекулярные бром, иод (за счет расширения валентной оболочки);
- электронодефицитные $pi $-системы (соединения, в которых $pi $-система или $pi $-связь обеднены электронной плотностью в результате акцепторного влияния заместителей).
Пример 3
Бензол-ион серебра (А), диоксан-триоксид серы (Б), металлоцены — $pi $-комплексы ароматического циклопентадиенид-иона с ионами переходных металлов $(Co^{2+}, Fe^{2+}, Ni^{2+})$.
В ферроцене $(B)$ взаимодействие двух колец циклопентадиенид-ионов с ионом железа происходит в результате перекрывания связывающих $pi $- молекулярных орбиталей богатых электронной плотностью колец с вакантными $3d$ атомными орбиталями иона $Fe^{2+}$
Рисунок 3.
Образование донорно — акцепторных комплексов. Трансанулярный эффект
При образовании донорно — акцепторных комплексов действуют силы, способные сблизить молекулы на расстояние , которое меньше ван-дер-ваальсовыхрадиусов. Если одно соединение имеет пустую низко находящуюся орбиталь, а другое соединение — заполненную несвязывающую орбиталь, то между ними возможно взаимодействие, в результате которого появляются прочные комплексы:
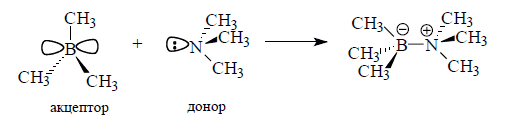
- Рисунок 4.
- Так как органическое соединение с ковалентной связью имеет занятые (связывающие и несвязывающие) молекулярные орбитали, возникновение донорно — акцепторных комплексов становится общим явлением.
Появление комплекса между двумя первоначально кинетически независимыми молекулами связано с уменьшением энтропии.
Следовательно, возможно, что донорно — акцепторное взаимодействие будет достаточно большим, если донорная и акцепторная группы расположены внутри одной молекулы и в результате особенностей молекулярной структуры сближены на расстояние, необходимое для осуществления такого взаимодействия.
Такой тип внутримолекулярного взаимодействия называется трансаннулярным эффектом.
Пример 4
Трансаннулярный эффект встречается у элементоорганических соединений атранов со связями типа $N: >M$, где $M=B$, $Si$ и др.
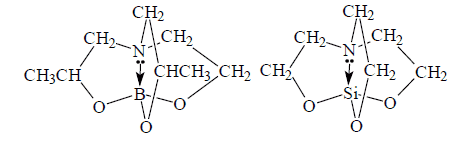
Рисунок 5.
В соединениях баратран и силатран донорно — акцепторная связь показана стрелкой, направленной от азота к бору и от азота к кремнию.
Структура молекул не является полностью цвиттерионной, содержащей фрагмент $N^+-M^-$, то есть связь не полностью ковалентная. Переход пары электронов от азота к атому элемента М является неполным.
Поэтому донорно — акцепторные комплексы называют комплексами с переносом заряда (КПЗ).
КПЗ можно наблюдать спектрально, когда в результате фотовозбуждения происходит полный перенос заряда. Если раствор смеси донора и акцептора в видимом или ультрафиолетовом спектрах дают новую полосу, отсутствующую в спектрах растворов донора и акцептора, которые сняли порознь (полоса переноса заряда), то это служит доказательством образования комплекса с переносом заряда.
При донорно — акцепторном взаимодействии перенос заряда возможен только при тесном сближении донора и акцептора. Электроны переходят от донора к акцептору в результате перекрывания пустой орбитали акцептора с заполненной орбиталью донора. Между донором и акцептором в области перекрывания происходит «делокализация».
- Донорно — акцепторное взаимодействие характерно для $pi $-систем, электроны которых способны легко поляризоваться, а орбитали с легкость проникают одна в другую.
- Сопряжение кратных связей является боковым донорно — акцепторным взаимодействием, которое ведет к переносу заряда, то есть к делокализации.
- В результате донорно — акцепторного взаимодействия образуются $pi $-комплексы.
Семиполярная связь
Семиполярная связь является разновидностью донорно — акцепторной связи. Атом — донор образует связь с нейтральным атомом, у которого не хватает двух электронов для завершения внешней оболочки.
Пример 5
Семиполярная связь образуется в $N$-оксидах при взаимодействии аминов с пероксидом водорода. Атом азота дает свою пару электронов для образования связи с атомом кислорода. Происходит перераспределение электронной плотности. На связанных атомах появляются разноименные заряды:
[R_3ddot{N}+H_2O_2 o R_3N^+-O^-+H_2O]
В результате взаимодействия третичного амина с пероксидом водорода образуется $N$-оксид третичного амина.
Семиполярная связь является совмещением ковалентной и ионной связей. Ее характерный признак — наличие противоположных зарядов на ковалентно связанных атомах.
18.2. Донорно-акцепторные комплексы [1968 Маррел Дж., Кеттл С., Теддер Дж. — Теория валентности]
Новости Библиотека Таблица эл-тов Биографии Карта сайтов Ссылки О сайте
Молекулярным комплексом называют группу из двух или большего числа молекул, связанных между собой. Типичные примеры таких комплексов: BF3 ← NH3 и хинон — гидрохинон (хингидрон).
Оба эти комплекса можно приготовить в виде кристаллов с точно определенной стехиометрией 1:1.
Известно также много примеров, когда объединение двух молекул в комплекс происходит в растворе (получить такие соединения в виде кристаллов не удается). Одним из примеров такого рода является комплекс иод-бензол.
Все эти комплексы имеют общую особенность: одна из молекул является донором электронов, а другая — акцептором:
Донором электронов является молекула, облагающая слабо связанными электронами (например, неподеленная пара в NH3) и соответственно малым потенциалом ионизации. Благодаря этому свойству молекула может быть восстановителем или льюисовским основанием.
Акцептор, с другой стороны, имеет вакантную орбиталь с низкой энергией (например, вакантная 2р-орбиталь в BF3). Акцепторы обладают большим сродством к электрону и могут быть окислителями или льюисовскими кислотами.
Однако на самом деле способность к захвату или отдаче электронов (акцепторное и донорное свойства) следует всегда рассматривать по отношению к партнеру в комплексе.
Так, фенильная группа захватывает электроны заместителя в молекуле анилина, но отдает их заместителю в нитробензоле; точно так же бензол ведет себя как донор по отношению к молекуле иода, но как акцептор по отношению к молекуле или атому с более сильными донорными свойствами (например, щелочному металлу).
Во многих случаях донорно-акцепторный комплекс сильно окрашен. Например, гидрохинон бесцветен, а хинон желтого цвета: кристаллы же хингидрона имеют характерный зеленый цвет с металлическим отливом. Аналогично растворы бензол — иод обнаруживают в ультрафиолетовой области полосу поглощения около 3000 А, которая отсутствует в спектрах иода и бензола в отдельности.
Первое удовлетворительное квантовомеханическое рассмотрение таких молекулярных комплексов было проведено Малликеном. Он показал, что как стабильность комплексов, так и их характерные электронные спектры поглощения связаны с донорно-акцепторными свойствами.
Пусть Ψ(D) и Ψ(А) — соответственно волновые функции донора и акцептора в отдельности. Волновую функцию системы из невзаимодействующих донора и акцептора можно записать в виде
Ψ∞ (D, A) = Ψ(D) Ψ(A). (18.2)
Подобно этому, если имеются ионы D+ и А-, разведенные на большое расстояние, волновой функцией такой системы является
Ψ∞ (D+, A-) = Ψ(D+) Ψ(A-). (18.3)
Когда две молекулы сближаются и их электронные облака перекрываются, то обе волновые функции следует исправить таким образом, чтобы учесть возможность обмена электронов в соответствии с принципом антисимметрии. Формально это можно сделать, если ввести оператор антисимметризации, который преобразует простое произведение в антисимметризованную сумму произведений *).
Ψ (D, A) = A Ψ (D) Ψ (A);
Ψ (D+, A-) = A Ψ (D+) Ψ (A-). (18.4)
- *) ()
- Запишем полную волновую функцию молекулярного комплекса в виде линейной комбинации этих двух функций
- Ψ = aΨ (D, А) + bΨ (D+, A-) (18.5)
и определим коэффициенты этой комбинации, решая соответствующие уравнения. При этом получим два решения. Соответствующие волновые функции можно представить в виде
Ψ1 = a1 Ψ (D, A) + b1 Ψ (D+, A-),
Ψ0 = a0 Ψ (D, A) + b0 Ψ (D+, A-). (18.6)
Энергия, соответствующая функции Ψ0, ниже энергий, отвечающих функциям Ψ (D, А) и Ψ (D+, — А-) в отдельности, и потому возможное объяснение стабильности комплекса следует искать именно во взаимодействии этих состояний. Электронный переход Ψ0 → Ψ1, которому нет аналога ни у донора, ни у акцептора, можно связать с полосами поглощения, характерными для комплекса.
Рассмотрим сначала слабые комплексы, которые обычно образуются органическими молекулами.
В этом случае состоянию Ψ (D, А), которое Малликен называет несвязывающим, соответствует значительно более низкая энергия, чем ионному (с переносом заряда) состоянию Ψ (D+, — А-).
Кроме того, матричный элемент гамильтониана, вычисленный с функциями Ψ (D, А) и Ψ (D+, — А-), обычно мал. Поэтому волновую функцию основного состояния можно записать в виде
- Ψ0 = Ψ (D, A) + b0 Ψ (D+, A-), (18.7)
- где b0
Типы химической связи
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
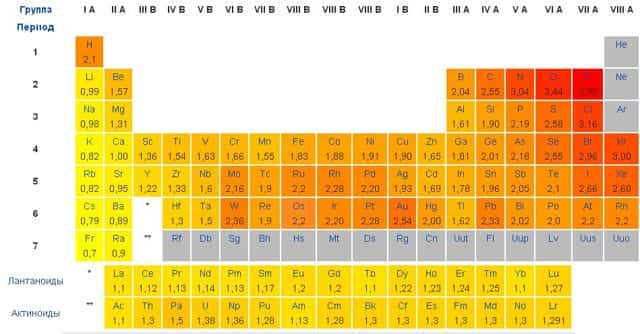
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4
Разница между Донорными и Акцепторными примесями
Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в группе V периодической таблицы элементов обычно действуют как Донорные примеси (отдающие), тогда как элементы в группе III обычно действуют как Акцепторные примеси (принимающие).
Легирование полупроводников — это процесс, при котором добавляются примеси в полупроводник. Легирование используется для увеличения проводимости полупроводника. Существует две основные формы примесей: Донорные и Акцепторные. При донорном легировании добавляются Донорные примеси, тогда как при акцепторном легировании добавляются Акцепторые примеси.
Содержание
- Обзор и основные отличия
- Что такое Донорные примеси
- Что такое Акцепторные примеси
- В чем разница между Донорными и Акцепторными примесями
- Заключение
Что такое Донорная примесь?
Донорные примеси — это донорные (отдающие) химические элементы, добавляемые к полупроводнику для увеличения его электропроводности.
Элементы в V группе периодической таблицы элементов являются общими донорными примесями. Донором является атом или группа атомов, которые могут образовывать области n-типа (от англ.
«negativ» — что переводится как «отрицательный») при добавлении в полупроводник. Типичным примером является кремний (Si).
Кремний с Донорной примесью фосфора
К элементам V группы, которые часто служат в качестве донорных примесей, относятся мышьяк (As), фосфор (P), висмут (Bi) и сурьму (Sb). Эти элементы имеют пять электронов в своей внешней электронной оболочке (у них есть пять валентных электронов). При добавлении одного из этих примесных элементов к кремнию, образуется четыре ковалентные связи.
Но теперь есть свободный электрон, так как было пять валентных электронов. Этот электрон так и останется свободным электроном, что увеличит проводимость полупроводника. Число примесных атомов определяет количество свободных электронов, присутствующих в доноре.
Что такое Акцепторная примесь?
Акцепторная примесь представляют собой акцепторные (принимающие) химические элементы, добавляемые в полупроводник для увеличения его электропроводности. Элементы в III группе периодической таблицы элементов используются в качестве акцепторных примесей.
Эти элементы включают алюминий (Al), бор (B) и галлий (Ga). Акцептор представляет собой легирующую примесь, которая образует области р-типа (от англ. «positiv» — что переводится как «положительный») при добавлении в полупроводник.
Атомы акцепторных примесей имеют три валентных электрона в своих внешних электронных оболочках.
Кремний с Акцепторной примесью бора
При добавлении в полупроводник акцепторного атома примеси, например такого как алюминий, он заменяет атомы кремния в полупроводнике. Перед этим атом кремния имеет вокруг себя четыре ковалентные связи.
Когда атом алюминия занимает положение кремния, этот атом алюминия образует только три ковалентные связи, что, в свою очередь, приводит к образованию свободной вакансии ковалентной связи у соседних атомов. Эта свободная вакансия называется дыркой. Из соседней ковалентной связи на место свободной дырки может перескочить электрон.
Эти дырки используются при прохождении электричества через полупроводник. При прохождении электричества в полупроводнике происходит хаотическое блуждание дырок.
Когда число добавленных примесных атомов увеличивается, число дырок, присутствующих в полупроводнике, также увеличивается. Это добавление примеси, увеличивает проводимость в полупроводнике. После завершения процесса легирования полупроводник становится внешним (легированным) полупроводником.
В чем разница между донорными и акцепторными примесями?
| Донорные против Акцепторных примесей | |
| Донорные примеси — это донорные элементы, добавляемые к полупроводнику для увеличения его электропроводности | Акцепторные примеси представляют собой акцепторные элементы, добавляемые к полупроводнику для увеличения его электропроводности |
| Распространенные примеси | |
| Элементы V группы | Элементы III группы |
| Примеры примесей | |
| Мышьяк (As), фосфор (P), висмут (Bi) и сурьма (Sb) | Алюминий (Al), бор (B) и галлий (Ga) |
| Процесс | |
| Увеличение свободных электронов в полупроводнике | Увеличение дырок в полупроводнике |
| Валентные Электроны | |
| Атомы имеют пять валентных электронов | Атомы имеют три валентных электрона |
| Ковалентное соединение | |
| Образует четыре ковалентные связи внутри полупроводника, оставляя пятый электрон в качестве свободного электрона | Образует три ковалентные связи внутри полупроводника, оставляя дырку, где ковалентная связь отсутствует |
Полупроводники — это материалы, занимающие промежуточное место между диэлектриками, который не является проводником, и проводниками. Доноры и Акцепторы — это легирующие примеси, которые образуют проводящие электрический ток области в полупроводниках. Легирование Донором или Акцептором — это процессы, которые увеличивают электропроводность полупроводника. Основное различие между Донорными и Акцепторными примесями заключается в том, что элементы в III группе периодической таблицы действуют как Донорные примеси, тогда как элементы в V группе действуют как Акцепторные примеси.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Доноры электронов, подводимые к частице из газовой фазы, способны образовывать комплексы с кислотой Льюиса и водородом ( перемещающимся из другой части структуры или из внешнего источника), обусловливающие структурные смещения кислорода и водорода и образование структур с четырехкоординационно связанным алюминием. Адсорбированный донор электрона ведет себя по отношению к четырехкоординационно связанному иону алюминия, со -: держащемуся на активных участках катализатора, как стабилизирующий ион. [1]
Донор электронов в органических реакциях замещения характеризуется нуклеофильной реакционной способностью.
Долгое время РѕРЅР° связывалась СЃ основностью реагента РїРѕ отношению Рє протону, Рё лишь сравнительно недавно было окончательно установлено, что нуклеофильность — это значительно нечто большее, чем основность. [2]
- Доноры электронов ( называемые РЅР° языке классической С…РёРјРёРё заместителями первого СЂРѕРґР°) поэтому Рё ориентируют электрофильные замещения РІ орто — Рё пара-положения. [3]
- Донор электронов во всех случаях является источником углерода для клеточного синтеза. [4]
- Доноры электронов в карбонильной или эфирной части ацеталей повышают, таким образом, скорость реакции. [5]
Донор электронов Y для фотосистемы I расположен РІ конце последовательности компонентов электронтранспортной цепи — после пластохинона, цитохрома f Рё пластоцианина. Q является акцептором электронов РІ фотосистеме II Рё получает РёС… через Р -680 РѕС‚ РґРѕРЅРѕСЂР° Z. Как уже отмечалось, восстановительный акцептор Q передает электроны фотосистеме I. Окисленный РґРѕРЅРѕСЂ Z является достаточно сильным окислителем, способным окислить РІРѕРґСѓ, что РїСЂРёРІРѕРґРёС‚ Рє выделению кислорода. [6]
Донорами электронов, как известно, часто бывают атомы азота, кислорода, серы.
Металл соединяется в комплексах с рядом атомов, или групп, число которых ( так называемое координационное число) гораздо больше его валентности. [7]
Донором электронов является молекула, обладающая слабо связанными электронами ( например, неподеленная пара в NH3) и соответственно малым потенциалом ионизации.
Благодаря этому свойству молекула может быть восстановителем или льюисовским основанием.
Акцепторы обладают большим сродством к электрону и могут быть окислителями или льюисовскими кислотами.
Однако на самом деле способность к захвату или отдаче электронов ( акцепторное и донорное свойства) следует всегда рассматривать по отношению к партнеру в комплексе. [8]
Донорами электронов могут служить молекулы соединений азота ( аммиак, триметиламин, пиридин и др.), кислорода ( окись углерода, вода, диметиловый эфир и др.), а также ионы галогенов. [9]
Донором электрона при генерировании анион-радикалов ароматических соединений может служить частица нуклеофила.
Начиная с работы [109], многими исследователями показано, что ароматические нитросоединения могут восстанавливаться в анион-радикалы под действием различных нуклеофильных реагентов. [10]
Донорами электронов могут служить любые атомы, имеющие неподеленную пару электронов.
Такими, например, являются атомы О, S, Р, As, C1 и др.
в ониевых соединениях: оксониевых, сульфоние-вых, фосфониевых, арсониевых, хлорониевых и других солях. [11]
Донорами электронов могут быть не только атомы с неподеленными электронными парами. [12]
Донорами электронов могут служить также отрицательные органические ионы: прл этом образуются комплексные ионы.
Так, например, триметилбор реагирует с метиллитием в эфирном растворе с образованием тетраметилбората лития.
[13]
- Донорами электронов служат Н2 или различные органические соединения. [14]
- Донором электрона в КПЗ диацетильного производной; XXXV следует принять ТГХ-систему по аналогии с диаце тильным производным димера ДГХ ( XXXII), где отщепление ацетильной группы имело место у донора. [15]
- Страницы: 1 2 3 4






