- Общие физические и химические свойства металлов
- Общие химические свойства металлов
- 1. Реакции металлов с неметаллами
- 2. Реакции металлов с кислотами
- 3. Взаимодействие металлов с водой
- 4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Коррозия металлов
- Химические свойства металлов
- 1. Взаимодействие металлов с неметаллами
- 2. Взаимодействие металлов с водой
- 3. Взаимодействие металлов с растворами солей
- 4. Взаимодействие металлов с растворами щелочей
- 5. Взаимодействие металлов с кислотами
- Химические свойства металлов
- Взаимодействие с простыми веществами
- Взаимодействие металлов друг с другом
- Взаимодействие металлов с водой
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с солями
- Примеры решения задач
- Химические свойства металлов | Химическая энциклопедия
- Урок 5: Общие свойства металлов
- Строение атомов металлов
- Разновидности металлов
- Щелочные металлы
- Химические свойства щелочных металлов
- Взаимодействие с неметаллами
- Взаимодействие со сложными веществами
- Щелочноземельные металлы
- Химические свойства
- Взаимодействие с неметаллами
- Взаимодействие со сложными веществами
- d- металлы
- Железо
- Медь
- Цинк
- Цветной и черный металлы
- Способы получения металлов
- Электролиз
- Электролиз расплавов
- Электролиз воды
- Свойства металлов
- Физические свойства металлов
- Химические свойства металлов
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с азотной кислотой (HNO3)
- Взаимодействие металлов с разбавленной азотной кислоты
- Нахождение металлов в природе
- Урановая руда
- Сплавы
- Алюминиевые сплавы
- Вывод
- Химические свойства металлов
- Сегодня мы с вами изучим общие химические свойства металлов.
- В реакциях металлы проявляют восстановительные свойства, то есть они отдают электроны и превращаются в положительные ионы, сами при этом окисляются.
- Сначала разберём реакции металлов с простыми веществами – неметаллами.
- Например, с кислородом взаимодействуют практически все металлы, кроме золота и платины, при этом образуются оксиды.
Щелочные и щелочноземельные металлы при обычной температуре легко окисляются на воздухе, поэтому их обычно хранят в закрытых сосудах или под слоем масла.
Так, в реакции лития с кислородом воздуха образуется оксид лития, при этом литий повышает свою степень окисления с 0 до +1, а кислород понижает свою степень окисления с 0 до -2, литий является восстановителем, а кислород – окислителем, четыре атома лития отдают по одному электрону молекуле кислорода.
В реакции кальция с кислородом, кальций также повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2. Металл кальций выступает в роли восстановителя, а кислород – в роли окислителя, при этом два атома кальция отдают по два электрона молекуле кислорода. В результате реакции образуется оксид кальция.

Такие металлы, как алюминий, цинк, свинец при обычной температуре реагируют с кислородом воздуха, покрываясь тонкой плёнкой оксида, которая защищает их от дальнейшего окисления. Слой оксида, образующегося на поверхности алюминия, настолько тонок, что металл не теряет своего блеска.
Так, в реакции алюминия с кислородом, образуется оксид алюминия, алюминий повышает свою степень окисления с 0 до +3, являясь при этом восстановителем, а кислород, наоборот, понижает свою степень окисления с 0 до -2.
В этой реакции четыре атома алюминия отдают по три электрона молекуле кислорода.
Многие металлы взаимодействуют с кислородом при нагревании: например, медь при нагревании на воздухе чернеет, так как покрывается плёнкой чёрного оксида меди два.
В этой реакции медь выступает в роли восстановителя и повышает свою степень окисления с 0 до +2, а кислород – окислитель, понижает свою степень окисления с 0 до -2. При этом два атома меди отдают по два электрона молекуле кислорода.
При прокаливании железа образуется железная окалина – это смешанный оксид, который состоит из оксида железа два и оксида железа три.
Железо, в данном случае, является восстановителем, оно повышает свою степень окисления с 0 до +2 и +4, значит, железо – это восстановитель, а кислород – окислитель, он понижает свою степень окисления с 0 до -2. В этой реакции три атома железа отдают восемь электронов молекуле кислорода.

А вот магний при поджигании на воздухе сгорает яркой вспышкой, образуя оксид магния.
Магний также является восстановителем, потому что повышает свою степень окисления с 0 до +2, а кислород понижает свою степень окисления с 0 до -2 и является окислителем. В результате реакции образуется оксид магния, а два атома магния отдают по два электрона молекуле кислорода.

- Таким образом, большинство металлов реагируют с кислородом с образованием оксидов, активные металлы вступают во взаимодействие с кислородом при обычных условиях, менее активные при нагревании, а такие, как золото или платина не реагируют с кислородом.
- Металлы в этих реакциях являются восстановителями и, соответственно, повышают свою степень окисления, а кислород является окислителем и понижает свою степень окисления.
- С серой все металлы, кроме золота, способны взаимодействовать при незначительном нагревании, образуя сульфиды:
В реакции натрия с серой образуется сульфид натрия, натрий повышает свою степень окисления с 0 до +2, он является восстановителем, сера является окислителем и понижает свою степень с 0 до -2. В результате взаимодействия два атома натрия отдают по одному электрону молекуле серы.
В реакции кальция с серой образуется сульфид кальция, кальций также повышает свою степень окисления с 0 до +2, являясь при этом восстановителем, а сера понижает свою степень окисления с 0 до -2 и является окислителем, при этом, каждый атом кальция отдаёт по два электрона молекуле серы.
А в реакции железа с серой образуется сульфид железа два. Здесь также железо является восстановителем, повышает свою степень окисления с 0 до +2, а серя, являясь окислителем, понижает свою степень окисления с 0 до -2. Каждый атом железа здесь отдаёт по два электрона молекуле серы.

Если смешать небольшое количество порошка алюминия с порошком серы и нагреть сверху смесь пламенем лучинки, то в результате бурной реакции образуется сульфид алюминия:
Алюминий выступает в роли восстановителя и повышает свою степень окисления с 0 до +3, а сера понижает свою степень окисления с 0 до -2 и является окислителем. В этой реакции два атома алюминия отдают по три электрона молекуле серы.

Таким образом, с серой при определённых условиях реагируют все металлы кроме золота, в результате этого взаимодействия образуются сульфиды, в которых степень окисления серы равна мину двум. В этих реакциях металлы выступают в роли восстановителей, а сера – в роли окислителя.
C фтором, хлором, бромом и йодом – металлы реагируют с образованием галогенидов.
Так, в реакции алюминия с йодом образуется йодид алюминия, а катализатором в этой реакции является вода.
В этой реакции алюминий также повышает свою степень окисления с 0 до +4, являясь при этом восстановителем, а йод является окислителем и понижает свою степень окисления с 0 до -1. При этом два атома алюминия отдают по три электрона молекуле йода.
Таким образом, в реакциях с галогенами, металлы являются восстановителями и повышают свою степень окисления, а сами галогены являются окислителями и понижают свою степень окисления, при этом металлы окисляются, а галогены восстанавливаются. В результате этих реакций образуются галогениды.
Металлы не только реагируют с неметаллами – простыми веществами, но и вступают в реакции со сложными веществами.
Например, с водой эффективно реагируют щелочные и щелочноземельные металлы. Если натрий поместить в ёмкость с водой, в которую добавили несколько капель фенолфталеина, то он будет двигаться по поверхности воды, бурно реагируя с ней. При этом выделяется водород и образуется гидроксид натрия, окрашивающий фенолфталеин в малиновый цвет.
Металлический натрий выступает в качестве восстановителя, он повышает свою степень окисления с 0 до +1, а ионы водорода выступают в качестве окислителя и водород понижает свою степень окисления с +1 до 0. В этой реакции два атома натрия отдают по одному электрону ионам водорода.
Некоторые металлы взаимодействуют с водой при определённых условиях, например, цинк – при нагревании, железо – в раскалённом виде с парами воды. При этом образуются оксиды металлов и выделяется водород.
Так, в реакции с цинком образуется оксид цинка и водород. Цинк при этом, являясь восстановителем, повышает свою степень окисления с 0 до +2 и отдаёт по два электрона ионам водорода.
Катионы водорода выступают в роли окислителя и понижают свою степень окисления с +1 до 0.
В реакции с железом, аналогично, железо является восстановителем, повышает свою степень окисления с 0 до +2 и +3, при этом три атома железа отдают по восемь электронов ионам водорода, а ионы водорода понижают свою степень окисления с +1 до 0 и являются окислителями.
- Если металл стоит в ряду активности после водорода, то он не вытесняет водород из воды ни при каких условиях.
Таким образом, щелочные и щелочноземельные металлы реагируют с водой с образованием щелочей, при этом выделяется водород, некоторые металлы реагируют с водой только при нагревании, при этом образуются оксиды и выделяется водород, а металлы, стоящие в ряду активности после водорода не реагируют с водой. В этих реакциях металлы выступают в роли восстановителей, а ионы водорода – в роли окислителя.
Металлы реагируют и с кислотами. Активность металлов при взаимодействии с растворами кислот зависит от положения металла в ряду активности. Металлы, стоящие в ряду активности до водорода, способны вытеснять водород из разбавленных растворов кислот.
- Следует учитывать и следующее металл реагирует с кислотой:
- · металл должен стоять в ряду активности до водорода
- · если образуется растворимая соль
- · концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами, при этом водород не выделяется
- · на щелочные металлы это правило не распространяется, так как они реагируют активно с водой, а речь в данном случае идёт о растворах кислот
- Например, в реакции магния с раствором серной кислоты, магний выступает в роли восстановителя, а ионы водорода в качестве окислителя.
При этом магний повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0. Каждый атом магния отдаёт по два электрона ионам водорода.
- Металлы, стоящие в ряду активности после водорода, к такому взаимодействию не способны:
- Например, медь стоит в ряду активности после водорода, поэтому она не реагирует с раствором соляной кислоты.
Если налить в две пробирки растворы кислот: в первую – раствор соляной кислоты, во вторую – раствор серной кислоты, а затем поместить в каждую по грануле цинка, то в результате у нас появляются пузырьки газа и в первой, и во второй пробирке. Значит, цинк стоит в ряду активности металлов до водорода, поэтому он способен вытеснять водород из раствора кислот.
Цинк в обеих реакциях является восстановителем, он повышает свою степень окисления с 0 до +2, а водород понижает свою степень окисления с +1 до 0, при этом выступая в роли окислителя. В этих двух реакциях атом цинк отдаёт по два электрона ионам водорода.
- Следует помнить, что металлы, стоящие в ряду активности до водорода, реагируют с растворами кислот, но в результате этих реакций должна образоваться растворимая соль, на щелочные металлы эти правила не распространяются, концентрированная серная и азотная кислота любой концентрации иначе реагируют с металлами.
- Металлы реагируют с растворами солей, при этом нужно также использовать ряд активности металлов: более активный металл способен вытеснять другой металл из раствора соли, однако при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, потому что они реагируют с водой, а реакции эти протекают в растворе.
Если в две пробирки налить раствора сульфата меди (II) и поместить в первую кусочек железа, а во вторую гранулу цинка, то реакция будет у нас идти в двух пробирках. На кусочке железа и грануле цинка оседает медь и раствор сульфата (II) изменяет свою окраску: в первой пробирке – на жёлтую, во второй – с голубой на более светлую.
В этой реакции железо выступает в роли восстановителя, само при этом окисляясь. Атомы железа превращаются в ионы железа. Ионы меди выступают в роли окислителя, они восстанавливаются, превращаясь в атомы меди. В результате окислительно-восстановительной реакции электроны от атомов железа переходят к ионам меди.
- Во второй реакции, в роли восстановителя выступает цинк, сам он окисляется, атомы цинка превращаются в ионы цинка, ионы меди выступают в роли окислителя, ионы меди восстанавливаются и превращаются в атомы меди, электроны от атомов цинка переходят к ионам меди.
- Следовательно, металлы реагируют и с растворами кислот, но нужно помнить, что каждый металл вытесняет из раствора соли другой металл, стоящий правее него в ряду напряжений металлов, при этом должна образоваться растворимая соль и щелочные металлы брать нельзя, так как они реагируют с водой.
- Сделаем вывод:
- · металлы реагируют с простыми веществами, такими, как:
- · кислород
- · сера
- · галогены
- · со сложными:
- · вода
- · кислоты
- · соли
Общие физические и химические свойства металлов
Чтобы поделиться, нажимайте
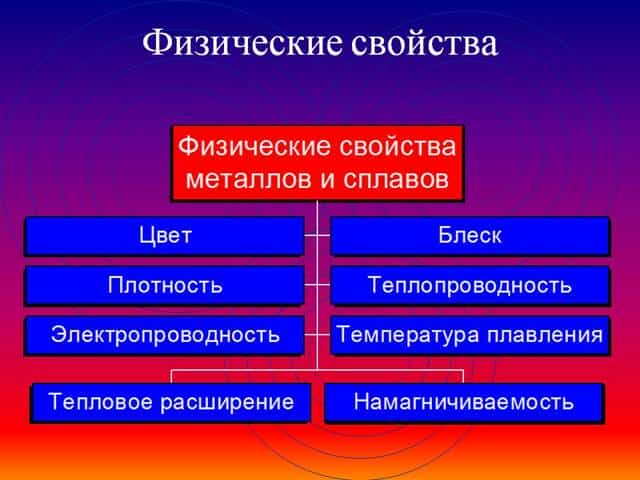
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
- 1) С кислородом:
2Mg + O2 → 2MgO - 2) С серой:
Hg + S → HgS - 3) С галогенами:
Ni + Cl2 –t°→ NiCl2 - 4) С азотом:
3Ca + N2 –t°→ Ca3N2 - 5) С фосфором:
3Ca + 2P –t°→ Ca3P2 - 6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH - Ca + H2 → CaH2
2. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
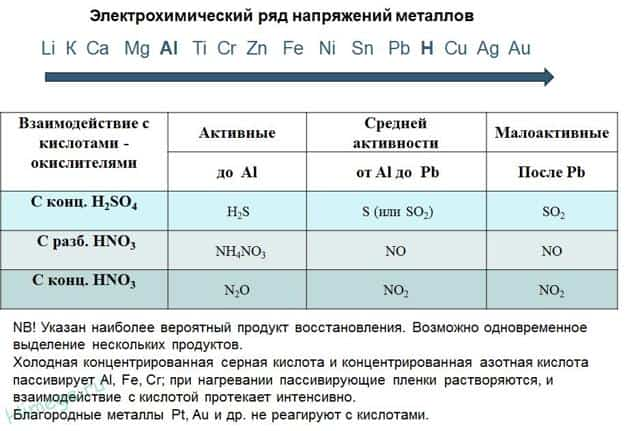
- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
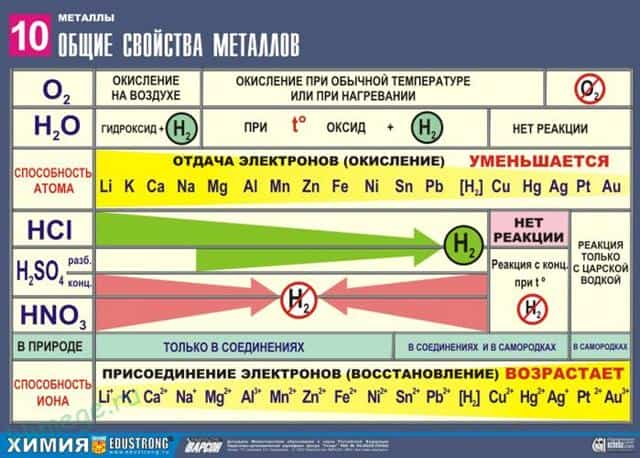
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами
- а) Взаимодействие металлов с водородом.
- С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
- Например:
- 2Na + H2 = NaH
- Ca + H2 = CaH2
- Образуются нестехиометрические соединения с ионной кристаллической структурой.
- б) Взаимодействие металлов с кислородом.
- Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
- Пример:
- 2Na + O2 = Na2O2 (пероксид)
- 4K + O2 = 2K2O
- 2Mg + O2 = 2MgO
- 2Cu + O2 = 2CuO
- в) Взаимодействие металлов с галогенами.
- Все металлы реагируют с галогенами с образованием галогенидов.
- Пример:
- 2Al + 3Br2 = 2AlBr3
- В основном это ионные соединения: MeHaln
- г) Взаимодействие металлов с азотом.
- С азотом взаимодействуют щелочные и щелочноземельные металлы.
- Пример:
- 3Ca + N2 = Ca3N2
- Mg + N2 = Mg3N2 – нитрид.
- д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды.
Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой
- Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
- Na + 2H2O = H2↑ + 2NaOH
- Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
= – 0,76 B., = + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
- Пример:
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
- 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
- Zn0 – восстановитель
- 1 2H2O + 2e = H2 + 2OH– восстановление
- H2O – окислитель
- Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
- Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
- 4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами
- Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
- По активности металлы условно делятся на активные, средней активности и малоактивные.
- Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑).
С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
- H2S↑ – c активными металлами
- 6+ +8е
- H2SO4 +6е S0↓ – с металлами средней активности
- SO2↑ – c малоактивными металлами
- NH3 ( NH4NO3 )– c активными металлами
- 5+ +8e
- HNO3 +4,5e N2O, N2 – с металлами средней активности
- разб.
- +3e
- NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Химические свойства металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
- Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
- 4Li + O2 = 2Li2O (оксид лития)
- 2Na + O2 =Na2O2 (пероксид натрия)
- K + O2 = KO2 (надпероксид калия)
- Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
- 2Al + 3/2 O2 = Al2O3
- 2Cu + O2 = 2CuO
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
- 6Li + N2 = 2Li3N (азид лития)
- Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
- 2Li+2C = Li2C2 (карбид лития)
- 2Na + H2 = NaH (гидрид натрия)
- С серой реагируют все металлы кроме Au и Pt:
- 2K +S = K2S (сульфид калия)
- Также металлы способны взаимодействовать с галогенами и фосфором:
- 2Na + Cl2 = 2NaCl (хлорид натрия)
- 3Ca + 2P = Ca3P2 (фосфид кальция)
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
- Fe + S = FeS
- Fe -2e = Fe2+ процесс окисления, железо — восстановитель
- S +2e = S2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
3Cu + Au = Cu3Au
Взаимодействие металлов с водой
- Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
- Ba + 2H2O = Ba(OH)2 + H2↑
- 2Na + 2H2O = 2NaOH + H2↑
- Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
- Pb + H2O = PbO + H2↑
- Неактивные металлы с водой не реагируют.
- Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
- Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
- 2Al + 6HCl = 2AlCl3 + 3 H2↑
- Zn + 2HCl = ZnCl2 + 2H2↑
- Fe + H2SO4 = FeSO4 + H2↑
- Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
- Cu + 2H2SO4 = CuSO4 + SO2↑ +2H2O (1)
- Cu + 4HNO3(60%) = Cu(NO3)2 + 2NO2↑ + 2H2O
- 3Cu +8HNO3(30%) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
3Na + AlCl3 = 3NaCl + Al
Примеры решения задач
Химические свойства металлов | Химическая энциклопедия
По своей химической активности металлы очень сильно различаются. О химической активности металла можно примерно судить по его положению в ЭХРНМ.
Самые активные металлы расположены в начале этого ряда (слева), самые малоактивные — в конце (справа). Реакции с простыми веществами. Металлы вступают в реакции с неметаллами с образованием бинарных соединений. Условия протекания реакций, а иногда и их продукты сильно различаются для разных металлов.
Так, например, щелочные металлы активно реагируют с кислородом (в том числе в составе воздуха) при комнатной температуре с образованием оксидов и пероксидов
- 4Li + O2 = 2Li2O; 2Na + O2 = Na2O2
- Металлы средней активности реагируют с кислородом при нагревании. При этом образуются оксиды:
- 2Mg + O2 =t 2MgO.
- Малоактивные металлы (например, золото, платина) с кислородом не реагируют и поэтому на воздухе практически не изменяют своего блеска. Большинство металлов при нагревании с порошком серы образуют соответствующие сульфиды:
- Ca + I2 = CaI2; 2Fe + 3Br2 = 2FeBr3; 2Au + 3Cl2 =t 2AuCl3.
Реакции со сложными веществами. С металлами реагируют соединения всех классов — оксиды (в том числе вода), кислоты, основания и соли. Активные металлы бурно взаимодействуют с водой при комнатной температуре:
2Li + 2H2O = 2LiOH + H2↑; Ba + 2H2O = Ba(OH)2 + H2↑.
Поверхность таких металлов, как, например, магний и алюминий, защищена плотной пленкой соответствующего оксида. Это препятствует протеканию реакции с водой. Однако если эту пленку удалить или нарушить ее целостность, то эти металлы также активно вступают в реакцию. Например, порошкообразный магний реагирует с горячей водой:
Mg + 2H2O =100 °C Mg(OH)2 + H2↑.
При повышенной температуре с водой вступают в реакцию и менее активные металлы: Zn, Fe, Mil и др. При этом образуются соответствующие оксиды. Например, при пропускании водяного пара над раскаленными железными стружками протекает реакция:
- 3Fe + 4H2O =t Fe3O4 + 4H2↑.
- Металлы, стоящие в ряду активности до водорода, реагируют с кислотами (кроме HNO3) с образованием солей и водорода. Активные металлы (К, Na, Са, Mg) реагируют с растворами кислот очень бурно (с большой скоростью):
- Ca + 2HCl = CaCl2 + H2↑; 2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑.
Малоактивные металлы часто практически не растворяются в кислотах. Это обусловлено образованием на их поверхности пленки нерастворимой соли. Например, свинец, стоящий в ряду активности до водорода, практически не растворяется в разбавленной серной и соляной кислотах вследствие образования на его поверхности пленки нерастворимых солей (PbSO4 и PbCl2).
Урок 5: Общие свойства металлов
Металлы — элементы, способные «отдавать» электроны с внешних энергетических уровней, вступая в реакцию. Эта очень обширная категория элементов. И согласно расположению в периодической системе и химико-физическим свойствам их принято делить на: щелочные, щелочноземельные, d-металлы и благородные.
- План урока:
- Строение атомов металлов
- Разновидности металлов
- Способы получения металлов
- Электролиз
- Свойства металлов
- Нахождение металлов в природе
Строение атомов металлов
Решетки атомов металлов кристаллические, связанные металлической связью. Отличие металлической связи от ковалентной в том, что валентные электроны в атомах металлов притягиваются с меньшей силой к своим атомам или к своей паре атомов, и поэтому отщепление электронов от атомов происходит свободнее. И движения электронов напоминает «блуждание» между атомами.
Атомы металлов на внешнем уровне содержат от одного до четырех электронов. Этими электронами атомы металлов «делятся» с другими элементами (преимущественно с неметаллами) при взаимодействии, принимая роль восстановителей.
Разновидности металлов
Щелочные металлы
Щелочные металлы представлены: литием, натрием, калием, рубидием, цезием и францием. Все эти элементы входят в Ia группу.
Вещества характеризуются прежде всего большой активностью, потому как быстро окисляются даже на воздухе. С водой происходит активная реакция, сопровождаемая нагреванием веществ. Поэтому есть свои особенности хранения этих веществ. Хранят обычно под керосином.
По физическим свойствам данный класс веществ мягкие на ощупь, серебристо-серого цвета, могут обладать блеском, но только на свежо срезанной поверхности.
Сверху вниз в периодической таблице увеличивается атомный радиус, усиливаются основные, металлические, восстановительные свойства и реакционная активность.
Строение атома лития, как типичного представителя щелочных металлов
Химические свойства щелочных металлов
Взаимодействие с неметаллами
Щелочные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
Взаимодействие со сложными веществами
- Таблица нахождения щелочных металлов в природе
Щелочноземельные металлы
К этой категории относят: бериллий, магний, кальций, стронций, барий и радий. Это металлы IIa группы. Металлы легкие, мягкие и реакционно активные. Они тверже щелочных, и редко обладают блеском, только серый цвет объединяет их с щелочными металлами.
Свойства веществ данной группы в зависимости от положения в периодическую систему сходны со свойствами предыдущей группы.
Рисунок. Щелочноземельные металлы в периодической системе
Получают их так же, как и щелочные металлы, электролизом расплавов, веществ, расплавленных до жидкого состояния. Или используя алюминотермию и вытеснение их из солей другими более активными металлами.
- MgCl2 → Mg + Cl2 (электролиз расплава)
- CaO + Al → Al2O3 + Ca (эта реакция носит название алюминотермии–процесс получения металлов из их оксидов, где алюминий вытесняет щелочные металлы из соединений).
- MgBr2 + Ca → CaBr2 + Mg
Химические свойства
Взаимодействие с неметаллами
Взаимодействие со сложными веществами
- Таблица нахождения щелочноземельных металлов в природе
d- металлы
Помимо щелочных и щёлочноземельных существуют d-металлы. Класс элементов, содержащих от 1 до 10 электронов на d-подуровне, уступающие щелочным и щёлочноземельным металлам в активности.
К d-металлам относят: скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь, цинк и т.д.Отличий этих металлов в строении атома, а точнее в заполнении d-подуровня.
Железо
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, по ряду активности металлов в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями..
Источник
Медь
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика.
Источник
Цинк
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2.
Источник
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами.
По своей значимости особо можно выделить роль этих элементов в организме человека. Микроэлементы цинка, марганца, железа, кобальта и меди очень важны для организма, наряду с биологически активными веществами, жирами, белками.
Цветной и черный металлы
Отличие цветного и черного металлов состоит в составе, структуре и свойствах. Например, черный металл подвергается влиянию магнитов, и зачастую прочнее цветных.
Черный металл — это прежде всего железо, его сплав с углеродом и добавлением иных веществ (как металлов, так и неметаллов).
Типы черных металлов
- Углеродистая сталь — железо смешано с углеродом
- Мягкая сталь — железо смешивается с относительно меньшим количеством углерода
- Нержавеющая сталь — смесь железа и хрома
- Чугун — очень высокое содержание углерода с железом
- Кованое железо — почти чистое железо
Цветные металлы — это тоже сплавы, но уже без железа, это могут быть: алюминий, магний, медь, никель, цинк, олово, свинец.
Данные подразделения металлов очень важны в жизни человечества. Но основная металлургическая промышленность использует черный металл (90% от общего объема). Важнейшие черные металлы: чугун, сталь, кованное железо.
Благодаря свойству цветного металла сопротивляться окислению, мы легко можем отличить его от черного. Черный металл ржавеет, цветной – нет. Большинству черных металлов присущи магнитные свойства.
Что используют в автомобильной и технической промышленности. Черные металлы очень прочные, а цветные легкие, но менее прочные.
Цветные металлы очень популярны в авиационной, консервной, электронной, электротехнической, строительной промышленностях
Благородными металлами называют те редкие металлы, не подвергающиеся окислению, коррозии и не взаимодействующие с кислотами.Также эти металлы называют драгоценными в силу редкости и большой цены.
Способы получения металлов
Основные способы получения металлов представлены в схеме ниже. Промышленным способом металлы получают электролизом растворов и расплавов.
- Более подробное рассмотрение пирометаллургических способов получения металлов
- Более подробное рассмотрение гидрометаллургических способов получения металлов
Электролиз
Электролизом называют процесс разложения веществ на составляющие, под действием тока. Его можно рассмотреть, как химическую реакцию.
На катоде реакции происходят различные для разных металлов. И для того, чтобы определить какая именно реакция произойдет необходимо обратиться к такому фактору, как активность металла. Эти данные мы получим из положения в электрохимическом ряду напряжений металла.
Источник
Как видно из электрохимического ряда напряжений металлов наиболее активным металлом является литий. Металлами средней активности считают элементы в ряду от алюминия до свинца. После водорода металлы малоактивные.
Электролиз расплавов
Из выше указанного стало ясно как получать малоактивные металлы в чистом виде при электролизе, а как получать активные металлы, если они не восстанавливаются на катоде при электролизе их растворов?В таких случая используют расплавы не содержащие воды.
Электролиз воды
Электролиз воды, как и в целом электролиз, это физико-химический процесс, осуществляемый с помощью электрического тока. Этот процесс позволяет очистить воду от тяжелых металлов и других примесей (примеси и металлы оседают на катоде и аноде). В результате данного процесса выделяется два газа: водород и кислород.
Электролиз воды необходим для очистки сточных вод. Сточные воды попадают в землю, в почву, и для предотвращения загрязнения окружающей среды, необходимо очищение воды.
Свойства металлов
Физические свойства металлов
Химические свойства металлов
Взаимодействие металлов с кислотами
- Взаимодействие металлов с серной кислотой
- Разбавленный раствор серной кислоты взаимодействует с металлами, стоящими в ряду активности до водорода по схеме:
- Ме + H2SO4(разб.) ↔ соль + Н2↑
Взаимодействие металлов с азотной кислотой (HNO3)
Очень сильный окислитель. И нужно запомнить, что при взаимодействии с кислотой никогда не выделяется водород в свободном виде.
- Процесс протекает следующим образом:
- Продукты восстановления HNO3:
- Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Взаимодействие металлов с разбавленной азотной кислоты
При реакции с разбавленной азотной кислотой металла продукты реакции другие, и каков будет продукт восстановления зависит от активности металла и представлен в схеме ниже.
Нахождение металлов в природе
Благородные малоактивные металлы, в свободном (самородном) состоянии встречаются в природе не часто, ввиду своей редкости.В самородном состоянии встречаются золото, серебро, платина, медь.
В малых количествах металлы находятся в морской воде (1,05%, — 0,12%), растениях, живых организмах. Играют при этом важную роль в организмах живых существ. Например, входят в состав важнейших питательных веществ, и в состав ферментов, необходимых для работы множества процессов.
Пожалуй, наиболее важное значение в организме живых существ играет железо, входя в состав крови, а точнее в составную часть гемоглобина крови – гемо. Гемоглобин — это белок крови транспортирующий кислород в нужные органы живого организма по крови.
Недостаток железа вызывает анемию, заболевание характеризирующийся вялым состоянием, слабостью, снижением трудоспособности и утомляемостью и в некоторых случаях имеет летальные последствия. Определяется заболевание преимущественно анализом крови.
- Таблица содержание некоторых металлов в земной коре
Урановая руда
Уран принято использовать в атомной промышленности, как топливо. Но элемент является очень активным поэтому уран в чистом виде не встречается, для его производства используют такие образования, как урановые руды. Последний содержит достаточно элемента, чтобы можно было считать добычу руды экономически выгодной.
Урановая руда Источник
Сплавы
Алюминиевые сплавы
Алюминиевые сплавы очень часто используются в отраслях промышленности. Обусловлено это тем, что сплавы алюминия отличаются большой прочностью.
Наиболее применяемые сплавы алюминия: дюралюминий, силумин.
МЕТАЛЛОТЕРМИЯ – способ восстановления металлов и соединений этих металлов.Сопровождается выделением теплоты. Этот процесс подлежит классификации по природе металла-восстановителя (алюминотермия, магниетермия, кальциетермия и др.).
- Источник
Вывод
Металлы очень большая категория веществ, объединяющая в себе элементы с различными физическими и химическими свойствами. Но при этом имеющие много общего, главное из которых — это принятие роли восстановителя в реакциях, отдавая свои электроны.
Так же многие металлы широко применяются человечеством в промышленности, в быту, в медицине, в фармацевтике и т.д. Исторически именно добыча железа из руд ознаменовала новый виток развития в истории человека.
Поэтому сложно переоценить данную категорию веществ.
Современное человечество использует металлы в промышленности, в быту и в хозяйстве. На протяжения многих веков металл является верным спутником прогресса. Но набольшее распространение металл получил в строительстве, позволяя сделать здания прочнее, а сроки возведения в разы короче.
К щелочным металлам относят: К щёлочноземельным металлам относят: 1процесс восстановления металлов химикатов 2взаимодействие металлов в особых условиях 3взаимодействие металлов с кислотой 4процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе 1синоним коррозии, или взаимодействие металлов 2способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 3это однородный материал, созданный при смеси двух или более химических элементов, где преобладают металлические компоненты При взаимодействии металла с азотной кислотой выделяется: 1выделяется водород в свободном виде 2НЕ выделяется водород в свободном виде 1 вопрос:
К щелочным металлам относят: 1) ртуть 2) железо 3) золото 4) литий
2 вопрос:
К щёлочноземельным металлам относят: 1) платина 2) золото 3) кальций 4) торий
3 вопрос:
Коррозия это …: 1) процесс восстановления металлов химикатов 2) взаимодействие металлов в особых условиях 3) взаимодействие металлов с кислотой 4) процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе
4 вопрос:
МЕТАЛЛОТЕРМИ́Я это -: 1) синоним коррозии, или взаимодействие металлов 2) способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 3) это однородный материал, созданный при смеси двух или более химических элементов, где преобладают металлические компоненты
5 вопрос:
При взаимодействии металла с азотной кислотой выделяется: 1) выделяется водород в свободном виде 2) НЕ выделяется водород в свободном виде 3) реакция невозможна
3 вопрос: процесс разрушения металлов под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе 4 вопрос: способ восстановления металлов и соединений этих металлов, сопровождаемо с выделением теплоты 5 вопрос: НЕ выделяется водород в свободном виде






