- Общая характеристика элементов IVa группы
- Природные соединения
- Получение
- Химические свойства
- Оксид углерода II — СO
- Оксид углерода IV — CO2
- Угольная кислота
- Углерод: его свойства и соединения — Без Сменки
- Углерод: формула, химические свойства, характеристики
- Строение углерода
- Аллотропия углерода
- Алмаз
- Графит
- Графен
- Карбин
- Уголь
- Сравнение основных аллотропных модификаций углерода
- Нахождение углерода в природе
- Доля углерода в составе горючих ископаемых
- Оксиды углерода — урок. Химия, 9 класс
- Таблица оксидов
- Таблица оксидов (1 часть):
- Таблица оксидов (2 часть):
- Таблица оксидов (3 часть):
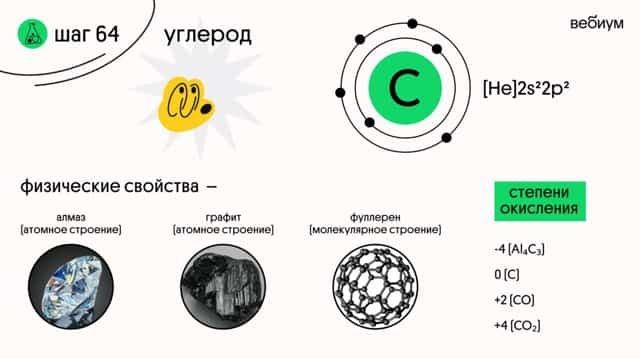
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
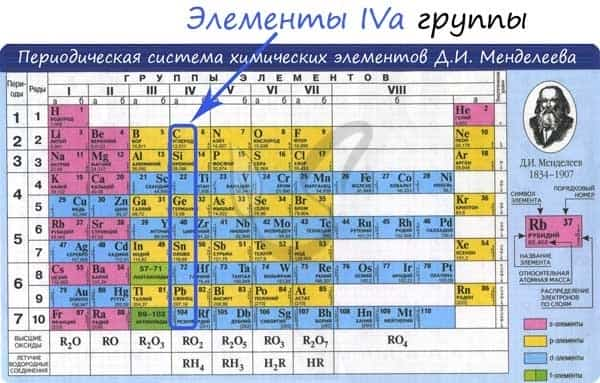
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
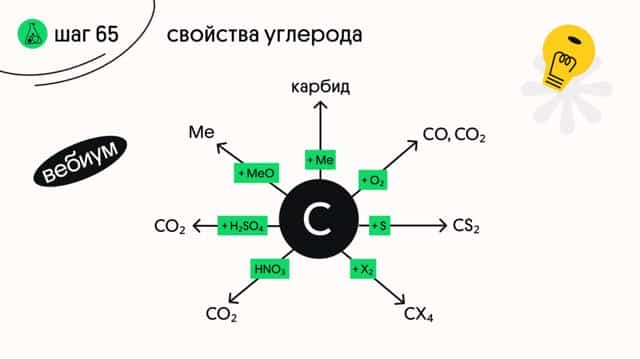
Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO3(конц.) → (t) CO2 + NO2 + H2O
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
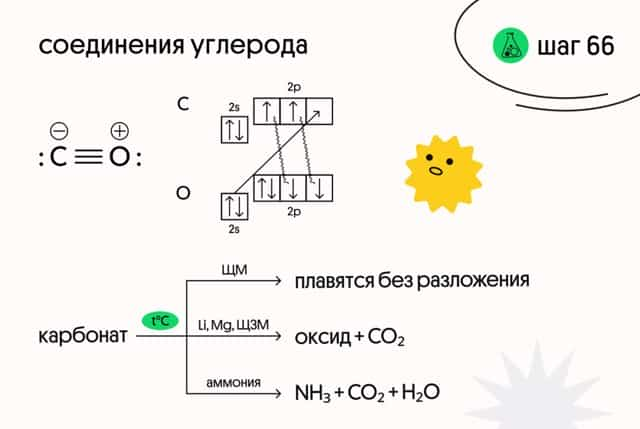
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Углерод: его свойства и соединения — Без Сменки
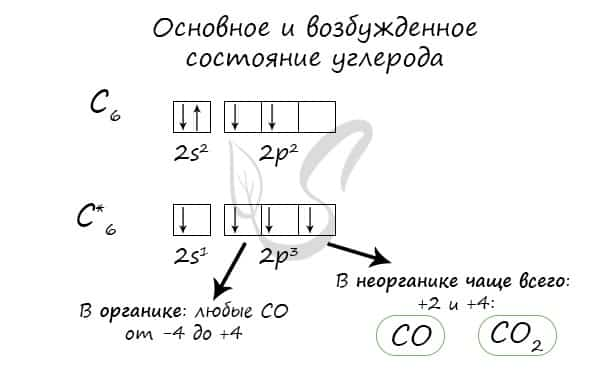
Углерод (С) — элемент IVA группы. У углерода 4 валентных электрона. В возбужденном состоянии у углерода 4 неспаренных электрона на четырех орбиталях.
С учетом органических соединений, углерод в соединениях проявляет степени окисления от -4 до +4. В неорганических соединениях углерод проявляет степень окисления -4, +2 и +4.
Углерод подарил нам органические соединения. Поэтому органическую химию иногда называют химией углерода!
- Количество органических соединений невозможно определить, именно органические вещества — основа всего живого.
- Углерод простое вещество существует в различных аллотропных модификациях:
- Графит представляет собой чёрное вещество атомного строения.
Каждый атом углерода ковалентно связан с двумя другими. Образующиеся слои связаны друг с другом слабыми межмолекулярными связями. Эта слабая связь легко рвется, поэтому графит используют для изготовления карандашей (при письме часть слоёв остается на бумаге).
Если оставить только один слой графита, то образуется другая модификация — графен.
За исследование графена не так давно (2010 г) была вручена Нобелевская премия ????
Это самая прочная (не путать со стабильностью) модификация! Представляет собой прозрачные кристаллы ???? Алмаз имеет атомное строение.
Это чёрное кристаллическое вещество молекулярного строения. В отличии от алмаза и графита фуллерен растворяется в органических растворителях.
В школе обычно изучают фуллерен С₆₀, но существуют и другие, только тсс ????
Получать углерод не нужно, он в больших количествах находится в природе, поэтому углерод добывают!
Различные модификации углерода обладают разной активностью, но обычно различия между ними в школьном курсе не делают..
- 1️⃣ + металлы
- При нагревании реагирует с активными металлами и некоторыми металами средней активности. Обратите внимание, что карбиды различных металлов отличаются строением и свойствами
- 2C + Ca → CaC₂ (t°C)
- CaC₂ + 2H₂O → Ca(OH)₂ + C₂H₂
- 3C + 4Al → Al₄C₃ (t°C)
- Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄ (t°C)
- 2️⃣ + неметаллы
- Углерод взаимодействует с неметаллами (водород, кремний, сера, кислород, фтор):
- С + 2H₂ → CH₄ (t°C)
- C + Si → SiC (t°C)
- C + 2S → CS₂ (t°C)
- 2C + O₂ (нед.) → 2CO (t°C)
- C + O₂ (изб.) → CO₂ (t°C)
- С + 2F₂ → CF₄ (t°C)
- Углерод не реагирует с азотом, иодом ❌
- 3️⃣ + конц. кислоты-окислители
- С + 2H₂SO₄ → CO₂ + 2SO₂ + 2H₂O
- C + 4HNO₃ → CO₂ + 4NO₂ + 2H₂O
- 4️⃣ + оксиды металлов
- 3С + Fe₂O₃ → 3CO + 2Fe (t°C)
- При взаимодействии углерода и оксидов активных металлов образуются карбиды:
- 3С + CaO → CaC₂ + CO (t°C)
- 5️⃣ + оксиды неметаллов
- С + СO₂ → 2CO (t°C)
- 2C + SiO₂ → Si + 2CO (t°C)
- 3C + SiO₂ → SiC + 2CO (t°C)
- C + H₂O → CO + H₂ (t°C) — паровая конверсия угля
- ОКСИД УГЛЕРОДА(II)
- CO — газ без цвета и запаха, легче воздуха. Угарный газ очень токсичен ⚠️
- Молекула CO имеет тройную связь (то есть валентность углерода и кислорода равна III)
- Этот оксид получают при горении угля в недостатке кислорода:
- 2C + O₂ (нед.) → 2СO (t°C)
- CO — несолеобразующий оксид, хотя может реагировать с твердыми щелочами с образованием формиатов:
- CO + KOH (тв.) → HCOOK (t°C)
- Оксид углерода(II) используют для восстановления металлов из оксидов:
- СuO + CO → Cu + CO₂ (t°C)
- Fe₃O₄ + СО → 3FeO + СО₂ (t°C)
- ОКСИД УГЛЕРОДА(IV)
- CO₂ — газ без цвета и запаха.
- Образуется в процессе дыхания ????
- В лаборатории углекислый газ можно получить действием сильных кислот на карбонаты:
- CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
- А ещё CO2 образуется при горении органических веществ и угля:
- C + O₂ (изб.) → СO₂ (t°C)
- 2СH₃CHO + 5O₂ → 4CO₂ + 4H₂O (t°C)
- 4СH₃NH₂ + 9O₂ → 4CO₂ + 2N₂ + 10H₂O (t°C)
- CO₂ — кислотный оксид, ему соответствует слабая летучая угольная кислота H₂CO₃
Углерод: формула, химические свойства, характеристики
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой.
Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен.
Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное.
Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
-
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
-
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
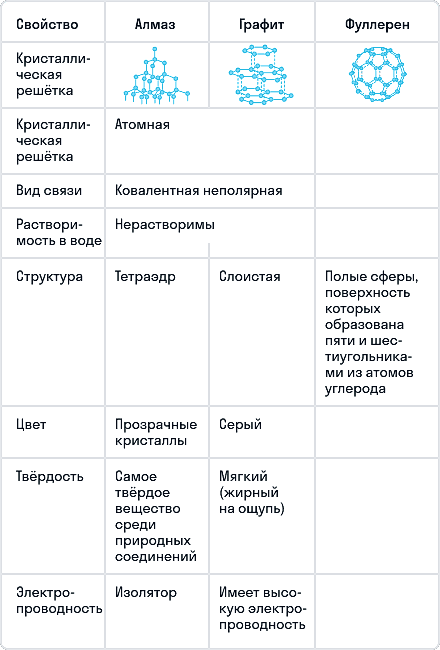
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность.
Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий.
Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
- Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
- На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
- При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния.
Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется.
Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
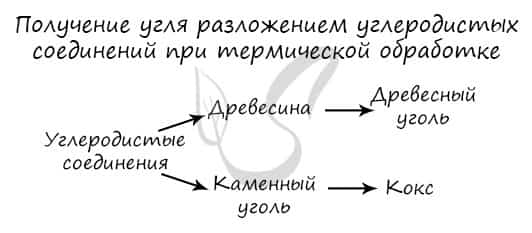
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
- Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
- Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
- Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Оксиды углерода — урок. Химия, 9 класс
Оксид углерода((II)), или угарный газ
Оксид углерода((II)) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде ((2,3) см³ в (100) см³ при (20) °С). Оксид углерода((II)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода((II)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода((II)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
- Cu+2O+C+2O=tCu0+C+4O2.
- Оксид углерода((II)) горит на воздухе голубым пламенем:
- 2C+2O+O02=t2C+4O−22.
- В реакции выделяется большое количество тепла.
Оксид углерода((IV)), или углекислый газ
Оксид углерода((IV)) CO2 — бесцветный газ без запаха. Он примерно в (1,5) раза тяжелее воздуха.
Малорастворим в воде (при комнатной температуре в (1) объёме воды растворяется (0,88) объёма CO2).
При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Рис. (1). Сухой лёд
Оксид углерода((IV)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
- CO2+H2O⇄H2CO3.
- В реакциях с основными оксидами и щелочами образуются карбонаты:
- CO2+CaO=CaCO3,
- CO2+2NaOH=Na2CO3+H2O.
- При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
- CO2+NaOH=NaHCO3.
- В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
- C+4O2+2Mg0=t2Mg+2O+C0.
- Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
- В промышленности для его получения используют прокаливание известняка:
- CaCO3=tCaO+CO2↑.
- В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
- Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Источники:
Рис. 1. Сухой лёд © ЯКласс
Таблица оксидов
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
|
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
|
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния), SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
|
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы), SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
|
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)), Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
|
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
|
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
|
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
|
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
|
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит), Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт), CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия), Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия), GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка), As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит), SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
|
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
|
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
|
| 53 | Йод | I | I+12O (монооксид дийода),
|
| 54 | Ксенон | Xe | |
| 55 | Цезий | Cs | |
| 56 | Барий | Ba | |
| 57 | Лантан | La | |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |






