Свойства металлов и сплавов делятся на:
- физические;
- механические;
- технологические;
- химические.
Физические свойства
Цвет и блеск. Эти два свойства обусловливают в основном внешний вид металла и являются чрезвычайно существенными для художника. Этими свойствами характеризуются художественно-эстетические достоинства металлов как материалов, из которых создаются произведения искусства.
Каждый металл или сплав обладает определенным присущим ему цветом. Однако большинство из них имеет довольно однообразную гамму серовато-белых, серебристых тонов, то более теплых, то холодных.
Исключение составляют два металла: золото, имеющее насыщенный желтый цвет, и медь, отличающаяся сильным оранжево-красным цветом. Добавка этих металлов в сплавы придает им желтые и красные оттенки. В табл.
1 приведены цвета наиболее распространенных в художественной промышленности металлов и сплавов.
 Таблица 1
Таблица 1
Часто готовые художественные изделия, выполненные из одних металлов, покрывают тонким слоем других, более эффективных по цвету или блеску металлов: например, золочение серебра и бронзы, хромирование и никелирование стали, серебрение меди и латуни и т. п.
Иногда для обогащения цвета применяют не сам металл, а его окислы или другие химические соединения. Такой прием носит название оксидирования или патинирования.
Этим способом можно получить очень разнообразные по силе и яркости тона и значительно расширять цветовую палитру художника-металлиста.
Оксидирование позволяет получить различные оттенки желтых, зеленых, синих, голубых, фиолетовых, красных, коричневых, черных цветов, весьма прочных и стойких против внешних условий.
Плотность. По плотности все металлы разделяются на легкие и тяжелые. Легкими принято называть металлы с плотностью до 3, а тяжелыми — с плотностью от 6 и выше.
В табл. 2 приведены плотности металлов и сплавов, наиболее часто применяемых в художественных изделиях.
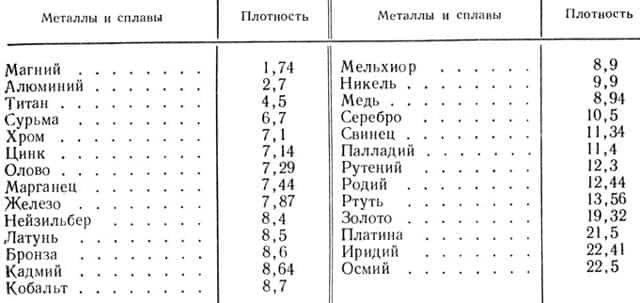 Таблица 2
Таблица 2
Плавкость, или температура плавления. Температуры плавления металлов и их сплавов находятся в огромных пределах.
Например, некоторые легкоплавкие сплавы (сплав Вуда) плавятся уже при температуре 60°С, а наиболее тугоплавкий из металлов — вольфрам плавится только при 3380°С.
Ртуть является примером металла, который при комнатной температуре находится в жидком состоянии. Она плавится при температуре минус 39°С.
По температурам плавления все металлы разделяются на легкоплавкие (температура плавления не превышает 700°С) и тугоплавкие — свыше 900°С.
В табл. 3 приведена температура плавления некоторых металлов в градусах Цельсия.
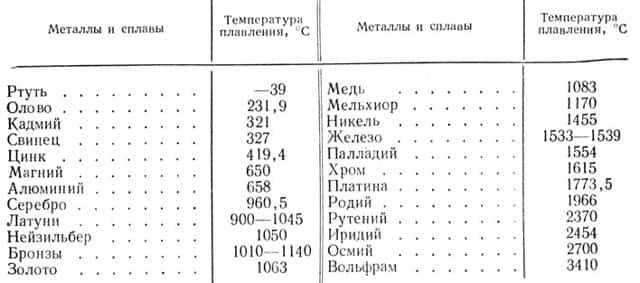 Таблица 3
Таблица 3
Как видно из табл. 3, к легкоплавким металлам относятся: олово, свинец, цинк, кадмий, сурьма, алюминий, магний и их сплавы.
Легкоплавкие металлы идут для приготовления легкоплавких сплавов и мягких припоев.
К тугоплавким металлам относятся: серебро, золото, платина, медь, никель, марганец, железо, хром, вольфрам и др.
Механические свойства
Механические свойства имеют большое значение при конструировании и производстве изделий художественной промышленности.
Прочность, или крепость,- это свойство металлов выдерживать различные нагрузки не разрушаясь. Прочность — одно из важных свойств металлов. При проектировании художественных изделий выбор металлов и сплавов осуществляется с учетом их прочности.
Для точного определения и измерения прочности из металла или сплава изготовляют образец и подвергают его испытанию на специальной разрывной машине, которая постепенно, но с возрастающей силой растягивает образец до полного его разрыва.
Наибольшее напряжение, которое может выдержать образец металла не разрушаясь, называется пределом прочности для данного металла или временным сопротивлением разрыву.
Упругость — свойство металла принимать свою первоначальную форму после снятия нагрузки.
При постепенном увеличении нагрузки на образец во время испытания его на разрывной машине он сначала вытягивается упруго, как резина или пружина. Если нагрузку снять, то образец снова сократится и примет свою первоначальную длину.
Наибольшее напряжение металла, после которого он возвращается к своей первоначальной длине, называется пределом упругости.
Если при дальнейшем повышении нагрузки напряжение превышает предел упругости и удлинение сохраняется после разгрузки образца, то такое состояние называют остаточным удлинением.
Затем наступает предел текучести, при котором образец продолжает удлиняться без увеличения нагрузки — в этом случае металл «течет».
Такая способность к текучести используется в штамповочном производстве, особенно при глубокой вытяжке.
Наибольшей упругостью обладает хромоникелевая закаленная сталь. Алюминий и медь совершенно не обладают упругостью — даже при незначительной нагрузке они образуют остаточное удлинение, а не упругое.
Пластичность — свойство металла изменять свою форму под действием силы, не проявляя признаков разрушения (трещин, разрывов и т. п.), и сохранять полученную форму после снятия нагрузки. Это свойство также определяется и измеряется на разрывной машине.
Пластичность металла характеризуется удлинением образца за время испытания. Для определения степени пластичности пользуются следующим приемом: после разрыва образца складывают его части и измеряют общую их длину.
Отношение приращения длины к его первоначальной длине, выраженное в процентах, является показателем пластичности металла и называется относительным удлинением. Это свойство металлов имеет большое значение в давильном и штамповочном производстве, а также при дифовке, чеканке, прокатке и волочении.
Высокой пластичностью обладают драгоценные металлы — золото, серебро, платина и их сплавы; не менее пластичны медь и свинец. Почти совершенно отсутствует это свойство у чугуна, сурьмы и некоторых других металлов.
Твердость — свойство металлов сопротивляться проникновению в них другого тела под действием внешней нагрузки. От этого свойства зависит возможность обработки металлов тем или иным инструментом. Например, при обработке резанием на станках важно знать твердость обрабатываемого металла, чтобы подобрать соответствующий резец, сверло или фрезу.
Для определения твердости существует несколько способов и специальных приборов. Наиболее распространенные и общепринятые следующие.
Способ Бринелля. Определение твердости этим способом заключается в том, что в испытуемый металл при помощи специального пресса вдавливается определенной нагрузкой стальной закаленный шарик.
От давления шарика на металле образуется лунка, отпечаток. Чем мягче металл, тем площадь лунки больше.
Диаметр лунки определяется мерительной лупой, а затем в специальной таблице находят число твердости по Бринеллю.
В табл. 4 приведены числа твердости по Бринеллю для некоторых металлов.
 Таблица 4
Таблица 4
Способ Роквелла. Определение твердости этим способом производится тоже путем вдавливания в металл алмазной призмы или стального шарика, но отсчет ведется не по площади, а по разнице глубины отпечатка между глубиной от стандартной нагрузки, равной 10 кг, и заданной.
Измерение производят специальным прибором — индикатором, и число твердости показывает сам прибор.
Способ Шора. Измерение по этому способу производится при помощи специального прибора — склероскопа. При этом стальной боек падает на испытуемый металл с определенной высоты.
Твердость металла характеризуется высотой, на которую отскакивает боек. Чем тверже металл, тем больше высота отскока.
Этот способ удобен тем, что он не портит поверхности и может применяться к готовым изделиям художественной промышленности.
Выносливость — свойство металлов выдерживать не разрушаясь большое количество повторяющихся переменных нагрузок.
Все механические свойства значительно изменяются в зависимости от температурных условий. Так, например, прочность всех металлов при нагреве понижается, а пластичность в большинстве случаев увеличивается.
Изменение свойств металлов в условиях пониженных температур изучено еще недостаточно. Однако хорошо известно, что на холоде у некоторых металлов резко падает пластичность и они становятся хрупкими. С этой точки зрения все металлы делятся на три группы:
- хладоломкие — сталь некоторых марок, цинк и его сплавы;
- нехладоломкие — медь, алюминий;
- хрупкие — металлы, обладающие хрупкостью и при нормальных условиях, например серый чугун.
Технологические свойства
При выборе металла или сплава для производства художественных изделий кроме физических и механических свойств учитывают и технологические свойства, т. е. способность металлов обрабатываться различными приемами и методами без особых затруднений.
Наиболее существенными являются следующие свойства.
Жидкотекучесть — свойство, обеспечивающее хорошее заполнение формы расплавленным металлом. Величина жидкотекучести зависит от атомного веса, температуры плавления, степени поверхностного натяжения и других показателей.
Металлы и сплавы, обладающие высокой жидкотекучестью, позволяют получать высокохудожественные отливки.
Они легко заполняют мельчайшие детали форм и хорошо передают все детали модели, включая и фактуру поверхности.
Хорошей жидкотекучестью обладают следующие металлы и сплавы: цинк и его сплавы, чугун, бронза, олово, силумин (сплав алюминия с кремнием), а также некоторые магниевые сплавы и литейные латуни.
Существует понятие, обратное жидкотекучести,- густоплавкость. Металлы и сплавы, обладающие густоплавкостью, даже при высоком нагреве остаются густыми и при заливке форм плохо их заполняют. К густоплавким относятся чистое серебро, красная медь, сталь.
Литейная усадка — уменьшение объема при переходе из жидкого состояния в твердое. При охлаждении металла отливка сокращается и как бы отходит от стенок формы. Отливка всегда меньше модели, по которой сделана форма. Величина усадки бывает различной. Металлы и сплавы с большой усадкой менее применимы для литья.
В табл. 5 приведены литейные усадки некоторых металлов и сплавов.
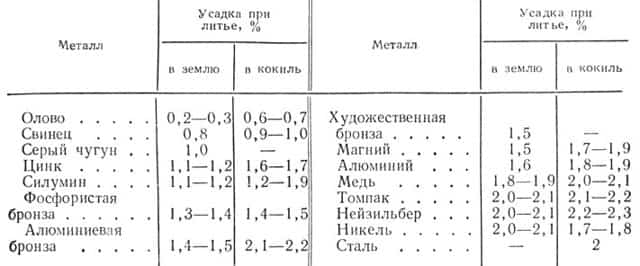 Таблица 5
Таблица 5
Зная величину литейной усадки, можно определить, насколько больше следует изготовить форму, чтобы получить отливку нужного размера.
Ковкость — свойство металла изменять свою форму под действием ударов или давления не разрушаясь. Степень ковкости зависит от многих параметров. Наиболее существенными из них являются следующие: пластичность, степень нагрева, величина деформирующего усилия, наличие примесей и др.
Металлы могут коваться как в холодном состоянии, например красная медь, золото, так и в горячем, например сталь.
Это свойство широко используется при изготовлении художественных кованых изделий из малоуглеродистой стали (ранее называемой ковочным железом).
Малоуглеродистая сталь, раскаленная докрасна, становится настолько пластичной и мягкой, что из нее можно изготовлять художественные изделия самой разнообразной сложной формы.
Свариваемость — способность металла прочно соединяться путем местного нагрева и расплавления свариваемых кромок изделия. , Чистые металлы свариваются легче, а сплавы труднее.
Легко свариваются изделия из малоуглеродистой стали. Чем выше процент содержания углерода в стали, тем свариваемость ее хуже.
Наиболее затруднительной считается сварка высокоуглеродистых легированных сталей и особенно чугуна.
Спекаемость — свойство, в результате которого образуется металлокерамика.
При этом металлы, предварительно измельченные в порошок, смешиваются, запрессовываются в специальные формы и подвергаются действию высокой температуры и давления до спекания.
Различные металлы спекаются неодинаково — одни лучше, другие хуже. Способом спекания сейчас производят особо твердые стойкие сплавы, например победит, который применяется при изготовлении режущих инструментов.
Обрабатываемость резанием на различных станках (токарном, фрезерном и пр.
), а также способность шлифоваться и полироваться — это свойства, играющие существенную роль в производстве художественных изделий и особенно в отделке (полировании).
Хорошо режутся бронзы, латуни и некоторые марки сталей, алюминия и чугуна. Особенно плохо обрабатываются на станках детали из красной меди и из свинца и его сплавов.
Химические свойства
Из химических свойств металлов практически наиболее важными в производстве изделий художественной промышленности являются растворение и окисление.
Растворение, или разъедание,— это способность металлов и сплавов растворяться в сильных кислотах и едких щелочах. Наиболее часто в производстве употребляются серная, азотная и соляная кислоты, а также смесь азотной и соляной кислот, называемая «царской водкой», а из щелочей — едкий натр и едкое кали.
Свойство металлов растворяться имеет очень широкое применение в самых различных областях производства художественных изделий из металла. При этом следует различать случаи, когда растворение носит частичный характер и ограничивается только поверхностным слоем металла, а также случаи полного растворения металла и перехода его в раствор. Примерами частичного растворения с поверхности являются:
- травление изделий в кислотах для получения чистой поверхности или узора (рис. 2);
 Рис. 2. Вазы из алюминия, обработанные травлением. Художник Л. Линакс
Рис. 2. Вазы из алюминия, обработанные травлением. Художник Л. Линакс - травление медных досок при изготовлении офорта и т. п.
Примерами полного растворения металла являются:
- растворение цинка в соляной кислоте для приготовления хлористого цинка, употребляемого в качестве флюса при пайке;
- растворение серебра в азотной кислоте при приготовлении азотнокислого серебра и т. п.
Окисление — способность металлов соединяться с кислородом и образовывать окислы металлов. При окислении вес металла увеличивается на вес кислорода, который с ним соединяется. Обычно почти все металлы и сплавы покрыты с поверхности тонкой оксидной (или окисной) пленкой, представляющей собой тончайший слой, состоящий из окислов.
Скорость образования такой пленки на поверхности изделия из различных металлов неодинакова. Например, магний и алюминий окисляются особенно быстро, бронза и латунь значительно медленнее, а изделия из золота и платины совсем не окисляются.
Особенно быстро окисление происходит при нагреве до высоких температур. В этом случае на поверхности металла быстро образуется более толстый слой, состоящий из окислов, который называется окалиной.
Чем выше нагрев и больше доступ воздуха к нагреваемому изделию, тем толще слой образующейся окалины.
Если металл нагревать в условиях избытка воздуха или кислорода, то весь металл может превратиться в окалину.
В одних случаях способность металлов к окислению и образование на их поверхности оксидной пленки является желательным, так как такая пленка предохраняет изделие от дальнейшего окисления металла в глубину и носит название защитной пленки. Таковы окисные пленки на изделиях из алюминиевых сплавов.
В других случаях образование окислов на поверхности металлов является нежелательным, например трудности пайки и сварки алюминиевых изделий обусловлены быстрым образованием очень прочной оксидной пленки, которая препятствует соприкосновению припоя с чистой поверхностью металла. Очень нежелательно и образование окалины на стальных изделиях в процессе их закалки, которая появляется даже при содержании кислорода в атмосфере, не превышающем 0,2%.
Видеоурок «Физические свойства металлов»
Содержание:
§ 1 Свойства металлов 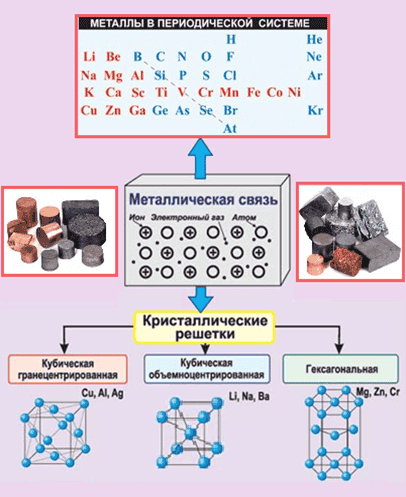
Физические свойства металлов объясняются особенностями строения их кристаллических решеток. В узлах решеток располагаются или положительно заряженные ионы металлов, или их атомы, а между ними перемещаются свободные электроны. Связь, между свободными электронами и ионами металла в кристаллической решетке, называется металлической.
Для металлов характерны как общие физические свойства, так и индивидуальные свойства. Металлический блеск, пластичность и ковкость, теплопроводность и электропроводность – это свойства, характерные для всех металлов, по ним отличают их от неметаллов. Температура плавления, плотность, твердость для каждого металла свои, в этом они отличаются друг от друга.
§ 2 Общие физические свойства металлов
Пластичность– способность металла изменять форму под действием внешних сил без разрушения и сохранять ее после прекращения воздействия. При воздействии на металлическую кристаллическую решетку происходит смещение слоев атом-ионов металла относительно друг друга без разрыва связей, поэтому для них характерна высокая пластичность.
Наиболее пластичные металлы: золото, серебро, медь, олово, свинец. Например из 1 г золота можно получить тончайшую проволоку длиной около 3 км или же лист, способный покрыть потолок трехкомнатной квартиры площадью около 50 м2.
Тончайшие листы золота, толщиной от 1 мкм до 3 мкм, называют сусальным золотом. Его применяют для декоративной отделки изделий, изготовленных в основном из дерева.
Листочками сусального золота оклеивают резные деревянные рельефы, предназначенные для украшения интерьеров дворцов, храмов, дорогой мебели.
- Электропроводность – свойство вещества проводить электрический ток.
- В металлической кристаллической решетке присутствуют свободные электроны, которые при обычных условиях двигаются в беспорядке, а при попадании в электрическое поле начинают двигаться направлено, в результате чего возникает электрический ток.
- Наибольшей электропроводностью обладают серебро, медь, золото, алюминий, железо;
а наименьшей – свинец, марганец, вольфрам и ртуть.
При повышении температуры электропроводность металлов уменьшается, это объясняется усилением колебательного движения атомов-ионов металлов, что затрудняет направленное движение электронов.
При понижении температуры электропроводность увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Медь и алюминий наиболее доступные металлы, поэтому их используют в виде проводников электрического тока.
Теплопроводность – способность металла передавать теплоту от более нагретых его частей менее нагретым. Это свойство металлов также объясняется подвижностью свободных электронов, они при движении сталкиваются с колеблющимися в узлах решетки ионами и обмениваются с ними энергией.
При повышении температуры колебания одних ионов передаются другим ионам с помощью электронов, и температура всего металлического предмета быстро выравнивается. Теплопроводность металлов изменяется в той же последовательности, что и электропроводность.
Наибольшей теплопроводностью обладают серебро, медь, золото, алюминий, железо; а наименьшей – свинец, марганец, вольфрам и ртуть.
Если одновременно в горячую воду опустить например чайные ложки, изготовленные из серебра, меди, золота, алюминия, железа, то быстрее нагреется ложка из серебра, так как ее теплопроводность выше теплопроводности других металлов, затем медная, золотая, алюминиевая и затем железная ложки.
§ 3 Отличительные особенности металлов
Твердость – способность твердого тела сопротивляться проникновению в него другого более твердого тела. Все металлы, за исключением ртути, при обычных условиях являются твердыми веществами.
По твердости металлы сравнивают с алмазом, твердость которого принята за 10.
Самыми мягкими являются щелочные металлы (цезий, рубидий, калий, натрий) их можно резать ножом, а самым твердым является хром, он царапают стекло.
Плотность – величина, определяемая отношением массы тела к его объему.
По плотности металлы делятся на легкие (с плотностью менее 5 г/см3) и тяжелые (с плотностью более 5 г/см3). К легким металлам относятся щелочные (литий, натрий), щелочноземельные (кальций, магний) и алюминий. К тяжелым – цинк, железо, никель, медь, серебро, свинец, ртуть, золото, платина. Самый легкий металл – литий (0,53 г/см3), а самый тяжелый – осмий (22,6 г/см3).
Плавкость металлов – это процесс перехода вещества из твердого в жидкое состояние. По температуре плавления металлы можно разделить на легкоплавкие и тугоплавкие.
К легкоплавким относятся металлы, температура плавления которых ниже 10000 С. Это ртуть, галлий, цезий, калий, олово, свинец, цинк, магний, алюминий.
Если температура плавления выше температуры плавления железа 15390 С, то металл является тугоплавким. К ним относятся: титан, хром, ванадий, цирконий, гафний, ниобий, молибден, вольфрам.
Самая низкая температура плавления у ртути – 390 С, поэтому это единственный металл, который при комнатной температуре находится в расплавленном состоянии. Самая высокая температура плавления у вольфрама 34200 С, из этого металла изготавливают нити накаливания электрических ламп.
§ 4 Краткие итоги по теме урока
К физическим свойствам металлов относятся: металлический блеск, пластичность и ковкость, теплопроводность и электропроводность, твердость, плотность, плавкость. Свойства металлов зависят от особенностей строения их кристаллических решеток.
Все металлы обладают металлическим блеском, электропроводностью, теплопроводностью, пластичностью.
Твердость, плотность и температура плавления и кипения металлов отличаются, на эти показатели влияют расположение атомов и ионов в узлах кристаллической решетки и их атомные радиусы.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений / М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя / О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 кл. общеобразоват. учреждений. – М.: Просвещение, 1999
Использованные изображения:
Физические свойства металлов
9. Физические свойства металлов
Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества.
И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов.
Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
-
Металлический блеск.
-
Электропроводность и теплопроводность.
-
Пластичность.
-
Твердость.
-
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск.
Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
- В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
- Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
- Прекрасно отражают свет палладий Pd, ртутьHg, сереброAg, медьCu.
- Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
- Электропроводность и теплопроводность.
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из нихпосуды.
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. СереброAg, медьCu, золотоAu и алюминий Al обладают наибольшей электропроводностью, поэтому медьCu и алюминийAl используют в качестве материала для изготовления электрических проводов.
- Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hgи вольфрам W.
- Пластичность.
- Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
- Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золотоAu, сереброAg, медьCu. Из золотаAu можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Твердость.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
Плотность.
По плотности металлы классифицируют на легкие (их плотность от 0,53 до 5 г/см3) и тяжелые (плотность этих металлов от 5 до 22,6 г/см3). Самым легким металлом является литий Li, плотность которого 0,53 г/см3. Самыми тяжелыми металлами в настоящее время считают осмий Os и иридий Ir (плотность около 22,6 г/см3).
Температура плавления.
Температура плавления металлов находится в диапазоне от 39 (ртутьHg) до 3410оС (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
- Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
- В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
- Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
- К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.
Физические и химические свойства металлов
Металлы широко распространены в природе и могут встречаться в различном виде: в самородном состоянии (Ag, Au, Rt, Cu), в виде оксидов (Fe3O4, Fe2O3, (NaK)2O×AlO3), солей (KCl, BaSO4, Ca3(PO4)2), а также сопутствуют различным минералам (Cd – цинковые руды, Nb, Tl – оловянные и т.д.).
Физические свойства металлов
Всем металлам присущи металлический блеск (однако In и Ag отражают свет лучше других металлов), твердость (самый твердый металл – Cr, самые мягкие металлы – щелочные), пластичность (в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe наблюдается уменьшение пластичности), ковкость, плотность (самый легкий металл – Li, самый тяжелый – Os), тепло – и электропроводность, которые уменьшаются в ряду Ag, Cu, Au, Al, W, Fe.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип > 1000С) и легкоплавкие (Tкип < 1000С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns1, ns2), р- элементы – металлы, расположенные в группах III – VI (ns2np1-4). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами.
Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d1-10ns2. Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов.
Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f1-14(n-1)d0-1ns2.
Химические свойства металлов
- Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
- 2Al + 3/2 O2 = Al2O3 (оксид алюминия)
- 2Na + Cl2 = 2NaCl (хлорид натрия)
- 6Li + N2 = 2Li3N (азид лития)
- 2Li+2C = Li2C2 (карбид лития)
- 2K +S = K2S (сульфид калия)
- 2Na + H2 = NaH (гидрид натрия)
- 3Ca + 2P = Ca3P2 (фосфид кальция)
- Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
- 3Cu + Au = Cu3Au
- Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
- Ba + 2H2O = Ba(OH)2 + H2↑
- 2Na + 2H2O = 2NaOH + H2↑
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
- Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
- 2Al + 6HCl = 2AlCl3 + 3 H2↑
- Zn + 2HCl = ZnCl2 + 2H2↑
- Fe + H2SO4 = FeSO4 + H2↑
Получение металлов
- Щелочные, щелочноземельные металлы и алюминий получают электролизом расплавов солей или оксидов этих элементов:
- 2NaCl = 2Na + Cl2↑
- CaCl2 = Ca + Cl2↑
- 2Al2O3 = 4Al + 3O2↑
- Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
- Cu2O + C = 2Cu + CO (1)
- CuSO4 + Fe = Cu + FeSO4 (2)
- Некоторые металлы получают термическим разложением их неустойчивых соединений:
- Ni(CO)4 = Ni + 4CO






