- Общая характеристика элементов VIIa группы
- Природные соединения
- Простые вещества — F2, Cl2, Br2, I2
- Галогеноводороды
- Естественные семейства химических элементов и их свойства в химии — формулы и определения с примерами решения задач
- Естественные семейства химических элементов и их свойства
- Щелочные металлы
- Галогены и инертные газы
- Металлы и неметаллы
- Галогены — ХИМИЯ!FOREVER!
- Токсичность галогенов
- Галогены | это… Что такое Галогены?
- Распространённость элементов и получение простых веществ
- Физические свойства галогенов
- Химические свойства галогенов
- Примечания
Галогены (греч. hals — соль + genes — рождающий) — химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
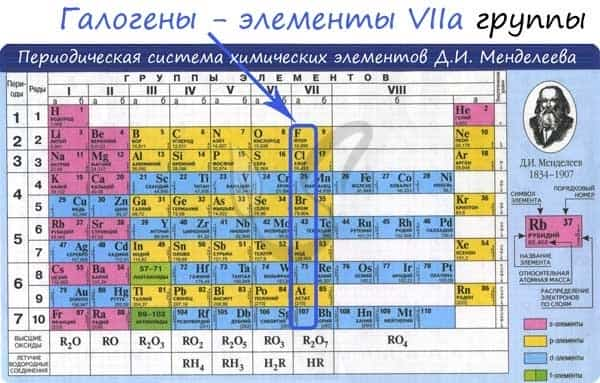
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F — 2s22p5
- Cl — 3s23p5
- Br — 4s24p5
- I — 5s25p5
- At — 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CaF2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простые вещества — F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
- NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
- Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF — был впервые получен фтор.
- HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

- В лабораторных условиях галогены могут быть получены следующими реакциями.
- HCl + MnO2 → MnCl2 + Cl2 + H2O
- HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
- Химические свойства
- Реакции с металлами
- Al + F2 → AlF3
- Cu + Cl2 → CuCl2
- Na + Br2 → NaBr
- Реакции с неметаллами
- F2 + H2 → HF (в темноте со взрывом)
- Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ?
- Br2 + F2 → BrF (фтор более электроотрицателен, чем бром — F-)
- Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод — Br-)
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
- KCl + F2 → KF + Cl2
- KBr + Cl2 → KCl + Br2
- KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
- Получение
- В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
- H2 + Cl2 → HCl
- В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
- NaCl + H2SO4 → NaHSO4 + HCl↑
- CaF2 + H2SO4 → CaSO4 + HF
- PBr3 + H2O → HBr↑ + H3PO3
- H2S + I2 → S + HI
- Химические свойства
- Кислотные свойства
- Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
- Na2O + HCl → NaCl + H2O
- ZnO + HI → ZnI2 + H2O
- KOH + HCl → KCl + H2O (реакция нейтрализации)
- С солями
- Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- AgNO3 + HCl → AgCl + HNO3
- Li2CO3 + HBr → LiBr + H2CO3
- Восстановительные свойства
- В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
- HI + MnO2 → I2 + MnI2 + H2O
- HI + H2SO4 → I2 + H2S + H2O
- HI + O2 → H2O + I2
- HI + Br2 → HBr + I2
- HBr + H2SO4 → Br2 + SO2 + H2O
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты. Mg + HBr → MgBr2 + H2↑ Zn + HCl → ZnCl2 + H2↑ 

Cr(OH)3 + HCl → CrCl3 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
Естественные семейства химических элементов и их свойства в химии — формулы и определения с примерами решения задач
Содержание:
После того как выяснилось, что классификация на металлы и неметаллы не является полной, ученые стали выделять из этих двух больших классов элементы, особенно близкие по свойствам их простых веществ. Такие группы элементов назвали естественными семействами.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Естественные семейства химических элементов и их свойства
Выделяют следующие естественные семейства: Щелочные металлы – Na, K, Cs, Rb, Li. Галогены – F, CI, Br, I.
Щелочные металлы
В любой отрасли науки по мере накопления фактов возникает необходимость в их систематизации и установлении внутренней причинно-следственной связи между ними.
Из курса биологии вы хорошо знакомы с систематизацией в растительном и животном мире. В химии накопление знаний об элементах и их соединениях привело к необходимости их группировки по сходным признакам.
Классификация элементов началась с деления их на металлы и неметаллы, что было предложено шведским химиком Й. Я. Берцелиусом.
Кроме металлов и неметаллов существуют химические элементы, которые проявляют двойственную природу, т. е. обладают свойствами и металлов, и неметаллов в зависимости от условий протекания химических реакций (Be, Zn, Аl и др.). Их оксиды и гидроксиды называют амфотерными веществами (от греческого аmphoteros – оба, тот и другой).
В природе существуют группы элементов со сходными химическими свойствами, их называют естественными семействами элементов. К типичным металлам относятся щелочные металлы. Кроме этих металлов мы будем рассматривать группу галогенов (VIIА) и инертных газов.
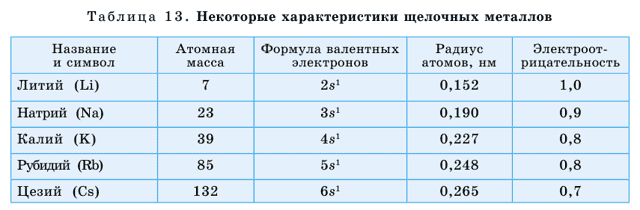
Щелочные металлы расположены в IА группе. Это литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr). Франций – радиоактивный элемент.
Они называются щелочными металлами, потому что при взаимодействии с водой образуют сильные растворимые основания – щелочи (рис. 39).
Общая электронная формула валентных электронов
Щелочные металлы обладают некоторыми общими свойствами: молекулы щелочных металлов состоят из одного атома, очень активные. Поэтому их нужно хранить под слоем керосина. Энергично реагируют с водой, в соединениях проявляют валентность, равную I.
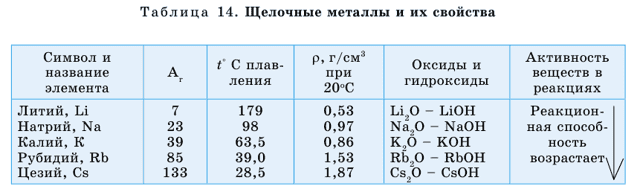
Металлическая активность щелочных металлов усиливается сверху вниз по группе, что связано с возрастанием атомных радиусов в этом направлении.
У щелочных металлов валентные электроны расположены на s-орбитали, поэтому их называют s-элементами. s-элементы в обычных условиях – это кристаллические вещества, которые по сравнению с остальными металлами обладают малыми значениями плотности (табл. 13).
Литий, калий и натрий легче воды поэтому они плавают на ее поверхности. У этих элементов температуры плавления и кипения также имеют низкие значения. Щелочные металлы и их соединения окрашивают пламя: натрий – в желтый, калий – в красно-фиолетовый, литий – в карминово-красный, рубидий – в розово-фиолетовый цвета (рис. 40).

Литий по своим свойствам несколько отличается от остальных металлов. С водой литий взаимодействует медленно, натрий – более энергично, калий – наиболее энергично реагирует с водой, вспыхивает фиолетовым пламенем, а рубидий – со взрывом.
Оксиды этих элементов являются основными, им соответствуют основания, хорошо растворимые в воде, – щелочи, основные свойства которых усиливаются сверху вниз по группе.
Литий был открыт в 1817 г. шведским ученым Арфедсоном, натрий и калий – в 1807 г. английским ученым Г. Дэви, рубидий и цезий – в 1861 г. Р. Бунзеном.
Литий используют для изготовления различных свинцовых и алюминиевых сплавов, которые применяются в самолетостроении. Добавка лития к сплавам увеличивает их твердость.
Рубидий и цезий используют для изготовления фотоэлементов.
Галогены и инертные газы
Какие галогены и инертные газы вы знаете? Где они применяются? Что вы знаете об инертных газах? Расскажите об их применении.
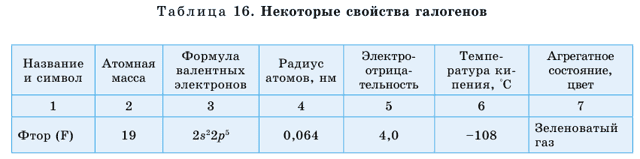
В природе существуют группы элементов с противоположными щелочным металлам свойствами, к примеру, галогены (табл. 15).

Галогены – типичные неметаллы, при взаимодействии с металлами образуют соли (галоген означает солерод). Молекулы галогенов двухатомные. Все галогены образуют летучие водородные соединения, растворы которых являются кислотами. В отличие от щелочных металлов, активность элементов по мере возрастания относительных атомных масс у галогенов ослабевает.
Галогены расположены в VIIА группе. Это фтор F, хлор Cl (рис. 41), бром Br, йод I, астат At. Астат – радиоактивный элемент.
Последний электрон у атомов галогенов поступает на р-орбиталь, поэтому они называются р-элементами.
По группе сверху вниз радиусы атомов увеличиваются, в том же направлении растут значения температур кипения и плотности.
Агрегатные состояния переходят из газообразного через жидкое в твердое а окраска сгущается (от желто-зеленой у хлора до черно-серого с фиолетовым блеском у йода).
Галогены – типичные неметаллы, на внешнем энергетическом уровне у них не хватает одного электрона для завершения слоя, поэтому они легко принимают один электрон, проявляя неметаллические свойства. При этом принимают электронное строение инертного газа, стоящего после них в периодической системе. Кроме фтора, все остальные галогены образуют кислотные оксиды.
В соединениях фтор проявляет валентность, равную I. Остальные галогены проявляют валентности I, III, V, VII.
Неметаллические свойства элементов в группе сверху вниз ослабевают, так как из-за увеличения атомных радиусов сила притяжения электронов к ядру уменьшается.
Еще одна природная группа элементов – инертные газы (табл. 17).
Каждый период в Периодической системе завершается инертным газом. Инертные газы характеризуются низкой химической активностью. Из-за чего такая пассивность? Для разрешения этого вопроса рассмотрим электронное строение этих элементов. У известных вам инертных газов внешний слой завершен (у гелия – два, у аргона и неона – по восемь электронов).
Это одноатомные газы без цвета и запаха. Среди них самым химически инертным является гелий, более активны криптон и ксенон. В направлении возрастания относительной атомной массы, от He до Xe, наблюдается возрастание температуры кипения и плавления. Усиливается также растворимость газов в воде и других растворителях.
Гелий обнаружен в атмосфере Солнца и других звезд. В земной атмосфере и коре гелий может накапливаться в результате распада радиоактивных элементов.
Он состоит из двух изотопов: неон и аргон из трех: и Криптон на Земле встречается в виде шести изотопов, ксенон – девяти, а радон не имеет устойчивых изотопов.
Аргон более распространен на Земле, его содержание в земной атмосфере составляет 0,9%.
Инертные газы (He, Ne, Ar) применяются в основном при сварке металлов, в лампах, в фонарях, а также как хладагенты при физических исследованиях (рис. 42).
Изучение свойств естественных семейств химических элементов и их соединений помогает нам систематизировать наши знания.
Йод был открыт при «помощи» кошки. Французский ученый Б. Кур-туа приготовил в двух склянках два различных раствора: в первой -концентрированную во второй — спиртовый раствор морских водорослей.
В это время на плече ученого сидела кошка, она прыгнула и опрокинула обе склянки. Эти вещества прореагировали с образованием сине-фиолетового газа. При охлаждении он превратился в фиолетовые кристаллы. Так в 1811 г.
был открыт йод.
Металлы и неметаллы
Вы знаете, что простые вещества в зависимости от электронного строения атомов подразделяются на металлы и неметаллы. Рассмотрим их структуру, свойства и применение в сравнительном аспекте. Обратите внимание на их различия и с чем они связаны.
В периодах в I, II, ІІІ группах находятся в основном металлы, а в IV–VIII главных подгруппах в основном расположены неметаллы.
Если провести диагональ от бора к астату, то справа вверх от диагонали расположены элементы – неметаллы (кроме элементов побочных подгрупп), а слева вниз – элементы металлы. На внешних энергетических уровнях металлов вращаются в основном 1–3 электрона, у неметаллов 4–8 электронов.
- Электронное строение металлов и неметаллов Радиусы атомов металлов большие, неметаллы характеризуются малыми значениями радиусов.
- В химических реакциях металлы отдают электроны
- неметаллы присоединяют и могут отдавать электроны, кроме фтора.
- Металлы, кроме ртути, твердые вещества, а неметаллы – твердые (S, P, C, Si, ), жидкие и газообразные
- Металлы и их соединения применяются в тяжелой индустрии, а соединения неметаллов применяются в пищевой, бумажной и текстильной промышленности.
- Металлы встречаются в литосфере, а соединения неметаллов чаще находятся в атмосфере.
По распространенности металлы подразделяются на благородные (Au, Ag, Pt), редкие, рассеянные, макро- и микроэлементы; неметаллы по содержанию в живых организмах – на макро-, микро- и ультраэлементы. В недрах земли они встречаются в виде минералов, в морских и водах океанов – в виде соединений.
Оксиды металлов I–II главных подгрупп – основные оксиды, им соответствуют гидроксиды: СаО → Оксиды неметаллов главных подгрупп VI–VII групп – кислотные оксиды, им соответствуют кислоты:
Металлы не образуют летучие водородные соединения. Неметаллы образуют летучие водородные соединения кислотного характера, например, HCl, HF, HBr, HI. А некоторые неметаллы образуют водородные соединения, проявляющие основные свойства в водных растворах, например, и
Металлы обладают характерной особенностью – металлическим блеском, легко куются, вытягиваются, гнутся и прокатываются.
Металлы хорошо проводят электричество и тепло, они хорошие провjдники. Из неметаллов хорошим проводником электрического тока является графит. Многие соединения неметаллов (кристаллический кремний) проявляют полупроводниковые свойства или являются диэлектриками.
Делаев выводы:
- Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда атомных ядер.
- Группы элементов со сходными физическими и химическими свойствами называются естественными семействами.
- Формулы валентных электронов щелочных металлов ns1, галогенов — ns2np5, а инертных газов — пз2пръ (кроме гелия).
- Щелочные металлы — легко отдают один электрон с внешнего энергетического уровня, а галогены легко присоединяют недостающий до завершения внешнего слоя один электрон.
- В группе металлические свойства щелочных металлов усиливаются сверху вниз, а у галогенов неметаллические свойства в этом направлении ослабевают.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Галогены — ХИМИЯ!FOREVER!
Галогены – это элементы VII A группы главной подгруппы. К ним относятся: фтор, хлор, бром, йод и астат, который очень редко встречается в природе.
- Все эти элементы являются типичными неметаллами. Галогены, означает «рождающие соли»
- Рассмотрим таблицу, в которой отражены физические свойства галогенов.
Фтор является светло-жёлтым газом, хлор – жёлто-зелёный газ, бром – бурая жидкость, а йод – твёрдое вещество чёрно-серого цвета.
- Из таблицы видно, что с ростом молекулярной массы увеличиваются температуры кипения и плавления галогенов, их плотность.
- Это связано, прежде всего, с увеличением размеров атомов и молекул, а, следовательно, и силами межмолекулярного взаимодействия.
- От фтора к йоду усиливается интенсивность окраски галогенов, а у кристаллов йода появляется металлический блеск.
- Галогены – химически активные соединения, их активность уменьшается от фтора к йоду.
Фтор самый активный галоген, который при нагревании реагирует даже с золотом, серебром и платиной. Алюминий и цинк в атмосфере фтора воспламеняются.
Если Вы хорошо изучили эту часть урока,ответьте на 5 вопросов теста
Получение галогенов.
- 1. Электролиз растворов и расплавов галогенидов:
- 2NaCl + 2H2O = Cl2+ H2+ 2NaOH
- 2KF = 2K + F2 (единственный способ полученияя F2)
- 2. Окисление галогенводородов:
- 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O – лабораторный способ получения хлора
- 14HBr+K2Cr2O7=2KBr+2CrBr3+3Br2+7H2O
- MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O– Лабораторный — (Для получения хлора, брома, иода)
- 3. Промышленный способ – окисление хлором (для брома и йода):
- 2KBr+Cl2=2KCl+Br2
- 2KI + Cl2=2KCl + I2
Химические свойства
Реакции с металлами
- Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
- 2Al + 3F2 → 2 AlF3
- Cu + Cl2 → CuCl2
- 2Na + Br2 → 2NaBr
- Реакции с неметаллами
- F2 + H2 → 2HF (в темноте со взрывом)
- Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ?
- Br2 + F2 →2 BrF (фтор более электроотрицателен, чем бром — F-)
- Br2 + 3 I2 →2 BrI3 (бром более электроотрицателен, чем йод — I-)
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
- 2KCl + F2 → 2KF + Cl2
- 2KBr + Cl2 → 2KCl + Br2
- KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
- Взаимодействие хлора с органическими веществами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.2Cl2 + Si → SiCl4Cl2 + H2 →2 HCl (на свету)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
2H2O + 2F2 →4 HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами — только при нагревании.
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF — фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
- Получение
- В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
- H2 + Cl2 → 2HCl
- В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
- NaCl + H2SO4 → NaHSO4 + HCl↑
- CaF2 + H2SO4 → CaSO4 + 2HF
- PBr3 + 3H2O → 3HBr↑ + H3PO3
- H2S + I2 → S + 2HI
- Химические свойства
- Кислотные свойства
- Mg + 2HBr → MgBr2 + H2↑
- Zn + 2HCl → ZnCl2 + H2↑
- Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
- Na2O + 2HCl → 2NaCl + H2O
- ZnO + 2HI → ZnI2 + H2O
- KOH + HCl → KCl + H2O (реакция нейтрализации)
- Cr(OH)3 + 3HCl → CrCl3 + 3H2O
- С солями
- Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
- AgNO3 + HCl → AgCl + HNO3
- Li2CO3 + 2HBr →2 LiBr + H2CO3
- Восстановительные свойства
- В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
- 4HI + MnO2 → I2 + MnI2 + 2H2O
- 2HI + H2SO4 → I2 + H2S + H2O
- 4HI + O2 → 2H2O +2 I2
- 2HI + Br2 → 2HBr + I2
- 2HCl + H2SO4 → Cl2 + SO2 + 2H2O
- Реакция с оксидом кремния
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + 4HF → SiF4 + 2H2O
Обнаружить ионы галогенов возможно воздействием на растворы солей, содержащих галоген ион нитратом серебра (AgNO3).
При наличии хлор-иона образуется белый творожистый осадок
хлорида серебра:
NaCl + AgNO3 → NaNO3 + AgCl↓ При наличии бром-иона образуется бледно-желтый творожистый осадок бромида серебра:
NaBr + AgNO3 → NaNO3 + AgBr↓ При наличии бром-иона образуется желтый творожистый осадок иодида серебра:
NaJ + AgNO3 → NaNO3 + AgJ↓
Осадки не растворимы в воде и азотной кислоте.
Природное соединение фтора — криолит Na3AlF6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве.
Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон.
Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
Галогены | это… Что такое Галогены?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 14 декабря 2011. |
|
|||
|
|||
|
|||
|
Галоге́ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов).
Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах.
Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление.
При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г.
французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное.
Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−).
Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Физические свойства галогенов
Фтор является трудносжижаемым, а хлор легкосжижаемым газом с удушливым резким запахом. Энергия связи галогенов сверху вниз по ряду изменяется не равномерно.
Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (Cl2 243, Br2 199, I2 150,7, At2 117 кДж/моль).
От хлора к астату энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. Аналогичные аномалии имеют и температуры кипения (плавления):
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж,
2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
Н2 + F2 = 2HF + 547 кДж,
Si + 2F2 = SiF4(г) + 1615 кДж.
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Хе + F2 = XeF2 + 152 кДж.
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
3F2 + ЗН2О = OF2↑ + 4HF + Н2О2.
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж,
2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж,
Si + 2Cl2 = SiCl4(Ж) + 662 кДж,
Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl,
Cl + Н2 → HCl + Н,
Н + Cl2 → HCl + Cl,
Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов (hν), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
СН3-СН3 + Cl2 → СН3-СН2Cl + HCl,
СН2=СН2 + Cl2 → СН2Cl — СН2Cl.
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
Cl2 + 2HBr = 2HCl + Br2,
Cl2 + 2HI = 2HCl + I2,
Cl2 + 2KBr = 2KCl + Br2,
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде),
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж,
Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
I2 + I− → I−3.
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату.
Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
А при диссоциации образуются не только протоны, но и ионы At+:HAt диссоц. на:2HAt=H++At-+H-+At+.
Примечания
- ↑ Таблица Менделеева на сайте ИЮПАК
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.






