В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
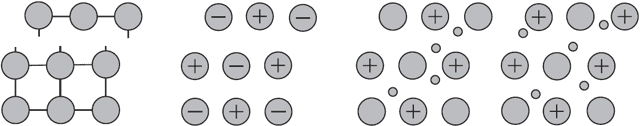
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа.
В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят.
Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.
Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.
- По степени пластичности металлы принято подразделять следующим образом:
- -высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
- -пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
- -хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
- Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.
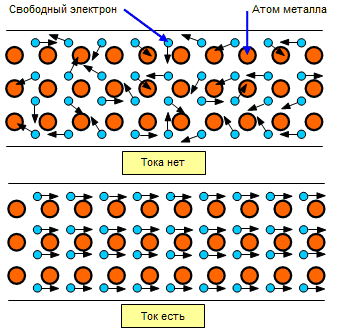
Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.
Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.
Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.
Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».
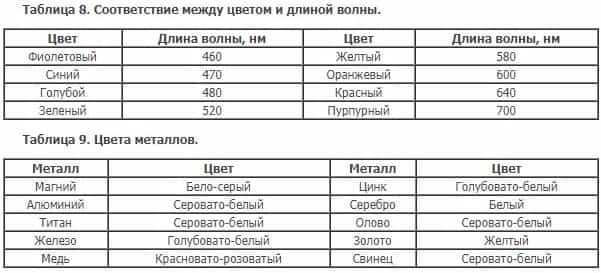
Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
- https://libmetal.ru/prop/tverd.htm
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами.
Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов.
В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
- Карбид вольфрама: 8.5-9
- Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
- -лёгкие (плотность не более 5 г/см3) — магний, алюминий, титан и др.:
- -тяжёлые — (плотность от 5 до 10 г/см3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
- -очень тяжёлые (плотность более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
- Таблицы с плотностями:
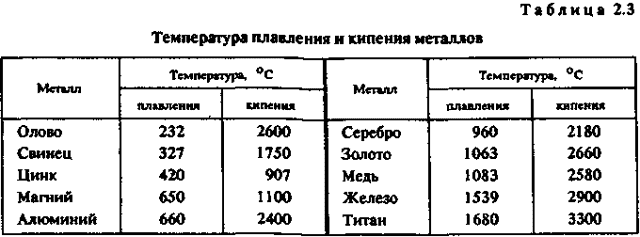
- Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
- Делят металлы на несколько групп:
- -легкоплавкие (температура плавления не превышает 600 oС) — цинк, олово, свинец, висмут и др.;
- -среднеплавкие (от 600 oС до 1600 oС) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
- -тугоплавкие ( более 1600 oС) — вольфрам, молибден, титан, хром и др.
- Больше про плавление написано здесь:
Дополнительная общая ссылка:
- https://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv
Большое спасибо за внимание!
Свойства металлов
Все чистые (с химической точки зрения) металлы — это простые вещества, состоящие из атомов одного химического элемента. В таблице Менделеева металлические свойства элементов возрастают справа налево. Все чистые металлы (как элементы) — являютя простыми веществами.
Сверхчистые металлы Кристаллический кремний — полупроводник Фотоэффект
Различают физические и химические свойства металлов. В общем случае, свойства металлов достаточно разнообразны.
Различают металлы щелочные, щелочноземельные, чёрные, цветные, лантаноиды (или редкоземельные — близкие по химическим свойствам к щелочноземельным), актиноиды (большинство из них — радиоактивные элементы), благородные и платиновые металлы. Кроме того, отдельные металлы проявляют как металлические, так и неметаллические свойства. Такие металлы — амфотерные (или как говорят — переходные).
Практически все металлы имеют некоторые общие свойства: металлический блеск, строение кристаллической решётки, способность в химических реакциях проявлять свойства восстановителя, при этом окисляясь. В химических реакциях ионы растворённых металлов при взаимодействии с кислотами образуют соли, при взаимодействии с водой (в зависимости от активности металла) образуют щёлочь или основание.
Почему блестят металлы
Свойства металлов
В узлах кристаллической решётки металлов содержатся атомы. Электроны, движущиеся вокруг атомов, образуют «электронный газ» который свободно может перемещаться в разных направлениях. Это свойство объясняет высокую электропроводность и теплопроводность металлов.
Электронный газ отражает почти все световые лучи. Именно поэтому металлы так сильно блестят и чаще всего имеют серый или белый цвет.
Связи между отдельными слоями металла невелики, что позволяет перемещать эти слои под нагрузкой в разных направлениях (по-другому — деформировать металл). Уникальным металлом является чистое золото.
С помощью ковки из чистого золота можно сделать фольгу толщиной 0,002 мм! такой тончайший листочек металла полупрозрачен и имеет зелёный оттенок если смотрень через него на солнечный свет.
Электрофизическое свойство металлов
Электрофизическое свойство металлов выражено в его электропроводности. Принято считать, что все металлы имеют высокую электропроводность, то есть хорошо проводят ток! Но это не так, да и к тому же, всё зависит от температуры, при которой замеряют ток.
Представим себе кристаллическую решётку металла, в которой ток передаётся с помощью движения электронов. Электроны движутся от одного узла кристаллическрой решётки к другому. Один электрон «выталкивает» из узла решётки другой электрон, который продолжает двигаться к другому узлу решётки и т.д.
То есть электропроводность также зависит от того, насколько легко электроны могут перемещаться между узлов решётки. Можно сказать, что электропроводность металла зависит от кристаллического строения решётки и плотности расположения в ней частиц. Частицы в узлах решётки имеют колебания, и эти колебания тем больше, чем выше температура металла.
Такие кролебания значительно препятствуют перемещению электронов в кристаллической решётке. Таким образом, чем ниже температура металла, тем выше его способность проводить ток!
Отсюда вытекает понятие сверхпроводимости, которое наступает в металле при температуре близкой к абсолютному нулю! При абсолютном нуле (-273 0C) колебания частиц в кристаллической решётке металла полностью затухают!
Электрофизическое свойство металлов, связанное с прохождением тока, называют температурным коэффициентом электросопротивления!
Электрофизическое свойство металлов
Электрофизическое свойство металлов
Установлен интересный факт, что, например у свинца (Pb) и ртути (Hg) при температуре, которая выше абсолютного нуля всего на несколько градусов, почти полностью исчезает электросопротивление, то есть наступает условие сверхпроводимости.
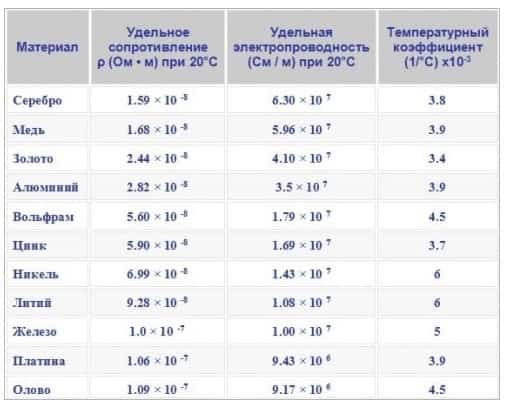
Самую высокую электропроводность имеет серебро (Ag), затем медь (Cu), далее идёт золото (Au) и алюминий (Al). С высокой электропроводностью этих металлов связано их использование в электротехнике. Иногда, для обеспечения химической стойкости и антикоррозионных свойств используют именно золото (позолоченные контакты).
Надо отметить, что электропроводность металлов значительно выше, чем электропроводность неметаллов. Вот например, углерод (С — графит) или кремний (Si) имеют электропроводность в 1000 раз меньше, чем, например, у ртути.
Кроме того, неметаллы, в своём большинстве не являются проводниками электричества.
Но среди неметаллов встречаются полупроводники: германий (Ge), кремний кристаллический, а также некоторые оксиды, фосфиты (химические соединения металла с фосфором) и сульфиды (химические соединения металла и серы).
Вам, наверное, знакомо явление фотоэффекта — это свойство металлов под действием температуры или света отдавать электроны.
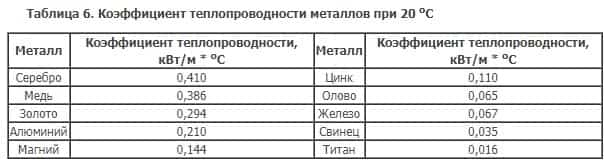
Что касается теплопроводности металлов, то её можно оценить из таблицы Менделеева, — она распределяется точно также, как электроотрицательность металлов.
(Металлы, находящиеся слева вверху имеют наибольшую электроотрицательность, например, электроотрицательность натрия Na равна -2,76 В).
В вою очередь, теплопроводность металлов объясняется наличием свободных электронов, которые переносят тепловую энергию.
Металлы
Как известно, все химические элементы и образуемые ими простые вещества делятся на металлы и неметаллы.
Так как в периодах и группах периодической системы Д.И.Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определенно указать положение элементов-металлов и элементов-неметаллов в периодической системе.
Если провести диагональ от бора к астату, то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от нее элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами.
Элементы, расположенные вблизи диагонали (например, Al, Ti, Ga, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы, а в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме Н и Не), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди р-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
 Самородки золота
Самородки золота
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия, олова, свинца на внешнем электронном слое имеют четыре электрона, атомы сурьмы, висмута – пять, атомы полония – шесть.
Атомы металлов имеют меньший заряд ядра и больший радиус по сравнению с атомами неметаллов данного периода. Поэтому прочность связи внешних электронов с ядром в атомах металлов небольшая.
Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твердыми кристаллическими веществами (кроме ртути).
Кристаллическая решетка металлов образуется за счет металлической связи.
Имеющиеся между узлами кристаллической решетки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
- Все металлы – твердые вещества (кроме ртути).
- Для всех металлов характерны металлический блеск и непрозрачность.
- Все металлы – проводники теплоты и электрического тока. Металлы, характеризующиеся высокой электрической проводимостью, обладают и высокой теплопроводностью.
- Важными свойствами металлов являются их пластичность, упругость, прочность. Они способны под давлением изменять свою форму, не разрушаясь.
 Ртуть
Ртуть
По степени твердости металлы значительно отличаются друг от друга. Так, калий, натрий – мягкие металлы (их можно резать ножом); хром – самый твердый металл (царапает стекло).
Температуры плавления и плотности металлов также изменяются в широких пределах. Самый легкоплавкий металл – ртуть (tпл.= — 39 ̊ С), самый тугоплавкий – вольфрам (tпл.= 3380 ̊ С). Плотность лития – 0,59 г/см3, осмия – 22,48 г/см3.
- Металлы отличаются своим отношением к магнитным полям и делятся на три группы:
- — ферромагнитные металлы способны намагничиваться под действием слабых магнитных полей (железо, кобальт, никель, гадолиний);
- — парамагнитные металлы проявляют слабую способность к намагничиванию (алюминий, хром, титан, почти все лантаноиды);
- — диамагнитные металлы не притягиваются к магниту, даже слегка отталкиваются от него (олово, медь, висмут).
Атомы металлов не могут присоединять электроны. Поэтому они во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов неодинакова. В периодах слева направо восстановительная активность металлов уменьшается; в главных подгруппах сверху вниз – увеличивается.
- Взаимодействие с простыми веществами – неметаллами:
- а) с галогенами металлы образуют соли – галогениды, например:
- Mg + Cl2 = MgCl2
- Zn + Br2 = ZnBr2
- б) с кислородом металлы образуют оксиды, например:
- 4Na + O2 = 2Na2O
- 2Cu + O2 = 2CuO
 Горение железа в кислороде
Горение железа в кислороде
- в) с серой металлы образуют соли – сульфиды, например:
- Fe + S = FeS
- г) с водородом самые активные металлы образуют гидриды, например:
- Ca + H2 = CaH2
- д) с углеродом многие металлы образуют карбиды, например:
- Ca + 2C = CaC2
- Взаимодействие со сложными веществами:
- а) металлы, находящиеся в начале ряда напряжений (от Li до Na), при обычных условиях вытесняют водород из воды и образуют щелочи, например:
- 2Na + 2H2O = 2NaOH + H2↑
- б) металлы, расположенные в ряду напряжений до водорода, взаимодействуют с разбавленными кислотами (HCl, H2SO4 и др.), в результате чего образуются соли и выделяется водород, например:
- 2Al + 6HCl = 2AlCl3 + 3H2↑
- в) металлы взаимодействуют с растворами солей менее активных металлов, в результате чего образуется соль более активного металла, а менее активный металл выделяется в свободном виде, например:
- Fe + CuSO4 = FeSO4 +Cu
Большинство металлов встречаются в природе в виде различных соединений (оксиды, сульфиды, сульфаты, хлориды, карбонаты и др.). Только наименее активные металлы встречаются в природе в свободном виде (самородные металлы) – золото, серебро, платина и др.
- Получение металлов из их соединений – это задача металлургии.
- Любой металлургический процесс является процессом восстановления ионов металла с помощью различных восстановителей, в результате которого получаются металлы в свободном виде.
- В зависимости от способа проведения металлургического процесса различают пирометаллургию, гидрометаллургию и электрометаллургию.
- Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей: углерода, оксида углерода (II), водорода, металлов (алюминия, магния) и др.
- Гидрометаллургия – это получение металлов, которое состоит из двух процессов: 1) природное соединение металла (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли металла; 2) из полученного раствора данный металл вытесняется более активным металлом.
Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя в данном процессе играет электрический ток.
Сплавы
Металлы в чистом виде применяют реже, чем их сплавы. Это объясняется тем, что сплавы часто обладают более высокими техническими свойствами, чем чистые металлы. Изготовление сплавов основано на свойстве металлов в расплавленном состоянии взаимно растворяться и смешиваться друг с другом.
По своему составу и строению сплавы бывают различными. Важнейшими из них являются:
- Механическая смесь металлов. Охлажденный расплав представляет собой смесь очень мелких кристаллов отдельных металлов (например, Pb + Sb)
- Твердые растворы. При охлаждении расплава образуются однородные кристаллы. В узлах их кристаллических решеток находятся атомы различных металлов (например, Cu + Ni).
- Интерметаллические соединения. При взаимном растворении металлов их атомы реагируют между собой, образуя химические соединения. В таких соединениях металлы чаще всего не проявляют валентность, характерную для них в соединениях с неметаллами (например, Cu3Zn, Zn3Mg, Ag2Zn5).
В состав сплавов могут входить и неметаллы (углерод, бор и др.)
 Бронза
Бронза
Способность металлов в расплавленном виде не только механически смешиваться, но и образовывать между собой (и атомами неметаллов) различные соединения – одна из главных причин, объясняющая, почему сплавы по физическим свойствам сильно отличаются от свойств составляющих их металлов.
Сплав полученный из монокарбида вольфрама и кобальта – «победит» — по твердости сравним с алмазом. В настоящее время в технике применяют большое число различных сплавов, обладающих заранее заданными свойствами.
Для их получения используют более 40 химических элементов в разнообразных сочетаниях и количественных соотношениях.
- Некоторые широко используемые сплавы
- Сталь – сплав железа и углерода, добавки: Mn, Cr, Ni, Si, P, S.
- Бронза – сплав меди с оловом, добавки: Zn, Pb, Al, Mn, P, Si.
- Латунь – сплав меди с цинком, добавки: Sn, Mn, Al, Pb, Si.
- Мельхиор – сплав меди с никелем.
- Дюралюминий – сплав алюминия с медью (3-5%), марганцем (1%), магнием (1%).
- Амальгамы – сплавы металлов, содержащие ртуть.
Металлы — Химия
 Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
- Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
- В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
- Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³).
Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.
6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь.
Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- Химические свойства металлов
- На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
- Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития пероксид натрия надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- Взаимодействие кислот с металлами
- Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
- Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:
ПОИСК
Металлы обладают металлическим блеском, если они находятся в крупнокристаллическом состоянии. Порошкообразные металлы блеска не имеют. Исключение составляют лишь магний и алюминий, которые и в мелкораздробленном состоянии сохраняют свой блеск. [c.
235]
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с.
обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Если необходимо показать некоторые физические свойства металлов (блеск, цвет), можно продемонстрировать образцы (по возможности, крупные) различных металлов Ре, А1, Мд, 2п, Сг, Т1, Си, 8п, РЬ и др. Для сравнения можно показать и образцы неметаллов. [c.165]
Алюминий — серебристо-белый легкий металл, р = 2,699 г/см , 660,24 С, i .,j,= 2500 С. Он очень пластичен, легко прокатывается в фольгу к протягивается в проволоку.
Прекрасный проводник электрического тока — его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида АЬОз.
Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск). [c.150]
Иод I 2 AI = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,940 [c.65]
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны. [c.29]
Соблюдение этих условий дало возможность получить светлое качественное покрытие с максимальной толщиной 10—12 мк на медной основе, с содержанием таллия 12,5—22,4 вес. %.
Покрытие имеет хорошее сцепление с поверхностью основного металла. Блеск покрытия достигается небольшим полированием. Это покрытие обладает устойчивыми сверхпроводящими свойствами при низких температурах.
[c.127]
Применяют для придания металлу блеска при никелирований. [c.1001]
Следует подчеркнуть, что положение этой граничной диагонали и само деление элементов на металлы и неметаллы весьма условны. Целый ряд элементов, обладая характерными физическими свойствами металлов — блеском, высокой электропроводностью, пластичностью, проявляет химические свойства двойственной природы — [c.109]
Сложных веществ насчитывается в природе сотни тысяч, простых около двухсот, а элементов, из которых образуются все вещества, известно 92.
Большее количество известных простых веществ в сравнении с количеством элементов объясняется свойством последних образовать несколько простых веществ.
Например, общеизвестные вещества — уголь, графит и алмаз, резко различающиеся по своим свойствам, являются видоизменениями одного и того же химического элемента — углерода. Хи.мические элементы подразделяются на металлы и металлоиды.
В группу металлов входит 71 элемент, а в группу металлоидов 21 элемент. Металлы обладают характерным блеском, хорошо проводят тепло и электричество,- обладают ковкостью и т. д. Металлоиды не имеют характерного для металлов блеска и плохо или совсем не проводят тепло и электрический ток. [c.8]
Класс 3. Карбиды промежуточного типа представляют собой огнеупорные материалы с некоторыми характерными свойствами металлов (блеск, металлическая проводимость) и, кроме того, отличаются необычной твердостью и тугоплавкостью.
Атомы металла в них плотно упакованы, а атомы С занимают октаэдрические пустоты, но следует отметить, что упорядочение атомов металла в карбиде не всегда такое, как в самом металле.
В таких случаях карбид МС нельзя рассматривать как предельный твердый раствор углерода в структуре металла наоборот, присутствие атомов С влияет на упорядочение [c.50]
Иод I2 Ai = 253,81 фиол.-черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
В свободном металле атомы плотно заполняют пространство, а их наружные энергетические уровни, весьма слабо заполненные электронами, перекрывают друг друга. Благодаря этому наружные электроны легко переходят от атома к атому, так что принадлежат не отдельному атому, а как бы обобществлены.
Таким образом ионы металла (ядра с внутренними энергетическими уровнями) крепко связываются в одно целое суммой свободно блуждающих между ними электронов. Эти свободные электроны обусловливают и физические свойства металлов (блеск, тепло- и электропроводность и пр.). [c.
75]
В связи с большим разнообразием вопросов, решаемых при изучении электроосаждения металлов, методы, применяемые в этой области, также очень разнообразны и охватывают не только электрохимические, но и физические, механические и другие способы исследования.
Это связано с тем, что при электроосаждении металлов изучают как кинетику электродных процессов, так и физико-механические свойства металлов, блеск, пористость, сцепляемость и другие свойства электролитических осадков.
Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Роспись фаянсовых и фарфоровых изделий проводят с использованием окислов и солей металлов, которые при обжиге переходят в силикаты, обладающие различной окраской окись кобальта дает синюю окраску, окись хрома — зеленую, закись урана — черную и т. д. Из солей легко восстанавливающихся металлов (золота и платины) при обх[c.121]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, прочностью на изгиб, стойкостью при эксплуатации на воздухе, внутри и вне помещения, преимущественно в условиях умеренного климата. [c.12]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, эластичностью. С повышением жирности алкидной смолы улучшается эластичность покрытий, но уменьшаются твердость, стойкость к растворителям и маслам, стабильность блеска и цвета при горячей сушке и действии света. [c.47]
Иод 1 2 М = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,9402 [c.65]
ТЕЛЛУР Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р — = 6,25 = 449,8 = 990 Ср = 0,202 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯпл = 17,5 ДЯ сп = 51,0 р = 0,1 2. [c.103]
Алкидные ЛКП имеют высокую адгезию к металлу, блеск, стойкость на изгиб. [c.10]
Металлические и неметаллические элементы различаются по своим физическим и химическим свойствам. Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности.
В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями.
Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы.
Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Теллур Те >1=127,60 серебр.-сер. с металл, блеском, триг. р = 6,252 44g g. ggg. 25,77 s = 49,50 [c.104]
Мышьяк обладает свойством придавать металлам блеск олову при- дает твердость и зво Н и делает его более плотным медь Т же.
юзо отбеливает, а соедипенный с неблагородными металлами сплавлезшем при болео длительной обработке облагораживает часть их Поэтому весьма вероятно, чтч з в состав блеска металлов входит некоторая мышьяковистая часть (особенно металлов, кото рые добываются из ншл чаще в соединении с мышьяком, чем с серою) и что благодаря ей они От других отличаются блеском и крепостью. Это можно с достаточным основанием утверждать П1режде Всего об олове. [c.53]
Теллур Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р = 6,25 5 = 449.8 / ип = 90 Ср = 0,20225 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯт=17,5 ДЯисп = 51,0 р=0,01 в 0,1 2 sn. 10632. 1001792. н р S2 реаг. H2SO4, HNO3, Ц. в. медл, реаг. [c.104]
Смотреть страницы где упоминается термин Металлы блеск: [c.81] [c.104] [c.107] [c.81] [c.107] [c.43] [c.50] [c.81] [c.107] [c.65] [c.81] [c.105]
Химический тренажер. Ч.1 (1986) — [ c.6 , c.21 ]
- Блески
- Изучение блеска в процессе электрополировки металлов
- Переходные металлы металлический блеск
© 2022 chem21.info Реклама на сайте






