- ПОИСК
- Электрохимический ряд напряжений металлов (ЭРН)
- Взаимодействие металлов с кислотами
- Взаимодействие металлов с водой
- Взаимодействие металлов с водными растворами солей
- Процесс термического распада нитратов
- Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
- История
- Теоретические основы
- Практическое использование ряда напряжений
- Таблица электрохимических потенциалов металлов
- Ссылки
- Литература
- Примечания
Изучая курс общей и неорганической химии мы с вами упустили очень важную тему, на который постоянно ссылаемся при изучении свойств простых веществ и их соединений, но ни разу не пояснили что это такое и почему именно так, а не иначе.
Речь сегодня пойдет про ряд напряжений и химические свойства металлов. Понять, что в заданиях ЕГЭ по химии нет прямого вопроса по этой теме, но без знания и понимая электрохимического ряда вы не сможете ответить на многие вопросы правильно.
Давайте разбираться вместе
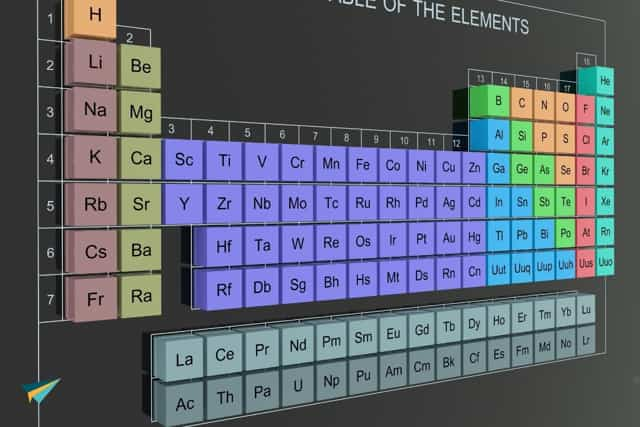
Вы наверняка знаете, что атомы типичных металлов могут отдавать электроны (не принимать, а только отдавать, они – доноры). Поэтому металлы в виде простых веществ в химических реакциях играют роль восстановителей. В случае действия сильных окислителей и при соблюдении определенных условий (к примеру нагревании) практически любой металл может быть окислен до положительной степени окисления.
Различная восстановительная способность металлов дает возможность разместить их в так называемый ряд напряжений и как его еще называют электрохимический ряд металлов.
В этом ряду металлы располагаются в порядке уменьшения их восстановительных свойств и возрастания окислительных свойств соответствующих гидратированных катионов (посмотрите внимательно на таблицу, которые есть в любом справочнике)
Таким образом, мы видим, что в ряду напряжений слева располагаются металлы, которые вступая в реакцию с водными растворами будут проявлять сильные восстановительные свойства. Напротив, ионы, которые образуются при окислении этих металлов, будут проявлять слабые окислительные свойства. Поэтому такие металлы легко окисляются, а отвечающие им ионы трудно восстанавливаются.
Расположение металла в ряду напряжений определяет процесс окисления металла с образованием гидратированного иона, соответствующего низшей устойчивой в водном растворе степени окисления данного металла.
Данный металл может восстанавливать из растворов их соей металлы, которые расположены справа от него в ряду напряжений. Иными словами, металл левее вытесняет из солей металл, который находится правее него.
Металлы, расположенные в электрохимическом ряду правее водорода, не могут замещать его в молекулах кислот. Эти металлы хоть и реагируют с кислотами, которые обладают сильными окислительными свойствами, но в ходе реакции выделения водорода не будет (вспоминайте предыдущую нашу статью, какие продукты реакции будут в этом случае?).
Металлы, которые у нас расположены в ряду напряжений слева от водорода, могут вступать в реакции замещения с кислотами, вытесняя из последних водород. При этом помним, что ЭДС на основании которого и устанавливается расположение металла и водорода в ряду, измеряется в строго определенных условиях.

От чего же зависит положение металла в ряд?
- От энергии ионизации атома металла.
- От энергии гидратации, получаемого иона.
- От заряда иона.
- От размеров иона.
Рассмотрим теперь кто у нас в ряду напряжений из щелочных металлов стоит первым? Правильно, литий, но почему не цезий? Ведь, по логике он электрон отдает намного быстрее, чем литий.
Но мы с вами вспоминаем правило выше, которое вы должны запомнить очень хорошо: ряд напряжений отражает процесс окисления металла с образованием гидратированного иона.
Чем лучше и быстрее протекает процесс окисления, тем левее будет находится металл в электрохимическом ряду.
Вернемся к нашему коварному литию. В его случае имеет значение высокая энергия гидратации иона.
Маленький размер приводит к притягиванию отрицательных концов полярных молекул воды гораздо сильнее, нежели у более «громоздкого» цезия, так как расстояние между центрами отрицательного и положительного зарядов в случае лития будет меньше. В итоге общий процесс (отдача электронов с последующей гидратацией полученного иона) энергетически более выгоден у лития чем у цезия.
Окисление металлов водой и раствором щелочей
Вытеснять водород из воды в состоянии только те металлы, которые стоят в ряду напряжений перед кадмием, но тут есть нюансы: ввиду ограничений кинетических порядков (образование нерастворимой в воде оксидной пленки тех же амфотерных металлов) при комнатной температуре в реакцию с водой вступают только щелочные и щелочноземельные металлы.
А вот металлы, располагающиеся правее в ряду, могут восстанавливать водород до воды при нагревании. К примеру магний, измельченный в порошок, реагирует с горячей водой, а алюминий, тоже в виде порошка реагирует с кипящей водой.
А такие металлы как цинк и алюминий могут восстанавливать водород даже из раствора щелочи:
2Al+2NaOH+ 6H2O=2Na[Al(OH)4]+3H2
По какому же принципу тот или иной металл растворяется в щелочи? Как это можно определить?
- Металл должен быть сильным восстановителем и окисляться ионами водорода даже в малых концентрациях последних, находящихся в растворе щелочей.
- Ион металла в степени окисления до которой он окисляется ионами водорода, образует в щелочном растворе растворимое соединение.
Мы должны всегда помнить, что восстановительные свойства металлов в одной и безводной среде могут отличаться. А значит и порядок расположения металлов исходя из их восстановительной способности отличается. К примеру, в безводной среде сильным восстановителем будет цезий, а в водной среде – литий.
ПОИСК
| Таблица 6. Стандартные электродные потенциалы металлов при 25 С |
| Таблица 15.1 Стандартные электродные потенциалы металлов |
Значения стандартных потенциалов металлических электродов в водных растворах приведены в табл. 20, которая является одновременно и рядом напряжения. Стандартные электродные потенциалы металлов указывают на меру восстановительной способности атомов металла и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. Например, литий, имеющий наиболее отрицательный стандартный потенциал, относится к наиболее сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают его ионы. Из табл. 20 видно, что к наиболее сильным окислителям принадлежат ионы золота, платины, палладия, серебра и ртути. [c.192]
Зная стандартные электродные потенциалы ( ) металлов, легко рассчитать ЭДС любого гальванического элемента. Для этого из потенциала электрода, имеющего большее алгебраическое значение, следует вычитать потенциал электрода, алгебраическое значение которого меньше. В качестве примера вычислим ЭДС элемента, составленного из железного и медного электродов, погруженных в растворы их солей с с = 1 моль/л при стандартных условиях. Из таблицы 18 следует что — 0,44 В, а Следователь- [c.81]
Сравните стандартные электродные потенциалы металлов -элементов II группы. [c.100]
Приближенное суждение о термодинамической устойчивости металлов и вероятных катодных деполяризационных процессах может быть сделано по величине стандартных электродных потенциалов металлов (табл. 5). [c.39]
Относительно потенциала стандартного водородного электрода измерены стандартные потенциалы для большого количества электродных реакций (t = 25 °С), что дает возможность решать различные электрохимические задачи.
Если разместить стандартные электродные потенциалы для различных металлов так, чтобы их величины возрастали, то получится ряд напряжений, известный из общего курса химии (табл. 3, с. 330).
Указанная последовательность стандартных электродных потенциалов металлов в значительной мере соответствует последовательности изменения их свойств и поэтому служит важным ориентиром при оценке возможности протекания различных реакций. [c.325]
В табл. 3 приведены значения стандартных электродных потенциалов металлов в водных растворах при 25° С. [c.24]
Защитные поверхностные покрытия металлов. Они бывают металлические (покрытие цинком, оловом, свинцом, никелем, хромом и другими металлами) и неметаллические (покрытие лаком, краской, эмалью и другими веществами). Эти покрытия изолируют металл от внешней среды.
Так, кровельное железо покрывают цинком, из оцинкованного железа изготовляют многие изделия бытового и промышленного значения. Слой цинка предохраняет железо от коррозии, так как цинк, хотя и является более активным металлом, чем железо (см. ряд стандартных электродных потенциалов металлов, рис. 5.5), покрыт оксидной пленкой. При повреждениях защитного слоя (царапины, пробои крыш и т.
д.) в присутствии влаги возникает гальваническая пара 2п Ре. Катодом (положительным полюсом) является железо, анодом (отрицательным полюсом) — цинк (рис. 5.10). Электроны переходят от цинка к железу, где связываются молекулами кислорода, цинк растворяется, но железо остается защищенным до тех пор, пока не будет разрушен весь слой цинка, на что требуется довольно много времени.
Покрытие железных изделий никелем, хромом, помимо защиты от коррозии, придает им красивый внешний вид. [c.164]
Как известно, п)1и конструировании оборудования и установок приходится часто применять разнородные металлы.
Об опасности контакта различных металлоЕ в первом приближении можно судить по величине стандартных электродных потенциалов металлов.
Желательно использовать сочетание металлов, находящихся как можно ближе друг к другу в электрохимическом ряде напряжении. Однако в большинстве случаев это практически неосуществимо. [c.85]
Приближенно судить о термодинамической возможности Протекания электрохимической коррозии можно по стандартным электродным потенциалам металлов. [c.4]
Из приведенных примеров можно сделать вывод, что рядом стандартных электродных потенциалов металлов следует пользоваться с учетом особенностей рассматриваемых процессов.
Самое же главное — всегда надо иметь в виду, что этот ряд применим только к водным растворам и характеризует химическую активность металлов лишь в окислительно-восстановительных реакциях, протекающих в водной среде.
В этих случаях гидратация ионов, зависящая от их радиусов и величины заряда, обусловливает несоответствие изменений активности металлов в ряду стандартных электродных потенциалов изменениям их активности в подгруппах периодической системы.
Например, активность лития ( °==—3,045 В) несколько больше активности цезия ( °= —2,923 В), хотя согласно месту, занимаемому в периодической системе, у лития она должна быть ниже. [c.232]
Пользуясь стандартными электродными потенциалами металлов, указать правильное значение э. д. с. гальванического элемента с электродами Fe /Fe и Nf VNi [c.109]
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т. е. в порядке возрастания электродных потенциалов, то получится ряд стандартных электродных потенциалов (ранее используемое название — ряд напряжений металлов) [c.327]
Из-за технических трудностей (платиновый электрод, водород) измерение стандартных электродных потенциалов металлов в учебной лаборатории неосуществимо. Но при наличии рН-метров (см. 17) очень просто и довольно точно определяется ЭДС гальванических элементов, составленных из двух металлических электродов, погруженных в растворы их солей. [c.331]
В зависимости от величины и знака стандартного электродного потенциала ф°, отвечающего цепи с химической реакцией (У.
7), все металлы располагаются в ряд напряжений, совпадающий с рядом активностей, эмпирически установленным путем оы-теснения металлов из их соединений другими металлами Н. Н, Бекетовым (1865).
Стандартные электродные потенциалы металлов приведены в табл. 38. [c.254]
Следует подчеркнуть, что ряд стандартных электродных потенциалов металлов нельзя рассматривать как абсолютную характеристику их свойств, действительную во всех случаях и при всяких условиях Например, металлический магний не вытесняет цинк из раствора его соли, хотя его потенциал значитель но отрицательнее, т. е. стандартный потенциал магния значительно меньше, чем цинка. [c.175]
Рассмотрим, как будет протекать восстановительный процесс на катоде в водных растворах. Руководствуясь таблицей стандартных электродных потенциалов, металлов, можно указать следующие случаи. [c.209]
Стандартные электродные потенциалы металлов [c.330]
Поясним, как образуется ряд стандартных электродных потенциалов металлов. Прн погружении любого металла в водный раствор его соли на границе раздела фаз металл/раствор возникает [c.157]
Возникновение электрического тока за счет химических реакций. Стандартные электродные потенциалы металлов. Ряд напряжений. Вытеснение металлами водорода и вытеснение одних металлов другими. Гальванический элемент. [c.167]
Стандартные электродные потенциалы металлов характеризуют способность металлов посылать ионы в растворы их солей при. ., условиях. [c.108]
Пользуясь таблицей потенциалов, выпишите стандартные электродные потенциалы металлов и соответствующие электродные реакции. Расположите металлы в порядке уменьшения отрицательного и роста положительного значения потенциалов. [c.108]
Ряд стандартных электродных потенциалов металлов. Располагая металлы в порядке возрастания алгебраической величины из стандартных электродных потенциалов Е°, получают электрохимический ряд напряжений металлов или, точнее, ряд стандартных электродных потенциалов металлов (табл. 19). [c.231]
Исторически ряду стандартных электродных потенциалов металлов предшествовал вытеснительный ряд Н. Н. Бекетова, являющийся прототипом современного ряда. [c.231]
С учетом ряда стандартных электродных потенциалов металлов возможны три случая протекания восстановительного процесса на катоде в водных растворах [c.166]
Стандартные электродные потенциалы металлов изменяются от —1,70 В у Ве до —2,92 В у На, поэтому в направлении от Ве к Ка возрастает восстановительная активность. Однако она меньше, чем у щелочных металлов. Об этом свидетельствует уменьшение радиусов атомов и увеличение энергии ионизации по сравнению со щелочными металлами. [c.204]
В средней школе вы изучаете электрохимический ряд напряжений металлов. Более точное название его — ряд стандартных электродных потенциалов металлов. Для некоторых металлов он приведен в табл. 12.1. Как же составляется такой ряд Почему, например, натрий стоит в нем после кальция Как этим рядом пользоваться [c.228]
Что такое стандартные электродные потенциалы металлов [c.264]
Для сравнительной характеристики металлов пользуются понятием — стандартный электродный потенциал металла.
Стандартным электродным потенциалом металла называют разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией 1 г-ион металла в литре, и нормальным водородным электродом.
Располагая металлы то величине их стандартных электродных потенциалов, получают ряд напряжений металлов щшожент А). [c.121]
Этим рядом вы пользовались прн изучении электролиза (с. 96), свойств солей азотной кислоты (с. 117) и в других случаях. Более точное название электрохимического ряда напрялстандартных электродных потенциалов металлов. Для важнейших металлов он предста1 лен на рис. 5.5. [c.157]
В ряду стандартных электродных потенциалов металлов располагается меаду магнием и цинком и является активным металлом. Однако химическая активность марганца в компактном состоянии сильно снижается за счет пассивирования поверхности оксидной пленкой.
При нафевании марганец сгорает на воздухе, образуя оксид состава МП3О4. Энергично юаимодействуег с галогенами, при этом образуются преимущественно солеобразные галогениды марганца (II). При нафевании марганец взаимодействует со всеми остальными неметаллами.
Водород хорошо растворим в марганце, но химических соединений не образует. [c.46]
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и в случае образования гальванических микроэлеме1 тов на поверхности одного металла) поток электронов направлен от более активного металла (с меньшей величиной электродного потенциала) к менее активному проводнику (с больщей величиной электродного потенциала) и более активный металл корродирует. Скорость коррозии тем больше, чем дальше стоят друг от друга в ряду стандартных электродных потенциалов металлы, из которых образовался гальванический элемент (галь- [c.179]
Электрохимический ряд напряжений металлов (ЭРН)
| Li | K | Ba | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | Hg | Ag | Pt | Au |
Ряд напряжений металлов широко используется в неорганической химии. В частности, результаты многих реакций и даже возможность их осуществления зависят от положения некоторого металла в ЭРН. Обсудим этот вопрос подробнее.
Взаимодействие металлов с кислотами
Металлы, находящиеся в ряду напряжений левее водорода, реагируют с кислотами — неокислителями. Металлы, расположенные в ЭРН правее Н, взаимодействуют только с кислотами — окислителями (в частности, с HNO3 и концентрированной H2SO4).
- Пример 1. Цинк расположен в ЭРН левее водорода, следовательно, способен реагировать практически со всеми кислотами:
- Zn + 2HCl = ZnCl2 + H2
- Zn + H2SO4 = ZnSO4 + H2
- Пример 2. Медь находится в ЭРН правее Н; данный металл не реагирует с «обычными» кислотами (HCl, H3PO4, HBr, органические кислоты), однако вступает во взаимодействие с кислотами-окислителями (азотная, концентрированная серная):
- Сu + 2HCl ≠
- Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
- Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
Обращаю внимание на важный момент: при взаимодействии металлов с кислотами-окислителями выделяется не водород, а некоторые другие соединения. Подробнее об этом можно почитать здесь!
Взаимодействие металлов с водой
- Металлы, расположенные в ряду напряжений левее Mg, легко реагируют с водой уже при комнатной температуре с выделением водорода и образованием раствора щелочи.
- Пример 3.
Натрий, калий, кальций легко растворяются в воде с образованием раствора щелочи:
- 2Na + 2H2O = 2NaOH + H2
- 2K + 2H2O = 2KOH + H2
- Ca + 2H2O = Ca(OH)2 + H2
Металлы, расположенные в ряду напряжений от водорода до магния (включительно), в ряде случаев взаимодействуют с водой, но реакции требуют специфических условий. Например, алюминий и магний начинают взаимодействие с Н2О только после удаления оксидной пленки с поверхности металла. Железо не реагирует с водой при комнатной температуре, но взаимодействует с парами воды. Кобальт, никель, олово, свинец практически не взаимодействуют с H2O не только при комнатной температуре, но и при нагревании.
Металлы, расположенные в правой части ЭРН (серебро, золото, платина) не реагируют с водой ни при каких условиях.
Взаимодействие металлов с водными растворами солей
- Речь пойдет о реакциях следующего типа:
- металл (*) + соль металла (**) = металл (**) + соль металла (*)
- Хотелось бы подчеркнуть, что звездочки обозначают в данном случае не степень окисления, не валентность металла, а просто позволяют различить металл № 1 и металл № 2.
- Для осуществления подобной реакции необходимо одновременное выполнение трех условий:
- соли, участвующие в процессе, должны растворяться в воде (это легко проверить, пользуясь таблицей растворимости);
- металл (*) должен находиться в ряду напряжений левее металла (**);
- металл (*) не должен реагировать с водой (что тоже легко проверяется по ЭРН).
- Пример 4. Рассмотрим несколько реакций:
- Zn + CuSO4 = ZnSO4 + Cu
- Fe + CuS ≠
- Pb + FeSO4 ≠
- K + Ni(NO3)2 ≠
- Первая реакция легко осуществима, все перечисленные выше условия выполнены: сульфат меди растворим в воде, цинк находится в ЭРН левее меди, Zn не реагирует с водой.
Вторая реакция невозможна, т. к. не выполнено первое условие (сульфид меди (II) практически не растворяется в воде). Третья реакция неосуществима, поскольку свинец — менее активный металл, нежели железо (находится правее в ЭРН). Наконец, четвертый процесс НЕ приведет к осаждению никеля, поскольку калий реагирует с водой; образовавшийся гидроксид калия может вступить в реакцию с раствором соли, но это уже совершенно другой процесс.
Процесс термического распада нитратов
Напомню, что нитраты — это соли азотной кислоты. Все нитраты разлагаются при нагревании, но вот состав продуктов разложения может быть разным. Состав определяется положением металла в ряду напряжений.
- Нитраты металлов, расположенных в ЭРН левее магния, при нагревании образуют соответствующий нитрит и кислород:
- 2KNO3 = 2KNO2 + O2
- В ходе термического разложения нитратов металлов, расположенных в ряду напряжений от Mg до Cu включительно, образуются оксид металла, NO2 и кислород:
- 2Cu(NO3)2 = 2CuO + 4NO2 + O2
- Наконец, при разложении нитратов наименее активных металлов (расположенных в ЭРН правее меди) образуются металл, диоксид азота и кислород:
- Hg(NO3)2 = Hg + 2NO2 + O2
Электрохимический ряд активности металлов | это… Что такое Электрохимический ряд активности металлов?
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам[1]. Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов.
Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах.
Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений[2].
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции[3].
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Последовательность металлов по их способности вытеснять друг друга, давно известная химикам, была в 1860-е и последующие годы особенно основательно и всесторонне изучена и дополнена Н. Н. Бекетовым. Уже в 1859 году он сделал в Париже сообщение на тему «Исследование над явлениями вытеснения одних элементов другими».
В эту работу Бекетов включил целый ряд обобщений о зависимости между взаимным вытеснением элементов и их атомным весом, связывая эти процессы с «первоначальными химическими свойствами элементов – тем, что называется химическим сродством»[4].
Открытие Бекетовом вытеснения металлов из растворов их солей водородом под давлением и изучение восстановительной активности алюминия, магния и цинка при высоких температурах (металлотермия) позволило ему выдвинуть гипотезу о связи способности одних элементов вытеснять из соединений с их плотностью: более лёгкие простые вещества способны вытеснять более тяжёлые («вытеснительный ряд Бекетова»).
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда.[5][6].
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности».
Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода.
Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов.
Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства.
Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда.
Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu2+/Eu[источник не указан 228 дней] до +1,691 В у пары Au+/Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au+.
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
- Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении.
- Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
- При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
Таблица электрохимических потенциалов металлов
| Li | Li+ | -3,0401 | реагирует с водой | выделяется водород |
| Cs | Cs+ | -3,026 | ||
| Rb | Rb+ | -2,98 | ||
| K | K+ | -2,931 | ||
| Ra | Ra2+ | -2,912 | ||
| Ba | Ba2+ | -2,905 | ||
| Fr | Fr+ | -2,92 | ||
| Sr | Sr2+ | -2,899 | ||
| Ca | Ca2+ | -2,868 | ||
| Eu | Eu2+ | -2,812 | ||
| Na | Na+ | -2,71 | ||
| Sm | Sm2+ | -2,68 | ||
| Md | Md2+ | -2,40 | реагирует с кислотами | |
| La | La3+ | -2,379 | ||
| Y | Y3+ | -2,372 | ||
| Mg | Mg2+ | -2,372 | ||
| Ce | Ce3+ | -2,336 | ||
| Pr | Pr3+ | -2,353 | ||
| Er | Er3+ | -2,331 | ||
| Ho | Ho3+ | -2,33 | ||
| Nd | Nd3+ | -2,323 | ||
| Tm | Tm3+ | -2,319 | ||
| Sm | Sm3+ | -2,304 | ||
| Pm | Pm3+ | -2,30 | ||
| Fm | Fm2+ | -2,30 | ||
| Dy | Dy3+ | -2,295 | ||
| Tb | Tb3+ | -2,28 | ||
| Lu | Lu3+ | -2,28 | ||
| Gd | Gd3+ | -2,279 | ||
| Es | Es2+ | -2,23 | ||
| Ac | Ac3+ | -2,20 | ||
| Dy | Dy2+ | -2,2 | ||
| Pm | Pm2+ | -2,2 | ||
| Cf | Cf2+ | -2,12 | ||
| Sc | Sc3+ | -2,077 | ||
| Am | Am3+ | -2,048 | ||
| Cm | Cm3+ | -2,04 | ||
| Pu | Pu3+ | -2,031 | ||
| Er | Er2+ | -2,0 | ||
| Pr | Pr2+ | -2,0 | ||
| Eu | Eu3+ | -1,991 | ||
| Lr | Lr3+ | -1,96 | ||
| Cf | Cf3+ | -1,94 | ||
| Es | Es3+ | -1,91 | ||
| Th | Th4+ | -1,899 | ||
| Fm | Fm3+ | -1,89 | ||
| Np | Np3+ | -1,856 | ||
| Be | Be2+ | -1,847 | ||
| U | U3+ | -1,798 | ||
| Al | Al3+ | -1,700 | ||
| Md | Md3+ | -1,65 | ||
| Ti | Ti2+ | -1,63 | конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде | |
| Hf | Hf4+ | -1,55 | ||
| Zr | Zr4+ | -1,53 | ||
| Pa | Pa3+ | -1,34 | ||
| Ti | Ti3+ | -1,208 | ||
| Yb | Yb3+ | -1,205 | ||
| No | No3+ | -1,20 | ||
| Ti | Ti4+ | -1,19 | ||
| Mn | Mn2+ | -1,185 | ||
| V | V2+ | -1,175 | ||
| Nb | Nb3+ | -1,1 | ||
| Nb | Nb5+ | -0,96 | ||
| V | V3+ | -0,87 | ||
| Cr | Cr2+ | -0,852 | ||
| Zn | Zn2+ | -0,763 | ||
| Cr | Cr3+ | -0,74 | ||
| Ga | Ga3+ | -0,560 | ||
| Ga | Ga2+ | -0,45 | ||
| Fe | Fe2+ | -0,441 | ||
| Cd | Cd2+ | -0,404 | ||
| In | In3+ | -0,3382 | ||
| Tl | Tl+ | -0,338 | ||
| Co | Co2+ | -0,28 | ||
| In | In+ | -0,25 | ||
| Ni | Ni2+ | -0,234 | ||
| Mo | Mo3+ | -0,2 | ||
| Sn | Sn2+ | -0,141 | ||
| Pb | Pb2+ | -0,126 | ||
| H2 | H+ | |||
| W | W3+ | +0,11 | низкая реакционная способность | выделение металла в чистом виде |
| Ge | Ge4+ | +0,124 | ||
| Sb | Sb3+ | +0,240 | ||
| Ge | Ge2+ | +0,24 | ||
| Re | Re3+ | +0,300 | ||
| Bi | Bi3+ | +0,317 | ||
| Cu | Cu2+ | +0,338 | ||
| Po | Po2+ | +0,37 | ||
| Тс | Тс2+ | +0,400 | ||
| Ru | Ru2+ | +0,455 | ||
| Cu | Cu+ | +0,522 | ||
| Te | Te4+ | +0,568 | ||
| Rh | Rh+ | +0,600 | ||
| W | W6+ | +0,68 | ||
| Tl | Tl3+ | +0,718 | ||
| Rh | Rh3+ | +0,758 | ||
| Po | Po4+ | +0,76 | ||
| Hg | Hg22+ | +0,7973 | ||
| Ag | Ag+ | +0,799 | ||
| Pb | Pb4+ | +0,80 | ||
| Os | Os2+ | +0,850 | ||
| Hg | Hg2+ | +0,851 | ||
| Pt | Pt2+ | +0,963 | ||
| Pd | Pd2+ | +0,98 | ||
| Ir | Ir3+ | +1,156 | ||
| Au | Au3+ | +1,498 | ||
| Au | Au+ | +1,691 |
Ссылки
Литература
- Корольков Д.В. Основы неорганической химии. — М.:Просвещение, 1982. — 271 с.
Примечания
- ↑ Рабинович В. Л. Алхимия как феномен средневековой культуры. — М.: Наука, 1979
- ↑ Пути познания / Головнер В.Н. Взгляд на мир глазами химика
- ↑ Штрубе В. Пути развития химии: в 2-х томах. Том 2. От начала промышленной революции до первой четверти XX века
- ↑ Беляев А.И. Николай Николаевич Бекетов – выдающийся русский физико-химик и металлург. М., 1953
- ↑ Леенсон И. А. Ряд активности металлов Бекетова: миф или реальность? // Химия в школе. — 2002. — № 9. — С. 90-96.
- ↑ Мчедлов-Петросян Н. О.Труды Н. Н. Бекетова и ряд активности металлов // Вестник Харьковского национального университета. — 2003. — № 596. — Химия. Вып. 10 (33). — С. 221-225.






