- Классификация фенолов
- Строение фенолов
- Химические свойства фенолов
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции фенола по бензольному кольцу
- 2.1. Галогенирование
- 2.2. Нитрование
- 3. Поликонденсация фенола с формальдегидом
- 4. Взаимодействие с хлоридом железа (III)
- 5. Гидрирование (восстановление) фенола
- Получение фенолов
- 2. Кумольный способ
- 3. Замещение сульфогруппы в бензол-сульфокислоте
- Химические свойства фенолов | Химия онлайн
- I. Реакции с участием гидроксильной группы
- II. Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- Фенолы
- Номенклатура фенолов
- Получение фенолов
- Химические свойства фенолов
- Фенолы — строение, общая характеристика и основные свойства
- Что такое фенол
- Общая и структурная формулы
- Химические свойства фенола
- Физические свойства
- С чем реагирует фенол
- Качественные реакции на фенол
- Реакция присоединения
- Окисление
- Получение фенола
- Применение
- Заключение
- Химия. 10 класс
- Химические свойства фенола — урок. Химия, 10 класс
- Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
- Гидроксисоединения делят на спирты и фенолы.
- Строение, изомерия и гомологический ряд феноло
- Химические свойства спиртов
- Способы получения спиртов
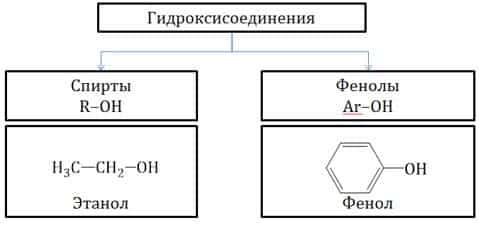
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
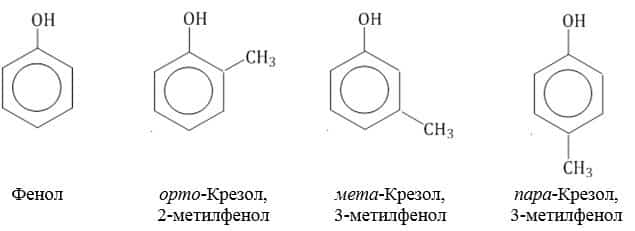
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.
| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |
Строение фенолов
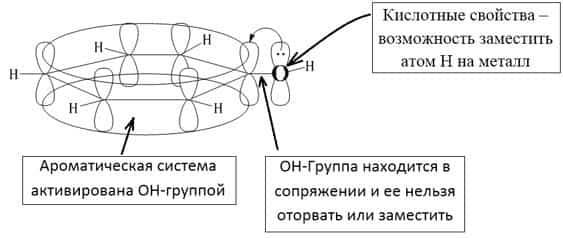
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.
Химические свойства фенолов
| Сходство и отличие фенола и спиртов. Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода. Отличия:
|
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |
- Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
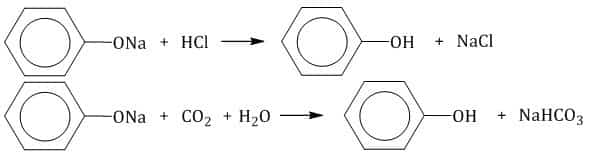
- Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода. |
Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |
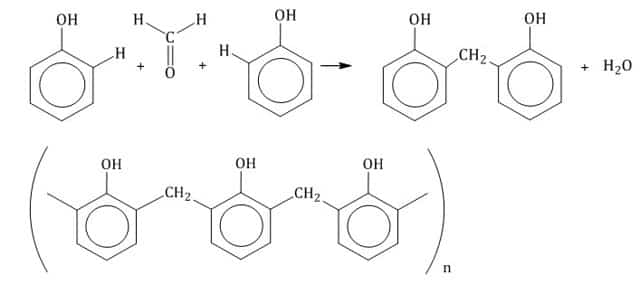
3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.
4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
- Присоединение водорода к ароматическому кольцу.
- Продукт реакции – циклогексанол, вторичный циклический спирт.
Получение фенолов
- При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.
- При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.
2. Кумольный способ
- Фенол в промышленности получают из каталитическим окислением кумола.
- Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
- Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
- Суммарное уравнение реакции:
3. Замещение сульфогруппы в бензол-сульфокислоте
- Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:
- Получается фенолят натрия, из которого затем выделяют фенол:
Химические свойства фенолов | Химия онлайн
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: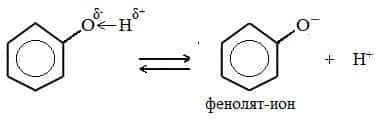
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
- 1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
- Видеоопыт «Взаимодействие фенола с металлическим натрием»
- 2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
- Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов.
Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
- C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
- Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
- 2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
- 3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: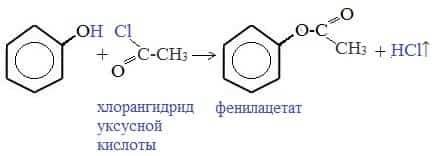
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
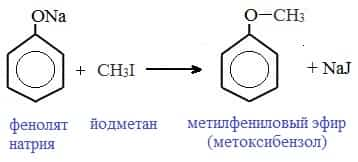
II. Реакции, с участием бензольного кольца
- Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
- Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
- Реакции замещения
- 1) Нитрование
- Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
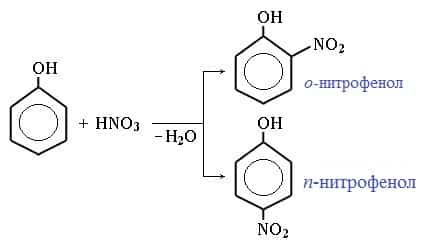
- При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
- Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
- 2) Галогенирование
- Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):
- Образуется белый осадок трибромфенола.
- Видеоопыт «Взаимодействие фенола с бромной водой»
- 3) Сульфирование
- Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер:Реакции присоединения
- 1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
- 2) Конденсация с альдегидами
- При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
- Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
- 1) Горение (полное окисление)
- Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
- 2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
- Видеоопыт «Качественная реакция на фенол»
- Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
- Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
- Фенолы
Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
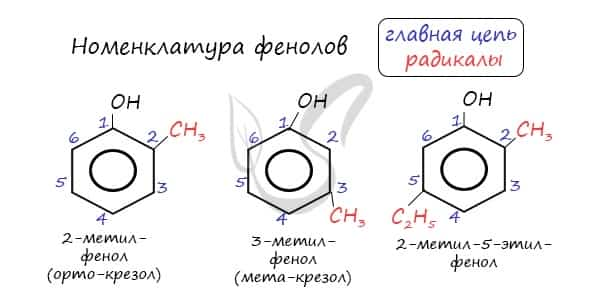
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена. 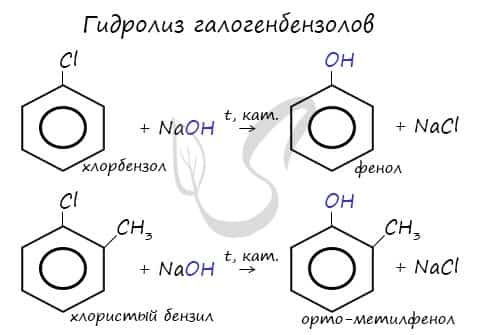
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон. 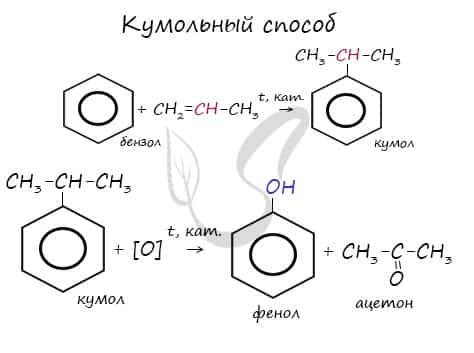
Химические свойства фенолов
- Кислотные свойства
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH) 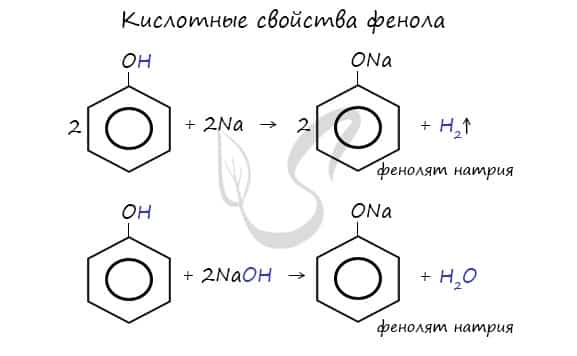
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола. 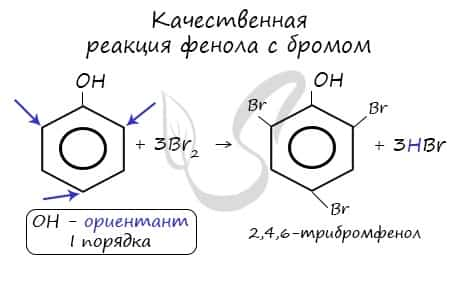
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении. 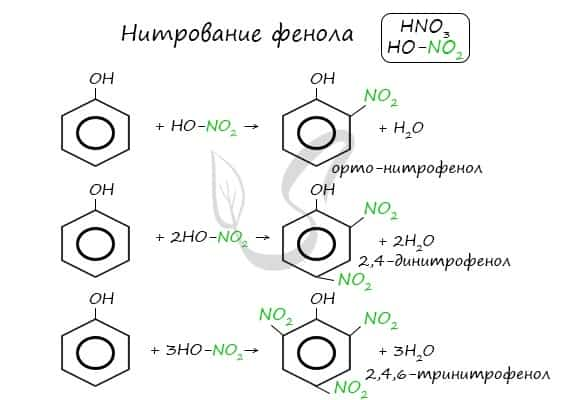
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол. 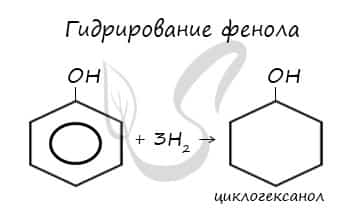
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды. 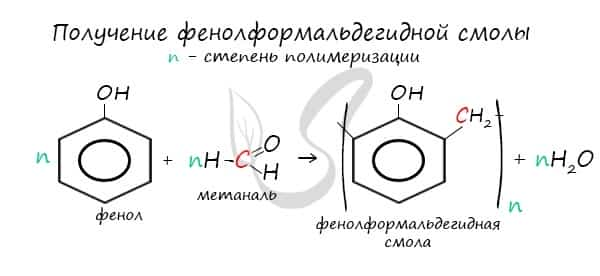
Фенолы — строение, общая характеристика и основные свойства
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.
Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Состав веществ можно выразить общей формулой С6Н6-n(ОН)n.
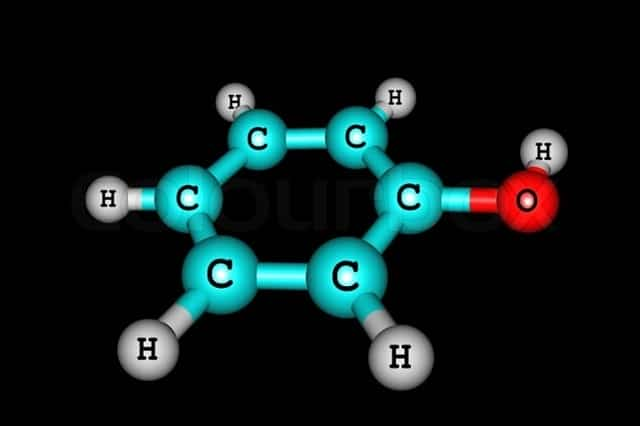
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
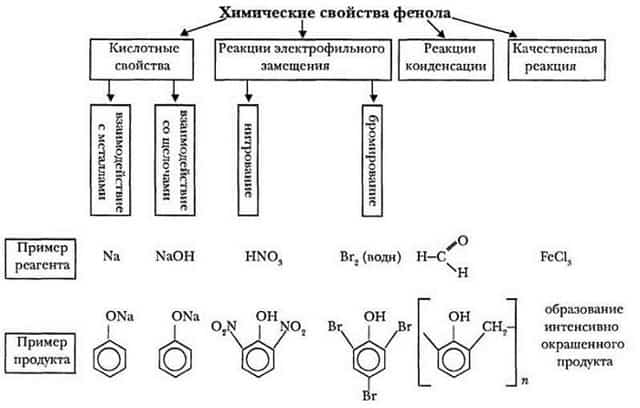
Свойства, идущие за счет фенил радикала:
- галогенирование;
- нитрование;
- гидрирование;
- реакция поликонденсации.
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
- диссоциация;
- взаимодействие с активными металлами;
- взаимодействие со щелочами.
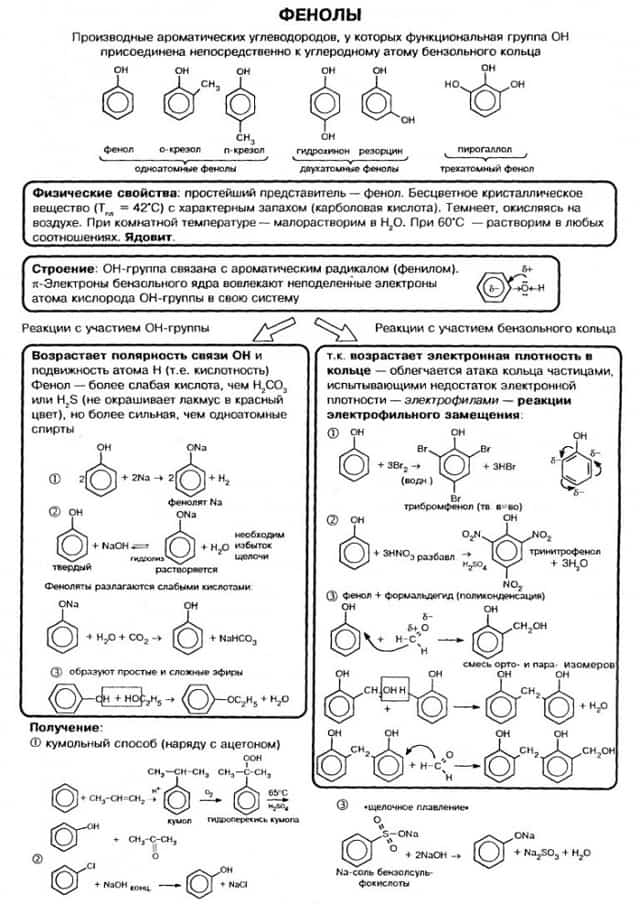
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
-
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
-
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,90С. Молярная масса 94 г/моль.

В холодной воде фенол является малорастворимым веществом. При температуре выше +700С растворяется хорошо. Карболовая кислота – так называют водный раствор фенола. Лучше растворяется в органических растворителях.
Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
- 2 С6Н5ОН + 2Na = 2С6Н5ОNa + H2
- В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
- С6Н5ОН + KOН = С6Н5ОK +H2O
- Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
- С6Н5 ОН + НО–С4Н9 = С6Н5–О–С4Н9 +Н2О
- Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
- С6Н5ОН + 3HNO3 = C6H2(NO2)3OH +3H2O
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
С6Н5ОН + 3Br2 = C6H2Br3ОН + 3HBr
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
2С6Н5ОН + 5Н2 = С6Н11ОН + С6Н10О
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
С6Н5ОН + Н2О2 = С6Н4(ОН)2
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
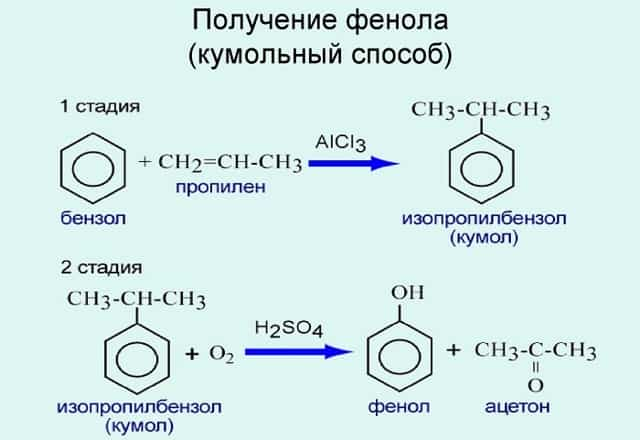
Разработаны разные способы получения:
-
По схеме С6Н6 —— С6Н5Cl —— С6Н5ОН. Минусом метода являются жёсткие условия замещения хлора на гидроксогруппу. Реакции приходится проводить при высокой температуре и давлении.
-
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
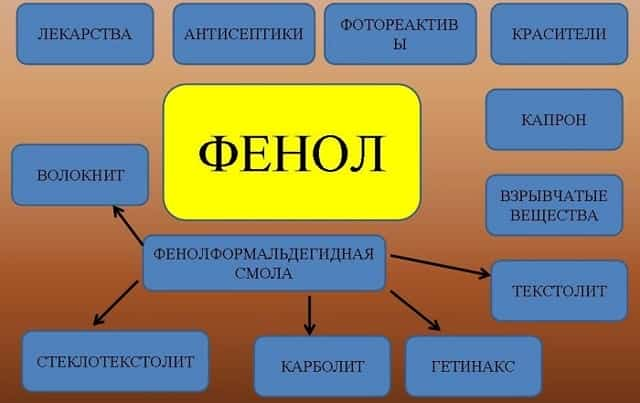
Применение
Вещество применяют для производства разнообразной продукции:
- фенолформальдегидных смол и пластмасс;
- лекарственных препаратов;
- взрывчатых веществ;
- красителей;
- раствор фенола в воде обладает антисептическими свойствами;
- искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.
Химия. 10 класс
В молекуле фенола имеется гидроксильная группа, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие спиртам. В то же время из-за влияния бензольного кольца на гидроксильную группу некоторые свойства фенола отличаются от химических свойств спиртов.
1. Взаимодействие со щелочными металлами
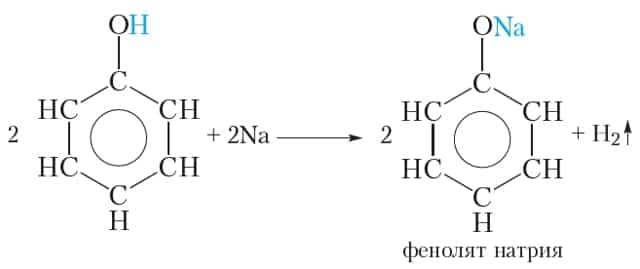
В результате образуется фенолят натрия. Феноляты, подобно алкоголятам, представляют собой твёрдые солеподобные вещества.
Реакция фенола со щелочными металлами свидетельствует о том, что фенол, как и спирты, проявляет слабые кислотные свойства.
2. Взаимодействие со щелочами (отличие фенола от спиртов)
Кислотные свойства фенола выражены сильнее, чем у спиртов. Это проявляется в том, что, в отличие от спиртов, фенол взаимодействует со щелочами:
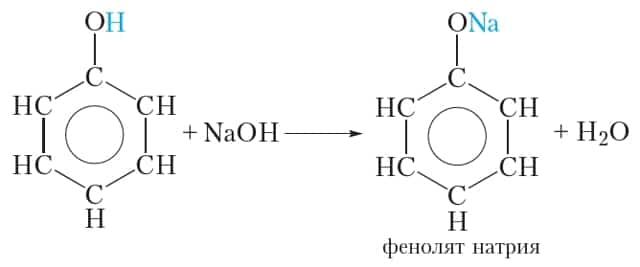
Образующийся фенолят натрия хорошо растворяется в воде. Таким образом фенол умеренно растворим в воде, но хорошо растворяется в растворе гидроксида натрия, так как при этом образуется растворимый фенолят натрия.
Усиление кислотных свойств фенола по сравнению со спиртами обусловлено влиянием бензольного кольца, которое приводит к уменьшению прочности связи О—Н.
В результате атом водорода гидроксильной группы молекулы фенола может замещаться на атом металла не только при взаимодействии со щелочными металлами, но и со щелочами.
По кислотным свойствам фенол превосходит не только спирты, но и воду. Поэтому феноляты, в отличие от алкоголятов, не разлагаются водой. Наличие у фенола кислотных свойств отражает его тривиальное название — карболовая кислота.
Тем не менее фенол — очень слабая кислота. Даже угольная кислота сильнее фенола и поэтому вытесняет его из фенолята натрия:
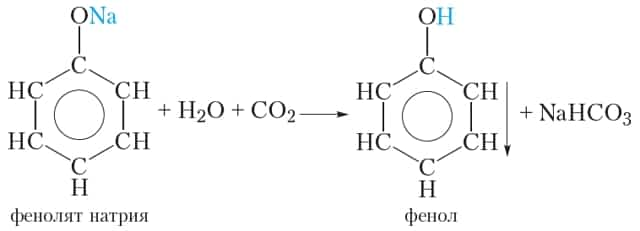
Эту реакцию можно осуществить следующим образом. Через раствор фенолята натрия пропускают углекислый газ, при этом наблюдается помутнение раствора, так как образующийся фенол выпадает в осадок.
3. Взаимодействие с бромной водой (отличие фенола от бензола)
В молекуле фенола содержится бензольное кольцо, следовательно, можно ожидать, что фенол будет проявлять химические свойства, присущие ароматическим углеводородам, например бензолу. Как вы уже знаете, для бензола характерны реакции замещения атомов водорода. Так, бензол в присутствии катализатора реагирует с бромом. При этом протекает реакция замещения одного атома водорода на бром:
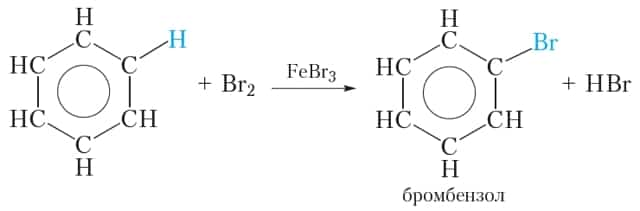
Бромную воду бензол не обесцвечивает!
В молекуле фенола гидроксильная группа влияет на свойства бензольного кольца, облегчая замещение атомов водорода, поэтому взаимодействие фенола с бромом легко протекает и без катализатора. Так, при смешивании разбавленного раствора фенола с бромной водой наблюдается обесцвечивание бромной воды и выпадение белого осадка. Уравнение протекающей реакции:
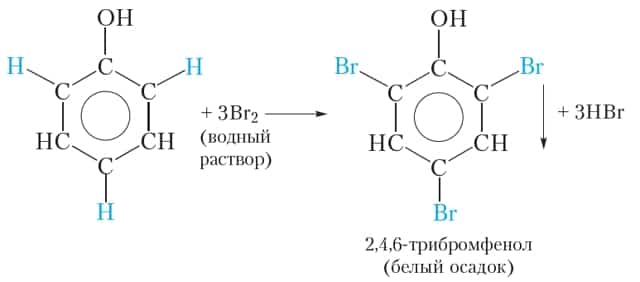
Видео 28.1.Качественные
реакции на фенол
В результате реакции происходит замещение трёх атомов водорода бензольного кольца атомами брома и образуется 2,4,6-трибромфенол. Отметим, что замещение атома водорода бензольного кольца атомом брома возможно и для бензола, но условия протекания реакции гораздо более жёсткие, чем для фенола.
Для этого требуется бром, а не бромная вода, а также катализатор. Бромирование фенола протекает в мягких условиях, что свидетельствует о повышенной реакционной способности бензольного кольца фенола.
Это обусловлено влиянием гидроксильной группы, которая облегчает замещение атомов водорода в положениях 2, 4, 6 бензольного кольца молекулы фенола.
4. Взаимодействие с азотной кислотой
При взаимодействии фенола со смесью концентрированных азотной и серной кислот можно заместить три атома водорода бензольного кольца на группы —NO2: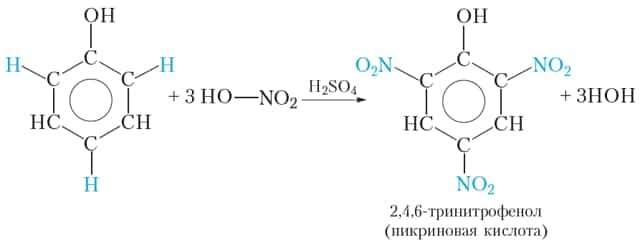
* Промышленноеполучение фенола
В результате реакции образуется 2,4,6-тринитрофенол. Кислотные свойства 2,4,6-тринитрофенола выражены значительно сильнее, чем у фенола. Тривиальное название 2,4,6-тринитрофенола — пикриноваякислота. Пикриновая кислота и её соли являются взрывчатыми веществами.
Рассмотренные химические свойства фенола демонстрируют взаимное влияние атомов в молекулах органических соединений: бензольное кольцо усиливает кислотность гидроксильной группы молекулы фенола, в свою очередь, гидроксильная группа влияет на бензольное кольцо, облегчая замещение атомов водорода в положениях 2, 4, 6.
Химические свойства фенола — урок. Химия, 10 класс
Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензольного кольца.
Реакции гидроксильной группы
Фенол так же, как насыщенные одноатомные спирты, реагирует с активными металлами. Но из-за действия бензольного кольца на гидроксильную группу кислотные свойства фенола выражены сильнее, чем у алканолов, и фенол взаимодействует также со щелочами.
- 1. Взаимодействие с активными металлами:
- 2C6H5OH+2Na→2C6H5ONa+H2↑.
- В этой реакции образуется фенолят, хорошо растворимый в воде.
- 2. Взаимодействие со щелочами:
- C6H5OH+NaOH→C6H5ONa+H2O.
- Кислотные свойства фенола выражены слабо. Они слабее, чем у угольной кислоты, что подтверждается реакцией при пропускании углекислого газа через раствор фенолята:
- C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
- При действии на феноляты других кислот также выделяется фенол:
- C6H5ONa+HCl→C6H5OH+NaCl.
Реакции бензольного кольца
1. Галогенирование.
Фенол в отличие от бензола легко вступает в реакцию с бромной водой:
C6H5OH+3Br2→C6H2Br3OH↓+3HBr.
Атомы брома замещают водород в положениях (2),(4),(6). В реакции с бромной водой выпадает белый осадок (2),(4),(6)-трибромфенола.
Эта реакция используется для качественного определения фенола.
Смотреть видео по теме дополнительно:
2. Нитрование.
- Фенол легко реагирует с азотной кислотой. Если кислота концентрированная, то в результате реакции образуется (2),(4),(6)-тринитрофенол (пикриновая кислота):
- C6H5OH+3HNO3→C6H2(NO2)3OH↓+3H2O.
- Структурная формула продукта реакции:
Пикриновая кислота обладает довольно сильными кислотными свойствами.
Качественная реакция на фенол
Фенол можно обнаружить с помощью хлорида железа((III)). Реакция протекает с образованием соединения, имеющего фиолетовую окраску.
Дополнительная информация в видео.






