- Открытие и история
- Свойства элемента
- Получение вольфрама
- Изготовление штабиков
- Вольфрамовые прутки
- Вольфрам и проволока
- Соединения вольфрама с углеродом
- Вольфрам и рений
- Вольфрам
- СТРУКТУРА
- СВОЙСТВА
- Запасы и добыча
- ПРОИСХОЖДЕНИЕ
- ПРИМЕНЕНИЕ
- КЛАССИФИКАЦИЯ
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
- Свойства вольфрама
- Физические свойства вольфрама:
- Химические свойства вольфрама:
- Свойства атома
- Химические свойства
- Термодинамические свойства простого вещества
- Кристаллическая решетка простого вещества
- Прочие характеристики
- Применение и использование вольфрама
- Характеристики вольфрама
- Получение вольфрама
- Метод порошковой металлургии
- Он включает несколько этапов:
- Плавка
- Марки вольфрама
- Где применяется вольфрам?
- Вольфрам: получение, свойства, основные соединения, область применения
- 1.6 Вольфрам, свойства вольфрама и его соединений, области применения
Одним из самых распространенных химических элементов является вольфрам. Он обозначается символом W и имеет атомный номер — 74. Вольфрам относится к группе металлов, имеющих высокую стойкость к изнашиванию и температуру плавления. В периодической системе Менделеева он находится в 6-й группе, обладает схожими свойствами с «соседями» — молибденом, хромом.
Открытие и история
Еще в XVI веке был известен такой минерал, как вольфрамит. Он был интересен тем, что при выплавке олова из руды его пена превращался в шлак и, конечно же, это мешало производству. С тех пор, вольфрамит стали называть «волчья пена» (с нем. Wolf Rahm). Название минерала перешло и на сам металл.

Шведский химик Шееле в 1781 году обрабатывал азотной кислотой металл шеелит. В процессе эксперимента у него получился жёлтый тяжёлый камень — оксид вольфрама (VI). Через два года братья Элюар (испанские химики) получили из саксонского минерала сам вольфрам в чистом виде.
Добывают этот элемент и его руды в Португалии, Боливии, Южной Корее, России, Узбекистане, а наибольшие запасы были найдены в Канаде, США, Казахстане и Китае. В год добывается всего 50 тонн этого элемента, поэтому он дорого стоит. Рассмотрим подробнее, что за металл вольфрам.
Свойства элемента
Как уже было сказано ранее, вольфрам – это один из самых тугоплавких металлов. Он имеет блестящий светло-серый цвет. Его температура плавления 3422°С, а кипения — 5555°C, плотность в чистом виде — 19,25 г/см3, а твердость 488 кг/мм². Это один из самых тяжелых металлов, обладающий высокой коррозионной стойкостью.
Он практически не растворим в серной, соляной и плавиковой кислотах, но быстро вступает в реакцию с перекисью водорода. Что за металл вольфрам, если он не реагирует с расплавленными щелочами? Вступая в реакцию с гидроксидом натрия и кислородом, он образует два соединения – вольфрамат натрия и обычную воду Н2О.
Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Получение вольфрама
На вопрос о том, к какой группе металлов относится вольфрам, можно ответить, что он входит в категорию редких элементов, как рубидий и молибден.
А это, в свою очередь, означает, что для него характерны небольшие масштабы производства.
Кроме того, такой металл не получают восстановлением из сырья, сначала он перерабатывается на химические соединения. Как же происходит получение редкого металла?
- Из рудного материала выделяют необходимый элемент и концентрируют его в растворе или осадке.
- Следующим шагом, получают чистое химическое соединение путем очистки.
- Из полученного вещества выделяют чистый редкий металл – вольфрам.
Для обогащения руды используют гравитацию, флотацию, магнитную или электростатическую сепарацию. В результате получают концентрат, который содержит 55-65% ангидрида вольфрама WO3.
Для получения порошка его восстанавливают при помощи водорода или углерода. Для некоторых изделий, на этом процесс получения элемента заканчивается.
Так, вольфрамовый порошок используют для приготовления твердых сплавов.

Изготовление штабиков
Мы уже выяснили, что за металл вольфрам, а теперь узнаем, в каком сортаменте он изготавливается. Из порошкового соединения изготавливают компактные слитки – штабики. Для этого используют только порошок, который был восстановлен водородом.
Их изготавливают путем прессования и спекания. Получаются довольно прочные, но хрупкие слитки. Иными словами, они плохо поддаются ковке. Для улучшения этого технологического свойства, штабики подвергают высокотемпературной обработке.
Из этого изделия изготавливают другой сортамент.

Вольфрамовые прутки
Конечно же, это один из самых распространенных видов продукции из этого металла. Что за вольфрам используется для их изготовления? Это вышеописанные штабики, которые подвергаются ковке на ротационной ковочной машине. Важно отметить, что процесс происходит в нагретом состоянии (1450-1500°С).
Полученные прутки применяют в самых различных отраслях промышленности. Например, для изготовления сварочных электродов. Кроме того, вольфрамовые прутки нашли широкое применение в нагревателях. Они работают в печах при температуре до 3000 °С в вакууме, инертном газе или водороде.
Прутки также могут быть использованы как катоды электронных и газоразрядных приборов, радиоламп.
Интересно, что сами по себе электроды являются неплавящимися, и поэтому во время сварки, необходима подача присадочного материала (проволока, прут). При расплавлении со свариваемым материалом он создает сварочную ванну. Данные электроды, как правило, применяются для сварки цветных металлов.
Вольфрам и проволока
Вот еще один вид широко распространённой продукции. Вольфрамовая проволока изготавливается из кованых прутков, рассмотренных нами ранее. Волочение производится с постепенным снижением температуры от 1000°С до 400°С.
Затем проводят очистку изделия путем отжига, электролитической полировкой или электролитическим травлением. Поскольку вольфрам – тугоплавкий металл, проволока используется в элементах сопротивления в нагревательных печах при температурах до 3000°С.
Из нее изготавливают термоэлектрические преобразователи, а также спирали ламп накаливания, петлевые подогреватели и многое другое.

Соединения вольфрама с углеродом
Карбиды вольфрама считаются очень важными с практической точки зрения. Они применяются для изготовления твердых сплавов. Соединения с углеродом имеют положительный коэффициент электросопротивления и хорошую проводимость металла. Карбиды вольфрама образуются двух видов: WC и W2C. Они различаются своим поведениям в кислотах, а также растворимостью в других соединениях с углеродом.
На основе вольфрамовых карбидов изготавливают два типа твердых сплавов: спеченные и литые. Последние получают из порошкообразного соединения и карбида с недостатком С (менее 3%) путем литья.
Второй тип изготавливают из монокарбида вольфрама WC и цементирующего металла-связки, которым может выступать никель или кобальт. Спеченные сплавы получают только методом порошковой металлургии.
Порошок цементирующего металла и карбид вольфрама смешивают, прессуют и спекают. Такие сплавы обладают высокой прочностью, твёрдостью износоустойчивостью.

В современной металлургической промышленности их используют для обработки металлов резанием и для изготовления бурового инструмента. Одним из самых распространённых сплавов являются ВК6 и ВК8. Их применяют для изготовления фрез, резцов, сверл и другого режущего инструмента.
Область применения карбидов вольфрама достаточно объёмная. Так, их используют для изготовления:
- бронебойных припасов;
- деталей двигателей, самолетов, космических кораблей и ракет;
- оборудования в атомной промышленности;
- хирургических инструментов.
На Западе особенно широко применяются карбиды вольфрама в ювелирных изделиях, в особенности, для изготовления свадебных колец. Металл смотрится красиво, эстетично, его легко обрабатывать.

Это объясняется тем, что они невероятно износоустойчивы. Чтобы поцарапать такое изделие, придется приложить немало усилий. Даже через несколько лет, кольцо будет выглядеть как новое. Оно не потускнеет, не повредится рельефный узор, да и полированная часть не потеряет своего блеска.
Вольфрам и рений
Сплав этих двух элементов довольно широко применяется для изготовления высокотемпературных термопар. Вольфрам – какой металл? Как и рений, это жаропрочный металл, а легирование элементов снижает это свойство. Но что, если взять два практически одинаковых вещества? Тогда температура их плавления снижаться не будет.

Если использовать рений в качестве присадки, будет наблюдаться повышение жаропрочности и пластичности вольфрама. Данный сплав получают методом плавки в порошковой металлургии.
Термопары, изготавливаемые из этих материалов, являются жаропрочными и могут измерять температуру больше 2000°С, но только в инертной среде.
Конечно же, подобные изделия стоят дорого, ведь в один год добывается всего 40 тонн рения и только 51 тонна вольфрама.
Источник: https://www.syl.ru/article/345174/volfram—chto-za-metall-svoystva-i-sferyi-primeneniya
Вольфрам
 Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек. Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm («волчьи сливки», «волчий крем»). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
Вольфрам — самый тугоплавкий из металлов. Более высокую температуру плавления имеет только неметаллический элемент — углерод. При стандартных условиях химически стоек. Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием лат. Spuma lupi («волчья пена») или нем. Wolf Rahm («волчьи сливки», «волчий крем»). Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).
СТРУКТУРА
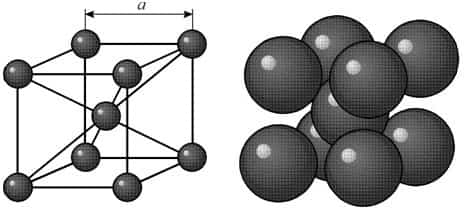 Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
СВОЙСТВА

Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Запасы и добыча
 Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре около 700 °C.
Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200—1300 °C, затем пропускают через него электрический ток.
Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
ПРОИСХОЖДЕНИЕ
 Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 * mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее.
Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия.
Главные импортёры: США, Япония, Германия, Великобритания.
Также есть месторождения вольфрама в Армении и других странах.
ПРИМЕНЕНИЕ

Вольфрам используют в качестве электродов для аргоно-дуговой сварки. Сплавы, содержащие вольфрам, отличаются жаропрочностью, кислотостойкостью, твердостью и устойчивостью к истиранию. Из них изготовляют хирургические инструменты (сплав «амалой»), танковую броню, оболочки торпед и снарядов, наиболее важные детали самолетов и двигателей, контейнеры для хранения радиоактивных веществ. Вольфрам — важный компонент лучших марок инструментальных сталей. Вольфрам применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов. Сплав вольфрама и рения применяется в таких печах в качестве термопары.
Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин, в горнодобывающей промышленности широко используются твёрдые сплавы и композитные материалы на основе карбида вольфрама (например, победит, состоящий из кристаллов WC в кобальтовой матрице; широко применяемые в России марки — ВК2, ВК4, ВК6, ВК8, ВК15, ВК25, Т5К10, Т15К6, Т30К4), а также смесей карбида вольфрама, карбида титана, карбида тантала (марки ТТ для особо тяжёлых условий обработки, например, долбление и строгание поковок из жаропрочных сталей и перфораторное ударно-поворотное бурение крепкого материала). Широко используется в качестве легирующего элемента (часто совместно с молибденом) в сталях и сплавах на основе железа. Высоколегированная сталь, относящаяся к классу «быстрорежущая», с маркировкой, начинающейся на букву Р, практически всегда содержит вольфрам. ( Р18, Р6М5. от rapid — быстрый, скорость).
Сульфид вольфрама WS2 применяется как высокотемпературная (до 500 °C) смазка. Некоторые соединения вольфрама применяются как катализаторы и пигменты. Монокристаллы вольфраматов (вольфраматы свинца, кадмия, кальция) используются как сцинтилляционные детекторы рентгеновского излучения и других ионизирующих излучений в ядерной физике и ядерной медицине.
Дителлурид вольфрама WTe2 применяется для преобразования тепловой энергии в электрическую (термо-ЭДС около 57 мкВ/К). Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества.
Стабильный 184W используется как компонент сплавов с ураном-235, применяемых в твердофазных ядерных ракетных двигателях, поскольку это единственный из распространённых изотопов вольфрама, имеющий низкое сечение захвата тепловых нейтронов (около 2 барн).
Вольфрам (англ. Tungsten) — W
КЛАССИФИКАЦИЯ
Физические свойства
Оптические свойства
Кристаллографические свойства
Источник: http://mineralpro.ru/minerals/tungsten/
Свойства вольфрама
Вольфрам (W) – удивительный металл с прекрасными физическими и химическими характеристиками. Его активно применяют практически во всех отраслях промышленности.

Физические свойства вольфрама:
- твердый тугоплавкий и тяжелый металл (вес вольфрама почти в 2 раза больше, чем у свинца);
- масса вольфрама составляет 184 г/моль;
- сплавы W отличаются прочностью, твердостью и высоким сопротивлением к высоким температурам;
- цвет зависит от способа получения (порошок имеет серый, темно-серый или черный цвет, сплавленный W – серый оттенок, напоминающий цвет платины);
- плотность вольфрама при нормальних условиях равна 19, 25 г/м3.
Температура плавления вольфрама составляет 3410 °C — соизмерима с температурой на поверхности Солнца – 6690 °C. Высокая твердость вольфрама позволяет применять его в химической промышленности и металлургии. При этом сопротивление вольфрама зависит только от температуры.
Химические свойства вольфрама:
- в природе состоит из стабильных изотопов (5 штук), массовые числа которых находятся в пределах 180-186;
- отделение 74 электронов атома W происходит легко;
- обладает 6 валентностью, в соединениях может иметь 0, 2, 3, 4 и 5-валентным;
- орбита элемента включает 2 яруса, что позволяет образовать крепкую химическую связь.

Наука относит вольфрам к химически активным элементам. Он может вступать в различные реакции и образовывать как простые, так и сложные соединения. В сплавах W чаще всего остается химически связанным. При этом с окислителями (например, с кислородом) он реагирует быстрее, чем другие металлы рода «тяжеловесов».
В случае нагревания элемента он еще быстрее вступает в реакцию с кислородом. Если в реакции участвуют водные пары, реакция протекает гораздо быстрее. Ученые выяснили: при нагреве элемента до 500 °C получается WO2 — низкий окислитель с высокой устойчивочтью.
Он затягивает поверхность металла коричневой пленкой. Если повышать температуру — можно получить еще один окислитель, который называют промежуточным (W4O11). Он имеет синюю окраску, а если продолжить нагрев до температуры в 923°C, она изменится на лимонно-желтую.
Этому будет способствовать WO3.
Если с вольфрамом смешивают сухой фтор, то даже при небольшом подогреве можно получить вещество WF6. Его именуют гексафторидом. Оно может плавиться даже при 2,5 градусах, а кипеть при 19,5. Такое же соединение можно получить и при использовании хлора. Однако для этой реакции потребуется высокая температура — около 600 °C.
Также вольфрам легко вступает в реакции с йодом и бромом. С ними он образовывает такие малоустойчивые соединения как дибромид, ментамид, а также дииодид и тетрадид. При высоких температурах вольфрам соединяется с селеном, азотом, серой, а также с кремнием и углеродом.
Одним из интересных соединений считают карбонил. В этой реакции вольфрам реагирует на окись углерода. Именно здесь и проявляется его нулевая валентность. Однако это вещество сложно назвать устойчивым. Поэтому его можно получить только при создании специальных условий. Из карбонила получают плотные и ультратонкие покрытия чистого вольфрама.
Нужно уделить внимание и вольфрамовым соединениям. Некоторые из них поддаются полимеризации, в частности окись вольфрама.

Свойства атома
- Имя, символ, номер — Вольфрам/Wolframium (W), 74
- Атомная масса (молярная масса), г/моль — 183,84 а. е. м.
- Электронная конфигурация — [Xe] 4f14 5d4 6s2
- Радиус атома, пм — 141
Химические свойства
- Ковалентный радиус, пм — 170
- Радиус иона, пм — (+6e) 62 (+4e) 70
- Электроотрицательность, шкала Полинга — 2.3
- Электродный потенциал, В — W < W3+ 0,11
- W < W6+ 0,68
- Степени окисления — 6, 5, 4, 3, 2, 0
- Энергия ионизации, кДж/моль(1-й ионизац. потенциал, эВ) — 769,7 (7,98)
Термодинамические свойства простого вещества
- Плотность, кг/м3 (при н. у., г/см3) — 19300 (19,3)
- Температура плавления, °C, K — 3422, 3695
- Температура кипения, °C, K — 5555, 5828
- Теплота плавления, кДж/кг, кДж/моль — 191, 35
- Теплота испарения, кДж/кг, кДж/моль — 4482, 824
- Теплоемкость, кДж/(кг·°С) — 0,134
- Молярная теплоемкость, Дж/(K·моль) — 24,27
- Молярный объем, см3/моль — 9,53
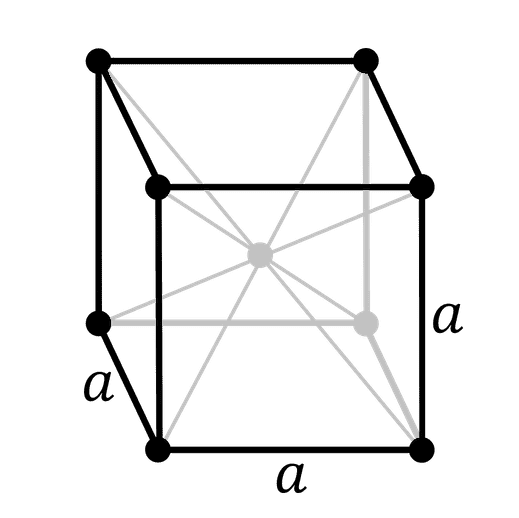
Кристаллическая решетка простого вещества
- Структура решетки — кубическая объемноцентрированая
- Параметры решетки, A — 3,160
- Температура Дебая, K — 310,00
Прочие характеристики
- Теплопроводность, K, Вт/(м·К) — 300, 173
- Удельное электросопротивление при 20°С, ом·мм2/м — 5,03
- Коэффициент теплопроводности при 20°С, кал/ (см·сек·град) — 0,4
- Коэффициент линейного расширения, 1/град — 43·10-6
- Временное сопротивление при растяжении, кг/мм2 — 35
Источник: https://specmetal.ru/spravochnaya-informatsiya/svojstva-volframa
Применение и использование вольфрама
Еще в 16 веке был известен минерал вольфрамит, который в переводе с немецкого (Wolf Rahm) означает «волчьи сливки». Такое название минерал получил в связи со своими особенностями.
Дело в том, что вольфрам, который сопровождал оловянные руды, во время выплавки олова превращал его просто в пену шлаков, поэтому и говорили: «пожирает олово, как волк овцу».
Спустя время, именно от вольфрамита и было унаследовано 74 химическим элементом периодической системы название вольфрам.

Характеристики вольфрама
Вольфрам является переходным металлом светло-серого цвета. Имеет внешнее сходство со сталью. В связи с обладанием достаточно уникальными свойствами, данный элемент является очень ценным и редким материалом, чистый вид которого в природе отсутствует. Вольфрам обладает:
- достаточно высокой плотностью, которая приравнивается к 19,3 г/см3;
- высокой температурой плавления, составляющей 34220С;
- достаточным электросопротивлением – 5,5 мкОм*см;
- нормальным показателем коэффициента параметра линейного расширения, равняющегося 4,32;
- наивысшей среди всех металлов температурой кипения, равняющейся 55550С;
- низкой скоростью испарения, даже не смотря на температуры, превышающие 2000С;
- относительно низкой электропроводностью. Однако, это не мешает вольфраму оставаться хорошим проводником.
| Свойства атома | |
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d4 6s2 |
| Радиус атома | 141 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 ВW ← W6+ 0,68 В |
| Степени окисления | 6, 5, 4, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25[2] г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F)[2] |
| Температура кипения | 5828 K (5555 °C, 10031 °F)[2] |
| Уд. теплота плавления | 285,3 кДж/кг 52,31[3][4] кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27[5] Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,160 Å |
| Температура Дебая | 310 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 162,8[6] Вт/(м·К) |
| Номер CAS | 7440-33-7 |
Все это делает вольфрам очень прочным металлом, который не поддается механическим повреждениям. Но наличие таких уникальных свойств не исключает присутствие недостатков, которые также есть у вольфрама. К ним относятся:
- высокая ломкость при воздействии на него очень низких температур;
- высокая плотность, что затрудняет процесс его обработки;
- низкая сопротивляемость кислотам при низких температурах.
Получение вольфрама
Вольфрам, наряду с молибденом, рубидием и рядом других веществ, входит в группу редких металлов, которые характеризуются очень малым распространением в природе. В связи с этим, его нельзя добыть традиционным способом, как многие полезные ископаемые. Таким образом, промышленное получение вольфрама состоит из следующих этапов:
- добычи руды, в составе которой содержится определенная доля вольфрама;
- организации надлежащих условий, в которых можно выделить металл от перерабатываемой массы;
- концентрации вещества в виде раствора или осадка;
- очистки получившегося в результате предыдущего этапа химического соединения;
- выделении чистого вольфрама.
Таким образом, чистое вещество из добытой руды, содержащей вольфрам, можно выделить несколькими способами.
- В результате обогащения вольфрамовой руды гравитацией, флотацией, магнитной или электрической сепарацией. В процессе этого образуется вольфрамовый концентрат, на 55-65% состоящий из ангидрида (трехокиси) вольфрама WO3. В концентратах данного металла ведется контроль за содержанием примесей, в качестве которых могут выступать фосфор, сера, мышьяк, олово, медь, сурьма и висмут.
- Как известно, трехокись вольфрама WO3 является основным материалом для выделения металлического вольфрама или карбида вольфрама. Получение WO3 происходит в результате разложения концентратов, выщелачивания сплава или спека и др. В таком случае, на выходе образуется материал на 99,9% состоящий из WO3.
- Из ангидрида вольфрама WO3. Именно путем восстановления данного вещества водородом или углеродом получают вольфрамовый порошок. Применения второго компонента для восстановительной реакции применяют реже. Это связано с насыщением в процессе реакции WO3 карбидами, в результате чего металл теряет свою прочность и его становится тяжелее обработать. Вольфрамовый порошок получают особыми способами, благодаря которым становится возможным проводить контроль его химического состава, размеров и формы зерен, а также гранулометрического состава. Так, фракцию частиц порошка можно увеличить путем быстрого нарастания температуры или низкой скоростью подачи водорода.
- Производство компактного вольфрама, который имеет вид штабиков или слитков и представляет собой заготовку для дальнейшего изготовления полуфабрикатов – проволоки, прутков, ленты и др.
Последний способ, в свою очередь, включает в себя два возможных варианта. Один из них связан с методами порошковой металлургии, а другой – с плавкой в электрических дуговых печах с расходуемым электродом.
Метод порошковой металлургии
В силу того, что благодаря данному способу можно равномернее распределить присадки, наделяющие вольфрам особыми его свойствами, он более популярен.
Он включает несколько этапов:
- Металлический порошок прессуется в штабики;
- Заготовки подвергаются спеканию при низких температурах (так называемое, предварительное спекание);
- Сваривание заготовок;
- Получение полуфабрикатов путем обработки заготовок.
Реализация данного этапа осуществляется ковкой или механической обработкой (шлифовка, полировка). Стоит отметить, что механическая обработка вольфрама становится возможной только под воздействием высоких температур, в противном случае, его обработать невозможно.
При этом, порошок должен быть хорошо очищен с максимально допустимым процентным содержанием примесей до 0,05%.
Данный метод позволяет получить вольфрамовые штабики, имеющие квадратное сечение от 8х8 до 40х40 мм и длину в 280-650 мм. Стоит отметить, что в условиях комнатных температур они достаточно прочны, однако имеют повышенную хрупкость.
Плавка
Данный способ применяется, если необходимо получить вольфрамовые заготовки достаточно крупных габаритов – от 200 кг до 3000 кг. Такие заготовки, как правило, необходимы для проката, вытяжки труб, изготовления изделий путем литья.
Для плавки необходимо создание специальных условий – вакуум или разреженная атмосфера водорода. На выходе образуются слитки вольфрама, обладающие крупнокристаллической структурой, а также высокой хрупкостью в связи с наличием большого количества примесей.
Содержание примесей можно снизить за счет предварительной плавки вольфрама в электронно-лучевой печи. Однако, структура при этом остается неизменной. В связи с чем, для уменьшения размера зерна происходит дальнейшая плавка слитков, но уже в электрической дуговой печи.
При этом, в процессе плавки к слиткам добавляются легирующие вещества, наделяющие вольфрам особыми свойствами.
Чтобы получить вольфрамовые слитки, имеющие мелкозернистую структуру, используют дуговую гарниссажную плавку с разливкой металла в изложницу.
Способ получения металла определяет наличие в нем присадок и примесей. Таким образом, сегодня производится несколько марок вольфрама.
Марки вольфрама
- ВЧ – чистый вольфрам, в котором отсутствуют какие-либо присадки;
- ВА – металл, имеющий в своем составе алюминиевую и кремнещелоную присадку, которые наделяют его дополнительными свойствами;
- ВМ – металл, имеющий в своем составе ториевую и кремнещелочную присадку;
- ВТ – вольфрам, в составе которого содержится оксид тория в качестве присадки, что существенно повышает эмиссионные свойства металла;
- ВИ – металл, содержащий оксид иттрия;
- ВЛ – вольфрам с окисью лантана, что также повышает эмиссионные свойства;
- ВР – сплав рения и вольфрама;
- ВРН – какие-либо присадки в металле отсутствуют, однако могут присутствовать примеси в больших объемах;
- МВ – сплав вольфрама с молибденом, что существенно повышает прочность после отжига, сохраняя при этом пластичность.
Где применяется вольфрам?
Благодаря своим уникальным свойствам, 74 химический элемент стал незаменимым во многих промышленных отраслях.
- Основное применение вольфрама – в качестве основы для производства тугоплавких материалов в металлургии.
- С обязательным участием вольфрама производятся нити накаливания, являющиеся главным элементом приборов освещения, кинескопов, а также иных вакуумных труб.
- Также данный металл лежит в основе производства тяжелых сплавов, используемых в качестве противовесов, бронебойных сердечников подкалиберных и стреловидных оперенных снарядов артиллерийских орудий.
- Вольфрам является электродами при аргонно-дуговой сварке;
- Его сплавы отличаются высокой устойчивостью к воздействиям различных температур, кислой среде, а также твердостью и устойчивостью к истиранию, в связи с чем применяются при производстве хирургических инструментов, брони танков, торпедных и снарядных оболочек, деталей самолетов и двигателей, а также контейнеров для хранения ядерных отходов;
- Вакуумные печи сопротивления, температура в которых достигает предельно высоких величин, оборудованы нагревательными элементами, произведенными также из вольфрама;
- Использование вольфрама популярно для обеспечения защиты от ионизирующего излучения.
- Соединения вольфрама используются в качестве легирующих элементов, высокотемпературных смазок, катализаторов, пигментов, а также для преобразования тепловой энергии в электрическую (дителлурид вольфрама).
Источник: http://mining-prom.ru/rud/volfram/primenenie-i-ispolzovanie-volframa/
Вольфрам: получение, свойства, основные соединения, область применения
- ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
РФ - ВЯТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- КАФЕДРА НЕОРГАНИЧЕСКОЙ И ФИЗИЧЕСКОЙ ХИМИИ
- Контрольная работа
- Тема: “Вольфрам: получение, свойства, основные соединения, область применения.”
Выполнила студентка: Серафимович Н. А.
шифр 09-ЭКУу-6738
Проверила, к.х.н., доцент: Рыкова Т.С.
- Киров, 2010г.
- СОДЕРЖАНИЕ
| ВВДЕНИЕ | 3 |
| 1 ПОЛУЧЕНИЕ ВОЛЬФРАМА | 4 |
| 2 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | 6 |
| 2.1 ФИЗИЧЕСКИЕ СВОЙСТВА ВОЛЬВРАМА | 6 |
| 2.2 ХИМИЧЕСКИЕ СВОЙСТВА ВОЛЬФРАМА | 8 |
| 3 ОСНОВНЫЕ СОЕДИНЕНИЯ | 9 |
| 4 ОБЛАСТЬ ПРИМЕНЕНИЯ | 11 |
| ЗАКЛЮЧЕНИЕ | 13 |
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК ЛИТЕРАТУРЫ | 14 |
ВВЕДЕНИЕ
Вольфрам — (Wolframium), W — химический элемент VI группы периодической системы Д.И.Менделеева, атомный номер 74, атомная масса 183,85 г/моль. Радиус атома 141 пм. Наиболее характерна степень окисления +6. Известны соединения со степенями окисления вольфрама +5, +4, +3, +2 и 0.
Еще в 14-16 вв. горняки и металлурги в
Рудных горах Саксонии отмечали, что
некоторые руды нарушали процесс
восстановления оловянного камня (минерала касситерита,), приводили к зашлаковыванию расплавленного металла. Рудокопы дали этой «надоедливой» породе названия «Wolfert» и «Wolfrahm», что в переводе означает «волчья пена».
В 1783 в Испании братья д’Эльгуйяр при помощи азотной кислоты выделили из этого минерала «кислую землю» — желтый осадок оксида неизвестного металла, растворимый в аммиачной воде. В минерале также были обнаружены оксиды железа и марганца.
Хуан и Фаусто прокалили «землю» с древесным углем и получили металл, который они предложили называть «вольфрамом», а сам минерал — «вольфрамитом». Таким образом, испанские химики д’Эльгуйяр первыми опубликовали сведения об обнаружении нового элемента.
В 1758 шведский химик и минералог Аксель Фредрик Кронштедт открыл и описал необычайно тяжелый минерал , названный в последствии шеелитом. Кронштедт был убежден, что этот минерал содержит новый, еще не открытый, элемент.
В 1781 великий шведский химик Карл Шееле
разложил «тяжелый камень» азотной
кислотой, обнаружив при этом, помимо соли кальция, «желтую землю»,
не похожую
на белую «молибденовую землю», впервые
выделенную им же три года назад. Интересно, что один из братьев д’Эльгуйяр работал в то время в его
лаборатории. Шееле назвал металл «tungsten», по названию минерала, из которого был
впервые выделен желтый оксид. Так
у одного и того же элемента появилось
два названия.
Вольфрам
долго не находил промышленного
применения. Лишь во второй половине 19 века начали изучать влияние добавок вольфрама на свойства стали.
1 ПОЛУЧЕНИЕ ВОЛЬФРАМА
Вольфрам
— довольно редкий элемент, его кларк (процентное содержание в земной коре) составляет 1,3·% (57-е место среди химических элементов).
Сырьем
для получения вольфрама служат вольфрамитовые и шеелитовые концентраты (50-60%).
Из концентратов непосредственно выплавляют ферровольфрам (сплав железа с 65-80% вольфрама), используемый в производстве стали; для получения вольфрама, его сплавов и соединений из концентрата выделяют вольфрамовый ангидрид. В промышленности применяют несколько способов получения.
Шеелитовые концентраты разлагают в автоклавах раствором соды при 180-200°С (получают технический раствор вольфрамата натрия) или соляной кислотой (получают техническую вольфрамовую кислоту):
1. + = +
2. + = +
Вольфрамитовые
концентраты разлагают либо спеканием
с содой при 800-900°С с последующим
выщелачиванием вольфрамата натрия ( водой, либо обработкой при нагревании раствором едкого натра. При разложении щелочными агентами (содой или едким натром) образуется раствор вольфрамата натрия , загрязненный примесями.
После их отделения из раствора выделяют техническую вольфрамовую кислоту ( . Для получения более грубых, легко фильтруемых и отмываемых осадков вначале из раствора осаждают, который затем разлагают соляной кислотой.) Высушенная содержит 0,2 — 0,3% примесей. Прокаливанием
при 700-800°С получают , а уже из него — твердые сплавы.
Для производства металлического вольфрама вольфрамовую кислоту
дополнительно очищают аммиачным способом — растворением в аммиаке и кристаллизацией паравольфрамата аммония. Прокаливание этой соли дает чистый .
Порошок вольфрама получают восстановлением водородом (а в производстве твердых сплавов — также и углеродом) в трубчатых электрических печах при 700-850°С. Компактный металл
получают
из порошка металлокерамическим
методом, то есть прессованием в стальных прессформах под давлением 3000-5000 кгс/и термической обработкой спрессованных заготовок — штабиков.
Последнюю стадию термической обработки — нагрев примерно до 3000°С проводят в специальных аппаратах непосредственно пропусканием электрического тока через штабик в атмосфере водорода. В результате получают вольфрам, хорошо поддающийся обработке давлением (ковке, волочению, прокатке и т. д.
) при нагревании. Из штабиков методом бестигельной электроннолучевой зонной плавки получают монокристаллы вольфрама.
Имеется еще один способ получения окиси вольфрама – через хлориды. Вольфрамовый концентрат при повышенной температуре обрабатывают газообразным хлором. Образовавшиеся хлориды вольфрама довольно легко отделить от хлоридов других металлов методом возгонки, используя разницу температур, при которых эти вещества переходят в парообразное состояние.
Полученные хлориды вольфрама можно превратить в окисел, а можно пустить непосредственно на переработку в элементарный металл. Превращение окислов или хлоридов в металл – следующая стадия производства вольфрама. Лучший восстановитель окиси вольфрама – водород. При восстановлении водородом получается наиболее чистый металлический вольфрам.
Процесс восстановления происходит в трубчатых печах, нагретых таким образом, что по мере продвижения по трубе «лодочка» с проходит через несколько температурных зон. Навстречу ей идет поток сухого водорода. Восстановление происходит и в «холодных» (450…600°C) и в «горячих» (750…1100°C) зонах; в «холодных» – до низшего окисла , дальше – до элементарного металла.
В зависимости от температуры и длительности реакции в «горячей» зоне меняются чистота и размеры зерен выделяющегося на стенках «лодочки» порошкообразного вольфрама. Восстановление может идти не только под действием водорода, на практике часто используется уголь.
Применение твердого восстановителя несколько упрощает производство, однако в этом случае требуется более высокая температура – до 1300…1400°C. Кроме того, уголь и примеси, которые он всегда содержит, вступают в реакции с вольфрамом, образуя
карбиды и другие соединения. Это приводит к загрязнению металла. Между
тем электротехнике нужен весьма чистый вольфрам. Всего 0,1% железа делает вольфрам хрупким и малопригодным
для изготовления тончайшей проволоки.
Получение вольфрама из хлоридов основано на процессе пиролиза. Вольфрам образует с хлором несколько соединений. С
помощью избытка хлора все
их можно перевести в высший хлорид –, который разлагается на вольфрам и хлор при 1600°C. В присутствии водорода этот процесс идет уже при 1000°C.
Так получают металлический вольфрам, но не компактный, а в виде порошка, который затем прессуют в токе водорода при высокой температуре. На первой стадии прессования (при нагреве до 1100…1300°C) образуется пористый ломкий слиток. Прессование продолжается при еще более высокой температуре, едва не достигающей под конец температуры плавления вольфрама.
В этих условиях металл постепенно становится сплошным, приобретает волокнистую структуру, а с ней – пластичность и ковкость.
2 ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
СВОЙСТВА
2.1 ФИЗИЧЕСКИЕ СВОЙСТВА
ВОЛЬВРАМА
Вольфрам
– металл серебристо-белого цвета, по внешнему виду похож на сталь: в порошкообразном состоянии – серого, тёмно-серого и даже черного цвета. Кристаллизуется в объемно-центрированной кубической решетке с периодом а = 0,31589 нм (-модификация).
К самому выдающемуся физическому свойству вольфрама относится его высокая температура плавления 3410°С, при температуре около 1600оС хорошо поддается ковке и может быть вытянут в тонкую нить; температура кипения 5930оС. Вольфрам — один из наиболее тяжелых металлов.
От других металлов отличается: высоким модулем упругости (для проволоки модуль упругости 380-410 ГПа), по которым он превосходит все металлы; низким давлением его паров и малым коэффициентом сжимаемости, которые являются самыми низкими по сравнению со всеми остальными металлами.
Вольфрам обладает высокой коррозийной стойкостью, при комнатной температуре не изменяется на воздухе, малопластичен .
Плотность вольфрама составляет 19,3 г/, что соответствует плотности золота, но меньше, чем у платины, иридия, осмия и рения. Благодаря высокой плотности и сравнительно большому поперечному сечению захвата тепловых нейтронов вольфрам является эффективным защитным материалом.
Теплопроводность вольфрама составляет менее половины теплопроводности меди, но она намного выше, чем у железа или никеля. Хотя электропроводность вольфрама примерно втрое меньше электропроводности отожженной меди, она все же выше, чем у железа, никеля, ртути, платины и фосфористой бронзы.
Другие физические свойства вольфрама приведены в таблице 2.1.
Таблица 2.1
| Свойства | Единицы измерения | Показатели |
| Атомный диаметр | пм | 248 |
| Электронная конфигурация | [Xe] | |
| Молярный объем | см³/моль | 9,53 |
| Молярная теплоёмкость | Дж/(К∙моль) | 24,27 |
| Группа металлов | тугоплавкий металл | |
| Твердость по Бринеллю | кг/ | 488 |
| Удельное электросопротивление: | Ом см∙ | |
| при 20 оС | 5,5 | |
| при 2700оС | 90,4 | |
| Скорость звука в отраженном вольфраме | м/с | 4290 |
| Теплопроводность | Вт/(м·K) | 173 |
| Плотность в жидком состоянии | г/ | 16,65 |
| Твердость | HB | 350 |
| Теплота плавления | кДж/моль | 35 |
| Теплота испарения | кДж/моль | 824 |
| Цвет искры | Короткий желтый прерывистый пучок искр |
2.2 ХИМИЧЕСКИЕ СВОЙСТВА ВОЛЬФРАМА
Вольфрам
– один из наиболее коррозионно-устойчивых металлов. В обычных условиях химически стоек к действию воды и воздуха, при 400-500°С заметно окисляется, при температуре свыше 600°С окисляется интенсивно, образуя вольфрамовый ангидрид
. Не взаимодействует с водородом вплоть до температуры плавления.
При температуре свыше 1500°С взаимодействует с азотом, образуя нитрид . Галогены, сера, углерод, кремний, бор взаимодействуют с вольфрамом при высоких температурах (фтор с порошкообразным вольфрамом — при комнатной). Твердый углерод при 1100 – 1200 °С реагирует с вольфрамом, образуя карбиды WC и .
В обычных условиях вольфрам стоек к соляной, серной, азотной и плавиковой кислотам, а также к царской водке, при 100°С слабо взаимодействует с ними, быстро растворяется в смеси плавиковой и азотной кислот. Растворы щелочей на холоде не действуют на вольфрам.
При нагревании в растворах щелочей вольфрам растворяется слегка, в расплавленных щелочах при доступе воздуха или в присутствии окислителей () интенсивно растворяется, образуя соли.
В соединениях вольфрам проявляет степень окисления +2, +3, +4, +5, +6. В высших степенях окисления вольфрам обладает кислотными свойствами, в низших – основными. Соединения со степенью окисления +2 и +3 неустойчивы. Двухвалентный вольфрамам известен лишь в виде галогенидов.
Из соединений вольфрама (IV) выделены в твёрдом виде устойчивые комплексные цианиды. Наибольшее практическое значение в анализе имеют соединения вольфрама (V) и (VI). Вольфрам (II) и (III) является сильным восстановителем, окислительная способность вольфрама (VI) проявляется слабо.
Поведение вольфрама в растворах сложно, особенно поведение в кислых растворах, из-за отсутствия простых
соединений. Существенное значение имеет его склонность к комплексообразованию.
Вследствие того, что в комплексных соединениях индивидуальные свойства отдельных элементов проявляются ярче, чем в простых, комплексоообразование вольфрама широко используют для его определения в присутствии близких по свойствам элементов.
3 ОСНОВНЫЕ СОЕДИНЕНИЯ
Из
соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфроматы, перекисные соединения (с общей формулой ME2WOX
), соединения с галогенами, серой и углеродом.
Источник: https://student.zoomru.ru/him/volfram-poluchenie-svojstva-osnovnye-soedineniya/80803.659370.s1.html
1.6 Вольфрам, свойства вольфрама и его соединений, области применения
Вольфрам
в ряду расплавленных металлов отличается
высокой стойкостью к коррозии. Например,
при 600 °С скорость коррозии менее 0,25
мм/год в ртути, натрии, галлии, а в сплаве
Bi—Pb—Sn
(сплав Вуда) вольфрам не корродирует.
С
расплавленным висмутом, кальцием, медью
вольфрам практически не взаимодействует, также устойчив в олове при 1680 °С. В
жидком уране при 1100 °С вольфрам медленно
растворяется в жидком уране [66,67-68].
Сплав
вольфрама с железом (ферровольфрам)
широко используют при легировании
инструментальных, конструкционных и
многих других сталей.
W
и ферровольфрам (FeW)
получают из руд и концентратов. Наиболее
известные четыре из них: ферберит,
гюбнерит, вольфрамит и шеелит (таблица
2), а также антуанит (Al2W2О9·H2O),
тунгстенит (WS2),
тунгстит [WO2(OH)2].
Содержание
WО3
в
рудах вольфрама в среднем 0,2–0,5 %, редко
превышая 1%. Кроме вольфрама в состав
руд входят минералы молибдена, меди,
мышьяка, олова и других элементов [69].
Таблица
3 – Основные свойства минералов вольфрама
| Минерал | Химическая формула | Массовое содержание, % | ρ, г/ см3 | Твердость по Моосу | |
| WO3 | W | ||||
|
|
|
|
|
|
Различными
методами химической обработки можно
довести шеелитовые концентраты до
установленных кондицией. Например, для
снижения содержания фосфора концентрат
обрабатывают на холоду соляной кислотой.
Одновременно с этим частично удаляют
кальцит и доломит. Применяя обжиг с
последующей обработкой кислотами и
другие методы можно очистить концентрат
от меди, мышьяка и висмута [11].
-
При
обогащении руд различного типа вольфрам
в кондиционные концентраты извлекают
в пределах от 65 — 70 до 85 – 95 %. -
В
таблице 4 [69]
приведен химический
состав вольфрамовых концентратов. -
Вольфрам
в виде чистого металла и в виде сплавов широко применяется в современной
технике, важные
из которых – износостойкие и жаропрочные
сплавы, легированные стали, твердые
сплавы на основе карбида вольфрама
[67-68]. - Таблица
4 – Химический состав вольфрамовых
концентратов
|
WO3, %( не менее) | Массовое содержание, % ( не более) | ||||||||
| MnO | SiO | P | S | As | Sn | Cu | Mo | CaO | ||
|
|
|
|
|
|
|
|
|
|
|
На рисунке
6 приведена диаграмма состояния системы
W—Fe.
Получение вольфрама с выпуском жидкого
сплава из печи практически невозможно,
т.к. при массовом содержании вольфрама
>60% температура плавления сплава
составляет 2850 0С.
13,8-15,5 г/ см3
— плотность промышленного ферровольфрама.
Рисунок
6 – Диаграмма состояния W—Fe
[67]
В
основном вольфрамовые концентраты
используют в производстве специальных
сталей. Состав быстрорежущих сталей: 9 — 24% W;
3,8 — 4,6% Cr;
1 — 5% V;
4 -10% Co;
0,7 — 1,5% C.
Особенность быстрорежущей стали
заключается в ее способности
самозакаливаться на воздухе, а также,
благодаря высокой температуре упрочняющего
отпуска, она сохраняет высокую твердость
и износостойкость до 600 — 650 0C.
Также
широкое применение нашли и другие
легированные инструментальные стали:
вольфрамовые (0,8-1,2% W),
хромовольфрамовые (2-9% W),
хромвольфрам — кремнистые (2-2,7% W).
Применяются Вольфрамсодержащие стали
применяются для изготовления следующих
инструментов: сверл, фрез, фильер, матриц
и пуансонов, штампов, деталей пневматических
инструментов и др.
Вольфрам
уменьшает возможность
образования горячих трещин, придает
свойство самозакаливания, повышает
прочность, твердость при высоких
температурах, временное сопротивление,
предел текучести стали, сопротивление
износу и удару.
Благодаря
содержанию вольфрама в магнитных сталях
увеличивается интенсивность намагничивания
и улучшаются коэрцитивные свойства.
Более 80% всего вольфрама используют для
легирования стали.
Если
повысить содержание вольфрама, то будет
возрастать ударная вязкость, устойчивость
против перегрева и снижаться
прокаливаемость, т.к. при этом образуется
устойчивый WC
(сталь объединяется углеродом и
вольфрамом), а также отпускная хрупкость,
теплопроводность, свариваемость.
Магнитные
стали. Существуют вольфрамовые
(5,2 — 6,2% W;
0,68-0,78% С;
0,3-0,5% Cr
— сортовые
стали для постоянных магнитов) и вольфрам
кобальтовые магнитные стали (11,5-14,5% W;
5,5-6,5% Мо;
11,5-12,5% Со
— магнитотвердые
материалы). Их особенности высокая
интенсивность намагничивания и
коэрцитивная сила.
Также
вольфрам входит в состав жаропрочных
сплавов, а именно сплавы с кобальтом и
хромом, так называемые стеллиты.
Они
имеют следующий состав в %: W
3-15; Co
45-65; Cr
25-35; C
0,5-2,75.
Их применяют для покрытий поверхности
сильно изнашивающихся деталей машин,
например, клапанов авиадвигателей,
лопастей турбин, экскаваторного
оборудования, рабочих частей ножниц
для горячей резки штампов и др.
- В
авиационной, ракетной технике, а также
в других областях, где требуется высокая
жаропрочность деталей машин, приборов
и двигателейв качестве жаропрочных
материалов используют сплавы вольфрама
с другими тугоплавкими металлами
(тантал, ниобий, молибден, рений). - Для
легирования инструментальных,
конструкционных и других сталей широко
применяется вольфрам в виде сплава
ферровольфрама (таблица 5) [2,
67]. - Таблица
5 — Характеристика химического состава
ферровольфрама (ГОСТ- 17293)
| Марка | W, %(менее) | Массовое содержание элементов, %, не более | |||||||||
| Mo | Mn | Si | C | P | S | Cu | As | Sn | Al | ||
| ФВ80а | 80 | 6,0 | 0,2 | 0,8 | 0,10 | 0,03 | 0,02 | 0,10 | 0,04 | 0,04 | 4,0 |
| В75а | 75 | 7,0 | 0,2 | 1,1 | 0,15 | 0,04 | 0,04 | 0,20 | 0,06 | 0,06 | 5,0 |
| ФВ70а | 70 | 7,0 | 0,3 | 2,0 | 0,3 | 0,06 | 0,06 | 0,30 | 0,08 | 0,10 | 6,0 |
| ФВ70 | 70 | 1,5 | 0,4 | 0,5 | 0,3 | 0,04 | 0,08 | 0,15 | 0,04 | 0,08 | – |
| Фв70Б | 70 | 2,0 | 0,5 | 0,8 | 0,5 | 0,06 | 0,10 | 0,20 | 0,05 | 0,10 | – |
| ФВ65 | 65 | 6,0 | 0,6 | 1,2 | 0,7 | 0,10 | 0,15 | 0,30 | 0,08 | 0,20 | – |
Восстановлением
концентратов углеродом и кремнием с
вычерпыванием сплава из рудовосстановителей
печи мощностью 2,5-5,0 МВ·А можно получить
ферровольфрам марок ФВ70, ФВ70Б и ФВ65.
Остальные марки получают алюминотермическим
методом [67].
Требованиям,
предъявляемые
к материалам деталей электровакуумных
приборов и источников света, удовлетворяют
вольфрам и его сплавы, что который раз
объясняет их широкое применение.
Проволока
изготовленная из вольфрама или его
сплавов имеет следующие свойства:
высокая формоустойчивость (отсутствие
ползучести и провисания) при температуре 2900 0С,
высокая температура первичной
рекристаллизации; крупнокристаллическая
структура с продольными границами у
проволоки диаметром менее 1 мм после
вторичной рекристаллизации; высокие
эмиссионные характеристики; минимальное
распыление в разряде и при высоких
температурах. Заготовки вольфрама всех
перечисленных марок легко подвергаются
обработке в проволоку, прутки, ленту,
вплоть до тончайших размеров [68].
Источник: https://studfile.net/preview/3535378/page:6/






