- 1.1. Взаимодействие с основаниями
- 1.2. Взаимодействие с металлами
- 1.3. Взаимодействие с основными оксидами
- 1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
- 2. Реакции замещения группы ОН
- 2.1. Образование галогенангидридов
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Получение ангидридов
- 3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
- 4. Свойства муравьиной кислоты
- 4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
- 4.2. Окисление хлором, бромом и азотной кислотой
- 4.3. Окисление перманганатом калия
- 4.4. Разложение при нагревании
- 5. Особенности бензойной кислоты
- 5.1. Разложение при нагревании
- 4.2. Реакции замещения в бензольном кольце
- 6. Особенности щавелевой кислоты
- 6.1. Разложение при нагревании
- 6.2. Окисление перманганатом калия
- 7. Особенности непредельных кислот (акриловой и олеиновой)
- 7.1. Реакции присоединения
- 6.2. Окисление непредельных карбоновых кислот
- Карбоновые кислоты
- Предельные монокарбоновые кислоты
- Номенклатура
- Изомерия
- Гомологический ряд
- Кислотные остатки и кислотные радикалы
- Электронное строение молекул карбоновых кислот
- Физические свойства
- Химические свойства
- I. Кислотные свойства
- 1. Реакции нейтрализации
- 2. Реакции с основными оксидами
- 3. Реакции с металлами
- 4. Реакции с солями более слабых кислот (в т. ч. с карбонатами и гидрокарбонатами)
- 5. Реакции с аммиаком
- II. Замещение группы -ОН
- 3. Образование галогенангидридов
- 4. Образование ангидридов кислот (межмолекулярная дегидратация)
- Особенности строения и свойств муравьиной кислоты
- Строение молекулы
- Химические свойства
- Способы получения предельных монокарбоновых кислот
- 1. Окисление спиртов и альдегидов
- 2. Гидролиз сложных эфиров
- 2. Декарбоксилирование щавелевой кислоты
- Получение высших карбоновых кислот
- Гидролиз природных жиров
- Высшие непредельные кислоты
- Особенности химических свойств
- Отдельные представители дикарбоновых кислот
- Предельные дикарбоновые кислоты HOOC-R-COOH
- Особенности химических свойств
- Карбоновые кислоты
- Классификация карбоновых кислот
- Номенклатура и изомерия карбоновых кислот
- Получение карбоновых кислот
- Химические свойства карбоновых кислот
- Сложные эфиры
- Ангидриды
- Непредельные карбоновые кислоты
- Формула масляной кислоты, свойства, риски и использование / химия
- Физико-химические свойства масляной кислоты
- Реактивность и опасности
- Использование и польза для здоровья
- ссылки
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
- Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
- Строение, изомерия и гомологический ряд карбоновых кислот
- Химические свойства карбоновых кислот
- Способы получения карбоновых кислот
- .
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
| Карбоновые кислоты – кислоты средней силы. В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |
4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
- При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
- Муравьиная кислота окисляется перманганатом калия до углекислого газа:
- 5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
- Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
- При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
- Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
- К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
3CH2=CH-COOH + 2KMnO4 + 3H2O = 3CH2(OH)-CH(OH)-COOK + KOH + 2MnO2
Карбоновые кислоты
Карбоновые кислоты — производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп -СООН.
а) По основности (т. е. числукарбоксильных групп в молекуле):
- — одноосновные (монокарбоновые) RCOOH; например:
- СН3СН2СН2СООН;
- — двухосновные (дикарбоновые) R(COOH)2; например:
- НООС-СН2-СООН пропандиовая (малоновая) кислота

— трехосновные (трикарбоновые) R(COOH)3 и т. д.
- б) По строению углеводородного радикала:
- — алифатические
- предельные; например: СН3СН2СООН;
- непредельные; например: СН2=СНСООН пропеновая(акриловая) кислота

— алициклические, например:
— ароматические, например:

Предельные монокарбоновые кислоты
(одноосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с одной карбоксильной группой -COOH. Все они имеют общую формулу CnH2n+1COOH (n ≥ 0 ); или CnH2nO2 (n≥1)
Номенклатура
- Систематические названия одноосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -овая и слова кислота.
- 1. НСООН метановая (муравьиная) кислота
- 2. СН3СООН этановая (уксусная) кислота
- 3. СН3СН2СООН пропановая (пропионовая) кислота
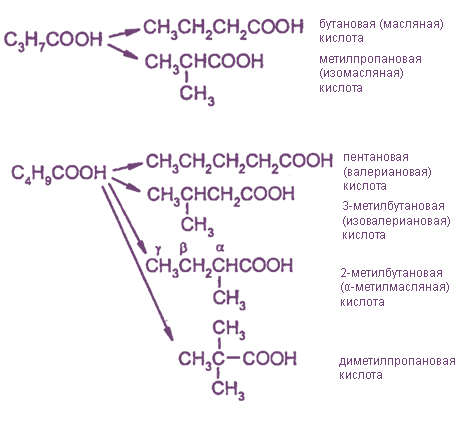
Изомерия
Изомерия скелета в углеводородном радикале проявляется, начиная с бутановой кислоты, которая имеет два изомера:
- Межклассовая изомерия проявляется, начиная с уксусной кислоты:
- — CH3-COOH уксусная кислота;
- — H-COO-CH3 метилформиат (метиловый эфир муравьиной кислоты);
- — HO-CH2-COH гидроксиэтаналь (гидроксиуксусный альдегид);
- — HO-CHO-CH2 гидроксиэтиленоксид.
Гомологический ряд
| Тривиальное название | Название по ИЮПАК | Формула |
| Муравьиная кислота | Метановая кислота | HCOOH |
| Уксусная кислота | Этановая кислота | CH3COOH |
| Пропионовая кислота | Пропановая кислота | C2H5COOH |
| Масляная кислота | Бутановая кислота | C3H7COOH |
| Валериановая кислота | Пентановая кислота | C4H9COOH |
| Капроновая кислота | Гексановая кислота | C5H11COOH |
| Энантовая кислота | Гептановая кислота | C6H13COOH |
| Каприловая кислота | Октановая кислота | C7H15COOH |
| Пеларгоновая кислота | Нонановая кислота | C8H17COOH |
| Каприновая кислота | Декановая кислота | C9H19COOH |
| Ундециловая кислота | Ундекановая кислота | C10H21COOH |
| … | … | … |
| Пальмитиновая кислота | Гексадекановая кислота | C15H31COOH |
| Стеариновая кислота | Октадекановая кислота | C17H35COOH |
Кислотные остатки и кислотные радикалы
| Кислота | Кислотный остаток | Кислотный радикал (ацил) |
| НСООН муравьиная | НСОО- формиат | |
| СН3СООНуксусная | СН3СОО- ацетат | |
| СН3СН2СООН пропионовая | СН3СН2СОО- пропионат | |
| СН3(СН2)2СООНмасляная | СН3(СН2)2СОО-бутират | |
| СН3(СН2)3СООНвалериановая | СН3(СН2)3СОО-валериат | |
| СН3(СН2)4СООНкапроновая | СН3(СН2)4СОО-капронат |
Электронное строение молекул карбоновых кислот
- Показанное в формуле смещение электронной плотности в сторону карбонильного атома кислорода обусловливает сильную поляризацию связи О-Н, в результате чего облегчается отрыв атома водорода в виде протона — в водных растворах происходит процесс кислотной диссоциации:
- RCOOH ↔ RCOO- + Н+
- В карбоксилат-ионе (RCOO-) имеет место р, π-сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с р-облаками, образующими π- связь, в результате происходит делокализация π- связи и равномерное распределение отрицательного заряда между двумя атомами кислорода:
В связи с этим для карбоновых кислот, в отличие от альдегидов, не характерны реакции присоединения.
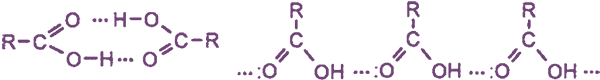
Физические свойства

Температуры кипения кислот значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода, что объясняется образованием циклических и линейных ассоциатов между молекулами кислот за счет водородных связей:
Химические свойства
I. Кислотные свойства
Сила кислот уменьшается в ряду:
НСООН → СН3СООН → C2H6COOH → …
1. Реакции нейтрализации
СН3СООН + КОН → СН3СООК + н2O
2. Реакции с основными оксидами
2HCOOH + СаО → (НСОО)2Са + Н2O
3. Реакции с металлами
2СН3СН2СООН + 2Na → 2СН3СН2COONa + H2↑
4. Реакции с солями более слабых кислот (в т. ч. с карбонатами и гидрокарбонатами)
- 2СН3СООН + Na2CO3 → 2CH3COONa + CO2↑ + Н2O
- 2НСООН + Mg(HCO3)2 → (НСОО)2Мg + 2СO2↑ + 2Н2O
- (НСООН + НСО3- → НСОО- + СO2 +Н2O)
5. Реакции с аммиаком
СН3СООН + NH3 → CH3COONH4
II. Замещение группы -ОН
Амиды кислот гидролизуются с образованием кислот:
или их солей:
3. Образование галогенангидридов
Наибольшее значение имеют хлорангидриды. Хлорирующие реагенты — PCl3, PCl5, тионилхлорид SOCl2.
4. Образование ангидридов кислот (межмолекулярная дегидратация)
Ангидриды кислот образуются также при взаимодействии хлорангидридов кислот с безводными солями карбоновых кислот; при этом можно получать смешанные ангидриды различных кислот; например:
III. Реакции замещения атомов водорода у α-углеродного атома
Особенности строения и свойств муравьиной кислоты
Строение молекулы
Молекула муравьиной кислоты, в отличие от других карбоновых кислот, содержит в своей структуре альдегидную группу.
Химические свойства
Муравьиная кислота вступает в реакции, характерные как для кислот, так и для альдегидов. Проявляя свойства альдегида, она легко окисляется до угольной кислоты:
В частности, НСООН окисляется аммиачным раствором Ag2O и гидроксидом меди (II) Сu(ОН)2, т. е. дает качественные реакции на альдегидную группу:
При нагревании с концентрированной H2SO4 муравьиная кислота разлагается на оксид углерода (II) и воду:
Муравьиная кислота заметно сильнее других алифатических кислот, так как карбоксильная группа в ней связана с атомом водорода, а не с электроно-донорным алкильным радикалом.
Способы получения предельных монокарбоновых кислот
1. Окисление спиртов и альдегидов
- Общая схема окисления спиртов и альдегидов:
- В качестве окислителей используют KMnO4, K2Cr2O7, HNO3 и другие реагенты.
- Например:
- 5С2Н5ОН + 4KMnO4 + 6H2S04 → 5СН3СООН + 2K2SO4 + 4MnSO4 + 11Н2O
2. Гидролиз сложных эфиров
СO + NaOH → HCOONa формиат натрия
2HCOONa + H2SO4 → 2НСООН + Na2SO4
2. Декарбоксилирование щавелевой кислоты
Так получают пищевую уксусную кислоту.
Получение высших карбоновых кислот
Гидролиз природных жиров
Общая формула алкеновых кислот: CnH2n-1COOH (n ≥ 2)
CH2=CH-COOH пропеновая (акриловая) кислота
Высшие непредельные кислоты
- Радикалы этих кислот входят в состав растительных масел.
- C17H33COOH — олеиновая кислота, или цис-октадиен-9-овая кислота
- Транс-изомер олеиновой кислоты называется элаидиновой кислотой.
- C17H31COOH — линолевая кислота, или цис, цис-октадиен-9,12-овая кислота
- C17H29COOH — линоленовая кислота, или цис, цис, цис-октадекатриен-9,12,15-овая кислота
Особенности химических свойств
Кроме общих свойств карбоновых кислот, для непредельных кислот характерны реакции присоединения по кратным связям в углеводородном радикале. Так, непредельные кислоты, как и алкены, гидрируются и обесцвечивают бромную воду, например:
Отдельные представители дикарбоновых кислот
Предельные дикарбоновые кислоты HOOC-R-COOH
- HOOC-CH2-COOH пропандиовая (малоновая) кислота, (соли и эфиры — малонаты)
- HOOC-(CH2)2-COOH бутадиовая (янтарная) кислота, (соли и эфиры — сукцинаты)
- HOOC-(CH2)3-COOH пентадиовая (глутаровая) кислота, (соли и эфиры — глутораты)
- HOOC-(CH2)4-COOH гексадиовая (адипиновая) кислота, (соли и эфиры — адипинаты)
Особенности химических свойств
Дикарбоновые кислоты во многом сходны с монокарбоновыми, однако являются более сильными. Например, щавелевая кислотасильнее уксусной почти в 200 раз.
- Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей — кислые и средние:
- HOOC-COOH + NaOH → HOOC-COONa + H2O
- HOOC-COOH + 2NaOH → NaOOC-COONa + 2H2O
- При нагревании щавелевая и малоновая кислоты легко декарбоксилируются:
Карбоновые кислоты
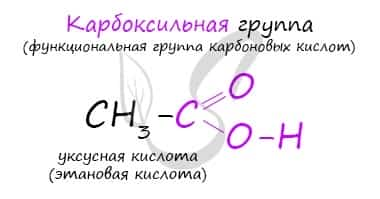
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .
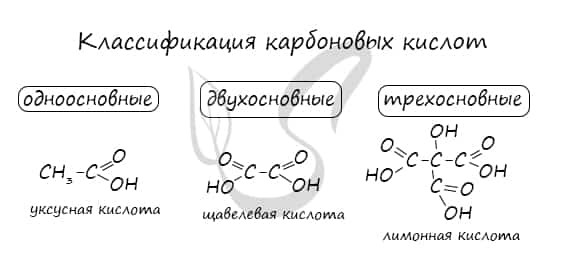
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
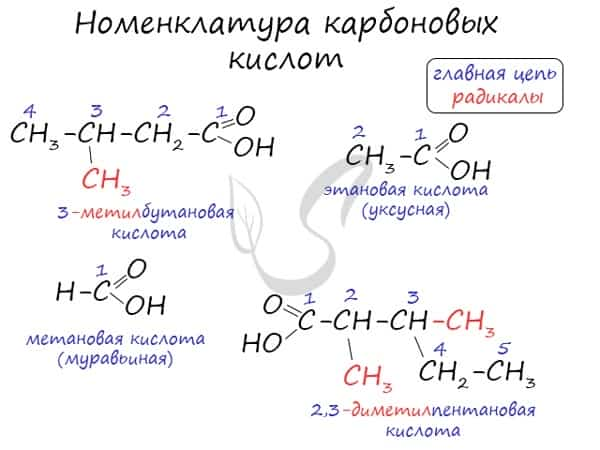
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота
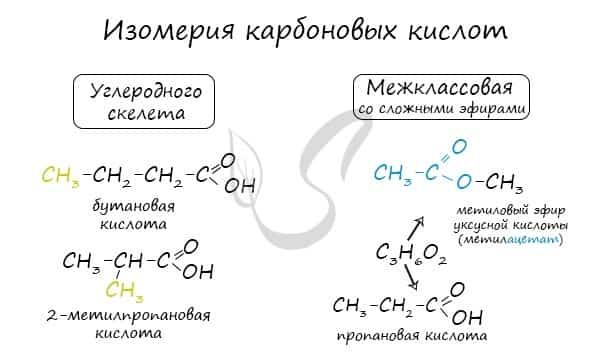
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты. 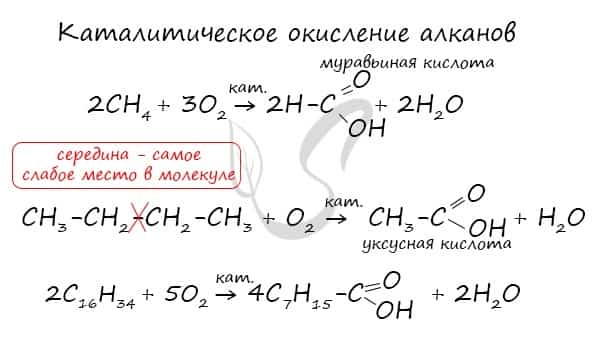
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот. 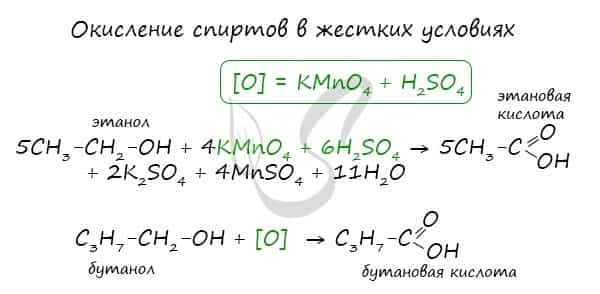
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала. 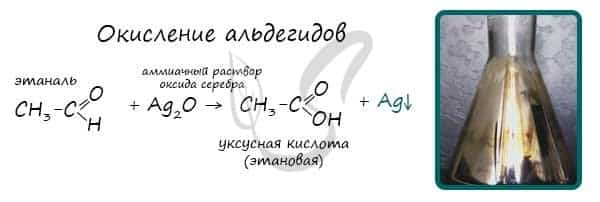 Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли. 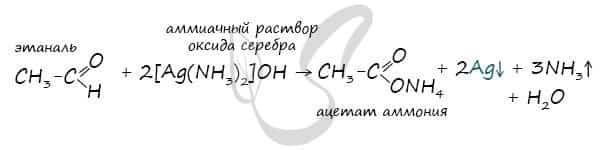 Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I. 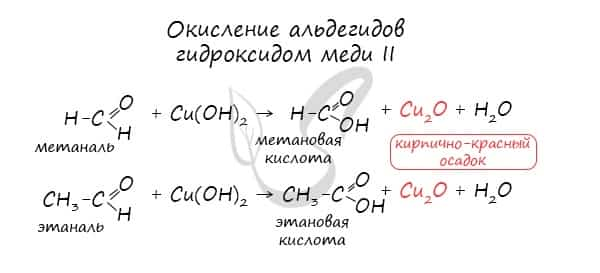
Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота. 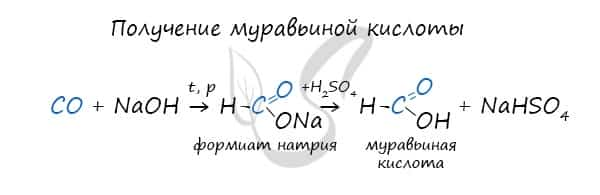
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется. Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода. Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная. Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала. В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ. HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Формула масляной кислоты, свойства, риски и использование / химия
масляная кислота, также известная как н-бутановая кислота (в системе IUPAC), это карбоновая кислота со структурной формулой CH3CH2CH2-COOH. Он классифицируется как жирная кислота с короткой цепью. Имеет неприятный запах, острый вкус и в то же время немного сладковатый (похож на эфир). Его структура показана на рисунке 1.
Он содержится особенно в прогорклом масле, сыре пармезан, сыром молоке, животных жирах, растительных маслах и рвоте. Его название происходит от греческого слова βουτυρος, что означает «масло» (contributors, 2016)..
Масляная кислота образуется в толстой кишке человека в результате бактериальной ферментации углеводов (в том числе пищевых волокон) и, предположительно, подавляет колоректальный рак.
Масляная кислота — это жирная кислота, которая встречается в форме сложных эфиров в животных жирах и растительных маслах. Интересно, что низкомолекулярные эфиры масляной кислоты, такие как метилбутират, имеют в основном приятные ароматы или ароматизаторы (Центр метаболических инноваций, S.F.).
индекс
- 1 Физико-химические свойства масляной кислоты
- 2 Реактивность и опасности
- 3 Использование и польза для здоровья
- 4 Ссылки
Физико-химические свойства масляной кислоты
Масляная кислота — бесцветная жидкость с неприятным запахом прогорклого масла. У этого также есть определенный вкус масла.
Он имеет молекулярную массу 88,11 г / моль и плотность 0,9528 г / мл при комнатной температуре. Температура его плавления составляет -5,1 ° С, а температура кипения составляет 163,75 ° С..
Соединение растворимо в воде, этаноле и эфире. Он мало растворим в четыреххлористом углероде. Это слабая кислота, что означает, что она не диссоциирует полностью, ее pKa составляет 4,82 (Национальный центр биотехнологической информации, S.F.).
Изомер 2-метилпропановой кислоты (изомасляной), (CH3) 2CHCO2H, найден как в свободном состоянии, так и в его этиловом эфире в нескольких растительных маслах. Хотя это коммерчески менее важно, чем масляная кислота (Brown, 2011).
Масляная кислота может реагировать с окислителями. Реакции накаливания происходят с триоксидом хрома при температуре выше 100 ° С. Они также несовместимы с основаниями и восстановителями. Может атаковать алюминий и другие легкие металлы (BUTYRIC ACID, 2016).
Реактивность и опасности
Масляная кислота считается легковоспламеняющимся соединением. Несовместим с сильными окислителями, алюминием и большинством других металлов, щелочами, восстановителями (Royal Society of Chemistry, 2015).
Соединение очень опасно в случае контакта с кожей (может вызвать ожоги), при проглатывании, попадании в глаза (раздражение) и вдыхании (может вызвать сильное раздражение дыхательных путей).
Распыленная жидкость или туман могут вызвать повреждение тканей, особенно слизистых оболочек глаз, рта и дыхательных путей..
Вещество токсично для легких, нервной системы, слизистых оболочек. Повторное или длительное воздействие вещества может вызвать повреждение этих органов, а также раздражение дыхательных путей, приводящее к частым приступам бронхиальной инфекции (паспорт безопасности материала масляная кислота, 2013 г.).
В случае попадания в глаза следует проверить, есть ли у жертвы контактные линзы, и снять их. Глаза жертвы следует промывать водой или физиологическим раствором в течение 20-30 минут, одновременно вызывая больницу.
В случае контакта с кожей пораженный участок следует погрузить в воду, одновременно снимая и изолируя всю загрязненную одежду. Аккуратно промойте все пораженные участки кожи водой с мылом. Медицинская помощь должна быть получена.
В случае вдыхания, вы должны оставить загрязненный участок в прохладном месте. При появлении симптомов (например, хрипы, кашель, одышка или жжение во рту, горле или в груди), обратитесь к врачу..
В случае проглатывания не следует вызывать рвоту. Если пострадавший находится в сознании и у него нет судорог, следует ввести один или два стакана воды, чтобы разбавить химическое вещество и вызвать больницу или токсикологический центр..
Если жертва находится в конвульсии или без сознания, не давайте ничего внутрь, убедитесь, что дыхательные пути жертвы открыты, и поместите жертву сбоку, опустив голову ниже тела. Необходимо немедленно обратиться к врачу.
Использование и польза для здоровья
Низкомолекулярные сложные эфиры масляной кислоты, такие как метилбутират, имеют запах и вкус, обычно приятные. Из-за этого они находят применение в качестве пищевых и парфюмерных добавок..
Бутират, конъюгированное основание масляной кислоты, может быть найдено в нескольких продуктах. Он также может быть добавлен в качестве добавки или ароматизатора в других.
Сложные эфиры масляной кислоты или бутираты используются для изготовления искусственных ароматизаторов и эссенций растительного масла. Бутиламират является основным ингредиентом абрикосового масла, а метилбутират можно найти в ананасовом масле..
Помимо использования в качестве ароматизатора, ананасовое масло также используется для стимулирования роста костей, лечения стоматологических операций и лечения простуды, ангины и острого синусита, в соответствии с производителем натуральных продуктов OCA Brazil (PULUGURTHA, 2015).
Бактерии, обнаруженные в желудочно-кишечном тракте, могут продуцировать значительные количества ферментированного бутирата, пищевых волокон и неперевариваемых углеводов. Употребление в пищу продуктов, богатых клетчаткой, таких как ячмень, овес, неочищенный рис и отруби, — это полезный способ повысить уровень бутирата.
Исследование, опубликованное в ноябрьском выпуске «Журнала питания» за ноябрь 2010 года, указывает на то, что употребление в пищу злаков в ночное время, богатых неусвояемыми углеводами, может повысить концентрацию бутирата плазмы на следующее утро..
Он добавляет, что это может быть механизм, с помощью которого цельное зерно помогает предотвратить диабет и болезни сердца.
Масляная кислота, как и бутират, образуется в толстой кишке человека как продукт ферментации волокон, и это считается фактором, объясняющим, почему диеты с высоким содержанием клетчатки защищают от рака толстой кишки..
Было рассмотрено несколько гипотез о возможном механизме этих взаимоотношений, в том числе о том, важен ли бутират для поддержания нормальной фенотипической экспрессии эпителиальных клеток или для улучшения удаления поврежденных клеток посредством апоптоза..
Другие преимущества масляной кислоты или бутирата:
- Помощь с потерей веса.
- Снимает синдром раздраженной толстой кишки (Andrzej Załęski, 2013).
- Лечение болезни Крона (Axe, S.F.).
- Борьба с инсулинорезистентностью.
- Обладает противовоспалительным действием.
ссылки
- Анджей Заленский, А. Б. (2013). Масляная кислота при синдроме раздраженного кишечника. Przegla̜d Gastroenterologiczny, 350-353. Получено с ncbi.nlm.nih.gov.
- Axe J. (S.F.). Что такое масляная кислота? 6 Преимущества масляной кислоты, о которых вы должны знать. Получено от draxe: draxe.com.
- Браун, В. Х. (2011, 2 декабря). Масляная кислота (CH3CH2CH2CO2H). Получено из Британской энциклопедии: восстановлено с сайта britannica.com.
- БУТИРОВАЯ КИСЛОТА. (2016). Получено из Cameochemicals: cameochemicals.noaa.gov.
- авторы, Н. З. (2016, 22 декабря). Масляная кислота Получено из Энциклопедии Нового Света: Получено с newworldencyclopedia.org.
- Паспорт безопасности материала Масляная кислота. (2013, 21 мая). Получено с sciencelab: sciencelab.com.
- Национальный центр биотехнологической информации. (S.F.). База данных PubChem Compound; CID = 264. Получено из PubChem: ncbi.nlm.nih.gov.
- PULUGURTHA, S. (2015, 1 июня). Какие продукты с высоким содержанием бутирата? Получено с livestrong: livestrong.com.
- Королевское химическое общество. (2015). Бутановая кислота. Получено с chemspider: chemspider.com.
- Центр метаболических инноваций. (S.F.). База данных метаболома человека, показывающая метабокарду для масляной кислоты. Получено с hmdb.ca: hmdb.ca.