- Пример недопустимых гальванических пар:
- Как защитить конструкцию или узел от контактной коррозии?
- Коррозия металлов
- Коррозия металлов. Виды коррозии металлов
- Виды химической коррозии
- Фактор Пиллинга-Бэдворса
- Виды электрохимической коррозии
- Химические покрытия
- Электрохимическая защита
- Коррозия металлов и способы защиты от нее
- Защитные покрытия
- Создание сплавов, стойких к коррозии
- Изменение состава среды
- Электрохимические методы защиты
- Коррозия металлов. Виды и особенности. Защита и принцип действия
- Виды коррозии
- Разрушение поверхностей наступает вследствие химического или электрохимического взаимодействия неблагоприятной среды. Обе разновидности являются одинаково пагубными для изделий из металла
- Химическая коррозия
- Химическая коррозия может быть двух видов:
- Электрохимическая коррозия металлов
- Процесс влияния электрохимической коррозии на металлы зависит от уровня их активности. По данному критерию их разделяют на 4 группы:
- Различают следующие виды электрохимической коррозии:
- Методы защиты от коррозии
- Покрытие изоляционными слоями:
- Коррозия металлов может быть приостановлена при наличии химического покрытия:
- Более редким решение является изменение состав окружающей среды. В таких условиях коррозия металлов замедляется или не происходит. Данный метод подразумевает очистку состава жидкости или газа от кислот и солей, вызывающих разрушение. Такой метод применим далеко не во всех случаях, поскольку отличается техническими сложностями и определенной дороговизной. Его используют в разных механизмах. К примеру, могут применять в определенных средах только те металлы, для которых те не агрессивны
- Похожие темы:

Контактная коррозия происходит при непосредственном контакте двух разнородных металлов. Нельзя, к примеру, соединять алюминиевые листы медной заклепкой, так как при определенных условиях они образуют сильную гальваническую пару.
Разные металлы имеют разные электродные потенциалы. В присутствии электролита один из них играет роль катода, а другой анода. В результате химической реакции, протекающей между ними, начнется коррозионный процесс, в котором медь (катод) будет беспощадно разрушать алюминий (анод).
Почти все пары разнородных металлов, находящиеся в контакте между собой, подвержены коррозии, так как даже влага из воздуха может выступить в роли электролита и активировать их электродный потенциал. Но одни пары уязвимы в большей степени, а другие – в меньшей.
Например, алюминий отлично контактирует с оцинкованной сталью, хромом и цинком, а латунь совершенно не «дружит» со сталью, алюминием и цинком. Чтобы узнать, какие металлы совместимы, а какие нет, обратимся к основам химии.
В ряду электрохимической активности металлы стоят в следующей последовательности:

Электрохимический ряд напряжения металлов
Для примера рассмотрим пару алюминий – медь. Алюминий стоит в ряду слева от водорода и имеет электроотрицательный потенциал равный -1.7В, а медь находится справа и имеет положительный потенциал +0.4В.
Большая разница потенциалов приводит к разрушению более активного алюминия. Медь сильнее всех, впереди стоящих элементов, поэтому в паре с любым из них она выйдет победителем.
Чем дальше друг от друга в ряду стоят элементы, тем выше их несовместимость и вероятность протекания гальванической коррозии.
Данные о совместимости некоторых металлов представлены в таблице:
| Алюминий | Латунь | Бронза | Медь | Оцинкованная сталь | Железо | Свинец | Нержавеющая сталь | Цинк | |
| Алюминий | Д | Н | Н | Н | Д | О | О | Д | Д |
| Медь | Н | О | О | Д | О | Н | О | Н | Н |
| Оцинкованная сталь | Д | О | О | О | Д | О | Д | О | Д |
| Свинец | О | О | О | О | Д | Д | Д | О | Д |
| Нержавеющая сталь | Д | Н | Н | Н | О | О | О | Д | Н |
| Цинк | Д | Н | Н | Н | Д | Н | Д | Н | Д |
Д – абсолютно допустимые контакты (низкий риск ГК); О – ограничено допустимые контакты (средний риск ГК); Н – недопустимые контакты (высокий риск ГК).
Приведенная таблица может служить кратким справочником для определения совместимости некоторых конструкционных металлов. Допустимость и недопустимость контактов разнородных в электрохимическом отношении металлов устанавливает ГОСТ 9.005-72.
Пример недопустимых гальванических пар:

Гальваническое действие может возникнуть, если строительную конструкцию из нержавеющей стали скреплять оцинкованными болтами. В этой нежелательной паре пострадает высоко анодный крепеж, поскольку его электроны будут перемещаться в направлении катодной нержавеющей стали. Поэтому, крепежные детали должны быть изготовлены из менее гальванически активного металла, чем материал металлоконструкции.

На скорость течения гальванокоррозии оказывает влияние площадь поверхности анода и катода. Если большой по размеру анод соединить с маленьким катодом, то анод будет ржаветь медленно, а если сделать наоборот, то быстро. Например, используйте болты из нержавеющей стали для крепления алюминия, но не наоборот.
Степень интенсивности протекания контактной коррозии зависит и от условий эксплуатации соединения.
В обычных атмосферных условиях процесс будет протекать менее быстро и возрастает в агрессивной электропроводной среде, например, растворах кислот и щелочей.
Присутствие в воде других веществ увеличивает проводимость электролита и скорость коррозии. Поэтому при проектировании конструкций важна оценка окружающей среды.
Как защитить конструкцию или узел от контактной коррозии?
Если по конструктивным соображениям невозможно избежать нежелательного контакта разнородных металлов, то можно попытаться уменьшить гальваническую коррозию с помощью следующих методов:
- окраска поверхностей в районе их стыка;
- нанесение совместимых металлических покрытий;
- изоляция соединения от внешней среды;
- электрическая изоляция;
- установка неметаллических прокладок, вставок, шайб в болтовых соединениях.
Практика показывает, что в тех случаях, когда пренебрегают требованиями к допустимости контактов разных металлов, приходится дорого за это расплачиваться. Неправильная компоновка контактных пар выводит из строя узлы крепления, металлоконструкции и может стоять человеческой жизни.
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2.
Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании.
Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования.
Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
- Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
- 2Fe + O2=2FeO
- 4Fe + 3O2 = 2Fe2O3
- 3Fe + 2O2 =FeO · Fe2O3
- 4Fe + 3O2 +6H2O=4Fe(OH)3
- Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
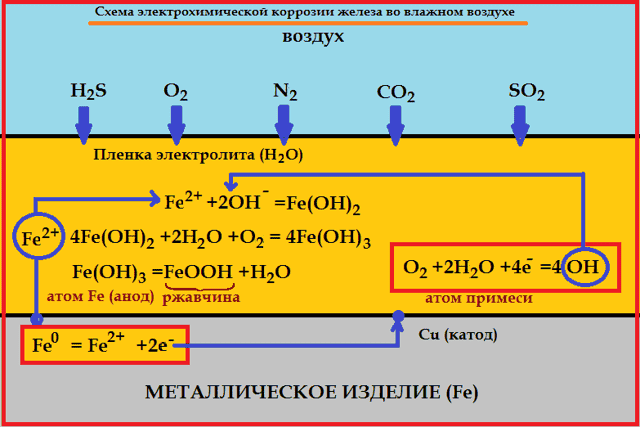
Металлы обычно содержат примеси других металлов и неметаллов.
При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии.
Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Метельский А.В. Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год Дата в источнике: 1999 год
Коррозия металлов. Виды коррозии металлов
- Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
- Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
- Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла.
Это, например, кислород, диоксид серы, сероводород, пары воды, галогены.
Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
- Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
- α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
- где Vок — объем образовавшегося оксида
- VМе — объем металла, израсходованный на образование оксида
- Мок – молярная масса образовавшегося оксида
- ρМе – плотность металла
- n – число атомов металла
- AMe — атомная масса металла
- ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
- Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
- При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
- Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
- Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
- Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
- Водородная деполяризация
- Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
- 2H++2e— = H2 разряд водородных ионов
- 2H3O++2e— = H2 + 2H2O
- Кислородная деполяризация
- Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
- O2 + 4H++4e— = H2O восстановление растворенного кислорода
- O2 + 2H2O + 4e— = 4OH—
- Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
- Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
- А: Fe – 2e— = Fe2+
- K: O2 + 4H+ + 4e— = 2H2O
- Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием.
Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
- В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
- оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.
);
- фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
- азотирование – поверхность металла (стали) насыщают азотом;
- воронение стали – поверхность металла взаимодействует с органическими веществами;
- цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
- 3Fe + 2O2 = Fe3O4
- При химической коррозии также возможны процессы:
- Fe + 2HCl → FeCl2 + H2
- 2Fe + 3Cl2 → 2FeCl3
- Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
- Fe –2e = Fe 2+
- На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
- 2H+ + 2e → H2
- O2 + 2H2O + 4e → 4OH–
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
- Анод: Fe –2e → Fe 2+
- Катод: 2H+ + 2e → H2
- Суммарная реакция: Fe + 2H+ → H2 + Fe2+
- Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
- Анод: Fe –2e → Fe 2+
- Катод: O2 + 2H2O + 4e → 4OH–
- Суммарная реакция:
- Fe 2+ + 2OH – → Fe(OH)2
- 4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
- При этом образуется ржавчина.
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Коррозия металлов. Виды и особенности. Защита и принцип действия
Коррозия металлов – это процесс разрушения металлической поверхности в результате неблагоприятного воздействия окружающей среды. Ее причиной является термодинамическая неустойчивость материала к влиянию различных веществ, которые с ним контактируют.
Виды коррозии
Разрушение поверхностей наступает вследствие химического или электрохимического взаимодействия неблагоприятной среды. Обе разновидности являются одинаково пагубными для изделий из металла
Химическая коррозия
Данный процесс осуществляется в среде, которая не производит передачу электрического тока. Он наблюдается, например, при нагреве, в результате чего осуществляется образование химических соединений, таких как сульфиды, а также различные виды пленок.
Нередко образованные сплошные пленки становятся непроницаемыми и консервируют поверхность, поэтому последующая коррозия металлов останавливается. Такой защитный слой можно встретить на поверхности из алюминия, хрома, никеля и свинца.
Пленка на стали или чугуне является непрочной, поэтому ее наличие не останавливает дальнейшее продвижение разрушения вглубь материала.
Химическая коррозия может быть двух видов:
Газовая возникает в результате действия агрессивной газовой среды или пара на поверхность металла, что сопровождается повышенными температурами. Благодаря горячей среде на поверхности отсутствует конденсат.
В качестве газа может применяться кислород, диоксид серы, водяной пар, сероводород и так далее.
Подобное коррозийное влияние может вызывать абсолютное разрушение активного металла, за исключением случаев, когда образуется защитная непроницаемая пленка.
Жидкостная коррозия металлов возникает в жидкостных средах, которые не способны передавать электричество. В первую очередь она наблюдается при контакте металлов с сырой нефтью, нефтепродуктами или смазочными маслами. При наличии в таких веществах небольшой доли воды, коррозия переходит в электрохимическую.
В обоих вариантах химической коррозии скорость разрушения является пропорциональной химической реакции, с которой окислитель проникает сквозь созданную оксидную пленку на поверхности.
Электрохимическая коррозия металлов
Эта разновидность разрушения поверхности металла происходит в среде, которая может передавать электрический ток. В результате данного процесса наблюдается изменение состава металла. Атомы удаляются от кристаллической решетки в результате анодного или катодного воздействия.
При анодном влиянии ионы металла переходят в раствор жидкости, которая его окружает. При катодном влиянии получаемые при анодном процессе электроны связываются с окислителем. Наиболее распространенной является электрохимическая коррозия под воздействием водорода или кислорода.
Процесс влияния электрохимической коррозии на металлы зависит от уровня их активности. По данному критерию их разделяют на 4 группы:
- Активные.
- Средней активности.
- Малоактивные.
- Благородные.
Активные имеют высокую нестабильность. Для них характерно возникновение коррозии даже в нейтральной водной среде, которая лишена растворенного кислорода или окислителей. Ярким представителем такого металла является кадмий.
Металлы средней активности располагаются на таблице химических элементов между кадмием и водородом. Они неподвержены началу разрушения в нейтральной жидкостной среде лишенной кислорода, но начинают интенсивно поддаваться коррозии при влиянии кислот.
Малоактивные металлы располагаются в таблице Менделеева между водородом и родием. Они не подвергаются влиянию коррозии при контакте с нейтральными жидкостями и кислой средой. Для активизации процесса их разрушения необходимо наличие кислорода или прочих окислителей.
Благородные металлы отличаются стабильностью, благодаря чему подвержены коррозии только при воздействии кислой среды при условии контакта с сильными окислителями. К перечню благородных металлов относится платина, золото, палладий и иридий.
Электрохимическая коррозия металлов является самой распространенной, поскольку естественные условия, в которых хранятся и эксплуатируются металлические изделия, зачастую подвержены влиянию влажной среды.
Различают следующие виды электрохимической коррозии:
- Электролитная – наблюдается при контакте с растворами солей, кислотами, оснований, в том числе и обычной водой.
- Атмосферная – наблюдается в условиях атмосферы, где содержатся испарения воды. Данный вид является самым распространенным, именно он влияет на практически все металлические изделия.
- Почвенная – наблюдается в результате воздействия влажной почвы, в составе которой могут содержаться различные химические элементы ускоряющие процесс разрушения металла. При воздействии с кислыми почвами процесс коррозии наблюдается наиболее агрессивно. Грунты с песком воздействуют медленней всего.
- Аэрационная – является более редкой и наблюдается в тех случаях, если к разным поверхностям металла оказывается неравномерный доступ воздуха. В результате неоднородного воздействия линии переходов между такими участками начинают разрушаться.
- Морская коррозия металлов подразумевает разрушение от влияния морской воды. Она выделяется в отдельную группу, поскольку данная жидкость отличается высоким содержанием солей и растворенных органических веществ. Это делает ее более агрессивной.
- Биокоррозия – данный вид разрушения возникает при условии воздействия на поверхность металла бактериями, которые в результате жизнедеятельности вырабатывают углекислый газ и прочие вещества.
- Электрокоррозия – такой вид разрушения металла наблюдается при воздействии на него блуждающих токов, что характерно для подземных сооружений, в частности рельсов метрополитена, стержней заземления, трамвайных линий и т.д.
Методы защиты от коррозии
Голая поверхность подавляющего большинства металлов склонна к быстрой коррозии, поэтому для снижения разрушающего воздействия применяются различные способы защиты.
Покрытие изоляционными слоями:
- Другим металлом.
- Цементным раствором.
- Лаками.
- Красками.
- Битумом.
Одним из самых эффективных способов защиты от коррозии является покрытие поверхности одного металла другим, менее склонным к коррозии. Примером такого технического решения является оцинковка, когда сталь защищается слоем цинка.
Внутренний металл полностью изолирован до тех пор, пока цинк в результате естественной коррозии, которая протекает очень медленно, полностью не разрушится, оголив сталь. Такой метод защиты является одним из самых эффективных, поскольку покрывной металл полотна удерживается на основании, поэтому его невозможно срывать слоями.
Недостаток метода заключается в том, что при механическом воздействии можно сцарапывать тонкую защитную пленку.
Покрытие металла защитным цементным раствором, битумом, лаками и красками является также очень распространенным решением, которое все же уступает оцинковке. Это связано с неоднородностью составов основания и покрытия. В результате низкой адгезии краски готовое покрытие будет отслаиваться. Такая защита может покрываться трещинами, обеспечивая доступ влаги.
Коррозия металлов может быть приостановлена при наличии химического покрытия:
- Оксидирование.
- Фосфатирование.
- Азотирование.
- Воронение.
- Цементация.
Поверхность металла подвергается влиянию различных веществ, фосфатов, азота или оксидов, в результате чего создаются пленки, которые благодаря своей непроницаемости предотвращают разрушение. Такие методы применимы в первую очередь для сталей.
Также распространенным решением является воронение стали, когда поверхность металла взаимодействует с органическими веществами. Обработанные таким способом поверхности приобретают темный цвет, напоминающий крыло ворона, за что данный метод и получил свое название.
Одним из наиболее эффективных вариантов химического покрытия является цементация, когда на поверхность воздействуют углеродом, в результате чего создается корка вступившего в реакцию металла.
Для защиты от коррозии черных металлов может применяться технология изменения их состава. Добавление различных соединений позволяет получить сплавы, отличающиеся большей устойчивостью к коррозии. Примером такого соединения является нержавеющая сталь.
Самым необычным является протекторная защита, которая подразумевает покрытие сооружений из одного металла пластинами из более активного металла, так называемого протектора. Поскольку он имеет более отрицательный потенциал, то выступает в роли анода.
Защищаемая поверхность используется как катод. Они соединяются между собой проводником тока, благодаря чему создаются неблагоприятные условия для протектора. Как следствие разрушению поддается именно он, в то время как ценное сооружение остается целым.






