- Оксиды серы. Общая характеристика, химические свойства
- Вопросы к параграфу 18 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)
- 2. Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества: Li2S, ZnS, SO2, SF6. Поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях
- 3. При образовании из простых веществ 1 моль оксида cepы (IV) выделяется теплота в количестве 332,8 кДж. Сколько выделится теплоты при сгорании 1 г серы?
- Тестовые задания
- 1. Установите соответствие между приведённой схемой химической реакции и примером, иллюстрирующим её
- A. 2H2S + 3O2 = 2SO2 + 2Н2O
- Б. Н2 + S = H2S
- B. 2SO2 + О2 = 2SO3
- Г. S + O2 = SO2
- Д. 2H2S + SO2 = 3S + 2Н2O
- 2. Бинарные соединения серы с металлами называют
- 1) сульфатами
- 2) сульфитами
- 3) сульфидами
- 4) сернистыми металлами
- SO2 | это… Что такое SO2?
- Получение
- Химические свойства
- Применение
- Физиологическое действие
- Дополнительные сведения о токсичности
- Оксид серы (IV) SO2, сернистый газ
- Химические свойства сернистого газа
- Получение и применение сернистого газа
- Свойства сернистой кислоты и её взаимодействие с другими веществами
- Химические и физические свойства
- Качественная реакция на сернистую кислоту
- Способы получения и как применяется
- Оксид серы(VI), серная кислота, сульфаты — урок. Химия, 9 класс
- Репетитор по Химии
- Конспекты
На этой странице Вы можете найти конспект на тему «Производство
серной кислоты» и оценить уровень подготовленного материала.
Я надеюсь, что Вы, обращаясь ко мне за помощью, уже не будете покупать кота в мешке. Вы будете знать, что Вашего ребенка или Вас учит знающий свое дело специалист — репетитор по химии.
Более подробную информацию обо мне Вы сможете прочитать здесь.
С уважением, доктор биологических наук,ведущий научный сотрудник НИИ акушерства и гинекологии им. Д.О.Оттарепетитор по химии и биологии
Соколов Дмитрий Игоревич
- Производство
серной кислоты. - Серную кислоту в промышленности производят двумя
способами: контактным и нитрозным. - Контактный
способ производства серной кислоты. - Серную кислоту
контактным способом производят в больших количествах на сернокислотных заводах. - I. Сырьё, используемое для
производства серной кислоты:
| 1. | Самородная сера S |
| 2. | Пирит (серный колчедан) FeS2 |
| 3. | Сероводород H2S |
| 4. | Сульфиды цветных металлов ZnS, Cu2S |
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2.
1) Измельчение пирита. Перед использованием большие
куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении
вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности
соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его
очищают от примесей (пустой породы и земли) методом флотации. Для этого
измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая
порода всплывает наверх, затем пустую породу удаляют.
III. Химизм производства.
Производство серной кислоты
из пирита состоит из трёх стадий.
- ПЕРВАЯ СТАДИЯ
— обжиг пирита в печи для обжига в «кипящем слое». - Уравнение реакции первой
стадии - t = 800°C
- 4FeS2
+ 11O2 2Fe2O3 +
8SO2 + Q
Измельчённый очищенный влажный (после флотации)
пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу
(принцип противотока) пропускают воздух, обогащённый кислородом, для более
полного обжига пирита.
Температура в печи для обжига
достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном
состоянии» из-за продуваемого снизу воздуха. Похоже это всё на
кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции
поддерживается температура в печи. Избыточное количество теплоты отводят: по
периметру печи проходят трубы с водой, которая нагревается. Горячую воду
используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3
(огарок) в производстве серной кислоты не используют. Но его собирают и
отправляют на металлургический комбинат, на котором из оксида железа получают
металл железо и его сплавы с углеродом — сталь (2% углерода С
в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется
принцип химического производства — безотходность производства.
Из печи выходит печной газ, состав которого: SO2,
O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка
(оксида железа). Такой печной газ необходимо очистить от примесей твёрдых
частиц огарка и паров воды.
Очистка печного газа от
твёрдых частичек огарка проводят в два этапа — в циклоне (используется
центробежная сила, твёрдые частички огарка ударяются о стенки циклона и
ссыпаются вниз) и в электрофильтрах (используется электростатическое
притяжение, частицы огарка прилипают к наэлектризованным пластинам
электрофильтра, при достаточном накоплении под собственной тяжестью они
ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа)
используют серную концентрированную кислоту, которая является очень хорошим осушителем,
поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне —
снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная
серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек
огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы
SO2 и кислорода О2.
- ВТОРАЯ СТАДИЯ
— окисление SO2 в SO3 кислородом. - Протекает в контактном
аппарате. - Уравнение реакции этой
стадии: 2SO2 + O2 2SO3
+ Q
Сложность второй стадии заключается в том, что
процесс окисления одного оксида в другой является обратимым. Поэтому необходимо
выбрать оптимальные условия протекания прямой реакции (получения SO3).
а) температура:
Прямая реакция является экзотермической +Q, согласно
правилам по смещению химического равновесия, для того, чтобы сместить
равновесие реакции в сторону экзотермической реакции, температуру в системе
необходимо понижать. Но, с другой стороны, при низких температурах, скорость
реакции существенно падает.
Экспериментальным путём химики-технологи
установили, что оптимальной температурой для протекания прямой реакции с
максимальным образованием SO3 является температура 400-500°С. Это
достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой
температуре в реакцию вводят катализатор.
Экспериментальным путём установили,
что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
б) давление:
Прямая реакция протекает с уменьшением объёмов
газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3.
Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам
смещения химического равновесия давление в системе нужно повышать. Поэтому этот
процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2
попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С.
Нагрев смеси начинается в теплообменнике, который установлен перед контактным
аппаратом.
Смесь проходит между трубками теплообменника и нагревается от этих
трубок. Внутри трубок проходит горячий SO3
из контактного аппарата.
Попадая в контактный аппарат смесь SO2 и О2 продолжает нагреваться до нужной температуры,
проходя между трубками в контактном аппарате.
Температура 400-500°С в
контактном аппарате поддерживается за счёт выделения теплоты в реакции
превращения SO2 в SO3. Как только смесь оксида серы и
кислорода достигнет слоёв катализатора, начинается процесс окисления SO2
в SO3.
- Образовавшийся оксид серы SO3 выходит из
контактного аппарата и через теплообменник попадает в поглотительную башню. - ТРЕТЬЯ СТАДИЯ
— поглощение SO3 серной кислотой. - Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают
водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O
H2SO4.
Но дело в том, что если для поглощения оксида серы использовать воду,
образуется серная кислота в виде тумана, состоящего из мельчайших капелек
серной кислоты (оксид серы растворяется в воде с выделением большого количества
теплоты, серная кислота настолько разогревается, что закипает и превращается в
пар).
Для того, чтобы не образовывалось
сернокислотного тумана, используют 98%-ную концентрированную серную кислоту.
Два процента воды — это так мало, что нагревание жидкости будет слабым и
неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум:
H2SO4·nSO3.
Уравнение реакции этого процесса nSO3 + H2SO4
H2SO4·nSO3
Образовавшийся олеум сливают в металлические
резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют
железнодорожные составы и отправляют потребителю.
Нитрозный
способ производства серной кислоты.
Технологическая схема производства серной кислоты
контактным путём хорошо известна из школьных учебников. В нашей стране
используется и другой, так называемый нитрозный, способ её получения.
На первой стадии, одинаковой для обоих методов,
получают сернистый ангидрид SO2.
Исходным сырьём может
быть, в принципе, любое вещество, содержащее серу: природные сульфиды железа
(прежде всего, пирит FeS2), а также сульфиды меди и
никеля, сульфидные полиметаллические руды, гипс CaSO4.2H2O и
элементарные сера.
Всё больше и больше используют газы, которые выделяются при
переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения
серы.
Полученный SO2 окисляют до H2SO4, используется для этого в
нитрозном методе используется окислы азота. С этой стадии оба метода отличаются
друг от друга.
- В специальной окислительной башне 3 смешивают окись
азота NO и NO2 с воздухом в таком соотношении, чтобы половина имеющихся NO и NO2. - 2NO + O2 ® 2NO2
- В результате газовая смесь содержит равные NO и NO2. Она подаётся в башни 4 и
5, орошаемые 75% — ной серной кислотой; здесь смесь окислов азота поглощается с
образованием нитрозиллерной кислоты: - NO +
NO2 + 2H2SO4 ®2NO(HSO4) + H2O - Раствор нитрозиллерной
кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда
противотоком поступает SO2 и добавляется вода. В
результате гидролиза нитрозиллерной кислоты
образуется азотная кислота: - NO(HSO4) + H2O®H2SO4 + HNO2
- Она — то и окисляет SO2 по уравнению:
- SO2 + 2HNO2®H2SO4 + 2NO
В нижней части башен 1 и 2 накапливается 75%-ная
серная кислота, естественно, в большем количестве, чем её было затрачено на
приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись
азота NO возвращается снова на окисление. Поскольку некоторое количество её
меряется с выхлопными газами, приходится добавлять в систему HNO3, служащую источником
окислов азота.
Недостаток башенного метода состоит в том, что
полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации
плохо идёт гидролиз нитрозиллерной кислоты).
Концентрирование же серной кислоты упариванием представляет дополнительную
трудность.
Преимущество этого метода в том, что примеси содержащиеся в SO2, не влияют на ход процесса,
так что исходный SO2 достаточно очистить от пыли, т.е. механических
загрязнений.
Естественно, башенная серная кислота бывает недостаточно чистой,
что ограничивает её применение.
Охрана окружающей среды,
связанная с производством серной
кислоты.
Основным сырьем для производства серной кислоты,
является сера. Она относится к числу наиболее распространенных числу химических
элементов на нашей планете.
Производство серной кислоты происходит
в три стадии на первой стадии получают SO2, путем обжига FeS2, затем SO3, после чего на третьей
стадии получают серную кислоту.
Научно-техническая революция и связанный с ней
интенсивный рост химического производства, вызывает существенные негативные
изменения в окружающей среде. Например отравление
пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В
результате мир оказался в тисках экологического кризиса.
Вредные выбросы
сернокислых заводов следует оценивать не только по действию содержащегося в них
оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие
факторы — увеличение количества случаев респираторных заболеваний человека и
животных, гибель растительности и подавление ее роста, разрушение конструкций
из известняка и мрамора, повышение коррозионного износа металлов. По вине
“кислых” дождей повреждены памятники архитектуры (Тадж-Макал).
В зоне до 300 км от источника загрязнения (SO2) опасность представляет
серная кислота, в зоне до 600 км. — сульфаты.
Серная кислота и сульфаты замедляют рост с/х культур.
Закисление
водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб.
Помимо экологического ущерба налицо экономический ущерб — громадные суммы
каждый год теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее
распространенных газообразных загрязняющих воздух веществ. Известно более 60
методов.
Наиболее перспективны методы, основанные на поглощение оксида серы
известняком, раствором сульфита — гидросульфита аммония и щелочным раствором
алюмината натрия.
Интерес также представляют каталитические методы окисления
оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от
фторсодержащих примесей, которые даже в незначительной концентрации вредно
влияют на растительность. Если в газах содержится фтороводород
и фтор, то их пропускают через колоны с насадкой
противотоком по отношению к 5-10% раствору гидроксида
натрия. В течении одной минуты протекают следующие
реакции:
- F2+2NaOH-> O2+H2O+2NaF
- HF+NaOH->NaF+H2O;
- Образующийся фторид натрия обрабатывают
для регенерации гидроксида натрия: - 2NaF+CaO+H2O->CaF2+2NaOH
Оксиды серы. Общая характеристика, химические свойства
Задания по подготовке к ЕГЭ по химии 17 апреля 2020 г., 11:15 
- Большинство школьников знают два оксида серы — SO2 и SO3.
- Однако, это не все соединения, которые сера образует с кислородом.
- Рассмотрим их все.
- Монооксид серы — SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2, то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио — спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла — Боппа (или «Большая комета 1997 года»);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы — SO2
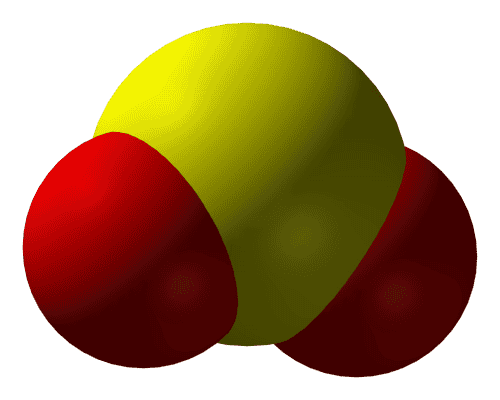
- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на планете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина — служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газ является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид — SO3
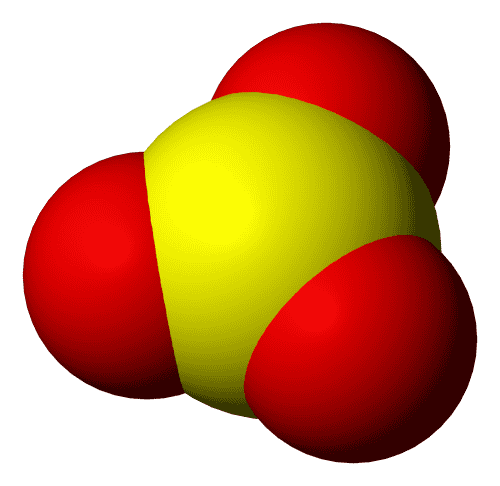
- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2ONa2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен — теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы — SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 — озон.
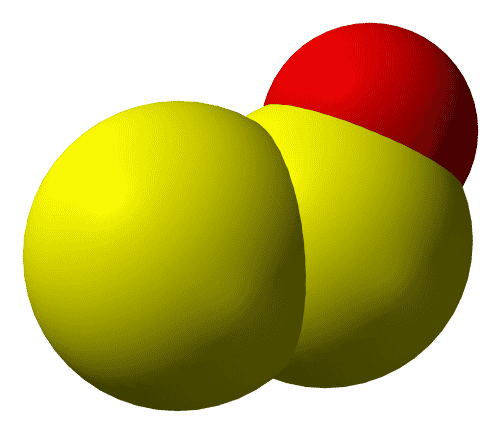
Монооксид дисеры, субоксид серы — S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы — сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
| Реагент |
|
|
| Получение |
|
|
| + O2 | 2SO2 + O2 = 2SO3 + Q | ≠ |
| + H2O | SO2 + H2O = H2SO3 | SO3 + H2O = H2SO4 |
| + H2O2 | SO2 + H2O2 = H2SO4 | ≠ |
| + Основные оксиды | SO2 + CaO = CaSO3 SO2 + Na2O = Na2SO3 | SO3 + Na2O = Na2SO4 SO3 + CaO = CaSO4 |
| + Кислотные оксиды | SO2 + CO = S + 2CO2 (Al2O3, 500 C) SO2 + NO2 = SO3 + NO (нитрозный способ получения серной кислоты) | ≠ |
| + Амфотерные оксиды | SO2 + Al2O3, BeO, ZnO ≠ | SO3 + Fe2O3 = Fe2(SO4)3 |
| + Основания |
|
SO3 + 2NaOH (разб.) = Na2SO4 + H2O SO3 + Ca(OH)2 = CaSO4 + H2O |
| + Кислоты |
|
|
| + Соли |
|
|
| + Комплексные соли | 3SO2 + Na3[Al(OH)6] (P) = Al(OH)3 + 3NaHSO3 | ≠ |
| + Неметалл |
|
2SO3 + C = 2SO2 + CO2 10SO3 + P4 = P4O10 + 10SO2 |
| + Металл | SO2 + Me + H2O = MeSO3 + H2 (активные Ме) SO2 + Me = MeS2O4 (Me = Zn, Co; в смеси этанола иводы) | SO3 + Mg = MgO + SO2 |
| ОВР |
|
|
pangenes.ru © 2022

Вопросы к параграфу 18 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман (решебник)

Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Издательство: Просвещение
Тип: Учебник
- С углеродом, водородом и металлами сера проявляет окислительные свойства:
- Сера проявляет восстановительные свойства с более электроотрицательными элементами:
2. Составьте уравнения реакций, при которых из простых веществ образуются сложные вещества: Li2S, ZnS, SO2, SF6. Поясните, какие свойства (окислительные или восстановительные) проявляет сера в этих реакциях
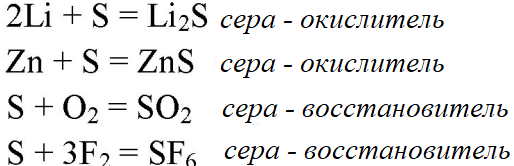
3. При образовании из простых веществ 1 моль оксида cepы (IV) выделяется теплота в количестве 332,8 кДж. Сколько выделится теплоты при сгорании 1 г серы?
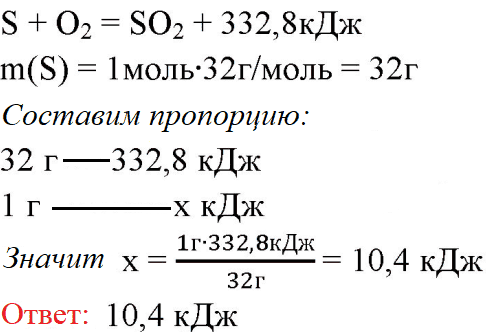
Тестовые задания
1. Установите соответствие между приведённой схемой химической реакции и примером, иллюстрирующим её
A. 2H2S + 3O2 = 2SO2 + 2Н2O
Б. Н2 + S = H2S
B. 2SO2 + О2 = 2SO3
Г. S + O2 = SO2
Д. 2H2S + SO2 = 3S + 2Н2O
- 1. Б
- 2. В
- 3. Г
2. Бинарные соединения серы с металлами называют
1) сульфатами
2) сульфитами
3) сульфидами
4) сернистыми металлами
3) сульфидами
Вам также может понравиться
SO2 | это… Что такое SO2?
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички).
Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой сернистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте.
SO2 — один из основных компонентов вулканических газов.
Получение
- Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑ + Q.
- В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты:
- Na2SO3 + H2SO4 → Na2SO4 + H2SO3.
- Образующаяся сернистая кислота сразу разлагается на SO2 и H2O:
- Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑.
- Также можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
2H2SO4 (конц.) + Cu → CuSO4 + SO2↑ + 2H2O.
Химические свойства
Спектр поглощения SO2 в ультрафиолетовом диапазоне
- Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
- SO2 + H2O ↔ H2SO3.
- Со щелочами образует сульфиты:
- SO2 + 2NaOH → Na2SO3 + H2O.
- Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
- SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
- 2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°),
- 5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
- Последняя реакция является качественной реакцией на сульфит-ион SO32- и на SO2 (обесцвечивание фиолетового раствора).
- В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
- SO2 + 2CO → 2CO2 + S↓.
- Или для получения фосфорноватистой кислоты:
- PH3 + SO2 → H(PH2O2) + S↓
Применение
В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Физиологическое действие
SO2 токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, першение в горле. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
- ПДК максимально-разового воздействия — 0,5 мг/м3
Дополнительные сведения о токсичности
Интересно, что чувствительность по отношению к SO2 весьма различна как у людей, так и у растений. Наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — сосна и ель. Наиболее чувствительными к SO2 являются розы. При попадании на них сернистого газа они моментально белеют.
Wikimedia Foundation. 2010.
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
SO2+NaOH = NaHSO3 — гидросульфит натрия SO2+2NaOH = Na2SO3+H2O — сульфит натрия - реакции сернистого газа с основными оксидами:
SO2+CaO = CaSO3
SO2+K2O = K2SO3 - с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
H2O+SO2 ↔ H2SO3
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
H2SO3 ↔ H++HSO3-
HSO3- ↔ H++SO32-
- пример реакции сернистой кислоты в качестве восстановителя:
2H2SO3+O2 = 2H2SO4 - пример реакции сернистой кислоты в качестве окислителя:
H2SO3+2H2S = 3S+3H2O
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
S+4O2+2H2S-2 = 3S0↓+2H2O - в реакции с кислородом при нагревании сернистый газ является восстановителем:
2S+4O2+O20 = 2S+6O3-2
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
S+O2 = SO2
4Fe+2S2-1+11O20 = 2Fe2+3O3-2+8S+4O2
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
2HCl+Na2SO3 = 2NaCl+SO2↑+H2O
Cu+2H2SO4(конц.) = CuSO4+SO2↑+2H2O
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Свойства сернистой кислоты и её взаимодействие с другими веществами
Формула
Формула серной кислоты в химии —H2SO4. Степень окисления серы: +6. Данные характеристики отличают соединение от сернистой кислоты. Серная кислота может существовать в виде разбавленных и концентрированных растворов.
Сернистую кислоту лишь называют кислотой, так как вещество может существовать в только в разбавленном водном растворе, в чистом виде не выделяется. В процессе концентрации определенное количество кислоты, которое превышает максимальную концентрацию, распадается.
В результате происходит образование воды и сернистого ангидрида SO2. По этой причине водный раствор сернистой кислоты всегда обладает запахом сернистого ангидрида, то есть сгоревшей головки спички. Серная кислота не имеет запаха.
Концентрированная серная кислота практически в два раза тяжелее, чем сернистая.
Химические и физические свойства
Сернистый ангидрид SO2 представляет собой бесцветный газ и обладает резким запахом.
Свойства 1Свойства 2Свойства 3Свойства 4Свойства 5Свойства 6
Качественная реакция на сернистую кислоту
Способы получения и как применяется
Сернистую кислоту синтезируют с помощью растворения сернистого газа (SO2) в воде (H2O). Процесс можно наблюдать опытным путем. Необходимо взять концентрированную серную кислоту (H2SO4), медь (Cu) и пробирку. Алгоритм действий таков:
- аккуратно добавить в пробирку концентрированную серную кислоту;
- поместить в пробирку, содержащую кислоту, кусочек меди;
- смесь требуется нагреть.
Далее можно наблюдать реакцию, протекающую по уравнению:
Cu(медь)+2H2SO4(сернаякислота)=CuSO4(сульфатсеры)+SO2(сернистыйгаз)+H2O(вода)
Затем поток сернистого газа следует направить в пробирку с водой. При нахождении в ней газообразное вещество растворяется, частично протекает химическая реакция с водой. В итоге синтезируется сернистая кислота:
SO2(сернистыйгаз)+H2O(вода)=H2SO3
Таким образом с помощью пропускания сернистого газа через воду получают сернистую кислоту.
Сернистая кислота нашла применение в качестве восстановителя. Вещество используют для беления шерсти, шелка и других материалов, которые не способны выдержать отбеливание сильными окислителями в виде хлора. Сернистую кислоту используют в процессе консервирования плодов и овощей, а также для:
- обесцвечивания натуральных тканей, древесной массы, бумаги;
- консервации, антисептической обработки — к примеру, для защиты от ферментации зерна в производстве крахмала, предотвращения процесса брожения в бочках вина;
- переработки древесной щепы в сульфитную беленую целлюлозу, необходимую для изготовления бумаги.
Оксид серы(VI), серная кислота, сульфаты — урок. Химия, 9 класс
- Оксид серы(VI)
- Oксид серы((VI)) образуется при каталитическом окислении сернистого газа:
- 2SO2+O2⇄t,k2SO3.
- При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
- SO3+H2O=H2SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
- Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
- Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
- SO3+2NaOH=Na2SO4+H2O,
- SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота H2SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Рис. (1). Смешивание серной кислоты с водой
- Серная кислота очень гигроскопична и используется для осушки разных веществ.
- Химические свойства серной кислоты зависят от её концентрации.
- Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
H2SO4+CuO=CuSO4+H2O,
H2SO4+Zn(OH)2=ZnSO4+2H2O;
- с солями, если образуется газ или нерастворимое вещество:
H2SO4+CaCO3=CaSO4+H2O+CO2↑,
H2SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
H2+1SO4+Zn0=Zn+2SO4+H2↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2H2S+6O4+Cu0=Cu+2SO4+S+4O2+2H2O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
H2SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Рис. (2). Обугливание сахара концентрированной серной кислотой
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
- Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
- Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
- Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5H2O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2H2O применяется в строительстве, сульфат бария BaSO4 — в медицине.
Источники:
Рис. 1. Смешивание серной кислоты с водой © ЯКласс
Рис. 2. Обугливание сахара концентрированной серной кислотой © ЯКласс






