Щелочные металлы
Сегодня мы поговорим о строении и свойствах атомов элементов I A группы, о физических и химических свойствах щелочных металлов, об основных соединениях щелочных металлов, истории открытия некоторых щелочных металлов и ещё много чего интересного.
Как вы помните, к щелочным металлам относятся элементы I A группы. Это литий, натрий, калий, рубидий, цэзий, франций. Франций является редким радиоактивным элементом.
Теперь рассмотрим строение и свойства атомов элементов I A группы.
Посмотрев в Периодическую таблицу, мы видим, что на внешнем энергетическом уроне у этих атомов один электрон, потому что все они расположены в I A группе, этот внешний электрон находится далеко от ядра, поэтому он легко отрывается и атом превращается в ион. Для всех элементов этой группы характерна только степень окисления +1.
Все щелочные металлы являются восстановителями из-за способности отдавать электроны. Причём восстановительные свойства сверху вниз в группе увеличиваются, так как увеличиваются радиусы атомов, металлические свойства также усиливаются сверху вниз. Элементы I A группы – типичные металлы.
Строение мы разобрали, а теперь поговорим о физических свойствах щелочных металлов.
Как вы уже знаете, это серебристо-белые мягкие металлы. Наиболее твёрдым является литий, но он также как и все щелочные металлы легко режется ножом.
Посмотрите таблицу, здесь указана температура плавления, температура кипения и плотность щелочных металлов.
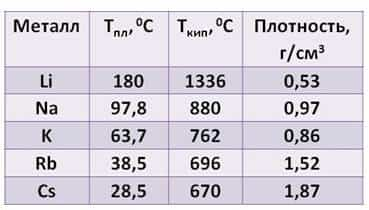
- Из таблицы видно:
- · плотность их увеличивается от лития к цезию
- · температура плавления, в отличие от плотности, уменьшается от лития к цезию
- · температура кипения тоже уменьшается от лития к цезию.
Все щелочные металлы лёгкие. Например, плотность лития примерно в два раза ниже плотности воды. А температура плавления цезия меньше температуры человеческого тела.
С физическими свойствами мы разобрались, теперь можем перейти и к химическим свойствам.
Элементы I A группы обладают очень высокой химической активностью. В лабораториях эти металлы хранят под слоем керосина, с которым они не взаимодействуют.
В реакции с кислородом оксид образует только литий, при этом образуется оксид лития, степень окисления лития +1, а кислорода -2. А натрий в реакции с кислородом образует пероксид натрия, в этом соединении, в отличие от оксида, степень окисления кислорода -1, а натрия степень окисления +1.
В реакцию с азотом при обычной температуре вступает только литий, при этом образуется нитрид лития, в этих бинарных соединениях степень окисления азота -3, а лития +1. Остальные щелочные металлы реагируют с азотом тольлко при нагревании.
В реакции с водородом щелочные металлы образуют гидриды. Так в реакции водорода с натрием образуется гидрид натрия. Степень окисления натрия +1, а водорода -1.
С галогенами щелочные металлы образуют галогениды. Так в реакции калия с бромом образуется бромид калия, где степень окисления калия +1, брома -1, в реакции натрия с хлором образуется хлорид натрия, где степень окисления натрия +1, а хлора -1.

С серой эти щелочные металлы образуют сульфиды. Например в реакции лития с серой образуется сульфид лития, где степень окисления лития +1, а серы -2.
- Как вы помните, все щелочные металлы активно реагируют с водой с образованием щелочей, при этом вода восстанавливается до водорода.
- Например, в результате взаимодействия натрия с водой образуется газ водород, который можно собрать методом вытеснения воздуха.
- Так в реакии натрия с водой образуется щёлочь – гидроксид натрия и выделяется водород.
- Причём скорость взаимодействия металла с водой будет увеличиваться от лития к цэзию, ведь металлические и восстановительные свойства также усиливаются.
Все щелочные металлы легко растворяются в растворах кислот с образованием соответствующих солей и водорода. Однако эти реакции проводят редко из-за того, что идут побочные реакции с водой. Например, в реакции калия с соляной кислотой образуется соль – хлорид калия и газ водород, в реакции натрия с серной кислотой образуется соль – сульфат натрия и газ водород.
Сами щелочные металлы получают путём электролиза расплавленных хлоридов или гидроксидов. Например, твёрдый хлорид натрия под действием электрического тока разлагается на металл натрий и газ – хлор.
- Вы убедились, что щелочные металлы обладают высокой химической активностью, поэтому в свободном виде они не встречаются, а только в виде соединений.
- Познакомимся с некоторыми из них.
Оксиды щелочных металлов – твёрдые вещества, обладают ярко выраженными основными свойствами, они реагируют с водой, кислотами и кислотными оксидами.
Так, в реакции оксида лития с водой образуется гидроксид лития, в реакции оксида натрия с серной кислотой образуется соль – сульфат натрия и вода, в результате взаимодействия оксида калия с оксидом углерода четыре, образуется соль – карбонат калия.
Оксиды натрия и калия получают, прокаливая пероксиды с соответствующими металлами. Это окислительно-восстановительная реакция, при которой кислород меняет свою степень окисления с минус -1 до -2, а натрий повышает свою степень окисления с 0 до +1.
Гидроксиды элементов I A группы – твёрдые белые вещества, хорошо растворимые в воде с образованием щелочей, очень гигроскопичны, поэтому расплываются на воздухе.
Растворы щелочей мыльные на ощупь. При растворении их в воде выделяется большое количество теплоты.
Гидроксиды щелочных металлов – сильные основания, они реагируют с кислотами, кислотными оксидами, солями, амфотэрными оксидами и гидроксидами.
Например, в рекции гидроксида калия с серной кислотой, образуетсся соль – сульфат калия и вода. В реакции гидроксида натрия с кислотным оксидом серы (VI) – образуется соль – сульфит натрия и вода.
В результате взаимодействия гидроксида натрия с солью сульфатом меди (II) , образуется соль – сульфат натрия и нерастворимое основание гидроксид меди (II). В реакции гидроксида калия с амфотэрным оксидом цинка, образуется соль – цинкат калия и вода.
В результате взаимодействия гидроксида калия с амфотэрным гидроксидом цинка в водной среде , образуется комплексная соль – тэтрагидроксоцинкат натрия.
Естественно, что гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов с водой или их оксидов с водой. При зиимодействии натрия с водой образуется гидроксид натрия и водород, в результате реакции оксида натрия с водой также образуется гидроксид натрия.
Рассморим свойства и применения соединений щелочных металлов.
Например, гидроксид натрия – NaOH – в технике известен как едкий натр, каустическая сода, а также каустик, а вот гидроксид калия – KOH называют в технике едкое кали. Оба этих гидроксида разъедают ткани и бумагу, поэтому их называют едкими щелочами.
Едкий натр применяют для очистки нефтепродуктов, в бумажной и текстильной промышленности, производства мыла и волокон, а едкое кали – для производства жидкого мыла.
Соли щелочных металлов – твёрдые кристаллические вещества с ионным типом кристаллической решётки. В прошлом из-за соли нередко вспыхивали войны и народные волнения (соляные бунты), а в некоторых странах куски соли служили разменной монетой.
- Рассмотрим наиболее значимые соли.
- Кристаллическую соду – Na2CO3 ∙ 10 H2O – используют при производстве стекла, бумаги, мыла, в быту и стиральных порошках.
- Питьевую соду – NaHCO3используют в быту и пищевой промышленности, а также в медицине.
- Поташ, или карбонат калия – K2CO3используют при производстве жидкого мыла, в качестве удобрения и получения тугоплавкого стекла.
- Кристаллогидрат сульфата натрия, или глауберова соль –
- Na2SO4 ∙ 10 H2O применяется для производства соды и стекла, в качестве слабительного средства.
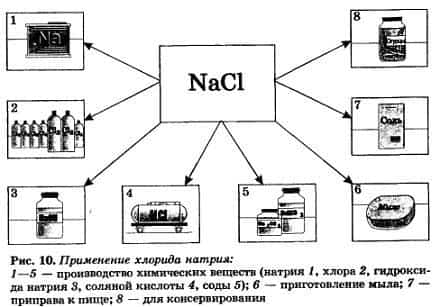
Поваренная соль, или хлорид натрия – NaCl используется при производстве соляной кислоты, гидроксида натрия, хлора, натрия и соды, для консервирования, как приправа к пище, при производстве мыла. Хлорид натрия – галит содержится в моской воде и при высыхании морей образует мощные пласты каменной соли.
Биологическая роль ионов натрия и калия очень велика. Так, ионы натрия содержатся в крови и лимфе, ионы калия – основной внутриклеточный ион.
Соотношение концентраций этих ионов регулирует давление крови, обеспечивает перемещение растворов солей из корней в листья растений. В организме человека концентрация ионов калия внутри клеток выше, чем ионов натрия.
В межклеточном постранстве, наоборот, концентрация ионов натрия выше, чем ионов калия. Различные концентрации этих ионов внутри и снаружи клеток позволяет регулировать водные потоки через мембраны.
Кроме этого, калий поддерживает работу сердечной мышцы.
Взрослому человеку в сутки необходимо три с половиной грамма калия. Калий содержится в кураге, сое, фасоле, зелёном горошке, черносливе, изюме и других продуктах.
Ребята, решите интересную задачу. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
В условии задачи нам сказано, что в 100 г кураги содержится 2,034 г калия, а в сутки человеку необходимо 3,5 г калия. Найти необходимо массу кураги.
Для решения этой задачи составим выражение: 2 г калия содержится в 100 г кураги, 3,5 г калия содержится в Х граммах кураги, найдём Х. Для этого 3,5 умножим на 100 и разделим на 2,034, получаем 172 г.
Для того, чтобы получить суточную норму калия человеку необходимо съесть 172 г кураги.
Калий нужен и растениям. Он является одним из элементов питания. Ежегодно большое количество калия уходит из почвы. Недостаток калия в почве, понижает интенсивность фотосинтеза. Это приводит:
- · к уменьшению содержания сахаров в корнеплодах свёклы и крахмала в зерне
- · отмиранию листьев растений
- · повышению восприимчивости к грибковых и бактериальным заболеваниям
- · снижению всхожести семян.
- Поэтому для получения высоких урожаев сельскохозяйственных культур необходимо внесение калийных удобрений, таких солей калия, как хлорид, нитрат, карбонат, сульфат калия.
- Соли щелочных металлов окрашивают пламя в различные цвета: литий – в карминово-красный цвет, натрий – в жёлтый, калий, рубидий и цэзий – в фиолетовый.
Для того чтобы это доказать, проведём лабораторный опыт. Возьмём лучинку и закрепим на ней спираль из проволоки. Обмакнём её сначала в соляную кислоту, затем в сухую соль натрия и поднесём к пламени спиртовки. Пламя, окрашивается в жёлтый цвет.
Сейчас возмём лучинку со спиралью из проволоки, обмакнём в кислоту, но теперь поместим в сухую соль калия и поднесём к пламени спиртовки. Пламя окрашивается в фиолетовый цвет.
Открытии щелочных металлов. Так, литий был открыт в 1817 году шведским химиком Арфвэдсоном и назван литием, так как литос от греческого означает камень, потому что он был обнаружен в камне.
Натрий и калий был получен английским химиком Дэви в 1807 году при электролизе едких щелочей. Натрий от арабского натрун означает сода, а калий от арабского алкали – щёлочь.
Сделаем вывод: щелочные металлы – это элементы I А группы, у них один электрон на внешнем энергетическом уровне. Все они – восстановители, проявляют степень окисления равную +1.
Это мягкие металлы и легко режутся ножом, у них сравнительно невысокие температуры плавления, они обладают высокой химической активность, реагируют с простыми и сложными веществами .
Их получают в результате электролиза расплавов, встречаются в природе только в виде соединений, соединения щелочных металлов имеют большое значение в жизни человека и в народном хозяйстве.
Щелочные металлы — Гипермаркет знаний
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Щелочные металлы
Строение и свойства атомов. Щелочные металлы — это элементы главной подгруппы I группы Периодической системы Д. И. Менделеева: литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs и франций Fг. Франций — редкий радиоактивный элемент.
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1.
Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.Щелочные металлы — простые вещества.
Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов М, запишем в общей форме уравнения реакций щелочных металлов с неметаллами — водородом, хлором и серой.
- При взаимодействии с кислородом натрий и калий образуют не оксиды, а пероксиды:
Как вы уже знаете, все щелочные металлы активно взаимодействуют с водой, образуя щелочи и восстанавливая воду до водорода (рис. 9). Скорость взаимодействия щелочного металла с водой будет увеличиваться от лития к цезию (почему?).
Соединения щелочных металлов. В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности.
Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.
Рассмотрим основные соединения щелочных металлов на примере соединений натрия и калия — наиболее важных представителей этой группы элементов.Оксиды М20 — твердые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами.
Оксиды натрия Na2O и калия К2O получают, прокаливая пероксиды с соответствующими металлами.
Гидроксиды МОН — твердые белые вещества. Очень гигроскопичны. Хорошо растворяются в воде с выделением большого количества теплоты. Их относят к щелочам, они проявляют ярко выраженные свойства сильных растворимых оснований: взаимодействуют с кислотами, кислотными оксидами, солями, амфотерными оксидами и гидроксидами.
Образуются при взаимодействии металлов или их оксидов с водой.Гидроксид натрия КаОН в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали.Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон.Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твердые кристаллические вещества ионного строения.
Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты, хлориды.
Nа2СO3 — карбонат натрия, образует кристаллогидрат Nа2СO3* 10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Это средняя соль.Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3, она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода).К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.NаСl — хлорид натрия, или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту (рис. 10).
Ионы натрия и калия играют большую биологическую роль: Nа+ — главный внеклеточный ион, содержится в крови и лимфе, а К+ — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений.
Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка калия в организме очень сказывается на здоровье человека. Калий необходим для всех растений, при его недостатке снижается интенсивность фотосинтеза растений.Взрослый человек должен в сутки потреблять с пищей 3,5 г ионов калия.
С помощью соединений калия можно устранить отеки, калий помогает при ревматизме, улучшает работу кишечника. В этом случае организму нужно больше калия — до 5 г в сутки. Больше всего калия содержат курага, соя, фасоль, зеленый горошек, чернослив, изюм и другие продукты.
Соли калия широко используются в сельском хозяйстве в качестве калийных удобрений.Соли натрия, как и сам натрий, окрашивают пламя в желтый цвет, а соли калия и калий — в розово-фиолетовый.Открытие щелочных металлов. Литий был открыт шведским химиком И. Арфведсоном в 1817 г. и по предложению Й. Бер-целиуса назван литием (от греч.
литое — камень), так как в отличие от калия, который до тех пор находили только в золе растений, он был обнаружен в камне.Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й.
Берцелиус предложил назвать элемент № 11 натрием (от араб, натрун — сода), а элемент № 19 по предложению Гильберта получил название калий (от араб, алкали — щелочь).
1. Строение атомов щелочных металлов.
2. Химические свойства щелочных металлов: образование гидридов, хлоридов, сульфидов, пероксидов, оксидов, гидроксидов.
3. Оксиды и пероксиды щелочных металлов.
4. Едкие щелочи.
5. Соли: сода питьевая, сода кристаллическая, поташ, глауберова соль, поваренная соль.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Какой объем водорода может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного?Прочитайте сочинение, написанное ученицей 9 класса 531-й школы г. Москвы Наташей Фроловой (1991).Добрый Литий
2Na + O2 = Na2O2 (пероксид натрия)
4Li + O2 = 2Li2O (оксид лития)
В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый легкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень легким и всплывал в керосине.
Но все же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и Кислороду, и Азоту, и многим другим элементам.
Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода.
Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени.
Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны кислороду отдаешь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете.
Я рад, что в моем оксиде Кислород имеет свою обычную степень окисления — 2, не то что —1 в ваших странных, ни на что не похожих перок-сидах». Сказал так и ушел восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е.
создадут соответствующие условия — нагревают пероксид (Nа2O2) с таким же металлом — «жадиной (Nа)».Какие химические понятия использовала в художественной форме Наташа?Приготовьте сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или какой-либо один химический процесс.
В 100 г кураги содержится 2,034 г калия.
Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
словарь терминов, новаторство на уроке химии, конспекты уроков химии 9 класса
Содержание урока
конспект урока
опорный каркас презентация урока
акселеративные методы интерактивные технологии Практика
задачи и упражнения самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты Дополнения
рефераты
статьи фишки для любознательных шпаргалки учебники основные и дополнительные
словарь терминов прочие
Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей
идеальные уроки
календарный план на год методические рекомендации программы
обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Щелочные металлы
Вся элементы группы химически активны, поэтому на Земле встречаются только в составе различных минералов, например, каменной, калийной, поваренной соли, буры, полевого шпата, морской воды, подземных рассолов, чилийской селитры. Франций часто сопутствует урановым рудам; рубидий и цезий — минералам с натрием и калием.
Свойства
Все представители группы — мягкие металлы, их можно резать ножом, сгибать руками. Внешне — блестящие, белого цвета (кроме цезия). Цезий отливает золотистым блеском. Легкие: натрий и калий легче воды, литий всплывает даже в керосине.
Классические металлы с хорошей электро- и теплопроводностью. Горят, придают пламени характерный цвет, являющийся одним из аналитических способов определить тип металла. Легкоплавкие, самым «тугоплавким» является литий (+180,5 °С).
Цезий тает прямо в руках при температуре +28,4 °С.
Активность в группе увеличивается по мере роста атомной массы: Li →Cs. Обладают восстановительными свойствами, в том числе в реакции с водородом. Проявляют валентность -1. Бурно реагируют с водой (все кроме лития — со взрывом); с кислотами, кислородом. Взаимодействуют с неметаллами, спиртами, водным аммиаком и его производными, карбоновыми кислотами, многими металлами.
Калий и натрий являются биогенными элементами, участвуют в водно-солевом и кислотно-щелочном балансе человеческого организма, необходимы для нормальной циркуляции крови и функционирования многих энзимов. Калий важен для растений.
В нашем организме есть и рубидий. Его нашли в крови, костях, головном мозге, легких. Он оказывает противовоспалительное, противоаллергическое действие, притормаживает реакции нервной системы, усиливает иммунитет, положительно влияет на состав крови.
Меры предосторожности
Щелочные металлы очень опасны, способны воспламеняться и взрываться просто от контакта с водой или воздухом. Многие реакции протекают бурно, поэтому работать с ними допускается только после тщательного инструктажа, с применением всех мер предосторожностей, в защитной маске и защитных очках.
Растворы калия, натрия и лития в воде являются сильными щелочами (гидроксиды калия, натрия, лития); контакт с кожей приводит к глубоким болезненным ожогам. Попадание щелочей, даже низкой концентрации, в глаза может привести к слепоте. Реакции с кислотами, аммиаком, спиртами проходят с выделением пожаро- и взрывоопасного водорода.
Щелочные металлы хранят под слоем керосина или вазелина в герметичных емкостях. Манипуляции с чистыми реактивами проводят в аргоновой атмосфере.
Следует тщательно следить за утилизацией остатков после опытов со щелочными металлами. Все остатки металлов предварительно должны быть нейтрализованы.
Применение
- Цезий и рубидий используются в фотоэлементах, топливных элементах.
- Цезий применяется в источниках тока, энергоемких аккумуляторах, счетчиках радиоактивных частиц, гамма-спектрометрах для космических аппаратов; приборах ночного видения и оружейных прицелах. Изотопы цезия используются для стерилизации пищевой тары, медицинских инструментов, мясных продуктов, лекарств; они входят в состав некоторых лекарств, применяются для радиотерапии опухолей.
- Рубидий входит в состав болеутоляющих, снотворных, успокаивающих препаратов. Применяется в телевизионных трубках, оптических приборах, низкотемпературных источниках тока, в смазке для космических аппаратов, высокочувствительных магнитометрах для космических и геофизических исследований. Производные рубидия используются в атомной промышленности, химпроме, вакуумных радиолампах, высокотемпературных термометрах.
- Калий и натрий применяются в воздухо-восстановительных системах на подводных лодках и батискафах, в автономных противогазах и дыхательных аппаратах.
- Литий востребован в источниках тока, для производства подшипниковых сплавов и литийорганических соединений, как катализатор в химпроме.
- Натрий применяется в газоразрядных лампах, в металлургии; как теплоноситель в атомной индустрии; в химической индустрии в процессах орг.синтеза.
- В разных сферах промышленности и быта используется большое количество производных щелочных металлов, например, пищевая и кальцинированная сода, поваренная соль, натриевая и калийная селитра, нитраты, сульфаты, карбонаты, гидроксиды натрия, калия и лития и пр.
Урок в 9-м классе "Щелочные металлы"
Тип урока:
изучение нового материала.
Вид урока:
комбинированный урок
Задачи урока:
Обучающие:
формирование знаний учащихся о щелочных металлах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие:
развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие:
воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы:
проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Оснащение:
компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”
Оборудование:
коллекция щелочных металлов, коллекция применения щелочных металлов.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека.
На предыдущих уроках мы изучили общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов.
Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных щелочных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
Беседа.
Учитель:
— На какие две большие группы происходит деление химических элементов?
Ученик:
— На металлы и неметаллы
Учитель:
— Где находятся металлы в периодической системе Д.И. Менделеева.
Ученик:
— В периодической системе элементы – металлы расположены в начале всех периодов, а также в четных рядах больших периодов побочных подгруппах.
Условной границей, отделяющей металлы от неметаллов, служит диагональ, отведенная от бора к астату.
Металлы оказываются левее и ниже этой прямой, неметаллы – правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, их называют амфотерными.
Учитель:
— Какие группы естественных семейств в периодической системе мы знаем?
Ученик:
– Мы знаем особые группы отдельных металлов: щелочные металлы, щелочно-земельные металлы, редкоземельные металлы (иттрий, лантан и лантаноиды).
– Благородные металлы (серебро, золото и шесть платиновых металлов) . Платиновые металлы (платиноиды, рутений, родий, палладий, осмий, иридий, платина) металлы подгруппы алюминия.
Учитель:
– Каковы особенности строения атомов металлов?
Ученик:
— Атомы металлов имеют сравнительно большие атомные радиусы, поэтому их внешние электроны значительно удалены от ядра и слабо сними связаны. И вторая особенность, которая присуща атомам наиболее активных металлов – это наличие на внешнем энергетическом уровне 1-3 электронов.
Учитель:
— Как особенности строения атома влияют на физические свойства?
Ученик:
— Характерные физические свойства металлов металлический блеск, электрическая проводимость, теплопроводность, Связана с особенностью строения кристаллических решеток атомов металлов.
В узлах располагаются атомы и положительные ионы металлов, связанные посредством обобществленных внешних электронов, которые принадлежат всему кристаллу, эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решетки.
Учитель:
— Как особенности строения металлов влияют на их химические свойства?
Ученик:
— Самое характерное химическое свойство всех металлов – их восстановительная способность, т.е. способность атомов легко отдавать свои внешние электроны, превращаясь в положительные ионы. Металлы не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
Учитель:
Тема нашего урока “Щелочные металлы”
- Задачи нашего урока: Дать общую характеристику щелочным металлам.
- Рассмотреть их электронное строение, сравнить физические и химические свойства.
- Узнать о важнейших соединениях металлов.
- Определить области применения этих соединений.
Учитель :
— Что мы будем изучать в этой теме? Каков наш план урока?
Ученик:
— Мы будем изучать положение щелочных металлов в периодической системе; строение атома щелочных металлов, физические и химические свойства и применение щелочных металлов.
Учитель:
— Наш план урока написан на доске, будем работать соответственно плана.
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочных металлов.
Беседа.
Учитель:
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
1. .Перечислите щелочные металлы
Ученик:
— Это литий, натрий, калий, рубидий, цезий, франций.
Учитель:
2. Почему данные металлы назвали щелочными?
Ученик:
— При взаимодействии с водой они образуют растворимые в воде основания – щелочи.
Учитель:
3. Где располагаются щелочные металлы в ПСХЭ Д.И.Менделеева ?
Ученик:
— Щелочные металлы – это элементы главной подгруппы первой группы Периодической системы Д.И. Менделеева.
Учитель:
4.Почему данные металлы Д.И. Менделеев объединил в одну группу?
Ученик:
— На внешнем энергетическом уровне атомы элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра.
Учитель:
5.Почему данные металлы Д.И. Менделеев объединил в одну группу?
Ученик:
— Они легко отдают электроны, поэтому являются очень сильными восстановителями. Во всех соединениях проявляют степень окисления +1.
Учитель:
- — Просматриваем кадры виртуальной лаборатории, вы внимательно смотрите и готовите ответы на вопросы.
- (Кадры о положение в периодической системе и строение атома)
- Вопросы:
Учитель:
— Какую степень окисления проявляют щелочные металлы в соединениях?
Ученик:
— Щелочные металлы проявляют степень окисления + 1
Учитель:
— Как изменяются восстановительные свойства щелочных металлов от лития к цезию?
Ученик:
От лития к цезию восстановительные свойства усиливаются, активный металл цезий. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Учитель:
— Сделаем вывод о строении атома щелочных металлов.
Ученик:
— Вывод: У щелочных металлов одинаковое количество электронов на внешнем уровне, и они проявляют одинаковую степень окисления.
Учитель:
Записать строение атомов щелочных металлов в тетрадь.
Учитель:
Итак, мы рассмотрели положение щелочных металлов в периодической системе, рассмотрели строение атомов щелочных металлов.
— Обратим внимание на коллекцию щелочных металлов, их хранят в керосине, легко режутся ножом и быстро окисляются на воздухе. Исходя из строения атома, познакомимся с физическими свойствами щелочных металлов.
Для металлов характерна низкая твердость, вернее мягкость, труднее всего резать литий, тогда как натрий и калий легко поддаются скальпелю.
На основании таблицы, сделаем вывод о физических свойствах щелочных металлов.
Таблица
Некоторые физические свойства щелочных металлов
| металлы | цвет | Радиус,нм | t пл.,С | t кип., C | плотность г/см3 | твердость |
| литий | Серебристо- белый | 155 | 179 | 137 | 0,53 | 0,6 |
| натрий | тот — же | 189 | 97,8 | 883 | 0,97 | 0,4 |
| калий | 236 | 63,7 | 766 | 0,86 | 0,5 | |
| рубидий | 248 | 38,7 | 713 | 1,52 | 0,3 | |
| цезий | золотисто — белый | 267 | 28,5 | 690 | 1,87 | 0,2 |
| франций | В природе не существует в таких количествах, которые достаточны для изучения его свойств. |
Вопросы:
Учитель:
— Каков внешний вид и твердость щелочных металлов?
Ученик:
— Щелочные металлы серебристо-белые вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности.
Учитель:
— С возрастанием радиуса атома, от лития к цезию, наблюдается закономерность в их физических свойствах. Обратите внимание на таблицу. Как изменяется плотность щелочных металлов в группе?
Ученик:
— Все они легкие и легкоплавкие плотность их меньше 5 г/см3,
Учитель:
— Сравните щелочные металлы по твердости.
Ученик:
— Самый твердый из щелочных металлов литий, самый легкий цезий.
Учитель:
— Сделаем вывод исходя из физических свойств щелочных металлов.
Ученик:
— По мере увеличения характера изменения физических свойств, возрастает плотность металлов, а твердость, температура плавления и кипения уменьшаются.
Затем учащиеся сравнивают физические показатели плотности металлов и температуры плавления. Делают вывод о зависимости температуры плавления от плотности металла.
Проблема:
В каком виде щелочные металлы встречаются в природе?
Почему в природе щелочные металлы в основном существуют в виде соединений?
Ответ:
В природе щелочные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие одного неспаренного электрона на внешнем энергетическом уровне)
Учитель:
— Какие места по распространенности в земной коре занимают элементы натрий и калий?
Ученик:
Натрий шестое, а калий седьмое.
Физкультминутка – отдых глазам.
Учитель:
— Зная общие физические свойства, активность металлов, предположите химические свойства щелочных металлов. С какими веществами взаимодействуют щелочные металлы?
Ученик:
— Щелочные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
Учитель:
— А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочных металлов.
Цель:
провести реакции, подтверждающие химические свойства щелочных металлов.
Повторяем правила техники безопасности для работы со щелочными металлами.
- работать в вытяжном шкафу
- на подносе
- сухими руками
- брать в малых количествах
Работаем с текстом, который читаем по виртуальной лаборатории.
Опыт № 1.Взаимодействие натрия с водой.
Опыт № 2. Взаимодействие лития, натрия, калия с водой.
Опыт № 3. Горение лития.
Опыт № 4. Горение натрия.
Опыт № 5. Горение калия.
Записать уравнения реакции и наблюдения в тетрадь.
Учитель:
— Проверим правильность написания уравнений на доске.
Учитель:
Пользуясь учебником, подготовьте рассказ о применении щелочных металлов.
Что запомнилось на уроке, что понравилось.
Параграф 11 упр.1(б) упр.4 стр.50 ( творческое).
16.04.2009






