- Устаревшая и новая нумерация группы
- Строение атомов щелочных металлов
- Последовательность открытия щелочных металлов
- Физические свойства щелочных металлов
- Кристаллическое состояние
- Химические свойства щелочных металлов
- Получение и применение щелочных металлов
- Щелочные металлы
- Щелочные металлы
- Свойства
- Меры предосторожности
- Применение
- Металлы главной подгруппы I группы
- Физические свойства щелочных металлов
- Химические свойства
- 2. Взаимодействие с галогенами
- 3. Взаимодействие с другими неметаллами (S, С, Si, Р)
- 4. Взаимодействие с водородом
- 5. Взаимодействие с водой
- 6. Взаимодействие с кислотами
- 7. Взаимодействие со спиртами и фенолами
- 8. Взаимодействие с галогеналканами (реакция Вюрца)
- 9. Замещение атомов водорода в гидридах неметаллов
- Способы получения
- 2. Вакуум-термический способ
- I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- Щелочные металлы в химии
- Физические свойства щелочных металлов
- Получение щелочных металлов
- Химические свойства щелочных металлов
- Качественные реакции
- Примеры решения задач
Щелочные металлы — общее название элементов 1-й группы периодической системы химических элементов.
Ее состав: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr), и гипотетический элемент — унуненний (Uue).
Наименование группы произошло от названия растворимых гидроксидов натрия и калия, обладающих реакцией и вкусом щелочи. Рассмотрим общие черты строения атомов элементов, свойства, получение и применение простых веществ.
Устаревшая и новая нумерация группы
По устаревшей системе нумерации щелочные металлы, занимающие крайний слева вертикальный столбец таблицы Менделеева, относятся к I-А группе. В 1989 году в качестве основного Международный химический союз (IUPAC) предложил иной вариант (длиннопериодный).
Щелочные металлы в соответствии с новой классификацией и сплошной нумерацией относятся к 1-й группе. Открывает эту совокупность представитель 2-го периода — литий, завершает ее радиоактивный элемент 7-го периода — франций.
У всех металлов 1-й группы во внешней оболочке атомов содержится один s-электрон, который они легко отдают (восстанавливаются).
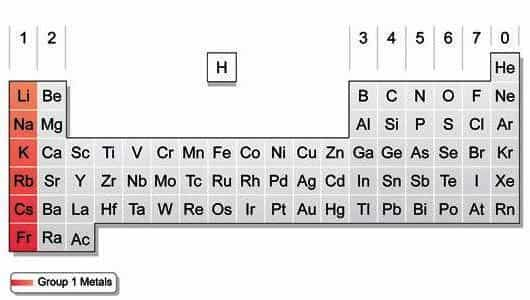
Строение атомов щелочных металлов
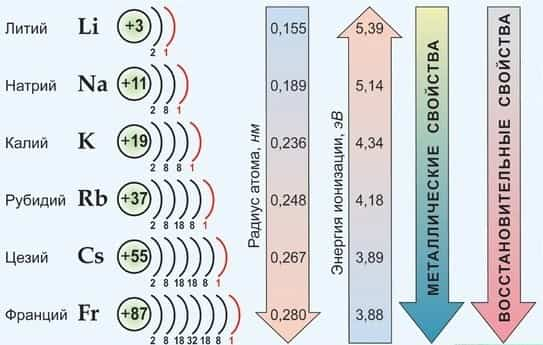
Для элементов 1-й группы характерно наличие второго энергетического уровня, повторяющего строение предшествующего инертного газа. У лития на предпоследнем слое — 2, у остальных — по 8 электронов. В химических реакциях атомы легко отдают внешний s-электрон, приобретая энергетически выгодную конфигурацию благородного газа.
Элементы 1-й группы обладают малыми величинами энергии ионизации и электроотрицательности (ЭО). Они легко образуют однозарядные положительные ионы. При переходе от лития к францию возрастает количество протонов и электронов, радиус атома. Рубидий, цезий и франций легче отдают внешний электрон, чем предшествующие им в группе элементы.
Следовательно, в группе сверху вниз увеличивается восстановительная способность.
Легкая окисляемость щелочных металлов приводит к тому, что элементы 1-й группы существуют в природе в виде соединений своих однозарядных катионов. Содержание в земной коре натрия — 2,0%, калия — 1,1%. Другие элементы в ней находятся в малых количествах, например, запасы франция — 340 г. Хлорид натрия растворен в морской воде, рапе соленых озер и лиманов, образует залежи каменной или поваренной соли. Вместе с галитом встречаются сильвинит NaCl • KCl и сильвин KCl. Полевой шпат образован алюмосиликатом калия K2[Al2Si6O16]. В воде ряда озер растворен карбонат натрия, а запасы сульфата элемента сосредоточены в акватории Каспийского моря (Кара-Богаз-Гол). Встречаются залежи нитрата натрия в Чили (чилийская селитра). Существует ограниченное число природных соединений лития. В качестве примесей к соединениям элементов 1-й группы встречаются рубидий и цезий, а франций находят в составе урановых руд.
Последовательность открытия щелочных металлов
Британский химик и физик Г. Дэви в 1807 году провел электролиз расплавов щелочей, впервые получив натрий и калий в свободном виде. В 1817 году шведский ученый Иоганн Арфведсон открыл элемент литий в минералах, а в 1825-м Г. Дэви выделил чистый металл.
Рубидий был впервые обнаружен в 1861 году Р. Бунзеном и Г. Кирхгофом. Немецкие исследователи анализировали состав алюмосиликатов и получили в спектре красную линию, соответствующую новому элементу.
В 1939 году сотрудница Парижского института радиоактивности Маргарита Пере установила существование изотопа франция. Она же дала название элементу в честь своей родины. Унуненний (эка-франций) — предварительное название нового вида атомов с порядковым номером 119.
Временно используется химический символ Uue. Исследователи с 1985 года предпринимают попытки синтеза нового элемента, который станет первым в 8-м периоде, седьмым в 1-й группе.
Физические свойства щелочных металлов
Почти все щелочные металлы обладают серебристо-белым цветом и металлическим блеском на свежем срезе (цезий имеет золотисто-желтую окраску). На воздухе блеск тускнеет, появляется серая пленка, на литии — зеленовато-черная. Этот металл обладает наибольшей твердостью среди соседей по группе, но уступает тальку — самому мягкому минералу, открывающему шкалу Мооса. Натрий и калий легко сгибаются, их можно разрезать. Рубидий, цезий и франций в чистом виде представляют тестообразную массу. Плавление щелочных металлов происходит при относительно низкой температуре. Для лития она достигает 180,54 °С. Натрий плавится при температуре 97,86 °С, калий — при 63,51 °С, рубидий — при 39,32 °С, цезий — при 28,44 °С. Плотность щелочных металлов меньше, чем родственных им веществ. Литий плавает в керосине, поднимается на поверхность воды, калий и натрий также всплывают в нем.
Кристаллическое состояние
Кристаллизация щелочных металлов происходит в кубической сингонии (объемно-центрированной). Атомы в ее составе обладают зоной проводимости, на свободные уровни которой могут переходить электроны.
Именно эти активные частицы осуществляет особую химическую связь — металлическую. Общность строения энергетических уровней и природа кристаллических решеток объясняют сходство элементов 1-й группы.
При переходе от лития к цезию возрастают массы атомов элементов, что приводит к закономерному увеличению плотности, а также к изменению других свойств.
Химические свойства щелочных металлов
Единственный внешний электрон в атомах щелочных металлов слабо притягивается к ядру, поэтому им свойственна низкая энергия ионизации, отрицательное или близкое к нулю сродство к электрону. Элементы 1-й группы, обладая восстановительной активностью, практически не способны окислять. В группе сверху вниз возрастает активность в химических реакциях:
- Натрий, калий и литий при небольшом нагревании загораются на воздухе. Для первых двух металлов характерно образование в этой реакции пероксидов и надпероксидов, а для лития — оксида Li2O. Рубидий и цезий на воздухе самовоспламеняются.
- Щелочные металлы способны восстанавливать даже водород. При нагревании взаимодействуют с атомами самого легкого элемента и восстанавливают его до отрицательно заряженного иона H-. В реакции получаются гидриды, например, NaH, KH.
- Простые вещества, соответствующие элементам 1-й группы, взаимодействуют с водой и образуют щелочи, например, LiOH, NaOH, KOH. Процесс сопровождается выделением газообразного водорода, который самовоспламеняется или взрывается. 2Na + 2H2O = 2NaOH + H2↑. Рубидий и цезий вступают в реакцию даже со льдом. Хранение щелочных металлов допускается под слоем минерального масла, в керосине, в запаянных стеклянных сосудах.
- Активно взаимодействуют металлы 1-й группы с галогенами, особенно энергично происходит реакция с фтором и хлором, при нагревании — с серой и фосфором. Большинство получившихся солей обладает хорошей растворимостью.
- Качественная реакция — разложение солей щелочных металлов в огне газовой горелки. Пары окрашивают пламя в определенный цвет.
- При взаимодействии щелочных металлов со спиртами получаются алкоголяты, с карбоновыми кислотами они дают соответствующие соли, например, формиат натрия.
Получение и применение щелочных металлов
Металлы, относящиеся к 1-й группе, в промышленности получают электролизом расплавов их галогенидов и других природных соединений. При разложении под действием электрического тока положительные ионы на катоде присоединяют электроны и восстанавливаются до свободного металла. На противоположном электроде происходит окисление аниона.
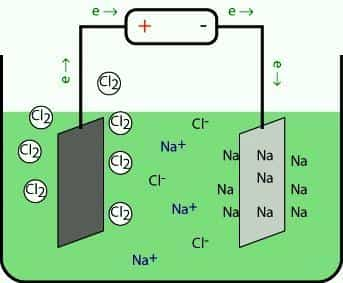
При электролизе расплавов гидроксидов на аноде окисляются частицы OH-, выделяется кислород и получается вода. Еще один метод заключается в термическом восстановлении щелочных металлов из расплавов их солей кальцием.
Простые вещества и соединения элементов 1-й группы имеют практическое значение. Литий служит сырьем в атомной энергетике, используется в ракетной технике. В металлургии применяется для удаления остатков водорода, азота, кислорода, серы.
Гидроксидом дополняют электролит в щелочных аккумуляторах.

Натрий необходим для атомной энергетики, металлургии, органического синтеза. Цезий и рубидий используются при изготовлении фотоэлементов. Широкое применение находят гидроксиды и соли, особенно хлориды, нитраты, сульфаты, карбонаты щелочных металлов. Катионы обладают биологической активностью, особенно важны для организма человека ионы натрия и калия.
Щелочные металлы


Средняя оценка: 4.4
Всего получено оценок: 642.
Средняя оценка: 4.4
Всего получено оценок: 642.
Наиболее активными среди металлов являются щелочные металлы. Они активно вступают в реакции с простыми и сложными веществами.
Щелочные металлы находятся в I группе периодической таблицы Менделеева. Это мягкие одновалентные металлы серо-серебристого цвета с небольшой температурой плавления и невысокой плотностью. Проявляют единственную степень окисления +1, являясь восстановителями. Электронная конфигурация – ns1.
Рис. 1. Натрий и литий.
Общая характеристика металлов I группы приведена в таблице.
| Список щелочных металлов | Формула | Номер | Период | t°пл., °C | t°кип., °C | ρ, г/см3 |
| Литий | Li | 3 | 2 | 180,5 | 1340 | 0,533 |
| Натрий | Na | 11 | 3 | 98 | 883 | 0,968 |
| Калий | K | 19 | 4 | 63,07 | 759 | 0,856 |
| Рубидий | Rb | 37 | 5 | 39,5 | 688 | 1,532 |
| Цезий | Cs | 55 | 6 | 28,4 | 671 | 1,90 |
| Франций | Fr | 87 | 7 | 20 | 690 | 1,87 |
Активные металлы быстро реагируют с другими веществами, поэтому в природе находятся только в составе минералов.
Для получения чистого щелочного металла используется несколько способов:
-
электролиз расплавов, чаще всего хлоридов или гидроксидов –
2NaCl → 2Na + Cl2, 4NaOH → 4Na + 2H2O + O2↑; - прокаливание соды (карбоната натрия) с углём для получения натрия –
-
восстановление кальцием рубидия из хлорида при высоких температурах –
2RbCl + Ca → 2Rb + CaCl2; - восстановление цезия из карбоната с помощью циркония –
2Cs2CO3 + Zr → 4Cs + ZrO2 + 2CO2.
Свойства щелочных металлов обусловлены их строением. Находясь в первой группе периодической таблицы, они имеют всего один валентный электрон на внешнем энергетическом уровне. Единственный электрон легко переходит к атому окислителя, что способствует быстрому вступлению в реакцию.
Металлические свойства увеличиваются в таблице сверху вниз, поэтому литий расстаётся с валентным электроном труднее, чем франций. Литий – наиболее твёрдый элемент среди всех щелочных металлов. Реакция лития с кислородом проходит только под воздействием высокой температуры. С водой литий реагирует значительно медленнее, чем остальные металлы группы.
Общие химические свойства представлены в таблице.
| Реакция | Продукты | Уравнение |
| С кислородом | Оксид (R2O) образует только литий. Натрий образует смесь оксида и пероксида (R2O2). Остальные металлы образуют надпероксиды (RO2) |
|
| С водородом | Гидриды | 2Na + H2 → 2NaH |
| С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2↑ |
| С кислотами | Соли | 2Na + 2HCl → 2NaCl + H2↑ |
| С галогенами | Галогениды | 2Li + Cl2 → 2LiCl |
| С азотом (реагирует только литий при комнатной температуре) | Нитрид | 6Li + N2 → 2Li3N |
| С серой | Сульфиды | 2Na + S → Na2S |
| С углеродом (реагируют только литий и натрий) | Карбиды |
– 2Li + 2C → Li2C2; – 2Na + 2C → Na2C2 |
| С фосфором | Фосфиды | 3K + P → K3P |
| С кремнием | Силициды | 4Cs + Si → Cs4Si |
| С аммиаком | Амиды | 2Li + 2NH3 → 2LiNH2 + H2 |
При качественной реакции имеют разный цвет пламени. Литий горит малиновым, натрий – жёлтым, цезий – розово-фиолетовым пламенем. Оксиды щелочных металлов также имеют разный цвет. Натрий становится белым, рубидий и калий – жёлтыми.
 Рис. 2. Качественная реакция щелочных металлов.
Рис. 2. Качественная реакция щелочных металлов.
Простые металлы и их соединения используются для изготовления лёгких сплавов, металлических деталей, удобрений, соды и других веществ. Рубидий и калий используются в качестве катализаторов.
Пары натрия применяются в люминесцентных лампах. Не имеет практического применения только франций из-за радиоактивных свойств.
Как используют элементы I группы кратко описано в таблице применения щелочных металлов.
| Область применения | Применение |
| Химическая промышленность |
|
| Пищевая промышленность |
– Хлорид натрия – поваренная соль; – гидрокарбонат натрия – питьевая сода |
| Металлургия | Калий и натрий являются восстановителями при получении титана, циркония, урана |
| Энергетика |
– Расплавы калия и натрия используются в атомных реакторах и авиационных двигателях; – литий используется для производства аккумуляторов |
| Электроника | Цезий – производство фотоэлементов |
| Авиация и космонавтика | Сплавы из алюминия и лития используются для корпусов машин и ракет |
 Рис. 3. Питьевая сода.
Рис. 3. Питьевая сода.
Из урока 9 класса узнали об особенностях щелочных металлов. Они находятся в I группе таблицы Менделеева и при реакциях отдают один валентный электрон.
Это мягкие металлы, легко вступающие в химические реакции с простыми и сложными веществами – галогенами, неметаллами, кислотами, водой.
В природе встречаются только в составе других веществ, поэтому для их извлечения используется электролиз или реакция восстановления. Применяются в промышленности, строительстве, металлургии, энергетике.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.4
Всего получено оценок: 642.
А какая ваша оценка?
Гость завершил
Тест «Детство»с результатом 13/14
Гость завершил
Тест «Биография Гоголя»с результатом 11/12
Гость завершил
Тест на тему «Пунктуация»с результатом 3/5
Гость завершил
Тест «Тихий Дон»с результатом 13/18
Гость завершил
Тест «Разгром»с результатом 10/15
Не подошло? Напиши в х, чего не хватает!
Щелочные металлы
Вся элементы группы химически активны, поэтому на Земле встречаются только в составе различных минералов, например, каменной, калийной, поваренной соли, буры, полевого шпата, морской воды, подземных рассолов, чилийской селитры. Франций часто сопутствует урановым рудам; рубидий и цезий — минералам с натрием и калием.
Свойства
Все представители группы — мягкие металлы, их можно резать ножом, сгибать руками. Внешне — блестящие, белого цвета (кроме цезия). Цезий отливает золотистым блеском. Легкие: натрий и калий легче воды, литий всплывает даже в керосине.
Классические металлы с хорошей электро- и теплопроводностью. Горят, придают пламени характерный цвет, являющийся одним из аналитических способов определить тип металла. Легкоплавкие, самым «тугоплавким» является литий (+180,5 °С).
Цезий тает прямо в руках при температуре +28,4 °С.
Активность в группе увеличивается по мере роста атомной массы: Li →Cs. Обладают восстановительными свойствами, в том числе в реакции с водородом. Проявляют валентность -1. Бурно реагируют с водой (все кроме лития — со взрывом); с кислотами, кислородом. Взаимодействуют с неметаллами, спиртами, водным аммиаком и его производными, карбоновыми кислотами, многими металлами.
Калий и натрий являются биогенными элементами, участвуют в водно-солевом и кислотно-щелочном балансе человеческого организма, необходимы для нормальной циркуляции крови и функционирования многих энзимов. Калий важен для растений.
В нашем организме есть и рубидий. Его нашли в крови, костях, головном мозге, легких. Он оказывает противовоспалительное, противоаллергическое действие, притормаживает реакции нервной системы, усиливает иммунитет, положительно влияет на состав крови.
Меры предосторожности
Щелочные металлы очень опасны, способны воспламеняться и взрываться просто от контакта с водой или воздухом. Многие реакции протекают бурно, поэтому работать с ними допускается только после тщательного инструктажа, с применением всех мер предосторожностей, в защитной маске и защитных очках.
Растворы калия, натрия и лития в воде являются сильными щелочами (гидроксиды калия, натрия, лития); контакт с кожей приводит к глубоким болезненным ожогам. Попадание щелочей, даже низкой концентрации, в глаза может привести к слепоте. Реакции с кислотами, аммиаком, спиртами проходят с выделением пожаро- и взрывоопасного водорода.
Щелочные металлы хранят под слоем керосина или вазелина в герметичных емкостях. Манипуляции с чистыми реактивами проводят в аргоновой атмосфере.
Следует тщательно следить за утилизацией остатков после опытов со щелочными металлами. Все остатки металлов предварительно должны быть нейтрализованы.
Применение
- Цезий и рубидий используются в фотоэлементах, топливных элементах.
- Цезий применяется в источниках тока, энергоемких аккумуляторах, счетчиках радиоактивных частиц, гамма-спектрометрах для космических аппаратов; приборах ночного видения и оружейных прицелах. Изотопы цезия используются для стерилизации пищевой тары, медицинских инструментов, мясных продуктов, лекарств; они входят в состав некоторых лекарств, применяются для радиотерапии опухолей.
- Рубидий входит в состав болеутоляющих, снотворных, успокаивающих препаратов. Применяется в телевизионных трубках, оптических приборах, низкотемпературных источниках тока, в смазке для космических аппаратов, высокочувствительных магнитометрах для космических и геофизических исследований. Производные рубидия используются в атомной промышленности, химпроме, вакуумных радиолампах, высокотемпературных термометрах.
- Калий и натрий применяются в воздухо-восстановительных системах на подводных лодках и батискафах, в автономных противогазах и дыхательных аппаратах.
- Литий востребован в источниках тока, для производства подшипниковых сплавов и литийорганических соединений, как катализатор в химпроме.
- Натрий применяется в газоразрядных лампах, в металлургии; как теплоноситель в атомной индустрии; в химической индустрии в процессах орг.синтеза.
- В разных сферах промышленности и быта используется большое количество производных щелочных металлов, например, пищевая и кальцинированная сода, поваренная соль, натриевая и калийная селитра, нитраты, сульфаты, карбонаты, гидроксиды натрия, калия и лития и пр.
Металлы главной подгруппы I группы
6 элементов этой подгруппы принято называть щелочными металлами. Это название сложилось исторически, так как Na и К впервые были получены при электролизе щелочей
| 3Li | 1s2 2s1 |
| 11Na | [Ne] 3s1 |
| 19К | [Ar] 4s1 |
| 37Rb | [Кг] 5s1 |
| 55Cs | [Xe] 6s1 |
| 87Fr | [Rn] 7s1 |
- все атомы имеют крайне низкие величины энергии сродства к электрону и ЭО.
- Элементы данной подгруппы имеют значительное сходство друг с другом, что обусловлено одинаковым строением внешнего электронного слоя атомов и аналогией в их важнейших характеристиках:
- — атомы всех элементов на предвнешнем электронном слое имеют устойчивые 8-электронные конфигурации соответствующего благородного газа (у Li — оболочка Не);
- — все атомы имеют очень низкие значения Eион и легко превращаются в катионы Me+;
Физические свойства щелочных металлов
В чистом виде щелочные металлы представляют собой легкие, мягкие вещества серебристо-белого цвета на срезе, быстро тускнеющие на воздухе вследствие окисления (цезий имеет золотисто-желтый оттенок). Металлы отличаются высокой электро- и теплопроводностью.
Пары щелочных металлов интенсивно окрашены в различные цвета: Na — пурпурный, К — сине-зеленый, Rb — зеленовато-синий.
Щелочные металлы очень легкоплавки: Cs и Rb плавятся в руках; самый тугоплавкий Li имеет т. пл. 180°С. Плотность этих металлов также невелика — натрий и калий легче воды, а литий плавает даже в керосине.
Щелочные металлы хорошо растворяются в жидком аммиаке, полученные растворы имеют темно-синюю окраску (образуются коллоидные растворы).
Химические свойства
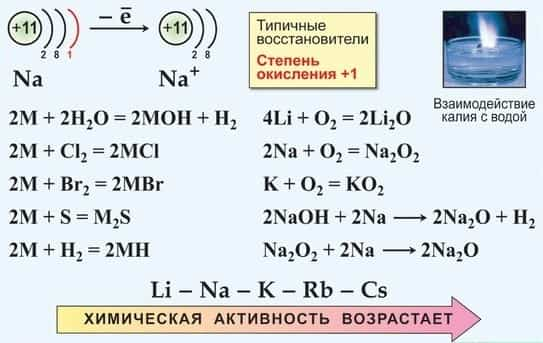
- Уже на воздухе щелочные Me немедленно окисляются, a Rb и Cs — самовоспламеняются
- При повышении Т все металлы сгорают с образованием ослепительного пламени.
- Все щелочные металлы очень химически активны, сильные восстановители:
- Me — 1e- → Me+
С активными окислителями, водой и кислотами реакции протекают настолько бурно, что происходит самовоспламенение или взрыв. Часто реакции проводят в охлаждаемой среде. Реакции с неметаллами осуществляют в вакууме или в среде инертных газов.
- а) только Li при горении образует нормальный оксид:
- 4Li + О2 → 2 Li2O
- б) Na при горении образует бесцветный или слегка желтоватый пероксид
- 2Na + O2 → Na2O2
- в) К, Rb и Cs сгорают с образованием окрашенных супероксидов:
- К + O3= КO3
- г) К, Rb и Cs легко реагируют с озоном, образуя озониды:
- К + O3= КO3
2. Взаимодействие с галогенами
- Соединение щел. Me с галогенами протекает очень бурно, часто в режиме горения, особенно с F2 и Cl2:
- 2Na + F2 = 2NaF;
- 2Na + Cl2 = 2NaCl;
- 2K + Br2 = 2KBr
3. Взаимодействие с другими неметаллами (S, С, Si, Р)
- а) все щел. Me реагируют с фосфором и серой (металлы предварительно нагревают):
- 2Na + S = Na2S сульфид натрия
- 3Na + Р = Na3Р фосфид натрия
- б) с углеродом и кремнием реагирует непосредственно только литий:
- 2Li + 2С = Li2C2 карбид лития
4. Взаимодействие с водородом
Наиболее легко реакция протекает между водородом и предварительно слабо нагретым литием:
2Li + Н2 = 2LiH
5. Взаимодействие с водой
2Me + 2Н20 —> Н2 + 2МеОН
6. Взаимодействие с кислотами
- Реакции протекают очень энергично, даже со слабыми кислотами.
- 1) реакции с кислотами за счет восстановления ионов Н+:
- 6Na + 2Н3РО4 = 2Na3P04 + 3H2
- 2Na + 2HCl = 2NaCl + H2
- 2) реакции с кислотами за счет восстановления анионов:
- 8Na + IOHNO3 = 8NaNO3 + NH4NO3 + 3H2O
- 3) реакции с органическими кислотами:
- 2 Na + 2СН3СООН → 2 CH3COONa + H2
7. Взаимодействие со спиртами и фенолами
2Na + 2С2Н5ОН → 2C2H5ONa + H2
2Na + 2С6Н5ОН → 2C6H5ONa + H2
8. Взаимодействие с галогеналканами (реакция Вюрца)
CH3Cl + 2Na + ClCH3 → CH3-CH3 + 2NaCI
9. Замещение атомов водорода в гидридах неметаллов
- а) реакции с аммиаком расплавленных щелочных металлов:
- 2Na + 2NH3 = 2NaNH2 + H2
- амид натрия
- б) реакции с ацетиленом и некоторыми его гомологами
- 2 Na + НС=СН → NaC =CNa + Н2
- ацетиленид натрия
Способы получения
- 2NaCI = 2Na + Cl2 (аналогично получают Li , К)
- 4КОН = 4К + O2 + 2Н2O
- Выделение металлов происходит на ртутном, свинцовом или стальном катоде
2. Вакуум-термический способ
- Металлы восстанавливают из расплавов их солей активными металлами:
- KCl + Na = К + NaCl
- 2CsCl + Са → 2Cs + CaCl2
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
- I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
- Литий Li,
- Натрий Na,
- Калий K,
- Цезий Cs,
- Рубидий Rb
- Франций Fr
- Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.
- Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns1:
- Li — 2s1
- Na — 3s1
- K — 4s1
- Rb — 5s1
- Cs — 6s1
- Fr — 7s1
- Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Литий
- Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
- Известен также способ получения лития из его оксида в вакууме при 300°С:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Na2CO3 + 2C = 2Na + 3CO
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
- KCl + Na = K + NaCl
- KOH + Na = K + NaOH
- В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
- Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
2Cs2CO3 + Zr = 4Cs + ZrO2 + 2CO2
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Качественные реакции — окрашивание пламени солями щелочных металлов
Цвет пламени:
Li — карминно-красныйNa — желтыйK — фиолетовыйRb — буро-красныйCs — фиолетово-красный
С кислородом
4Li + O2 = 2Li2O
- Натрий образует пероксид:
2Na + O2 = Na2O2
- Калий образует надпероксид:
- K + O2 = KO2
- С галогенами (F, Cl, Br, I)
- Щелочные металлы образуют галогениды:
- 2Li + F2 = 2LiF
- 2Na + Cl2 = 2NaCl
- 2K + I2 = 2KI
- С водородом
- Щелочные металлы образуют гидриды:
- 2Na + H2 = 2NaH
- С серой
- Щелочные металлы образуют сульфиды:
- 2Na + S = Na2S
- С азотом
- При комнатной температуре взаимодействует только литий:
- 6Li + N2 = 2Li3N
- Остальные щелочные металлы
реагируют с азотом при
нагревании: - 6Na + N2 = 2Na3N
- С углеродом
- Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
- 2Na + 2C → Na2C2 (t = 150-200 °C)
- С фосфором
- Щелочные металлы активно
реагируют с фосфором образуя фосфиды: - 3Na + P → Na3P
- С водой
- Щелочные металлы реагируют с водой при обычных
условиях: - 2Na + 2H2O = 2NaOH + H2
- Видео Взаимодействие щелочных металлов с водой
- С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
2K + H2SO4(разб) = K2SO4 +
H2
- С кислотами-окислителями (HNO3 и конц. H2SO4):
- с концентрированной серной:
- 8Na + 5H2SO4(конц) = 4Na2SO4 +
H2S + 4H2O; - с разбавленной азотной
- 8Na + 10HNO3(разб) = 8NaNO3 + NH4NO3 + 3H2O;
- с концентрированной азотной
- 8Na + 10HNO3(конц) =
8NaNO3 + N2O + 5H2O. - 2СH3COOH + 2Li → 2CH3COOOLi + H2↑
- С солями
- В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
- 3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
Щелочные металлы в химии
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1.
В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
- Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
- В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
- Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
- Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
- Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
- 2LiCl = 2Li + Cl2↑
- 2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
- 2MeCl + Ca = 2Mе↑ + CaCl2,
- где Ме – металл.
- Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
- 2Li2O + Si + 2CaO = 4Li + Ca2SiO4
- Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
- KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
- 2Me + H2O = 2MeOH + H2↑
- где Ме – металл.
- Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
- 4Li + O2 = 2Li2O
- 2Na + O2 =Na2O2
- K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
- 2Na + Cl2 =2NaCl
- 6Li + N2 = 2Li3N
- 2Li +2C = Li2C2
- 2K + S = K2S
- 2Na + H2 = 2NaH
- Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
- 2Li + 2NH3 = 2LiNH2 + H2↑
- Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
- 3Na + AlCl3 = 3NaCl + Al
- Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
- Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
- 2Na + 2C2H5OH = 2C2H5ONa + H2↑
- 2K + 2C6H5OH = 2C6H5OK + H2↑
- 2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |






