- Химические свойства карбоновых кислот
- 1.1. Взаимодействие с основаниями
- 1.2. Взаимодействие с металлами
- 1.3. Взаимодействие с основными оксидами
- 1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
- 2. Реакции замещения группы ОН
- 2.1. Образование галогенангидридов
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Получение ангидридов
- 3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
- 4. Свойства муравьиной кислоты
- 4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
- 4.2. Окисление хлором, бромом и азотной кислотой
- 4.3. Окисление перманганатом калия
- 4.4. Разложение при нагревании
- 5. Особенности бензойной кислоты
- 5.1. Разложение при нагревании
- 4.2. Реакции замещения в бензольном кольце
- 6. Особенности щавелевой кислоты
- 6.1. Разложение при нагревании
- 6.2. Окисление перманганатом калия
- 7. Особенности непредельных кислот (акриловой и олеиновой)
- 7.1. Реакции присоединения
- 6.2. Окисление непредельных карбоновых кислот
- Формула уксусной кислоты в химии
- Физические свойства уксусной кислоты
- Химические свойства уксусной кислоты
- Примеры решения задач
- Химические свойства уксусной кислоты
- Уксусная кислота – химические свойства
- Муниципальное
бюджетное образовательное учреждение - средняя
общеобразовательная школа №11 - с
углубленным изучением отдельных предметов г.Ишимбая - муниципального
района Ишимбайский район - Республики
Башкортостан - Исследовательская работа на тему:
- «Влияние уксусной кислоты на металл»
-
Работу выполнила -
ученица 3 В класса - МБОУ
СОШ № 11 - Ермолаева
Виктория - классный
руководитель - Бикбулатова
Елена - Владимировна
Г. Ишимбай 2015г.
Содержание
| Стр | |
| 1. Введение | 2 |
| 2. Цель и задачи исследования. | 3 |
| 3. Теоретическая часть Изучение объектов исследования. | 4-5 |
| 4. Практическая часть Опыты и наблюдения. | 6-16 |
| 5. Результаты опыта | 17 |
| 6. Заключение | 18 |
| 7. Список литературы | 19 |
Введение
Меня зовут Ермолаева Виктория. Я
учусь в третьем классе, и у меня ещё нет такого предмета, как химия. А в моей
комнате есть научная лаборатория с оборудованием и настоящими реактивами. Мне
очень нравится проводить опыты, смешивать разные составы, изучать различные
вещества и жидкости, узнавать новое и делать открытия.

Я — исследователь от природы и
очень люблю задавать вопросы. В процессе любого исследования, как и любого
познания, вопрос играет ключевую роль. Можно без преувеличения сказать, что познание начинается с
вопроса. Да, это верно, и
моя работа началась с вопроса: «Как уксусная кислота влияет на металлы?»
- Объекты
исследования: железный гвоздь и скрепка в пробирках с
уксусной кислотой - Цель исследования.
- Выяснить, что произойдет с
металлическими предметами под воздействием уксусной кислоты. - Задачи
исследования. - Для достижения
поставленной цели необходимо решить ряд задач:
1. Изучить
объекты исследования.
2. Провести
опыт.
3. Сделать
вывод.
Моя гипотеза: в
уксусной кислоте железо разрушается, то есть ржавеет.
Чтобы
провести данное исследование, мы с учителем Еленой Владимировной, изучили
специальную литературу (авторы указаны в списке литературы). При участии моей
семьи я ставила опыты, наблюдала, анализировала и делала выводы.
Теоретическая
часть
В
процессе исследования мне понадобились железный (металлический) предмет и
уксусная кислота. Изучив каждый компонент исследования, я узнала:
Железо — это элемент 8
группы четвертого периода Периодической системы химических элементов Д. И.
Менделеева, с атомным номером 26. Обозначается символомFe. Это один
из самых распространенных металлов в земной коре. Оно имеет серебристо – белый
цвет и высокую химическую реакционную способность.

Уксусная
кислота одна из первых кислот, которая стала известна людям еще в
древности. Обнаружено это было случайно – вследствие появления уксуса при
скисании вина. В природе она встречается в растениях или
в чистом виде, или в виде эфиров.
Уксусная кислота принадлежит к так
называемым жирным кислотам. В химическом чистом состоянии она представляет
собой бесцветную жидкость с резким запахом.
Уксусная кислота находит громадное
и разнообразное применение в жизни людей, а так же в промышленности.

Практическая часть
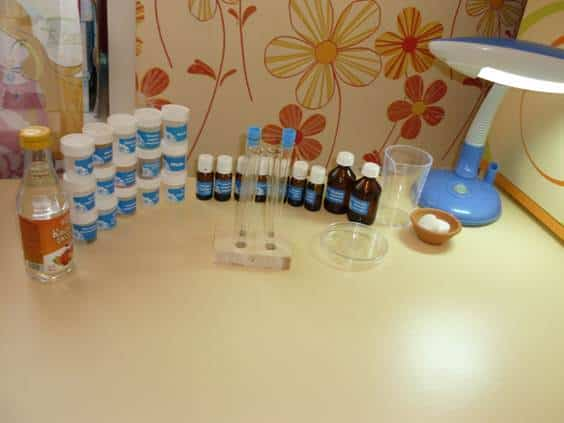
Я
подготовила для опыта необходимые инструменты: пробирки, чашку Петри, мерный
стаканчик. А так же защитные элементы: перчатки, очки, маску.
- Приготовила химические элементы:
уксусную кислоту, железо (стальной гвоздь и скрепку, покрытую хромовым
напылением). 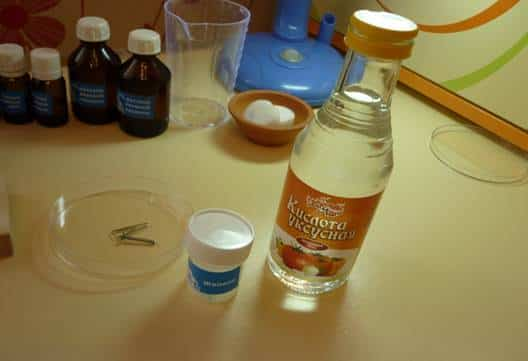
- Я
налила в мерный стаканчик 50мл уксусной кислоты. 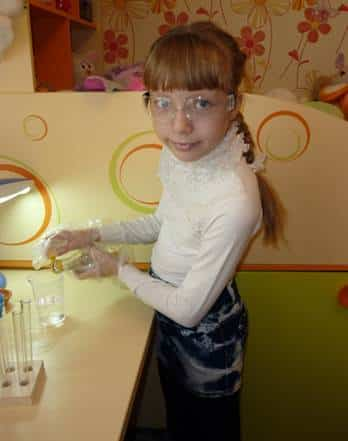
- Взяла из чашки Петри гвоздь, скрепку и
поместила их в две разные пробирки. 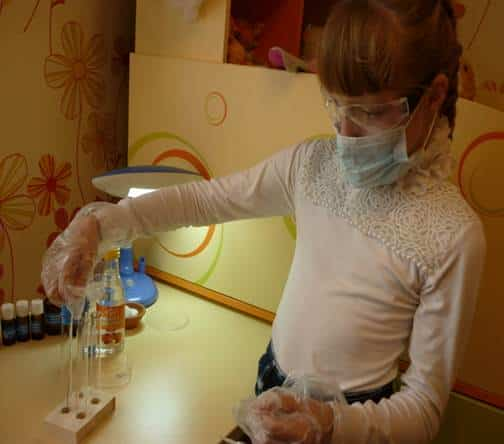
- С помощью мерного стаканчика налила в
пробирки уксусную кислоту в равных пропорциях.
Все готово для исследования! Я начала свои
наблюдения.

1-й день.
Я увидела, что в процессе взаимодействия уксусной кислоты с железом начал
выделятся водород. Это проявлялось появлением пузырьков, которые шли от металла
к поверхности.
2-й день. Реакция
выделения водорода продолжается, а гвоздь и скрепка остаются в первоначальном
виде.
3-й день.
В третий день наблюдения я вижу, что в первой пробирке водород еще выделяется,
а уксусная кислота приобрела розоватый оттенок. Во второй пробирке водород
выделяется в малых количестве.
Я пришла к выводу: так как гвоздь покрыт
защитным слоем, то и реакция у него с уксусной кислотой небольшая. Поэтому я
взяла третью пробирку, поместила в нее стальной винт и налила уксусную кислоту.
Сразу же увидела бурную реакцию выделения водорода.

4 день. В
нижней части пробирки со скрепкой, уксусная кислота осталась прозрачной, а в
верхней части она приобрела оранжевый оттенок.
- Во
второй пробирке все осталось по-прежнему.
В третьей пробирке все еще наблюдается
интенсивное выделение водорода. Уксусная кислота приобрела оранжевый оттенок,
появился небольшой осадок, в виде мелких частиц.
5 день. В
первой пробирке и во второй все без изменений. В третьей пробирке водород все
еще активно выделяется, осадок увеличивается, а уксусная кислота приобретает
насыщенно оранжевый оттенок.
6 день.
В первой пробирке без изменений. Во второй пробирке уксусная кислота темнеет и
приобретает красный оттенок. В третьей пробирке все реакции продолжаются.
7 день. В
первой пробирке водород выделяется в малом количестве. Уксусная кислота
поменяла цвет и стала бледно-оранжевого оттенка. Во второй пробирке водород
выделяется в малом количестве. Уксусная кислота приобрела 3 оттенка.
Внизу
пробирки она осталась прозрачной, в середине светло-оранжевого оттенка, а
вверху пробирки темно оранжевого цвета. В третьей пробирке водород все еще
выделяется. Уксусная кислота приобрела темно оранжевый оттенок.
А на стенках
пробирки появился темный налет.
8 день. В
первой пробирке все реакции продолжаются. Вторая пробирка без изменений. В
третьей пробирке появляется осадок в большом количестве.
9-10 день.
Во всех трех пробирках продолжаются реакции.
11 день. В
первой и во второй пробирках без изменений. В третьей пробирке осадок поднялся
на поверхность уксусной кислоты. А уксусная кислота начала светлеть.
12 день. В
первых двух пробирках те же реакции. А в третьей пробирке уксусная кислота
стала светлее, осадок остается на поверхности.
13 день. Во
всех трех пробирках продолжаются реакции.
14 день. В
первой пробирке уксусная кислота сохраняет два оттенка. Во второй пробирке все
еще в небольшом количестве выделяется водород, уксусная кислота имеет темно
оранжевый оттенок. В третьей пробирке так же выделяется водород, осадок усел на
стенки пробирки, уксусная кислота стала светлой.
2 недели я наблюдала за реакцией
уксусной кислоты и железа. Все реакции в пробирках завершились. Теперь посмотрю,
что же произошло с металлическими изделиями, помещенными в пробирки.
- Я взяла первую пробирку, вылила из нее
уксусную кислоту и извлекла скрепку. - Поместив ее в чашку Петри,
увидела, что скрепка не поменяла свой первоначальный вид. - Взяла вторую пробирку с гвоздем.
- Слила с нее уксусную кислоту и так же увидела,
что гвоздь не подвергся коррозии и остался таким, каким и был. - Я выполнила те же действия и с третьей
пробиркой. - Винт подвергся коррозии, он
почернел, его шляпка деформировалась, покрылась шершавым темным налетом. - Результаты
опыта.
В первой
пробирке со скрепкой покрытой хромовым напылением реакция была, но
небольшая. Уксусная кислота не смогла повредить железо, благодаря защитному
слою, которым была покрыта скрепка.
Во второй
пробирке гвоздь был покрыт защитным слоем цинка. И, так же как и скрепка не
подвергся коррозии под действием уксусной кислоты.
В третьей
пробирке винт без защитного слоя, взаимодействуя с уксусной кислотой,
показал бурную реакцию, в результате которой он подвергся коррозии и
деформировался. Я наблюдала выпадения осадка темно красно-коричневого цвета.
Этот осадок называется уксусной солью или по-другому ацетат железа.
Ацетат железа
это красно-коричневые кристаллы, которые не растворяются в воде. Из
энциклопедии я узнала, что эта соль употребляется в крашении, в ситценабивном
деле, для окрашивания в черный цвет. А чистая соль находит применение в
медицине.
Заключение.
Уксусная
кислота не может повредить железо, если оно покрыто защитным слоем. Если же на
железо не нанесен защитный слой, то в процессе реакции уксусной кислоты и
железа происходит коррозия металла, а так же в процессе этой реакции получается
уксусная соль, которую используют в ситценабивной промышленности и в медицине.
Уксусная
соль?!
- А это новый
вопрос для моего познания! - Следующее
мое исследование будет про это! - Список
литературы.
1. Большая
энциклопедия «Почемучек».- М.: «РОСМЭН», 2006
2. Савина
Л.А. Я познаю мир. ООО «Фирма АСТ», 1999
Химические свойства карбоновых кислот
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
- Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
- Строение, изомерия и гомологический ряд карбоновых кислот
- Химические свойства карбоновых кислот
- Способы получения карбоновых кислот
- .
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
| Карбоновые кислоты – кислоты средней силы. В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |
4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
- При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
- Муравьиная кислота окисляется перманганатом калия до углекислого газа:
- 5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
- Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
- При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
- Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
- К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
3CH2=CH-COOH + 2KMnO4 + 3H2O = 3CH2(OH)-CH(OH)-COOK + KOH + 2MnO2
Формула уксусной кислоты в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
- Химическая формула: CH3COOH
- Брутто-формула: C2H4O2
- Структурная формула:
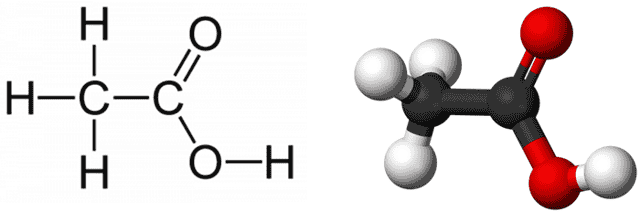
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10–5, рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
- Взаимодействует с оксидами металлов:
- Взаимодействует с гидроксидами металлов:
- В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
- Вступает в реакции галогенирования с образованием галогенуксусных кислот:
- Реакция горения:
- Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
- Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
- Биохимический способ – окисление этанола:
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.
| Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Химические свойства уксусной кислоты


Средняя оценка: 4.2
Всего получено оценок: 618.
Обновлено 3 Декабря, 2020
Средняя оценка: 4.2
Всего получено оценок: 618.
Обновлено 3 Декабря, 2020
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
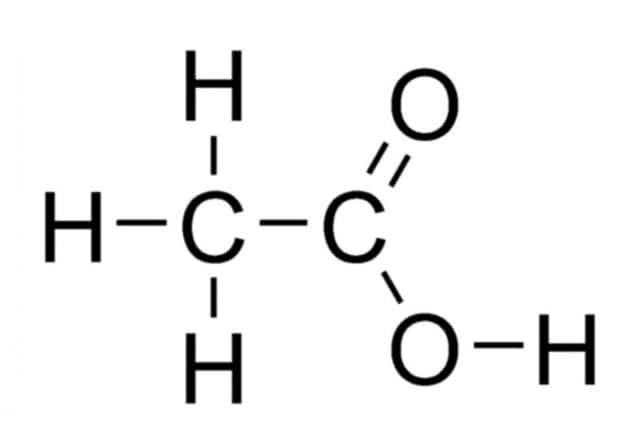 Рис. 2. Графическая формула уксусной кислоты.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
| Взаимодействие | Что образуется | Пример |
| С металлами | Соль, водород | Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
| С оксидами | Соль, вода | CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
| С основаниями | Соль, вода | CH3COOH + NaOH → CH3COONa + H2O |
| С солью | Соль, углекислый газ, вода | 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
| С неметаллами (реакция замещения) | Органическая и неорганическая кислоты |
|
| С кислородом (реакция окисления) | Углекислый газ и вода | CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
 Рис. 3. Использование уксусной кислоты.
Рис. 3. Использование уксусной кислоты.
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус.
Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом.
Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4.2
Всего получено оценок: 618.
А какая ваша оценка?
Гость завершил
Тест по теме Петр Первыйс результатом 10/20
Гость завершил
Тест «Отцы и дети»с результатом 12/15
Гость завершил
Тест на тему «Социализация»с результатом 6/10
Гость завершил
Тест «Биография Байрона»с результатом 9/10
Гость завершил
Тест «Сын полка»с результатом 10/16
Гость завершил
Тест «Робинзон Крузо»с результатом 16/16
Гость завершил
Тест «Ревизор»с результатом 15/17
Не подошло? Напиши в х, чего не хватает!
Уксусная кислота – химические свойства
Уксусная кислота представляет собой одноосновную кислоту. Химический характер данной кислоты определяется наличием в ней карбоксила – СООН.
По показателям химических свойств, уксусная кислота считается слабой кислотой, ее константа электролитической диссоциации составляет 1,82*105 мол/л при температуре 18°С.
Высококонцентрированная уксусная кислота, точно также, как и минеральные кислоты, способна нейтрализовать гидраты и основные окислы, а также эффективно вытеснять из углекислых солей углекислоту.
При этом она дает соответствующие средние соли которые называются ацетатами. Именно на этом свойства уксусной кислота основано получения уксуснокислых солей в технике.

В ходе нейтрализации гидроокисей уксусной кислотой, таких как КОН, NaOH, Ca(OH)2, интенсивно выделяется почти 56 кДж/г*экв. В случае нейтрализации гидроокиси аммония будет выделяться 50,3 кДж/г*экв.
Никак не воздействует на углекислые соли безводная уксусная кислота или же ее спиртовой раствор. Все наоборот, углекислота активно вытесняет уксусную кислоту из водно-спиртового раствора уксуснокислых солей, при этом углекислые соли, выпадают в осадок (будучи вовсе нерастворимыми в спирте).
- Уксуснокислые средние соли тяжелых металлов также можно получить при помощи обменного разложения ацетатов щелочноземельных или щелочных металлов с хлоридами или сульфатами соответствующих тяжелых металлов. Свинец, медь, железо (свободные металлы) способны заместить водород уксусной кислоты, при этом образуя соответствующие соли:
- 6СН3СООН + 2Fe = 2Fe(CH3CОО)3+3Н2; 2СН3СООН + Рb = Pb(CH3CОО)2+H2;
- ЗСН3СООН+Cu = Cu(CH3COO)2+CH3CHO+H2O
Последняя реакция, в которой часть кислоты восстанавливается до ацетальдегида из-за слабоактивной меди протекает, но очень медленно. По этой причине медь считается одним из самых важных материалов для производства оборудования, необходимого в ходе производства уксусной кислоты.

В присутствии кислорода (воздуха) реакция уксусной кислоты с металлами протекает намного быстрее, особенно если используется свинец или железо.
Реакция уксусной кислоты с магнием и цинком даже на холоде протекает достаточно энергично, особенно если в кислоте концентрация ионов водорода будет максимальной.
Практически все средние соли уксусной кислоты растворяются в воде и отлично кристаллизуются. Только одновалентная уксуснокислая ртуть и уксуснокислое серебро являются исключением.
Из солей щелочных металлов растворимость уксусного натрия в 100 г воды при 20°С — 46,5 г, а при 100°С — 170г.
При охлаждении горячего насыщенного раствора вначале выпадают кристаллы безводной соли, а затем (при охлаждении ниже 60°С) кристаллы трехводной соли CH3COONa*ЗН2O.
В водном растворе уксуснокислого натрия довольно хорошо растворяется гипс (на 100 частей Ch3COONa около 10 частей CaSO4) и некоторые другие нерастворимые в воде соли. В данном случае имеет место ионообмен и реакция вtдет до некоторого положения равновесия.
Хорошо растворимы в воде ацетаты щелочноземельных металлов, выделяющиеся из растворов в виде кристаллогидратов. Например, в 100г воды при 20°С растворяется безводной соли 35г Ca(CH3COO)2, 41г Sr(CH3C00)2 и 72г Ва(СН3С00)2. Константы диссоциации ионов 3CH3COO этих солей равны соответственно 0,17(Са), 0,36 (Sr) и 0,39 (Ba).






