- Что такое простые вещества
- Металлы
- Неметаллы
- Что такое сложные вещества
- Неорганические вещества
- Номенклатура неорганических веществ
- Аллотропия — это… Понятие, причины и примеры аллотропии :
- Определение
- Виды аллотропии
- Каким веществам свойственна аллотропия
- Примеры аллотропии
- Модификации неметаллов
- Модификации полуметаллов
- Модификации металлов
- Заключение
- Явление аллотропии в химии, химические предпосылки для аллотропных модификаций и их примеры
- Аллотропия, это
- Аллотропные преобразования
- Химия аллотропных переходов
- Некоторые химические элементы и их модификации
- Неметаллы
- Полуметаллы
- Металлы
- Видео
- Pereosnastka.ru
- Реклама:
- Аллотропия
- Аллотропные модификации
- ПОИСК
- Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
- Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
- В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
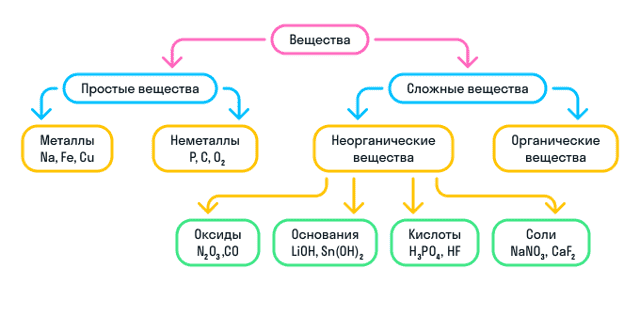
Что такое простые вещества
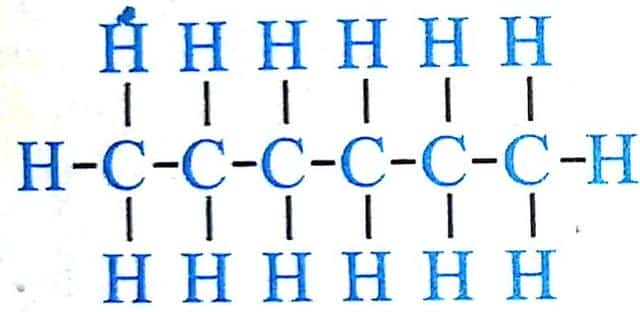
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
- одноатомные: He, Si, Ar и другие;
- двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
- трехатомные — например, молекула озона O3;
- и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
-
Проведите диагональ от 5-го до 85-го номера химических элементов.
-
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
-
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
|
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
|
- Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
- Образующиеся простые вещества называют аллотропными модификациями.
- Аллотропия характерна для следующих химических элементов:
- углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
- фосфор (красный, белый и черный);
- кислород (кислород и озон);
- кремний (аморфный и кристаллический);
- Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of «Crystal» by manfredxy on Envato Elements.
The image 2 is a derivative of «Rough Graphite rock» by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
- Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
- Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
- К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
-
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
-
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
-
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
-
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
- Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
- В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
- В систематической номенклатуре название зависит от вида неорганического вещества.
- Оксиды
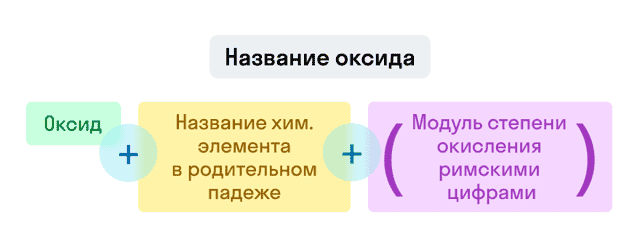
Если степень окисления у элемента постоянная, то она в конце названия не указывается.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три;
- Na2O — оксид натрия. Читается: натрий два о.
Основания
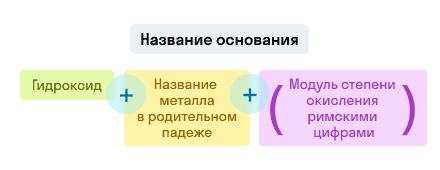
Примеры названий гидроксидов:
- Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
- NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
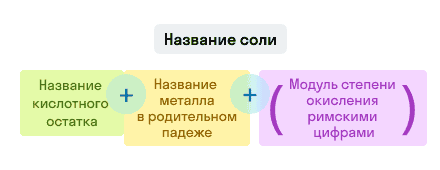
Примеры названий солей:
- KNO3 — нитрат калия. Читается: калий эн о три;
- AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
| HF | Фтороводород, плавиковая | F− | Фторид |
| HCl | Хлороводород, соляная | Cl− | Хлорид |
| HBr | Бромоводород | I− | Йодид |
| H2S | Сероводород | S2− | Сульфид |
| HCN | Циановодородная | CN− | Цианид |
| HNO2 | Азотистая | NO2− | Нитрит |
| HNO2 | Азотная | NO3− | Нитрат |
| H3PO4 | Ортофосфорная | PO43− | Фосфат |
| H3AsO4 | Мышьяковая | AsO43− | Арсенат |
| H2SO4 | Сернистая | SO32− | Сульфит |
| H2SO4 | Серная | SO42− | Сульфат |
| H2CO3 | Угольная | CO32− | Карбонат |
| H2SiO3 | Кремниевая | SiO32− | Силикат |
| H2CrO4 | Хромовая | CrO42− | Хромат |
| H2Cr2O7 | Дихромовая | Cr4O72− | Дихромат |
| HMnO2 | Марганцовая | MnO4− | Перманганат |
| HClO | Хлорноватистая | ClO− | Гипохлорит |
| HClO2 | Хлористая | ClO2− | Хлорит |
| HClO3 | Хлорноватая | ClO3− | Хлорат |
| HClO4 | Хлорная | ClO4− | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO− | Формиат |
| CH3COOH | Этановая, уксусная | CH3COO− | Ацетат |
| H3C2O4 | Этандиовая, щавелевая | C2O4− | Оксалат |
Знать свойства и строение простых и сложных веществ важно не только на экзамене, но и в жизни. Поэтому на курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart мы разбираем много реальных примеров, смотрим опыты и учимся применять полученные знания в быту.
Летняя перезагрузка
Бесплатный телеграм-марафон для мам и пап. Узнайте, как провести семейное лето с пользой, и подготовьтесь к нему уже сейчас!

Аллотропия — это… Понятие, причины и примеры аллотропии :
Химия изучает свойства и строение простых веществ. В большинстве своем они остаются неизменными в любых ситуациях. Однако есть ряд элементов, способных менять свои свойства в различных своих состояниях. Такое явление называется аллотропией. Знание о поведении элементов, подверженных аллотропии, расширяет понимание устройства мира и поведения в нем веществ и элементов.
Определение
Аллотропия — это возможность элемента трансформироваться в другой. В некоторых случаях даже в два или три. Если переводить название термина с греческого языка, то аллотропия — это «другое свойство». То есть буквальный перевод раскрывает сущность явления.
Виды аллотропии

Аллотропия, свойственная некоторым веществам, условно делится на два вида — по составу и по строению. В первом случае различно число атомов в молекуле. Во втором — строение кристаллической решетки.
В химии аллотропия — это изменение вещества независимо от того, жидкое оно, твердое или газообразное. Единственное отступление от терминологии появляется в работе с твердыми веществами, их строение сложнее, для их трансформации используется слово «полиморфизм», в переводе с греческого означающее «многообразный».
Каким веществам свойственна аллотропия
Не все вещества способны преобразоваться из сложных в простые даже под действием температур или других воздействий.
Это может происходить только с теми из них, у которых есть способность к образованию гомоцепных структур или хорошо окисляющихся. Именно поэтому аллотропия веществ свойственна неметаллам.
Хотя справедливости ради следует сказать, что есть металлы, способные преобразовываться в простые элементы, но это, скорее, полуметаллы.
Примеры аллотропии
Для понимания процесса существует ряд примеров преобразования вещества, причем оно бывает обратимым и необратимым. То есть вещество может после воздействия на него температуры или давления вернуться к первоначальному состоянию.
Но бывает так, что оно остается в видоизмененном состоянии. Например, ромбическая сера — при нагревании ее до температуры 95,5 градуса по Цельсию она преобразуется в моноклинную форму.
При снижении температуры до 95,5 градуса наступает обратное преобразование — из моноклинной формы в ромбическую.
Другой пример аллотропии — это изменение белого фосфора в черный. В данном случае для проведения преобразования требуется температура в 200 градусов по Цельсию и давление в 1,25 г Па. При воздействии тех же температур и давления на преобразованный черный фосфор он не сможет вернуться к первоначальному состоянию.
Как уже упоминалось, явление аллотропии свойственно и некоторым металлам. Но из-за сложности их структуры переходы из одного в другое состояние могут чередоваться.
Например, в нормальных условиях белое олово является пластичным металлом, но при нагревании его при температуре 173 градуса по Цельсию оно перестраивает свою кристаллическую решетку до очень хрупкого состояния, а при снижении температуры до 13 градусов кристаллическая решетка принимает вид кубической алмазоподобной и делает вещество порошкообразным.
Модификации неметаллов

Самыми яркими и многообразными физическими свойствами аллотропии обладает углерод. Он способен перерождаться в самое большое количество аллотропных форм, причем с различными не только свойствами, но и строением кристаллической решетки. Взять, например, графит и алмаз. Формы одного вещества, но с разными строениями кристаллических решеток – графит чуть плотнее порошка, а алмаз — самое крепкое вещество на земле. И это уже не говоря об углеродных нанотрубках, лонсдейлите, фуллерене, карбине и других формах углерода.
Аллотропия характерна для серы. В нормальных условиях структура вещества моноклинная, а под воздействием температур может преобразоваться в пластическую и следом за этим в ромбовидную.
Фосфор способен изменяться в 11 форм. Причем 3 из них — белый, черный, красный — даже встречаются в природе, остальные можно получить искусственным путем. Отличается одна форма вещества от другой количеством атомов в молекуле. Различными цветами в химии представлен селен. Он также бывает серный, черный и красный.
Очень известная аллотропия — это кислород. Он видоизменяется до озона под действием температуры или электрического тока. Известный пример природного воздействия – молния. Во время разряда электрического поля кислород превращается в озон.
Модификации полуметаллов

Бор — это полуметалл, встречающийся в природе в аморфной и кристаллической форме. Но у него есть еще 10 известных науке форм.
Аморфным и кристаллическим бывает кремний. Сурьма в четырех формах по своей структуре представляется металлом, и в трех она аморфная, аллотропная.
Как и в случае с фосфором или селеном, мышьяк бывает серый или черный, в зависимости от формы – полимер или неметаллическая структура.
Модификации металлов

Самым широким спектром форм среди металлов обладает железо. В первом виде феррита, с характерной объемно-центрированной кубической кристаллической решеткой, железо способно существовать в температурных пределах от 0 до 769 градусов по Цельсию. Имеет свойства ферромагнетиков.
Второй тип феррита существует при температурах в диапазоне 769-917 градусов по Цельсию. Отличается объемно-центрированной кубической кристаллической решеткой. Магнетические свойства проявляет как парамагнетик.
Третий тип железа называется аустенит, характерен гранецентрированной кубической кристаллической решеткой. Способен существовать только при температурах от 917 до 1394 градусов по Цельсию. Магнитных свойств не имеет.
Четвертый тип железа возникает при температурах свыше 1397 градусов по Цельсию. Магнитных свойств не имеет, характерен объемно-центрированной кубической кристаллической решеткой.
Другой металл, имеющий несколько типов преобразования, — это олово. В аллотропной форме может существовать в виде порошка с кристаллической решеткой, подобной алмазной. Это так называемое серое олово.
Есть и более привычная форма металла – белое олово. Оно встречается в виде пластичного метала серебряного цвета.
Третья форма характерна тугоплавкостью, так как обладает ромбической кристаллической решеткой, называется она гамма-оловом.
Заключение

Все металлы, полуметаллы и неметаллы различных аллотропных типов с характерным строением кристаллических решеток, массой, количеством и зарядом протонов и нейтронов могут встречаться в природе в чистом, натуральном виде или получаются только в лаборатории. В обычных условиях они не сохраняют своей стабильности. Все это говорит о многообразии химических элементов и перспективах открытий новых доселе неизвестных науке форм и типов веществ. Такие исследования ведут к развитию всех отраслей жизнедеятельности человека.
Явление аллотропии в химии, химические предпосылки для аллотропных модификаций и их примеры
В природе встречаются такие химические элементы, которые могут существовать в форме различных простых веществ, свойства которых, как химические, так и физические различны, а также кардинально различны строения их кристаллических решеток. В химии это называется «Аллотропия».
Аллотропия, это
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство.
Термин вошел в обиход с 1841 благодаря шведскому ученому, И. Я. Берцелиусу, в целях обозначения различных форм проявления одного и того же химического элемента.
Аллотропия химических элементов может проявляться в виде:
- аллотропии состава, когда различно число атомов в молекуле,
- аллотропии формы, когда различны строения кристаллических решеток.
В современной химии термин «Аллотропия» используется для простых веществ, вне зависимости от их агрегатного состояния.
Для веществ с твёрдым агрегатным состоянием, независимо от того, это вещество простое или сложное, используется термин «Полиморфизм» (от греческого слова Διαφοροποιημένο — многообразный).
Аллотропные преобразования
- Химические элементы, образующие различные простые вещества и встречающиеся в природе, называются аллотропными формами химического элемента.
- Химические элементы, образующие различные простые вещества под воздействием изменения окружающих условий, например, температура и давление, называются аллотропными модификациями химического элемента.
- Не все химические элементы обладают свойством аллотропии.
- Установлено, что аллотропией обладают химические элементы с высокой степенью окисления и способностью атомов к образованию гомоцепных структур.
- Поэтому аллотропные преобразования в основном наблюдаются у неметаллов (за исключением галогенов и инертных газов), а также у полуметаллов.
Аллотропные преобразования металлов в природе встречаются намного реже. Только 28 металлов при атмосферном давлении имеют аллотропные формы и 6 образуют аллотропные модификации при их технологической обработке.
Химия аллотропных переходов
Преобразования химического элемента происходят при химическом переходе его атомного или молекулярного состояния из одной формы в другую. Эти переходы могут происходить при изменении окружающих условий, например:
- при нормальном давлении и изменении температуры;
- при изменении давления при неизменной температуре;
- при одновременном изменении давления и температуры.
Эти преобразования могут носить обратимый (энантиотропный) характер или необратимый (монотропный).
Примеры преобразований:
- энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.
- монотропный переход — модификация белого фосфора P4 в чёрный фосфор при температуре 200 °C и давлении 1,25 ГПа. Возвращение температуры и давления к исходным условиям не приводит к обратному переходу.
- У некоторых химических элементов аллотропные переходы могут чередоваться.
- Примером является олово.
- Белое олово (β-Sn) в обычных условиях пластичное, имеет тетрагональную кристаллическую решетку и устойчиво.
Белое олово при повышении температуры выше 173 °C, превращается в хрупкую форму (γ-Sn). Превращение происходит энантиотропно.
Белое олово при понижении температуры ниже 13.2 °C, превращается в серое олово (α-Sn) порошкообразное с кубической алмазоподобной решёткой. Превращение происходит монотропно.
Некоторые химические элементы и их модификации
Неметаллы
- Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
- Сера — вторая по подверженности аллотропии среди неметаллов. Основные ее виды: ромбическая, моноклинная и пластическая. При нормальных условиях окружающей среды моноклинная и пластическая модификации серы переходят в ромбическую.
- Фосфор — имеет 11 аллотропных форм, различающихся числом атомов в молекуле, химическими связями и свойствами, из которых белый фосфор, красный фосфор и черный фосфор имеют устойчивые формы и встречаются в природе, остальные формы распадающиеся и в природе не встречаются.
- Селен — в свободном состоянии бывает в трех видах: красный цикло-Se8, гексагональный или серый селен Se и чёрный селен.
- Водород — бывает в виде o-H2 (орто-водород) и p-H2 (пара-водорода). Молекулы o-H2 и p-H2 отличаются построением ядерных спинов. У o-H2 они параллельные, у p-H2 антипараллельные.
- Кислород — модифицируется в два вещества: Кислород (O2) и Озон (O3).
Полуметаллы
- Бор — встречается в более, чем в 10 состояниях в аморфной и кристаллической формах. Физические свойства этих форм различны.
- Кремний — бывает в аморфной и кристаллической формах. У кристаллической модификации решётка атомная, алмазоподобная.
- Сурьма — имеет четыре металлические и три аморфные аллотропные модификации. Металлические формы существуют при разном давлении. Аморфные формы сурьмы: взрывчатая, чёрная и жёлтая.
- Мышьяк — встречается в трех аллотропных состояниях: в виде неметалла или жёлтый мышьяк, в виде полуметаллического полимера или серый мышьяк, в виде неметаллической молекулярной структуры или чёрный мышьяк.
Металлы
- Железо — бывает в виде четырех кристаллических модификаций:
- α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
- β-Fe. Имеет решётку объемноцентрированную кубическую. Существует при температурах от 769 °C до 917 °C. Обладает магнитными свойствами парамагнетики;
- γ-Fe или аустенит. Имеет решётку гранецентрированную кубическую. Существует при температурах от 917 °C до 1394 °C;
- δ-Fe. Имеет решётку объемноцентрированную кубическую. Имеет устойчивость при температуре выше 1394 °C.
- Олово — имеет две аллотропные формы: серое олово (α-Sn) с алмазоподобной кристаллической решёткой в виде мелкокристаллического порошка и белое олово (β-Sn) в виде пластичного серебристого металла, а также одну аллотропическую модификацию гамма-олово (γ-Sn) с ромбической структурой. Оно высокотемпературное.
Видео
Pereosnastka.ru
- Аллотропия металлов
- Категория:
- Металлы
Аллотропия металлов
Многие твердые тела способны существовать при различных условиях температуры и давления в нескольких кристаллических разновидностях (модификациях). О таких телах говорят, что они полиморфны или обладают полиморфизмом.
Углерод, например, может существовать в двух полиморфных формах или модификациях: в виде алмаза с весьма сложной кристаллической решеткой (решетка типа алмаза) и графита (гексагональная решетка).
Применительно к простым кристаллическим образованиям, типичным для металлов, принято говорить не о полиморфизме, а об аллотропии и об аллотропических модификациях.
Аллотропия свойственна не менее чем двенадцати металлам, Ряд из которых имеют важнейшее техническое значение (Sn, Ti, Zr. Сг, Mn, Fe, Co, Ni, V, Np, Pu).
Аллотропические модификации, число которых в некоторых случаях доходит до пяти, принято обозначать греческими буквами а, р, у, 8, « с добавлением символа элемента, например a-Sn, y-Fe, e-Pu и т. д.
Железо при разных температурах способно кристаллизоваться в кубической объемноцентрированной и в кубической гране-центрированной решетках.
Оно находится в виде аллотропической модификации альфа (объемноцентрированный куб) в пределах от абсолютного нуля до 910°, модификации гамма (гране-центрированный куб) в пределах от 910 до 140Г и от 1401 до точки плавления 1539° — вновь в виде модификации альфа.
При нагревании и охлаждении чистого железа на кривых температура—время (рис. 1) при переходе одной аллотропической модификации в другую наблюдаются температурные точки скачкообразного превращения в виде горизонтальных участков.
На кривой нагревания заметны две такие остановки: первая наблюдается при 910°, где а-железо переходит в у-железо, и вторая при 1401°, где Т-железо вновь превращается в a-железо.
Остановки при 768° и при 1539° не являются точками аллотропических превращений, так как первая остановка сопровождается не перестройкой решетки, а лишь потерей железом магнитных свойств.
Вторая остановка при 1539° характеризует не перестройку решетки, а ее разрушение, т. е. переход металла в жидкое состояние.
- Из изложенного следует, что на кривой нагревания имеется четыре критические точки:
1) при 768° точка магнитного превращения, при которой железо в процессе нагревания утрачивает магнитность (международное обозначение Асг);
2) при 910° точка аллотропического превращения а-железа немагнитного в т-железо (обозначение Ас3);
3) при 1401° точка аллотропического превращения у-железа вновь в a-железо немагнитное (Ас4); - 4) при 1539° точка плавления.
При охлаждении превращения идут в обратном порядке. Критическими точками окажутся: точка затвердевания при 1539°; точка Аг4 при 1401°, точка Аг3 при 898° вместо 910° вследствие температурного отставания или гистерезиса и точка Агг при 768°.
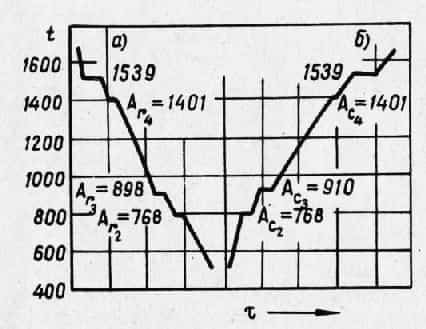
Рис. 1. Термические кривые охлаждения (а) и нагрева (б) железа
Кобальт при температурах до 419° имеет гексагональную решетку (а-Со), а от 419 и до точки плавления 1492° — гране-центрированную кубическую (р-Со).
Олово при комнатных и более высоких температурах существует в виде модификации fi-Sn (белое олово) с тетрагональной решеткой, а при температурах ниже 13,2° — в виде модификации a-Sn (серое олово) со сложной пространственной решеткой типа решетки алмаза.
Полиморфизм (аллотропия) присущ всем химическим элементам, с изменением температуры изменяющим свою валентность, т. е. способным отдавать в среду электронного газа переменное число электронов.
Такое изменение электронного газа сопровождается перестройкой пространственной решетки, причем новая модификация, как обладающая меньшим запасом свободной энергии, оказывается в данной температурной области более устойчивой по сравнению с прежней.
Реклама:
Аллотропия
Изучение простых веществ и их свойств чрезвычайно важно для неорганической химии и закладывает основу для ее изучения.
Кардинальная особенность простых веществ заключается в том, что при рассмотрении их свойств не нужно учитывать изменения их состава, поскольку он всегда один и тот же.
Но и у простых веществ необходимо уделить особое внимание явлению аллотропии. Это позволит выявлять зависимость свойств веществ от их химического строения.
Аллотропия (от греческого «tropos» — признак) — это процесс, при котором один химический элемент может трансформироваться в два или больше простых веществ.
К примеру, атомы кислорода могут преобразоваться в два других различных вещества – кислород и озон, а сера – кристаллическую и пластическую серу. Вещества, которые образовались из атомов одно химического элемента, называют аллотропными модификациями этого элемента.
Аллотропия вызвана разнящимся набором молекул в простом веществе или разным местонахождением частиц в кристаллической решётке этого вещества.
В 1841 году явление аллотропии стало известно науке благодаря ученому Йенсу Якобу Берцелиусу, позднее тщательные и долгие исследования этого явления были проделаны А. Шреттером.
В 1860 году, вскоре после того как был открыт закон Авогадро, по которому в веществах одного объема, где установлены равные температуры и давление, существует равное количество молекул, ученые поняли, что элементы имеют возможность находиться в форме молекул со множеством атомов. К примеру, О2 — кислород и О3 — озон.
В самом начале двадцатого века стало понятно, что отличия в кристаллической конструкции простых веществ — это еще одна причина аллотропии.
Аллотропные модификации
На сегодняшний день насчитывается больше четырехсот аллотропных модификаций простых веществ. К примеру, алмаз и графит – это аллотропные модификации углерода, хотя эти вещества внешне совершенно непохожи. У графита структура гексагональная слоистая, а у алмаза выглядит как правильно соединенная с друг другом сетка тетраэдрических образований.
Иногда это явление объединяют с полиморфизмом. Это возможность веществ твердого агрегатного состояния находится в двух или больше видоизменениях с различной кристаллическим построением и свойствами при одинаковом химическом составе.
Но аллотропия имеет отношение лишь к простым веществам, вне зависимости от их агрегатного состояния, а полиморфизм — к любому твердому вещество, без указания на то, простое оно или сложное.
Несмотря на количество аллотропных модификаций у химического элемента, самым стойким и не разрушающимся оказывается, в большинстве, только одно.
Вот примеры одних из самых распространенных примеров аллотропии веществ: углерод может образовать множество аллотропных модификаций — алмаз, графит, карбин и т.д. Кремний образует два аллотропных видоизменения: аморфный и кристаллический кремний.
Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Разнообразие сложных веществ наблюдается из-за их разного количественного состава. Его можно определить по набору электронов, находящихся на электронном уровне атома и количественное содержание протонов и нейтронов в ядре.
Но было обнаружено, что химические элементы могут образовывать различные вариации, у которых у ядер один и тот же заряд, но при этом у них разные массы. Такие разновидности атомов называются изотопами.
Явления аллотропии и изотопии являются подтверждениями многообразия неорганических веществ.
ПОИСК
Полиморфизм (аллотропия) металлов — это их способность к образованию различных кристаллических типов структур при изменении температуры.
[c.11]
Что такое аллотропия металлов [c.24]
Аллотропия металлов.
Аллотропией называется способность одного и того же элемента при различной температуре иметь разную
[c.17]
Полупроводниковые материалы 462 Поликристаллическое состояние 19 Полиморфизм — см. Аллотропия металлов Полосы скольжения 357 Полуспокойная сталь 131 Пороки
[c.498]
Аллотропия металлов. Аллотропией называется способность одного и того же элемента при различной температуре обладать разной кристаллической структурой. Уральский металловед П. Н. Васильев, показал, что все элементы, имеющие переменную валентность, меняющуюся при изменении температуры, обнаруживают аллотропию. Размещение ионов в узлах решетки определяется их взаимодействием с электронным газом. Изменение температуры, вызывающее изменение состояния электронов, может вызвать перемещения ионов в узлы новой решетки. Аллотропические превращения сопровождаются выделением или поглощением тепла. Различные аллотропические видоизменения элементов принято обозначать греческими буквами а, t5, f, и т. д., причем букву а присваивают той аллотропической форме, которая существует при самой низкой температуре. Многие металлы при разных температурах обладают различной кристаллической решеткой, т. е. встречаются в различных аллотропических формах (модификациях) см. таб.тт. 1.
[c.27]
И переход из одного вида кристаллической решетки в другой-. Такое явление носит название аллотропии металлов. Различные кристаллические формы, в которые кристаллизуется один и тот же твердый металл при определенных температурах, называются
[c.31]
С возрастанием температуры, по мере все большего увеличения расстояния между положительными ионами или атомами, существовавшая в металле элементарная ячейка кристаллического вещества может стать настолько неустойчивой, что при некоторой температуре положительные ионы или атомы часто перестраиваются в новую, более устойчивую в данных температурных условиях решетку с совершенно другими элементарными ячейками. Так, например, чистый кальций при нагреве свыше температуры 464° С изменяет свою элементарную ячейку с кубической гранецентрированной на кубическую объемноцентрированную. Это явление существования одного и того же кристаллического вещества в различных состояниях при разных температурах называется полиморфизмом или аллотропией металлов. Оно весьма важно для техники и проявляется у многих цветных и черных металлов.
[c.16]
Аллотропия металлов.
Аллотропия металлов (или полиморфизм) — свойство перестраивать решетку при определенных температурах в процессе нагрева и охлаждения — присуща многим металлам (железу, марганцу, никелю, олову, титану, ванадию и др.).
Каждое аллотропическое превращение происходит при определенной температуре (например, одно из превращений железа происходит при температуре 911 °С, ниже которой атомы составляют ре-
[c.20]
Существование одного металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии. Различные кристаллические формы одного вещества называются полиморфными, или аллотропическими модификациями.
[c.55]
Существование одного и того же металла в нескольких кристаллических формах носит название полиморфизма, или аллотропии. Перестройка кристаллических решеток при критических температурах называется полиморфными превращениями.
Полиморфные модификации обозначаются греческими буквами а, (3, v и другими, которые в виде индекса добавляют к символу элемента. Полиморфную модификацию при самой низкой температуре обозначают буквой а, при более высокой р и т. д.
[c.5]
Способность металла изменять тип своей кристаллической решетки в зависимости от температуры называется аллотропией полиморфизмом). Полиморфные превращения свойственны также титану, цирконию, олову и другим металлам.
[c.9]
Углеродистая сталь ввиду аллотропии железа при охлаждении стального слитка претерпевает вторичную кристаллизацию. Существовавшее при высокой температуре Y-железо превращается в а-железо.
В процессе этого превращения все первичные кристаллы дробятся на более мелкие вторичные кристаллы.
Однако первичная структура в слитке может определять многие свойства металла после вторичной кристаллизации и даже после последующей ковки, прокатки и других операций обработки.
[c.25]
Основной причиной аллотропии является стремление любого вещества обладать минимальным запасом свободной энергии Р, которая изменяется в зависимости от абсолютной температуры Г по формуле Р = и-Т8, где и — внутренняя энергия вещества, 8 — энтропия (термодинамическая функция). Если у металла по достижении какой-то определенной температуры изменение типа кристаллической решетки обеспечивает уменьшение запаса свободной энергии, то такой металл претерпевает аллотропическое превращение.
[c.11]
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом а (a-Fe), при более высокой индексом р, затем у и т.д.
[c.9]
Во многих случаях в разных температурных интервалах один и тот же металл обладает различными кристаллическими решетками. Такое явление носит название полиморфизм или аллотропия.
[c.19]
Существование различных кристаллических модификаций вещества носит название полиморфизма. Частным случаем полиморфизма является аллотропия — явление существования чистых элементов в различных кристаллических модификациях.
Аллотропия — распространенное явление. При нормальном давлении аллотропия проявляется у многих химических, элементов щелочных металлов, ряда редкоземельных элементов, титана, циркония, гафния, марганца, кобальта, железа, урана.
[c.
162]
Некоторые металлы (железо, кобальт, олово и др.) имеют в твердом состоянии два и более типа кристаллических реШеток при неодинаковых температурах.
Существование одного и того же металла в различных кристаллических формах называют аллотропией, а процесс перестройки атомов одного типа кристаллической решетки в другой — аллотропным превращением.
Аллотропные формы, в которые кристаллизуется металл, обозначают буквами , р, V, б и т. д.
[c.5]
Многие металлы обладают температурной аллотропией, т. е. при изменении температуры меняют свою кристаллическую решетку.
При этом установлено [12], что высокотемпературные (по сравнению с низкотемпературными) модификации обладают, как правило, более высокой симметрией и, таким образом, высокотемпературная модификация является обычно наиболее благоприятной для пластической деформации.
Отсюда вытекает целесообразность стабилизации — сохранения при комнатных температурах в сплавах высокотемпературных фаз для повышения пластичности сплава (например, переход от ферритных к аустенитным сталям) и, при прочих равных условиях,— целесообразность проведения обработки давлением при температурах высокотемпературной модификации.
[c.250]
Такое явление называется аллотропией. Оно повторяется каждый раз при медленном нагреве и охлаждении металла при определенной температуре, называемой критической точкой.
[c.136]
Эта способность металлов названа вторичной кристаллизацией, или аллотропией (по-гречески — иной вид ), а изменения, происходящие в расположении атомов в кристаллах, — аллотропическими превращениями. Одновременно с изменением кристаллической решетки изменяются. свойства мета-лла.
[c.17]
Аллотропия (полиморфизм) металлов. Некоторые металлы, как железо, марганец, кобальт, олово и др.
, в зависимости от температуры нагрева могут иметь кристаллические решетки различного строения и, следовательно, обладать различными свойствами. Это явление называется аллотропией, или полиморфизмом.
Аллотропические формы принято обозначать буквами греческого алфавита а Р )[ 8 и т. Д.
[c.40]
У некоторых металлов превращения происходят и в твердом состоянии. При таком превращении атомы в кристаллической решётке из одного вида элементарной ячейки перестраиваются в другой. Это явление называют полиморфизмом, или аллотропией, а процесс — полиморфным, или аллотропическим, превращением.
[c.76]
Аллотропия металлов заключается в том, что при еизменном химическом составе металл в зависимости от температуры изменяет свою структуру, т. е. вза Имиое расположение атомов.
[c.18]
Предлагаемая вниманию читателей книга Атомное строение металлов и сплавов является первым из этих выпусков ). Она состоит из пяти глав, в которых рассматриваются основы теории металлического состояния.
В первой главе изложены электронная структура атомов, типы межатомной связи, классификация кристаллических структур металлов, аллотропия металлов и их физические свойства, связанные с природой межатомного взаимодействия. Изложение ведется на уровне современных представлений электронной теории металлов.
Надо, однако, отметить, что не со всеми положениями автора можно согласиться. В частности, современным представлениям не соответствует утверждение о том, что ковалентные кристаллы являются изоляторами как в твердом, так и в жидком состоянии. Как установлено к настоящему времени, такие ковалентные кристаллы, как кремний и германий, становятся после плавления проводниками, т.
е. переходят в металлическое состояние. Некритично излагается также гипотеза Л. Полинга о резонансном характере межатомной связи в металлах переходных групп, в соответствии с которой пять d-орбиталей атомов этих элементов разделяются на две группы — связывающие и атомные. Известно, что указанную гипотезу в настоящее время большинство металлофизиков не разделяет.
Желающим детальнее ознакомиться с рассматриваемыми в этой главе вопросами можно рекомендовать помимо уже упоминавшихся трудов книгу В. К. Григоровича Периодический закон Менделеева и электронное строение металлов (изд-во Наука , 1965).
[c.7]
Аллотропия металлов.
Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы железо, олово, титан и др.
Например, железо в интервале температур 911-1392 С имеет гране цен-трированную кубическую решетку (ГКЦ) у-Ре рис.7). В интервалах до 91 Г С и от 1392 до 1539″С железо имеет объемно-центрированную кубическую решетку (ОЦК) — а-Ре. Аллотропические формы металла обозначаются буквами а, (3, у и т. д.
Существующая при самой низкой температуре аллотропическая форма металла обозначается через букву а, которая в виде индекса добавляется к символу химического элемента металла и т. д.
[c.12]
В табл. 9 П01казан интервал температур существования различных аллотропических форм некоторых, имеющих практическое значение металлов, у которых обнаружена температурная аллотропия.< [c.55]
Физические свойства плутония делают его очень интересным и весьма опасным материалом. Для специалистов, занимающихся физикой твердого тела, этот металл в чистом виде интересен тем, что имеет шесть различных кристаллических форм, называемых аллотропами, каждая из которых имеет собственные явно выраженные физические характеристики.
[c.40]
Многие металлы при изменении температуры меняют тип кристаллической решетки. К таким металлам относятся железо, кобальт, титан, марганец, олово и некоторые другие. Способность металла менять тип кристаллической решетки с изменением температуры называется аллотропией. ОдноВ(ременно с изменением кристаллической решетки изменяются и свойства металла.
[c.14]
Полиморфное превращение (перекристаллизация). Некоторые металлы в зависимости от темпер1атуры могут существовать в различных кристаллических формах.
Это явление называется полиморфизмом или аллотропией, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением.
Полиморфные превращения протекают при определенной температуре.
[c.20]
Diiatometer — Дилатометр. Прибор для измерения линейного расщирения или сужения в металле, в результате аллотропии и изменения температуры.
[c.938]
У многих элементов при нагреве или охлаждении можно наблюдать переход от одной структуры к другой. В табл. 3 присущие элементам аллотропические формы перечисляются сверху вниз, начиная с высокотемпературной модификации. При рассмотрении табл.
3 в отношении структуры металлов можно отметить две закономерности во-первых, при наличии двух аллотропических модификаций при высоких температурах структура ОЦК является более устойчивой, чем структуры ГЦК и ГПУ, и, во-вторых, явление аллотропии наиболее характерно для тех металлов, которые имеют незначительную разницу в энергиях электронных состояний ns, пр, п — 1) Z и п — 2) /, т. е.
для металлов подгруппы ПА, переходных металлов, а также для элементов, располагающихся в начале лантанидного и актинидного рядов.
[c.36]






