- Список радиоактивных металлов
- Самый радиоактивный металл
- Что такое радиация
- Изучение радиоактивных элементов
- Добыча и синтез
- Практическое применение
- Радиоактивные элементы
- Как был открыт
- Свойства и применение
- Запасы и месторождения
- Биологическая роль
- Радиоактивные металлы: список
- Свойства и характеристики
- Уран
- Радий
- Плутоний
- Биологическое воздействие
- Теги
- Радиоактивные элементы
- Радиоактивные металлы
- Почему одни предметы радиоактивные, а другие — нет?
- Что такое радиоактивность очень кратенько?
- Откуда берется радиация?
- Так почему же одни предметы фонят, а другие нет?
- Статьи по теме на моем канале:
- Ещё кое-что полезное:
Радиоактивные металлы — это металлы, которые самопроизвольно излучают поток элементарных частиц во внешнюю среду. Этот процесс называют альфа(α), бета(β), гамма(γ) излучением или просто радиоактивным излучением.
Все радиоактивные металлы со временем распадаются и превращаются в стабильные элементы (иногда проходя целую цепочку превращений). У разных элементов радиоактивный распад может длиться от нескольких миллисекунд до нескольких тысяч лет.
Рядом с названием радиоактивного элемента часто указывается массовое число его изотопа. Например, Технеций-91 или 91Tc. Разные изотопы одного и того же элемента как правило имеют общие физические свойства и различаются лишь длительностью радиоактивного распада.
Список радиоактивных металлов
| Технеций | Technetium | Tc-91 | 4.21 x 106 лет |
| Прометий | Promethium | Pm-145 | 17.4 года |
| Полоний | Polonium | Po-209 | 102 года |
| Астат | Astatine | At-210 | 8.1 часов |
| Франций | Francium | Fr-223 | 22 минут |
| Радий | Radium | Ra-226 | 1600 лет |
| Актиний | Actinium | Ac-227 | 21.77 лет |
| Торий | Thorium | Th-229 | 7.54 x 104 лет |
| Протактиний | Protactinium | Pa-231 | 3.28 x 104 лет |
| Уран | Uranium | U-236 | 2.34 x 107 лет |
| Нептуний | Neptunium | Np-237 | 2.14 x 106 лет |
| Плутоний | Plutonium | Pu-244 | 8.00 x 107 лет |
| Америций | Americium | Am-243 | 7370 лет |
| Кюрий | Curium | Cm-247 | 1.56 x 107 лет |
| Беркелий | Berkelium | Bk-247 | 1380 лет |
| Калифорний | Californium | Cf-251 | 898 лет |
| Эйнштейний | Einsteinium | Es-252 | 471.7 дней |
| Фермий | Fermium | Fm-257 | 100.5 дней |
| Менделевий | Mendelevium | Md-258 | 51.5 дней |
| Нобелий | Nobelium | No-259 | 58 минут |
| Лоуренсий | Lawrencium | Lr-262 | 4 часа |
| Резенфордий | Rutherfordium | Rf-265 | 13 часов |
| Дубний | Dubnium | Db-268 | 32 часа |
| Сиборгий | Seaborgium | Sg-271 | 2.4 минуты |
| Борий | Bohrium | Bh-267 | 17 секунд |
| Ганий | Hassium | Hs-269 | 9.7 секунд |
| Мейтнерий | Meitnerium | Mt-276 | 0.72 секунды |
| Дармштадий | Darmstadtium | Ds-281 | 11.1 секунды |
| Рентгений | Roentgenium | Rg-281 | 26 секунд |
| Коперниций | Copernicium | Cn-285 | 29 секунд |
| Унунтрий | Ununtrium | Uut-284 | 0.48 секунд |
| Флеровий | Flerovium | Fl-289 | 2.65 секунд |
| Унунпентий | Ununpentium | Uup-289 | 87 миллисекунд |
| Ливерморий | Livermorium | Lv-293 | 61 миллисекунда |
Радиоактивные элементы делятся на естественные (существующие в природе) и искусственные (получаемые в результате лабораторного синтеза). Естественных радиоактивных металлов не много — это полоний, радий, актиний, торий, протактиний и уран. Их наиболее стабильные изотопы встречаются в природе, чаще в виде руды. Все остальные металлы из списка созданы человеком.
Самый радиоактивный металл
Самый радиоактивный металл на данный момент — ливерморий. Его изотоп Ливерморий-293 распадается всего за 61 милисекунду. Впервые этот изотоп был получен в Дубне, в 2000 году.
Другой очень радиоактивный металл — унунпентий. Изотоп унунпентий-289 имеет чуть больший период распада (87 милисекунд).
Из более-менее стабильных, практически применяемых веществ, самым радиоактивным металлом считается полоний (изотоп полоний-210). Это серебристый белый радиоактивный металл. Хотя его период полураспада достигает 100 и более дней, даже один грамм этого вещества раскаляется до 500°C, а излучение может мгновенно убить человека.
Что такое радиация
Всем известно, что радиация очень опасна и лучше держаться подальше от радиоактивного излучения. С этим трудно поспорить, хотя в реальности мы постоянно подвержены влиянию радиации, где бы не находились. В земле залегает довольно большое количество радиоактивной руды, а из космоса на Землю постоянно прилетают заряженные частицы.
Кратко говоря, радиация это самопроизвольное испускание элементарных частиц. От атомов радиоактивного вещества отделяются протоны и нейтроны, «улетая» во внешнюю среду.
Ядро атома при этом постепенно изменяется, превращаясь в другой химический элемент. Когда все нестабильные частицы отделяются от ядра, атом перестает быть радиоактивным.
Например, торий-232 в конце своего радиоактивного распада превращается в стабильный свинец.
Наука выделяет 3 основных вида радиоактивного излучения
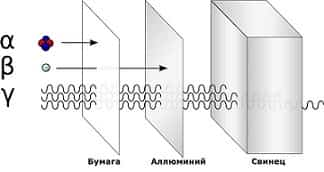
Альфа излучение(α) — поток альфа-частиц, положительно заряженных. Они сравнительно большие по размеру и плохо проходят даже через одежду или бумагу.
Бета излучение(β) — поток бета-частиц, негативно заряженных. Они довольно малы, легко проходят через одежду и проникают внутрь клеток кожи, что наносит большой вред здоровью. Но бета-частицы не проходят через плотные материалы, такие как алюминий.
Гамма излучение(γ) — это высокочастотная электромагнитная радиация. Гамма-лучи не имеют заряда, но содержат очень много энергии. Скопление гамма-частиц излучает яркое свечение. Гамма-частицы проходят даже через плотные материалы, что делает их очень опасными для живых существ. Их останавливают только самые плотные материалы, например, свинец.
Все эти виды излучения так или иначе присутствуют в любой точке планеты. Они не представляют опасности в малых дозах, но при высокой концентрации могут причинить очень серьезный ущерб.
Изучение радиоактивных элементов
Первооткрывателем радиоактивности является Вильгельм Рентген. В 1895 году этот Прусский физик впервые наблюдал радиоактивное излучение. На основе этого открытия был создан знаменитый медицинский прибор, названый в честь ученого.
В 1896 г изучение радиоактивности продолжил Анри Беккерель, он экспериментировал с солями урана.
В 1898 г Пьер Кюри в чистом виде получил первый радиоактивный металл — Радий. Кюри хоть и открыл первый радиоактивный элемент, однако, не успел толком его изучить.
И выдающиеся свойства радия привели к быстрой гибели ученого, который беспечно носил свое «детище» в нагрудном кармане.
Великое открытие отомстило своему первооткрывателю — Кюри умер в возрасте 47 лет от мощной дозы радиоактивного облучения.
В 1934 г был впервые синтезирован искусственный радиоактивный изотоп.
Сейчас изучением радиоактивности занимаются множество ученых и организаций.
Добыча и синтез
Даже естественные радиоактивные металлы не встречаются в природе в чистом виде. Их синтезируют из урановой руды. Процесс получения чистого металла чрезвычайно трудоемок. Состоит он из нескольких стадий:
- концентрирование (дробление и выделение осадка с ураном в воде);
- выщелачивание — то есть, перевод уранового осадка в раствор;
- выделение чистого урана из полученного раствора;
- перевод урана в твердое состояние.
В итоге, из тонны урановой руды можно получить всего несколько граммов урана.
Синтез искусственных радиоактивных элементов и их изотопов проходит в специальных лабораториях, в которых создаются условия для работы с подобными веществами.
Практическое применение
Чаще всего, радиоактивные металлы используют для выработки энергии.
Ядерные реакторы — это устройства, использующие уран для нагревания воды и создания потока пара, который вращает турбину, с помощью чего вырабатывается электричество.
Вообще, сфера применения радиоактивных элементов довольно широка. Они используются для изучения живых организмов, диагностирования и лечения болезней, выработки энергии и для мониторинга промышленных процессов. Радиоактивные металлы являются основой для создания ядерного оружия — самого разрушительного оружия на планете.
Радиоактивные элементы
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226.
Весь природный радий возникает при распаде урана-238, урана-235 или тория-232; наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238.
В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468×109 лет)/(1602 года)=2,789×106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия.
Как удалит смс без темы на телефоне хуавей
Как был открыт
Открытие радия (1898 год) – заслуга Марии Кюри:
- Годами она работала с урановой смолкой. Это были отходы с местного предприятия. После извлечения урана они должны были быть «чистыми», но «фонили» сильнее чистого урана.
- Позднее к ней присоединился супруг Пьер и коллега Жан Бемон.
- Лишь через 12 лет была получена первая в истории «песчинка» чистого радия.
 Реплики продуктов начала XX века, содержащих радий, на витрине в Музее Марии Кюри, Париж
Реплики продуктов начала XX века, содержащих радий, на витрине в Музее Марии Кюри, Париж
В тонне урановой смолки, которую перерабатывали супруги Кюри, было 0,1 г радия.
- Первые образцы стали самым дорогим веществом на планете: цена 1 г радия превосходила стоимость двух центнеров золота.
Попутно Мария открыла элемент, который назвала полонием – в честь своей родной страны Польши.
Как мутить в Дискорде на сервере всех или одного человека Отопление радием-камин 21 века. Французская карточка 1910 года
Отопление радием-камин 21 века. Французская карточка 1910 года
За открытие радия Марии Склодовской-Кюри присудили в 1911 году Нобелевскую премию.
Свойства и применение
Также радий — химический элемент, который формирует ряд солей. Известны его нитриды, хлориды, сульфаты, нитраты, карбонаты, фосфаты, хроматы. Также есть двойные соли с вольфрамом и бериллием.
То, что радий-226 может быть опасен для здоровья, его первооткрыватель Пьер Кюри узнал не сразу. Однако сумел убедиться в этом, когда провел эксперимент: сутки он ходил с привязанной к плечевой части руки пробиркой с металлом.
На месте контакта с кожей появилась незаживающая язва, избавиться от которой ученый не мог больше двух месяцев.
От своих экспериментов над явлением радиоактивности супруги не отказались, поэтому и умерли оба от большой дозы облучения.
Помимо отрицательного значения, существует и ряд областей, в которых радий-226 находит применение и приносит пользу:
- Индикатор смещения уровня океанских вод.
- Используется для определения количества урана в породе.
- Входит в состав осветительных смесей.
- В медицине используется для формирования лечебных радоновых ванн.
- Применяют с целью снятия электрических зарядов.
- С его помощью проводится дефектоскопия литья и свариваются швы деталей.
Запасы и месторождения
Запасы и месторождения представителей радиоактивной группы:
- Уран. Залежи металла в слоях литосферы на толщину 20 км — 1.3х1014 т. Содержание в морской воде — 3 мкг/л. Больше всего урана содержится в кислых породах, содержащих кремний.
- Радий. Редкий элемент. За все время было добыто не более 1,5 килограмма чистого радия. Природный радий появляется после распада урана 235 и урана 238.
- Плутоний. Из-за отсутствия стабильных изотопов его сложно найти в природе. Изотопы, с длительным периодом полураспада — 239, 244. В природе он встречается в виде соединения PuO2. Его добыча не имеет смысла из-за малого количества.
- Торий. Был открыт в 1815 году. Все природные изотопы элемента состоят из этого нуклида. В большом количестве содержится в природе. Самые стабильные изотопы — 232, 230, 229.
- Берклий. Некоторые изотопы этого радиоактивного элемента можно получить при облучении урановых, плутониевых руд в ядерных реакторах. Самые стабильные изотопы — 247, 249.
Большинство радиоактивных металлов редко встречаются в природе, добывать их сложно.
 Добыча руды ( Instagram / nornickel_official)
Добыча руды ( Instagram / nornickel_official)
Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
В начале XX века радий даже считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средства для повышения тонуса и потенции.
Радиоактивные металлы: список
Полный перечень всех принадлежащих к рассматриваемой группе элементов может быть достаточно внушительным, ведь всего к ней относятся около 80 металлов. В первую очередь это все, стоящие в периодической системе после свинца, включая группу лантаноидов и актиноидов. То есть висмут, полоний, астат, радон, франций, радий, резерфордий и так далее по порядковым номерам.
Как узнать пароль от личного кабинета мтс Домашний Интернет?
Выше обозначенной границы располагается множество представителей, каждый из которых также имеет изотопы.
При этом некоторые из них могут быть как раз радиоактивными. Поэтому важно, какие разновидности имеет химический элемент.
Радиоактивный металл, точнее одна из его изотопных разновидностей, есть практически у каждого представителя таблицы. Например, их имеют:
- кальций;
- селен;
- гафний;
- вольфрам;
- осмий;
- висмут;
- индий;
- калий;
- рубидий;
- цирконий;
- европий;
- радий и другие.
Таким образом, очевидно, что элементов, проявляющих свойства радиоактивности, очень много — подавляющее большинство. Часть из них безопасна из-за слишком длинного периода полураспада и содержится в природе, другая же создана искусственно человеком для различных нужд в науке и технике и является крайне опасной для организма людей.
Свойства и характеристики
Знание характеристик радиоактивных металлов поможет выявить уникальные свойства этих элементов, понять, где их лучше применять.
Уран
Свойства:
- В свободном состоянии — светло-серый металл.
- Плотность — 18700 кг/м3.
- Атомный номер — 92.
- Электросопротивление — 29,0•10-4 (Ом•м).
- Температура плавления — 1135°C.
- Теплоемкость — 27,66 Дж/(моль•К).
- Температура кипения — 3818°C.
- Теплопроводность — 22,5 Вт/(м•К).
- Степень окисления — до +6.
- Коэффициент линейного расширения — 10,7•10-6 К-1.
Уран растворяется в азотной и соляной кислоте, не взаимодействует с щелочами. При нагревании может вступать в реакции с азотом, фосфором.
 Химический элемент уран
Химический элемент уран
Радий
Характеристики:
- В нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 5500 кг/м3.
- Атомный номер — 88.
- Показатель теплоемкости — Cp0 29 Дж/(моль•К).
- Температура плавления — 969°C.
- Степень окисления — +2.
- Температура кипения — 1500°C.
По химической активности радий можно сравнить с барием. На воздухе быстро окисляется. При соединении с водой возникает бурная реакция с нагреванием жидкости.
Плутоний
Характеристики:
- При нормальном состоянии — серебристо-белый металл.
- Показатель плотности — 19,82 (25°C, г/см3).
- Атомный норме — 94.
- Удельное электрическое сопротивление — 150 мкОм·см (при +22 °C).
- Температура плавления — 640°C.
- Температура кипения — 3235°C.
Вступает в реакцию с водой.
 Окисленный плутоний ( Instagram / thoisoi)
Окисленный плутоний ( Instagram / thoisoi)
Биологическое воздействие
Радий проникает в живые организмы:
- В растительном мире его больше в стволах деревьев.
- Организм животных и человека получает его с водой, пищей.
- Четыре пятых поступившего радия оседает в костях.
- Концентрация вещества определяется пищевым рационом и районом проживания.
По стандартам РФ, кубический метр воздуха не должен содержать более 0,000001 мкг радия.
Нанодозы вещества полезны, превышение чревато онкологией. Поэтому критически важно видеть барьер, после которого достоинства материала становятся недостатками.
Теги
газообразный радон ио радоне При распаде тот
Радиоактивные элементы



Радиоактивные элементы, химическиеэлементы, все изотопы которых радиоактивны. К числу радиоактивных элементов принадлежат технеций (атомный номер 43), прометий (61), полоний (84) и все последующие элементы в периодической системе Менделеева. К 1975 известно 25 радиоактивных элементов. Те из них, которые расположены в периодической системе за ураном, называются трансурановыми элементами. 14 радиоактивных элементов с атомным номером 90—103 во многом сходны между собой; они составляют семейство актиноидов. Из природных радиоактивных элементов только два — торий (атомный номер 90) и уран (92) имеют изотопы, периоды полураспада которых (T1/2) сравнимы с возрастом Земли. Это 232Th (T1/2 = 1,41×1010 лет), 235U (T1/2 = 7,13×108 лет) и 238U (T1/2 = 4,51×109 лет). Поэтому торий и уран сохранились на нашей планете со времён её формирования и являются первичными радиоактивными элементами. Изотопы 232Th, 235U и 238U дают начало естественным радиоактивным рядам, в состав которых входят в качестве промежуточных членов вторичные природные радиоактивные элементы с атомными номерами 84—89 и 91. Периоды полураспадов всех изотопов этих элементов сравнительно невелики, и, если бы их запасы не пополнялись непрерывно за счёт распада долгоживущих изотопов U и Th, они давно бы уже полностью распались.
Радиоактивные элементы с атомными номерами 43, 61, 93 и все последующие называются искусственными, т.к. их получают с помощью искусственно проводимых ядерных реакций.
Это деление радиоактивных элементов на природные и искусственные довольно условно; так, астат (атомный номер 85) был сначала получен искусственно, а затем обнаружен среди членов естественных радиоактивных рядов.
В природе найдены также ничтожные количества технеция, прометия, нептуния (атомный номер 93) и плутония (94), возникающих при делении ядер урана — либо спонтанном, либо вынужденном (под действием нейтронов космических лучей и др.).
Два радиоактивных элемента — Th и U — образуют большое число различных минералов. Переработка природного сырья позволяет получать эти элементы в больших количествах.
Радиоактивные элементы — члены естественных радиоактивных рядов — могут быть выделены радиохимическими методами из отходов производства Th и U, а также из торий- или урансодержащих препаратов, хранившихся долгое время. Np, Pu и др.
лёгкие трансурановые элементы получают в атомных реакторах за счёт ядерных реакций изотопа 238U с нейтронами. С помощью различных ядерных реакций получают и тяжёлые трансурановые элементы Tc и Pm образуются в атомных реакторах и могут быть выделены из продуктов деления.
Многие радиоактивные элементы имеют важное практическое значение. U и Ри используют как делящийся материал в ядерных реакторах и в ядерном оружии. Облучение тория (его природного изотопа 232Th) нейтронами позволяет получить изотоп 233U — делящийся материал.
Pm, Po, Pu и др. Радиоактивные элементы применяют для изготовления атомных электрических батареек со сроком непрерывной работы до нескольких лет. См. статьи об отдельных радиоактивных элементах, а также Радиоактивные минералы, Ториевые руды, Урановые руды.
Лит.: Несмеянов Ан. Н., Радиохимия, М., 1972.
С. С. Бердоносов.
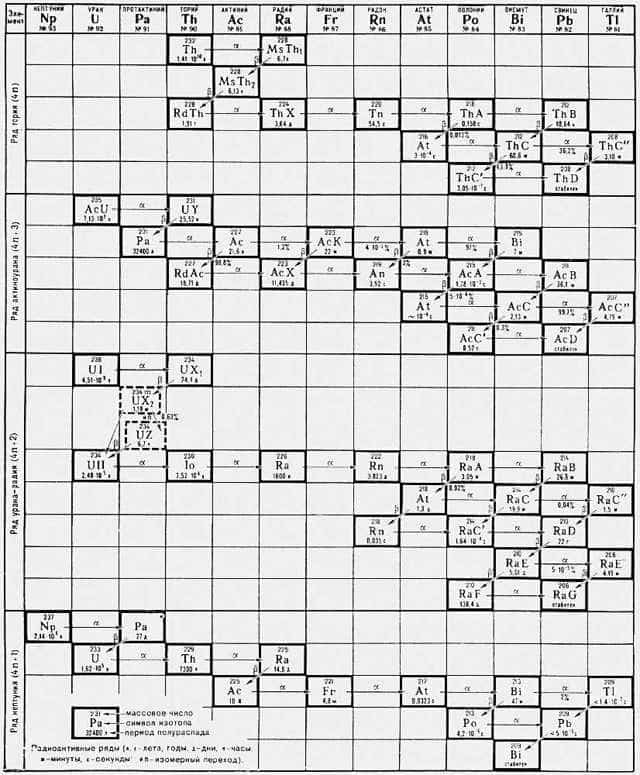
Рис. к ст. Радиоактивные элементы.
Радиоактивные металлы
Радиоактивные элементы — химические элементы, все изотопы которых радиоактивны. К числу радиоактивных элементов принадлежат технеций (атомный номер 43), прометий (61), полоний (84) и все последующие элементы в периодической системе Д.И. Менделеева.
Те из них, которые расположены в периодической системе за ураном, называются трансурановыми элементами (заурановыми элементами, трансуранами). 14 радиоактивных элементов с атомными номерами 90—103 во многом сходны между собой, они составляют семейство актиноидов. Элементы с атомным номером более 100 называются трансфермиевыми элементами.
Одиннадцать из известных трансурановых элементов (93— 103) принадлежат к числу актиноидов. Трансурановые элементы с атомным номером более 103 называются трансактиноидами.
Из природных радиоактивных элементов только два—торий (атомный номер 90) и уран (92) имеют изотопы, периоды полураспада которых (Т1/2) сравнимы с возрастом Земли.
Это 232Th (Т1/2 = = 1,4МО10 лет), 235U (Т1/2 = 7,13* 108 лет) и 238U (Т1/2 = 4,51-Ю9 лет). Поэтому торий и уран сохранились на нашей планете со времен ее формирования и являются первичными радиоактивными элементами.
Изотопы 232Th, 235U и 238U дают начало естественным радиоактивным рядам, в состав которых входят в качестве промежуточных членов вторичные природные радиоактивные элементы с атомными номерами 84—89 и 91.
Периоды полураспадов всех изотопов этих элементов сравнительно невелики, и, если бы их запасы не пополнялись непрерывно за счет распада долгоживущих изотопов U и Th, они давно бы уже полностью распались.
Радиоактивные элементы с атомными номерами 43, 61, 93 и все последующие называются искусственными, так как их получают с помощью искусственно проводимых ядерных реакций.
Это деление радиоактивных элементов на природные и искусственные довольно условно; так, астат (атомный номер 85) был сначала получен искусственно, а затем обнаружен среди членов естественных радиоактивных рядов.
В природе найдены также ничтожные количества технеция, прометия, нептуния (атомный номер 93) и плутония (94), возникающих при делении ядер урана—либо спонтанном, либо вынужденном (под действием нейтронов космических лучей и др.).
Два радиоактивных элемента — Th и U — образуют большое число различных минералов. Переработка природного сырья позволяет получать эти элементы в больших количествах.
Радиоактивные элементы — члены естественных радиоактивных рядов — могут быть выделены радиохимическими методами из отходов производства Th и U, а также из торий- или урансодержащих препаратов, хранившихся долгое время.
Np, Pu и другие легкие трансурановые элементы получают в атомных реакторах за счет ядерных реакций изотопа 238U с нейтронами. С помощью различных ядерных реакций получают и тяжелые трансурановые элементы, Тс и Pm образуются в атомных реакторах и могут быть выделены из продуктов деления.
Актиноиды (актиниды) — семейство, состоящее из 14 радиоактивных химических элементов III группы 7-го периода периодической системы с атомными номерами 90-103.
Данная группа состоит из тория, протактиния, урана, нептуния, плутония, америция, кюрия, берклия, калифорния, эйнштейния, фермия, менделевия, нобелия и лоуренсия. Актиний часто для удобства сравнения рассматривается вместе с этими элементами, однако к актиноидам он не относится. Термин «актиноиды» был предложен
В. Гольдшмидтом в 1937 г. Подобно лантаноидам, актиноиды образуют семейство схожих по свойствам элементов.
По сравнению с лантаноидами, которые (кроме прометия) обнаружены в природе в заметных количествах, актиноиды труднее синтезировать.
Но есть и исключения, например, легче всех синтезировать или найти в природе уран и торий, затем следуют плутоний, америций, актиний, протактиний и нептуний.
Таблица 1.26
Характеристики некоторых равновесных пар изотопов
| Материнский изотоп | ТУг | Дочерний изотоп | |
| 243Ат | 7370 лет |
|
2,35 дня |
| 245Ст | 8265 лет | 241Ри | 14 лет |
| 247Ст | 1,64-Ю7 лет | 243Ри | 4,95 ч |
| 254Es | 270 дней | 250Вк | 3,2 ч |
| 255Es | 39,8 дня | 255Fm | 22 ч |
| 257Fm | 79 дней | 253Cf | 17,6 дня |
По свойствам актиноиды сходны с лантаноидами, но между ними есть и различия.
Различие двух групп объясняется тем, что у актиноидов прерывается заполнение наружных электронных оболочек — шестой (группа 6d) и седьмой (после появления группы электронов 7s2), и при переходе от каждого предыдущего актиноида к последующему происходит (в основном, а начиная с кюрия — исключительно) заполнение /-электронов в пятой электронной оболочке. У актиноидов по аналогии с лантаноидами происходит заполнение /-слоя в четвертой электронной оболочке.
С физической точки зрения актиноиды — типичные металлы. Все они мягкие, имеют серебристый цвет, достаточно высокую плотность и пластичность. Некоторые из этих металлов можно разрезать ножом. Торий по твердости подобен мягкой стали.
Из нагретого чистого тория можно раскатывать листы, вытягивать проволоку. Торий почти вдвое легче урана и плутония, но тверже их обоих. Все актиноиды в той или иной степени радиоактивны.
Из них только торий и уран встречаются в природе в заметных количествах.
Для всех актиноидов, кроме актиния, характерен полиморфизм.
Температура плавления актиноидов изменяется при увеличении числа /-электронов нелинейно.
С ростом числа данных электронов температура плавления сначала (от протактиния к плутонию) понижается, а затем (от америция к кюрию) повышается.
От кюрия до эйнштейния температура плавления снова понижается, а затем возрастает до максимума у фермия. Аналогичная кривая температур плавления повторяется от фермия до лоуренсия (табл. 1.27).
Для актиноидов от америция до эйнштейния при любыхтемпера- турах ниже температуры плавления характерны гранецентрированная кубическая и гексагональная плотнейшие упаковки. Для трансурановых элементов сходство с металлическими лантаноидами усиливается — при комнатной температуре кристаллические структуры актиноидов от америция до калифорния и легких лантаноидов аналогичны.
Плутоний имеет семь полиморфных модификаций, а уран, нептуний и калифорний — три. Кристаллические структуры протактиния, урана, нептуния и плутония по своей сложности не имеют аналогов среди лантаноидов и более похожи на структуры 3^/-переходных металлов. Легкие актиноиды в точке плавления имеют объемнопентрированную решетку, а начиная с плутония — гранецентрированную.
Таблица 1.27
Физические свойства некоторых актиноидов
| Металл | Плотность при 25 °С, г/см3 |
|
Цвет | Поперечное сечение захвата нейтронов, б | Радиус атома, А |
| Актиний | 10,07 | 1050 ± 50 | Серебристо-белый (в темноте светится голубым светом) | — | 1,88 |
| Торий | 11,78 | 1750 | Серебристый | 7,57 | 1,798 |
| Протактиний | 15,37 | — | Серебристый | — | |
| Уран | 19,05 | 1132± 1 | Серебристо-белый | 7,68 (природная смесь) | 1,762 |
| Нептуний | 20,25 | 640 ±1 | Серебристый | — | — |
| Плутоний | 19,84 | 637 | Серебристо-белый | — | 1,58 |
| Америций | 11,7 | 1100 | Серебристый | — | 1,82 |
| Кюрий | 7,0 | 1345 ± 50 | Серебристый | — | 1,74 |
| Берклий | 14,78 | 1025 | — | — | 1,70 |
Все актиноиды являются химически активными металлами. Различие химических свойств актиноидов и лантаноидов проявляется в том, что актиноиды легче вступают в реакции и имеют разные валентные состояния.
Это объясняется меньшим размером 5/-орби- талей по сравнению с 4/-орбиталями, их экранированностью внешними электронами, и поэтому способностью к более легкому расширению за пределы 6s- и 6/?-орбиталей.
Большинство элементов данной группы могут иметь разные степени окисления, причем в наиболее стабильных соединениях проявляются следующие степени окисления:
- • актиний+3;
- • торий +4;
- • протактиний +5;
- • уран +6;
- • нептуний +5;
- • плутоний +4;
- • америций и остальные актиноиды +3.
Как и лантаноиды, все металлы-актиноиды легко соединяются с кислородом, галогенами и халькогенами, углеродом, водородом и серой.
Для америция установлено, что возможно получить гидрид данного вещества — АшН3. Торий, протактиний и уран также соединяются с водородом при 250 °С. Создают гидриды и другие актиноиды.
Гидриды с общей формулой МН3 своими свойствами напоминают соли. Все соединения имеют черный цвет.
При реакции с углеродом актиноиды преимущественно создают карбиды с общей формулой МС, МС2, а уран U2C3. С серой они производят сульфиды с общей формулой M2S3 и MS2.
Почему одни предметы радиоактивные, а другие — нет?
Наверняка у вас возникал вопрос, почему это вдруг одни предметы могут быть источником радиации, а другие нет? Для того, чтобы понять в чём заключается различие, нужно вспомнить понятие «радиация» и осознать, из-за чего она появляется.
Когда купил металлические изделия из металлоломаКогда купил металлические изделия из металлолома
Мы помним, что сама по себе радиация — штука очень опасная. Опасна она тем, что невидима. При этом воздействие на организм всё равно происходит. И появляется она частенько совершенно неожиданно.
Например, можно купить какую-нибудь китайскую железяку, а она будет фонить. Распознать наличие фона можно только с помощью специального оборудования, которое есть далеко не у всех.
Именно поэтому, при покупке металла нужно выбирать какие-то более или менее проверенные рынки-магазины.
Что такое радиоактивность очень кратенько?
Для начала, посмотрите ролик про радиацию на нашем канале:
Если очень кратко сформулировать, откуда вообще появляется радиоактивное излучение, то нужно вспомнить строение атома.
Атом имеет планетарную модель и состоит из ядра, которое включает протоны и нейтроны, и из электронов, вращающихся вокруг ядра этого атома. Конечно, описание мы тут сильно упрощаем, но для понимания радиоактивности этого вполне достаточно.
Планетарная модель атома
Излучение может быть нескольких видов. Оно может включать потоки атомных ядер, фотонов, нейтронов или элементарных частиц. При взаимодействии с окружающими материалами происходит ионизация этих материалов, поэтому радиоактивное излучение, которым часто пугают в кино, называют ещё и ионизирующим излучением.
Излучение делится на группы.
Может лететь так называемое нейтронное излучение, энергия, высвобождаемая при распаде атома в виде гамма-лучей, электроны, которые будут называться бета-излучением и сами ядра, называемые альфа-частицами.
Самый интересный вопрос…Почему это оно вдруг начинает лететь? Почему одни элементы испускают потоки частица, а другие нет?
Откуда берется радиация?
Термин «радиация» гораздо более широкий, нежели это используется в случае ионизирующих излучений, но применять для удобства будем именно его.
Представьте себе атом как некоторый ограниченный набор связанных друг с другом элементов. Число протонов, нейтронов и электронов строго уравновешены.
Если в этот тонкий баланс вмешаться извне, то произойдет разбалансировка. Силы взаимодействия не смогут удерживать частицы рядышком, а при их «разваливании» будет происходить ещё и выброс энергии — то самое гамма. Радиус ядра в результате тех или иных манипуляций может оказаться большим, нежели радиус действия сильных взаимодействий.
Отметим и то, что никакого вмешательства снаружи может не быть. Природа сама по той или иной причине может породить нестабильный атом. Вспоминаем таблицу Менделеева. Там все элементы после свинца являются, в общем-то, радиоактивными. Некоторые могут иметь радиоактивные изотопы (имеют одинаковый порядковый номер, но разные массовые числа). Не все рукотворные.
Классическая картинка из учебникаКлассическая картинка из учебника
Основные предпосылки к радиоактивности следующие:
- В атоме переизбыток нейтронов или недостаток нейтронов в ядре. Если их слишком много, то какое-то время они висят, а потом отправляются в путешествия, пронизывая всё на своём пути. Если мало — не будет «клея» для ядра и полетят уже протоны
- Переизбыток протонов в ядре. Если их слишком много, внутриатомные силы не удержат их на своем месте. Протоны тоже отправятся в путешествие
- Поглощение электрона с нижней орбиты с выделением энергии. Наблюдается, когда ядерная каша уже закипела или произвольно
Так почему же одни предметы фонят, а другие нет?
Итак, вернемся к главному вопросу в заголовке. Зная всё то, что мы сейчас обсудили, вы и сами наверняка уже поняли причины такой «аномалии». Они напрямую следуют из описанной теории.
Взаимодействие ядер. Абстракция.Взаимодействие ядер. Абстракция.
Объект может испускать ионизирующее излучение если:
- Ему довелось находиться рядом с источником радиоактивного ионизирующего излучения в природе и внутри произошёл ряд превращений. Структура самого этого предмета стала нестабильна и атомы стали рассыпаться в той или иной форме. Такой эффект можно, например, наблюдать рядом с крупными камнями или горными породами, которые находились рядом с залежами испускающего частицы элемента.
- Тело или предмет попало в зону искусственного радиоактивного излучения. Все ведь помнят, как дело было в Чернобыле? При таких условиях вполне вероятно, что техника или оборудование будут источником опасного излучения. Хотелось бы написать «вторичного», но это не совсем уместный термин ? Так или иначе, простая лопата, которая попала в зону действия ионизирующего излучения, может потом испускать некислый поток частиц.
- Предмет изначально был изготовлен из радиоактивных элементов или радиоактивных изотопов. Разумный вопрос…Зачем так делать? ? Ответ — производитель не утруждает себя поиском безопасного сырья. Покупает по дешевке исходники или лупит из того, что есть. Тут не нужно далеко ходить. В интернете есть целый канал, где автор рассматривает посылки из китайского оранжевого магазина, которые неплохо фонят. Понятно, что доза не столь велика, но и приятного мало. Например, опасным может быть даже припой для пайки.
- Конструкция включала в свой состав радиоактивный элемент как необходимый для работы функциональный фрагмент. Сказал очень мудрёно ? Смысл простой — например, альфа-излучение используется для обнаружения обледенений на корпусе самолёта. Тритий раньше использовался для подсвечивания знаков «Аварийный выход», а Радий-226 в своё время применяли даже для подсвечивания ёлочных украшений. Помимо того, что такие элементы сами фонят, они могут поставить и некоторый след на окружении.
Пожалуйста, подпишитесь на проект, оцените статью лайком и напишите комментарий! Сейчас это очень важно для выживания проекта!
Статьи по теме на моем канале:
Ещё кое-что полезное:
- Путеводитель по научно-популярным каналам ДЗЕНа: смотрите здесь
- Присоединяйся к моей телеге






