- Химическая активность металлов
- Реакции металлов с кислородом и водой
- Взаимодействие металлов с кислотами. ряд активности металлов
- Взаимодействие металлов с растворами солей
- Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
- Химические свойства металлов
- 1. Взаимодействие металлов с неметаллами
- 2. Взаимодействие металлов с водой
- 3. Взаимодействие металлов с растворами солей
- 4. Взаимодействие металлов с растворами щелочей
- 5. Взаимодействие металлов с кислотами
- 2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
- Взаимодействие средних солей с гидроксидами металлов
- Реакции средних солей с кислотами
- Реакции средних солей с другими средними солями
- Реакции термического разложения солей
- Разложение карбонатов
- Разложение нитратов
- Разложение солей аммония
- Разложение хлората калия
- Химические свойства кислых солей
- Отношение кислых солей к щелочам и кислотам
- Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
- Термическое разложение кислых солей
- Химические свойства основных солей
- Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- Химические свойства металлов
- Содержание:
- Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
- Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
- На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическая активность металлов
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Реакции металлов с кислородом и водой
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов? Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства.
В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д.
Этот металл от воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет.
Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. corrodere – разъедать).
- Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:
Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Ca). Железо и медь окисляются только при нагревании:
А золото и некоторые благородные металлы вообще не окисляются кислородом.
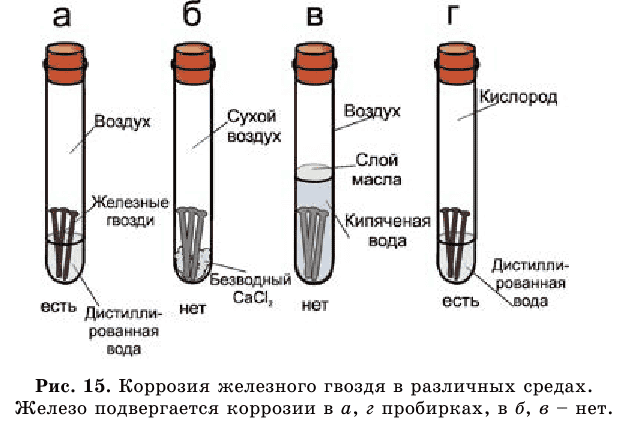
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).
Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов. Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии.
Это – золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г.
Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью.
Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Олово — достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо. Олово — это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу.
Олово — один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей.
Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.
Взаимодействие воды с некоторыми металлами (рис. 17). 1. Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения
При проведении таких опытов необходимо соблюдать меры предосторожности.
2. При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
3. Малоактивные металлы (Cu) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав
Свинец — тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
- Демонстрация №2
- Взаимодействие активных металлов с холодной и горячей водой
- Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
- Цель: узнать, как реагируют активные металлы с холодной и горячей водой.

Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку – Mg; во вторую – Zn; в третью – Sn; в четвертую – Cu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н.Н. Бекетовым был составлен ряд активности металлов:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить следующие правила:
1) металлы, стоящие в начале этого ряда, химически активны, они могут вытеснить водород из воды. 2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот (рис. 18):
активный металл + кислота —> соль + водород
Протекает реакция замещения. Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).
- Лабораторный опыт №3
Взаимодействие металлов с растворами кислот - Цель: исследовать реакции различных металлов с растворами кислот и сделать вывод о существовании химически инертных металлов.
Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую – поместите гранулы цинка, в третью – опилки железа, в четвертую – стружки меди.
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):
Выделение красного налета меди является признаком реакции. Обратная реакция не протекает потому что медь в ряду активности металлов находится после железа, поэтому не вытесняет его.
- Схема реакций замещения выглядит следующим образом:
- соль 4- активный металл = новая соль + новый металл (менее активный)
- Реакции такого типа протекают при следующих условиях: 1) взаимодействующие соли должны быть растворимыми в воде;
- 2) более активный металл вытесняет из соли менее активный металл.
- Демонстрация №3
Вытеснение металлов из растворов солей - Цель: понимать, что более активный металл вытесняет менее активный металл из растворов его солей.
В пробирку поместите гранулы цинка и налейте раствор сульфата меди. В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1 Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.
Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.
ДЕЛАЕМ ВЫВОДЫ:
- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
- Лекции по химии:
- Лекции по неорганической химии:
- Лекции по органической химии:
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей
- Учебная цель: обобщить знания о металлах и их свойствах.
- Образовательные результаты, заявленные во ФГОС третьего поколения:
- Обучающийся должен знать:
- — понятие металлов;
- — строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- — понятие металлической связи; типы кристаллических решеток разных металлов;
- — зависимость физических свойств металлов от их строения;
- — распространенность металлов в природе в зависимости от их активности.
- Обучающийся должен уметь:
— характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
— устанавливать связь между строением веществ и их свойствами.
Задачи практического занятия:
-
Закрепить теоретические знания о свойствах металлов.
-
Ответить на вопросы для закрепления теоретического материала.
-
Выполнить практические задачи.
-
Ответить на вопросы для контроля.
Обеспеченность занятия:
-
Учебно-методическая литература:
- Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
- Периодическая система химических элементов им. Д.И. Менделеева;
- Ряд стандартных электродных потенциалов Е0;
- Типы кристаллических решеток металлов.
- Ряд напряженности металлов.
-
Тетрадь для практических и контрольных работ.
-
Ручка.
- Краткие теоретические и учебно-методические материалы по теме практического занятия
- Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
- Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение.
По плотности металлы разделяют на легкие (до 3000 кг/м3) и тяжелые (от 6000 кг/м3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К).
Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
M – ne = Mn+
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
- По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е0 (приложение 4).
- Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
- Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
- Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
- Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
- Элементарная ячейка характеризует особенности строения кристалла.
- В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
- Вопросы для закрепления теоретического материала к практическому занятию
-
Перечислить общие физические свойства металлов.
-
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
-
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
-
Решить предложенные задачи.
-
Правильно оформить их в тетрадь для практических и контрольных работ.
-
Ответить на вопросы для контроля.
-
Отчитаться о выполненной работе преподавателю.
Задание 1
| Напишите уравнение реакции взаимодействия металла с кислотой | |
| Вариант 1 | Вариант 2 |
| алюминий + серная кислота | железо + соляная кислота |
- Образец решения задания № 1
- Напишите управление реакции цинка с соляной кислотой.
- Алгоритм решения
- Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
- Zn + 2HCl ZnCl2 + H2
- В результате реакции выделяется газ (H2) водород.
- Задание 2
| Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла | |
| Вариант 1 | Вариант 2 |
| алюминий + железный купорос | железо + медный купорос |
- Образец решения задания № 2
- Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
- Алгоритм решения
- Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
- Zn + CuSO4 ZnSO4 + Cu
- В результате реакции выделяется металлическая медь (красный осадок).
- Задание 3
| Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится. | |
| Вариант 1 | Вариант 2 |
| Магний оксид магния хлорид магния гидроксид магния сульфат магния Mg MgO MgCl2 Mg(OH)2 MgSO4 | Медь оксид меди сульфат меди гидроксид меди оксид меди Cu CuO CuSO4 Cu(OH)2 CuO |
Образец решения задания № 3
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
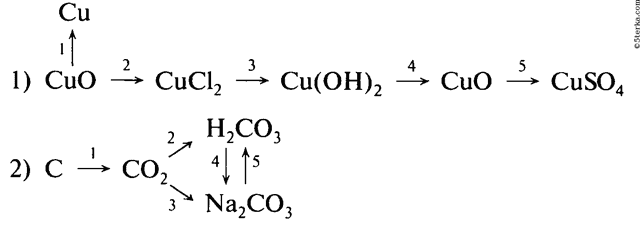
Алгоритм решения
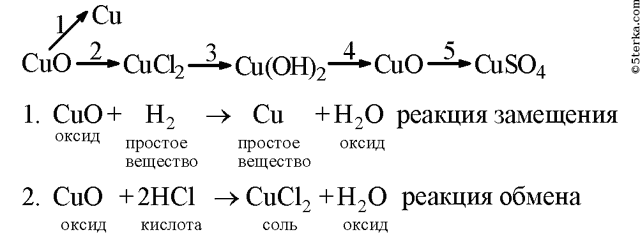
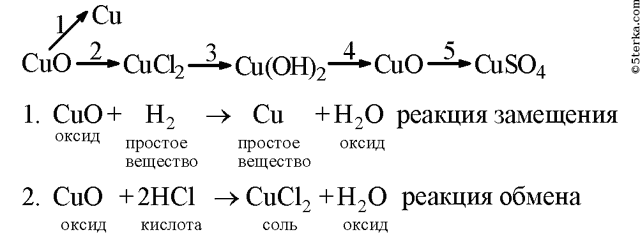
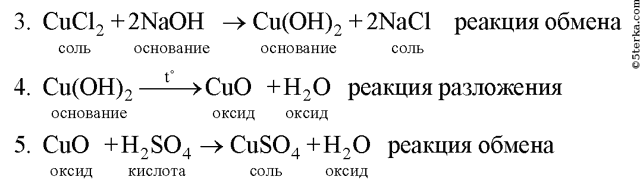
Вопросы для контроля
-
Перечислите основные химические свойства металлов?
-
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
-
Запишите, где в вашей профессии и в жизни применяются металлы.
- Форма контроля выполнения практического задания:
- Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
- 5
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
Ме – ne = Men+
1. Взаимодействие металлов с неметаллами
- а) Взаимодействие металлов с водородом.
- С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
- Например:
- 2Na + H2 = NaH
- Ca + H2 = CaH2
- Образуются нестехиометрические соединения с ионной кристаллической структурой.
- б) Взаимодействие металлов с кислородом.
- Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
- Пример:
- 2Na + O2 = Na2O2 (пероксид)
- 4K + O2 = 2K2O
- 2Mg + O2 = 2MgO
- 2Cu + O2 = 2CuO
- в) Взаимодействие металлов с галогенами.
- Все металлы реагируют с галогенами с образованием галогенидов.
- Пример:
- 2Al + 3Br2 = 2AlBr3
- В основном это ионные соединения: MeHaln
- г) Взаимодействие металлов с азотом.
- С азотом взаимодействуют щелочные и щелочноземельные металлы.
- Пример:
- 3Ca + N2 = Ca3N2
- Mg + N2 = Mg3N2 – нитрид.
- д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды.
Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
4Al + 3C = Al4C3
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой
- Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
- Na + 2H2O = H2↑ + 2NaOH
- Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Zn + CuSO4= Cu0↓ + ZnSO4
= – 0,76 B., = + 0,34 B.
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
- Пример:
- Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
- 1 Zn0 + 4OH– – 2e = [Zn(OH)4]2– окисление
- Zn0 – восстановитель
- 1 2H2O + 2e = H2 + 2OH– восстановление
- H2O – окислитель
- Zn + 4OH– + 2H2O = [Zn(OH)4]2– + 2OH– + H2↑
- Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
- 4Nb +5O2 +12KOH = 4K3NbO4 + 6H2O
5. Взаимодействие металлов с кислотами
- Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
- По активности металлы условно делятся на активные, средней активности и малоактивные.
- Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H+. При взаимодействии с металлами выделяется кислород (H2↑).
С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
- H2S↑ – c активными металлами
- 6+ +8е
- H2SO4 +6е S0↓ – с металлами средней активности
- SO2↑ – c малоактивными металлами
- NH3 ( NH4NO3 )– c активными металлами
- 5+ +8e
- HNO3 +4,5e N2O, N2 – с металлами средней активности
- разб.
- +3e
- NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe2+, Cr → Cr2+. При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe3+, Cr → Cr3+, при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
- Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
- Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Химические свойства металлов
Металлы на внешнем энергетическом уровне имеют небольшое число электронов (от 1 до 3). Как правило, в химических реакциях металлы проявляют только восстановительные свойства, их атомы отдают электроны, образуя в результате положительные ионы.
1. Взаимодействие металлов с неметаллами.
Показываем на примере взаимодействия цинка с серой. Тщательно перемешав порошки серы и цинка (1:1), помещают их в фарфоровую чашечку. Небольшие порции смеси берут и медленно посыпают сверху на пламя спиртовки. Наблюдаются синевато-белые вспышки, сопровождающиеся образованием сульфида цинка. Оставшуюся смесь поджигают тлеющей лучинкой.
Zn0 + S0 = Zn+2S-2
Zn0 – 2 ? ? Zn+2
восстановитель
S0 + 2 ? ? S-2
окислитель
2. Взаимодействие металлов с кислородом.
(Легко взаимодействуют с кислородом щелочные и щелочноземельные металлы, поэтому их хранят под слоем керосина) Mg, Fe, Zn, Cu окисляются кислородом только при нагревании. Покажем это на примере взаимодействия Mg с кислородом. Для этого мы сначала соберем кислород в баночку. Кислород тяжелее воздуха и будет собираться на дне баночки.
t
2KMnO4 ? K2MnO4 + MnO2 + O2 ?
Раскалим магний в пламени спиртовки и внесем в баночку с кислородом. Магний сгорает, образуя яркую вспышку.
2Mg0 + O02 = 2Mg+2O-2
Mg0 – 2 ? ? Mg+2
восстановитель
O0 + 2 ? ? O-2
окислитель
После того, как магний сгорит, в ложечке для сгорания образуется оксид магния MgO белого цвета. Следовательно, продуктами сгорания металлов являются основные оксиды. Золото, серебро, платина при обычных условиях и при нагревании не окисляются кислородом.
3. Взаимодействие металлов с водой.
Это свойство рассмотрим на примере взаимодействия натрия с водой. На демонстрационный стол ставим стакан с водой. Для безопасности наливаем воды не более 4/5 стакана. Бросаем в стакан с водой кусочек натрия величиной с горошину.
Стакан накрываем перевернутой воронкой. Через несколько секунд поджигаем выделяющийся водород у кончика воронки. Когда весь натрий прореагирует, то в воду капают раствор фенолфталеина, чтобы показать образование щелочи.
Делаем вывод: щелочные металлы бурно взаимодействуют с водой с выделением водорода.
2Na0 + 2H2+1O = 2Na+1OH + H20?
Na0 – 1 ? ? Na+1
восстановитель
2H+1 + 2 ? ? H20
окислитель
Менее активные металлы взаимодействуют с водой при нагревании. При этом образуется оксид и выделяется водород.
- Взаимодействие металлов с растворами кислот и солей.
- 1 правило: Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот, а стоящие правее, не вытесняют водород из растворов кислот.
- Взаимодействие цинка с соляной кислотой учащиеся выполняют самостоятельно на рабочих местах, предварительно вспомнив правила техники безопасности.
- Zn0 + 2H+1Cl = Zn+2Cl2 + H20?
Zn0 – 2 ? ? Zn+2
восстановитель
H+1 + 1 ? ? H0
окислитель
На щелочные металлы это правило не распространяется, т.к. они легко взаимодействуют с водой, а мы имеем дело с растворами кислот.
Это правило не относится к концентрированной H2SO4 и к азотной кислоте любой концентрации. При взаимодействии с ними кислород не выделяется.
2 правило: Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений. Взаимодействие железа с раствором сульфата меди. Этот опыт учащиеся выполняют также самостоятельно на рабочих местах.
Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4
Fe0 – 2 ? ? Fe+2
восстановитель
Cu+2 + 2 ? ? Cu0
окислитель
Это правило не распространяется на щелочные металлы.
- Металлотермия (взаимодействие металлов с оксидами металлов).
Показываем на примере взаимодействия кальция с оксидом меди (кальциетермия).
Cu+2O + Ca0 = Cu0 + Ca+2O
Cu+2 + 2 ? ? Cu0
восстановитель
Ca0 – 2 ? ? Ca+2
окислитель
Все реакции учащиеся разбирают на доске и в тетрадях с окислительно-восстановительной точки зрения.
В химических реакциях металлы проявляют только восстановительные свойства. Их атомы отдают электроны, образуя в результате положительные ионы.