- Когда делают УЗИ тимуса
- Особенности процедуры
- Преимущества УЗИ тимуса
- Наивные Т-клетки — ключ к долголетию
- Тимус — военная база иммунной системы
- Мы теряем наших бойцов!
- Старики с высоким разнообразием TCR
- Долгая, но бездетная жизнь
- Хранение наивных Т-клеток — полезная инвестиция в будущее
- Итоги
- Как увеличение вилочковой железы (тимуса) влияет на иммунитет ребенка – Medaboutme.ru
- Тимус – что это? Роль тимуса на первому году жизни ребенка — «Prezident-Med»
- Роль тимуса в жизни ребёнка
- Доктора данного направления
- Патология тимуса
- Увеличение тимуса у детей
- Симптомы заболевания или нарушения развития вилочкой железы
- В клиниках «президент-мед» вы можете
- Смотрите так же по теме:
- Вилочковая железа и аутоиммунные процессы в структурах мозга
Вилочковая железа (тимус) расположена в верхнем отделе грудной клетки. В структурном отношении представляет собой железистый орган в виде двух долей, и по внешнему виду напоминает вилку с двумя зубцами. Отсюда и название железы.
Тимус – это орган, которому свойственно в период роста и развития организма изменяться. Он расположен в верхней части грудной клетки. Его величина у новорожденных составляет 40-50 мм, у годовалых малышей – 70-80 мм. Основная задача тимуса – формирование иммунитета.
Когда орган увеличен, нарушается его нормальное функционирование.
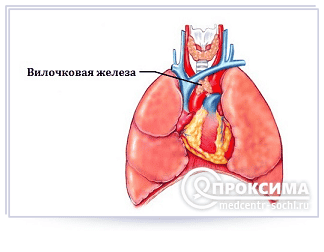 В функциональном отношении вилочковая железа представляет собой элемент иммунной системы. Здесь созревают Т-лимфоциты (тимусзависимые лимфоциты), обеспечивающие клеточный иммунитет. Кроме того, железистая ткань тимуса секретирует вещества белковой природы, которые формируют гуморальный иммунитет, оказывают гормоноподобное действие, и даже влияют на поведенческие реакции.
В функциональном отношении вилочковая железа представляет собой элемент иммунной системы. Здесь созревают Т-лимфоциты (тимусзависимые лимфоциты), обеспечивающие клеточный иммунитет. Кроме того, железистая ткань тимуса секретирует вещества белковой природы, которые формируют гуморальный иммунитет, оказывают гормоноподобное действие, и даже влияют на поведенческие реакции.
Примечательно, что тимус закладывается еще во внутриутробном развитии. Максимум активности этой железы приходится на первые годы жизни.
Далее, после периода полового созревания, происходит постепенное угасание, естественная атрофия или инволюция вилочковой железы. Поэтому большая часть случаев заболеваний тимуса приходится на детский возраст.
Эти заболевания протекают с тимомегалией, увеличением размеров тимуса.
Среди проявлений тимомегалии:
- Иммунологические нарушения: частые, более 10 раз в году, простудные заболевания, аллергические реакции, бронхиальная астма, длительное субфебрильное повышение температуры без конкретных причин.
- Лимфопролиферативные нарушение: увеличение размеров миндалин, лимфоузлов, селезенки.
- Сдавливание окружающих структур – верхней полой вены, трахеи, блуждающего нерва. При этом отмечается одышка, шумное дыхание, усиление сосудистого рисунка грудной клетки, осиплость голоса, набухание шейных вен, отечность шеи.
- Обменные нарушения: ухудшение аппетита, пищеварительные расстройства, патология печени, остеопороз, сердцебиение, замедление роста и полового созревания.
Впрочем, учитывая распространенность тимомегалии среди маленьких детей, мы рекомендуем УЗ диагностику с профилактической целью, даже если симптомы отсутствуют. Такая диагностика делается 3-х кратно в возрасте до 1 года.
Нарушения функции вилочковой железы в редких случаях наблюдаются и у взрослых. Проявляются они частыми инфекционными заболеваниями, аутоиммунными процессами (ревматизм, системная красная волчанка).
У взрослых патология тимуса вторична, и развивается на фоне надпочечниковой недостаточности.
Поэтому, если мы диагностируем заболевания надпочечников по данным анализов, УЗИ и других видов диагностики, мы обязательно направляем пациента на УЗИ тимуса.
Когда делают УЗИ тимуса

На сегодняшний день Узи вилочковой железы является информативным, безболезненным, весьма популярным диагностическим методом в педиатрии. Данное исследование позволяет оценить параметры тимуса, выявить врождённые, приобретённые патологические изменения.
Функциональные особенности органа позволяют ему полноценно работать весь период жизни. Тем не менее, на фоне возрастных изменений в организме, размеры тимуса претерпевают изменения. В пожилом возрасте от него остаётся лишь незначительная часть жировой ткани. Тяжёлое течение у взрослых таких заболеваний как краснуха, корь, ветрянка объясняется именно уменьшением вилочковой железы.
Если не удаётся найти причину постоянных болезней ребёнка при помощи лабораторной диагностики и других диагностических методов, прибегают к ультразвуковому исследованию вилочковой железы. Результаты, полученные в ходе обследования, информируют врача о наличии патологических изменений, которые как по отдельности, так и в совокупности могут встречаться у пациента. Среди них:
- атипичное прогрессирование тяжёлых болезней;
- рецидивы перенесённых ранее заболеваний;
- частые простуды, ГРВИ;
- большой вес для возраста младенца;
- аллергия невыясненного происхождения.
Кроме того, УЗИ тимуса показано в случаях, когда в роду ребёнка были случаи внезапных смертей родственников, и когда необходимо подтвердить / опровергнуть наличие патологий, диагностированных другими методами.
 УЗИ тимуса не требует предварительной подготовки. Возможно, у грудничков из-за громкого крика во время диагностики возможно срыгивание, и это следует учитывать. Впрочем, у врачей нашей клиники имеется большой опыт общения с маленькими детьми, и все негативные эмоции у малыша будут сведены к минимуму. К тому же диагностика у детей проводится только в присутствии мамы, и ее продолжительность невелика, не более 15 мин.
УЗИ тимуса не требует предварительной подготовки. Возможно, у грудничков из-за громкого крика во время диагностики возможно срыгивание, и это следует учитывать. Впрочем, у врачей нашей клиники имеется большой опыт общения с маленькими детьми, и все негативные эмоции у малыша будут сведены к минимуму. К тому же диагностика у детей проводится только в присутствии мамы, и ее продолжительность невелика, не более 15 мин.
Узи вилочковой железы грудничкам мы проводим в положении лежа, малышей постарше можно посадить маме на колени. Школьников, подростков и взрослых обследуем в положении стоя. В вертикальном положении тела структуры грудной клетки опускаются вниз, и железа становится более доступной для исследования.
Вообще, из-за особенностей строения и анатомического расположения вилочковой железы ультразвуковая диагностика требует наличия аппаратуры с высокой разрешающей способностью.
Именно такую аппаратуру используют опытные специалисты нашего центра.
В ходе УЗИ, осуществляемого в двух проекциях, наши специалисты оценивают основные параметры: размеры железы и ее долей, структуру железы, ее эхогенность и анатомическое расположение.
Эти параметры существенно различаются в зависимости от возраста. Чем старше обследуемый, тем железа меньше. В пожилом возрасте она едва различима от окружающей жировой ткани. Но уже после 50 лет тимус не визуализируется на УЗИ, и это является нормой.
Иногда недоразвитие железы (гипоплазия) отмечается еще в детском возрасте, что расценивается как врожденная аномалия. В редких случаях возможно полное отсутствие (аплазия) тимуса. Это состояние сочетается с другими тяжелыми генетическими аномалиями.
В большинстве случаев мы наблюдаем увеличение, гиперплазию тимуса, тимомегалию. Состояние тимуса отображается таким показателем как тимический индекс (ТИ). Этот индекс представляет собой процентное соотношение массы вилочковой железы к массе тела. Массу тимуса наш специалист рассчитывает по ее размерам, определяемым на основании УЗИ.
ТИ увеличивается пропорционально тимомегалии. В этой связи выделяют 3 степени тимомегалии. При выявлении тимомегалии мы направляем ребенка к педиатру, который в зависимости от степени тимомегалии назначает консервативное лечение.
УЗИ тимуса абсолютно безвредно, стоит недорого, и не имеет противопоказаний.
Но иногда для уточнения характера изменений тимуса после УЗИ мы направляем на другие, мене безопасные и более дорогостоящие исследования – рентгенографию, компьютерную томографию.
Опухоли тимуса обнаруживаются нечасто, и, как правило, носят доброкачественный характер. Для диагностики опухолей после УЗИ необходима биопсия. При диагностированном раке мы направляем пациента на операцию. Но случаи рака вилочковой железы встречается очень редко.
Особенности процедуры
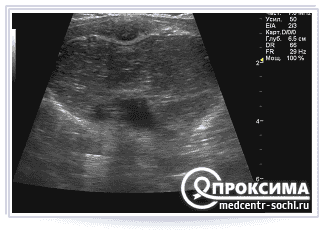
На УЗИ врач легко может определить структурность тканей тимуса, его величину, контуры. Во время исследования могут быть обнаружены такие патологии вилочковой железы как гипоплазия (недоразвитие органа), синдромы Ди Джорджи, Незелофа, различные деформации, а также оценены их размеры, эхогенность, место локализации.
Преимущества УЗИ тимуса
Ультразвуковое исследование вилочковой железы помогает наиболее точно определить структуру и величину органа. Среди преимуществ данной процедуры стоит выделить:
- безопасность;
- безболезненность;
- высокую информативность;
- быстроту;
- доступность.
Наивные Т-клетки — ключ к долголетию
Статья на конкурс «био/мол/текст»: Наивные Т-лимфоциты могут поведать о том, что вы хотели бы скрыть. Впервые было осуществлено секвенирование профиля Т-клеточных рецепторов периферической крови человека.
Успехи в развитии технологий секвенирования нового поколения дают возможность проследить за динамикой колебаний численности и разнообразия наивных Т-клеток по мере старения организма.
Вместе с этими знаниями появляется ответ на вопрос, почему женщины живут дольше мужчин, и приходит мысль о том, что увеличить продолжительность жизни можно, используя собственные Т-клетки. «Иммунологические часы» несложно обмануть, пойдя на хитрость.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Всегда ли можно дать сорокалетнему мужчине его сорок? А пятидесятилетнему? А скольким тридцатилетним женщинам вы бы не дали двадцати? Определять возраст человека по внешней составляющей не самая лёгкая задача. Однако, людям, перешагнувшим определённый порог, различный для мужчин и женщин, когда репродуктивная функция начинает стремительно угасать, становится сложнее скрывать свой возраст.
Для внутренних процессов человеческого организма характерны совершенно иные темпы изменений. «Возрастной порог» нашей иммунной системы расположен гораздо ближе к детству, чем к старости.
Уже с первого года жизни в тимусе ребёнка начинают происходить драматические изменения: функциональная ткань органа заменяется на соединительную, уменьшаясь каждый год на 3% до 35–45 лет, а после 45 — на 1% (рис. 1). В 70 лет соединительная ткань занимает 90% тимуса [1]. Наиболее активно тимус функционирует в пренатальный период и до наступления половой зрелости.
За это время происходит наработка максимальных возможностей Т-клеточного иммунитета, что будет во многом определять эффективность иммунного ответа человека на протяжении всей его жизни.
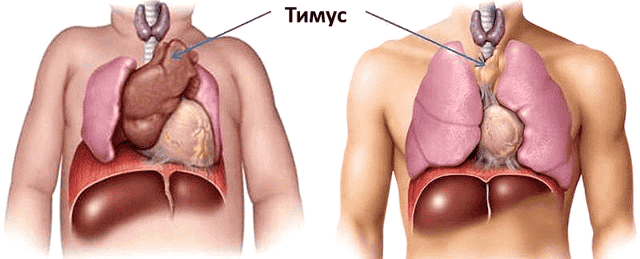
Рисунок 1. Сравнение размеров тимуса у новорождённого (а) и взрослого (б). К 50 годам тимус уменьшается в 5-7 раз по сравнению с первоначальным размером. Рисунок с сайта my.bpcc.edu.
Тимус — военная база иммунной системы
В тимусе иммунная система обучает своих «солдат». Предшественники Т-лимфоцитов размножаются в костном мозге и с кровью попадают в тимус.
В нём происходит ключевое событие в жизни Т-клеток, определяющее их специфичность к антигену, с которым они никогда ещё не встречались — соматическая рекомбинация (также V(D)J-рекомбинация, рис. 2).
Она заключается в перетасовке участков генов, кодирующих гипервариабельные участки α и β цепей Т-клеточного рецептора (TCR). С помощью TCR Т-клетки распознают «свой» антиген, к которому они специфичны, в составе главного комплекса гистосовместимости (MHC) антиген-презентирующих клеток (рис. 3).
Благодаря этому процессу создаётся гигантское разнообразие TCR — около 6 × 105 возможных вариантов на каждые 106 Т-клеток [2].
В силу такой огромной вариабельности Т-клеточных рецепторов существует высокая вероятность того, что при проникновении в организм какого-либо чужеродного агента найдётся Т-клетка, TCR которой окажется специфичным именно ему. Соматическая рекомбинация происходит в кортикальной части тимуса, из неё клетки мигрируют в медуллярную часть и претерпевают негативный отбор: в экземплярах, реагирующих на собственные антигены, экспрессируемые организмом, запускается апоптоз.
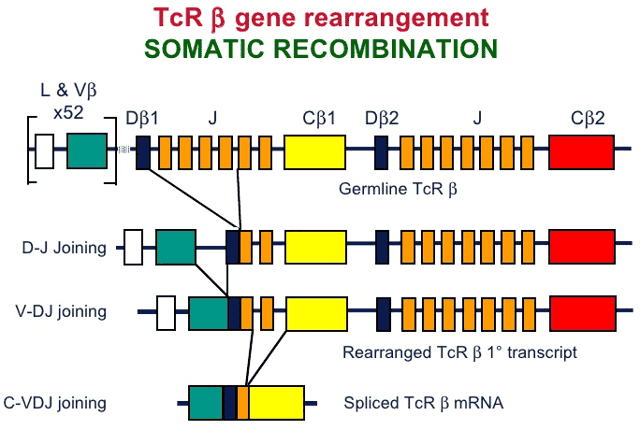
Рисунок 2. Соматическая рекомбинация на примере β цепи TCR. Исходная последовательность в гене, кодирующем β цепь TCR содержит V (variable), D (diversity), J (Joining) и C (constant) сегменты. Сначала один из двух D-сегментов соединятеся с одним из 13 J-сегментов.
Получившийся DJ-сегмент присоединяется к одному из 50 V-сегментов. Сегменты выбираются случайным образом, и механизм их сшивки также предполагает случайное варьирование количества пар оснований, это обеспечивает разнообразие TCR.
Аналогичный процесс происходит c последовательностью, кодирующей α-цепь только без D-сегмента. Рисунок с сайта Slideshare.
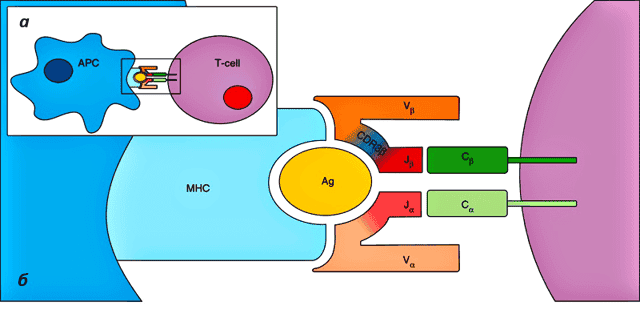
Рисунок 3. Взаимодействие TCR и антиген-презентирующей клетки. а — Т-клетка (фиолетовая) взаимодействует с антиген-презентирующей клеткой (APC, синяя).
б — APC презентирует антиген в составе MHC. Гетеродимер TCR состоит из α и β цепей, охватывающих MHC с антигеном.
С антигеном главным образом взаимодействуют области CDR3 — это домены, отвечающие за специфичность TCR к данному антигену. Рисунок с сайта Genomemedicine.
После наступления пубертатного периода производство тимусом наивных Т-клеток резко снижается и на протяжении всей взрослой жизни человека активность этого органа остаётся на самом базальном уровне.
Чем это грозит? Созданное за такой короткий период огромное разнообразие TCR действительно обеспечивает эффективный иммунный ответ на большинство потенциальных угроз.
Но это разнообразие остаётся константным только некоторое время.
Мы теряем наших бойцов!
Многие современные исследования в области иммунологии посвящены усовершенствованию подходов к вакцинации пожилых людей.
Почему для людей преклонного возраста вакцинация практически неэффективна? Наивные Т-клетки стареют вместе с человеком, за всю жизнь они проходят множество делений, в результате которых неизбежно «портится» ДНК, клетки начинают хуже выполнять свои функции.
Клетки памяти, произошедшие от стареющих наивных Т-клеток, при повторной встрече с антигеном секретируют скудный спектр цитокинов, их способность к пролиферации снижена [3].
Появление функциональных дефектов в пуле наивных Т-клеток с возрастом не вызывает удивления, но какой несправедливостью было бы уменьшение по мере старения человека разнообразия ТCR, созданного в результате блестящего тактического хода нашего организма ещё в детстве, мощнейшего оружия иммунной системы. Так и есть, жизнь несправедлива!
По результатам последних исследований [2], доля наивных Т-клеток как в CD4+ (Т-хелперы) так и в CD8+ (Т-киллеры) субпопуляциях периферической крови человека линейно уменьшается с возрастом. В детстве она составляет 50–80% от всего Т-клеточного пула и уменьшается на 0,75% каждый год, к 70 годам она составляет одну четверть первоначального изобилия.
Авторы исследования [2] создали новый подход к использованию технологии секвенирования нового поколения компании Illumina для получения наиболее точных индивидуальных профилей репертуара TCR у людей различных возрастных групп.
Было показано, что разнообразие TCR в периферической крови человека коррелирует с процентным содержанием в ней наивных Т-клеток и почти линейно уменьшается с возрастом — примерно на 5 × 103 вариантов TCR в год. Наивные Т-клетки сосуществуют в крови с Т-клетками памяти, клоны которых образуются в результате пролиферации наивных Т-клеток, повстречавших «свой» антиген.
Размножившиеся клоны с каждым годом занимают всё большую долю доступного для пролиферации пространства в крови, это отражается на численности наивных Т-клеток, так как общее количество Т-клеток в крови человека относительно стабильно.
Общее разнообразие TCR определяется количеством редких клонов в пуле Т-клеток, поэтому отсутствие возрастных изменений в разнообразии наиболее многочисленных Т-клеточных клонов указывает на то, что клоны наивных Т-клеток теряются с возрастом.
Это связано с тем, что клоны наивных Т-клеток обычно малочисленны, поэтому вероятность того, что ни одна клетка данного клона не сможет поделиться или погибнет в результате каких-то случайных событий гораздо выше, чем для клонов с большим числом клеток.
Старики с высоким разнообразием TCR
Исследователи [2] сравнивали Т-клеточные профили периферической крови людей из четырех возрастных групп. Удивительным оказалось то, что люди в возрасте 71–90 лет обладали большим разнообразием TCR и большим процентным содержанием наивных Т-клеток в пуле CD4+, чем люди возрастной категории 61–66 лет.
Возможным объяснением такого отклонения от линейной зависимости стало предположение о восстановлении утраченных функций тимуса вследствие прекращения выработки половых гормонов в пожилом возрасте.
Считается, что наиболее заметный спад активности тимуса происходит во время пубертатного периода, когда организм резко начинает вырабатывать большие количества половых гормонов.
Вероятно, это связано с перераспределением ресурсов: приоритет в этом возрасте отдаётся развитию половой системы, а процесс созревания наивных Т-клеток в тимусе довольно энергозатратен.
Смысл столь ранней инволюции органа может заключаться и в том, что в юном возрасте тимус состоит из молодых тканей, в структуре которых ещё нет дефектов, повышающих вероятность проникновения чужеродных агентов внутрь органа и использование их клетками тимуса для презентации созревающим наивным Т-клеткам как собственных антигенов, экспрессируемых организмом [5].
Другое объяснение явления увеличения разнообразия TCR после 70 лет заключается в том, что люди этой возрастной группы уже перешагнули определённый возрастной порог, пройдя в некотором смысле проверку на прочность — уникальный набор физиологических параметров, включая особенности иммунной системы, сделал их наиболее приспособленными среди всех особей популяции в данных условиях. Из этого можно заключить, что повышенное содержание наивных Т-клеток в субпопуляции CD4+ периферической крови человека коррелирует с долгожительством. Увеличение доли наивных Т-клеток в пуле CD4+, а значит и увеличение разнообразия TCR обеспечивает лучшую иммунорегуляторную функцию, что снижает общее воспаление, усиливающееся по мере старения организма из-за активации аутоиммунных процессов, увеличивает эффективность распознавания раковых клеток и обеспечивает более сбалансированный иммунный ответ [2].
Долгая, но бездетная жизнь
Рисунок 4. Придворные евнухи в Китае. Некоторые евнухи жили более ста лет. Рисунок с сайта Lacasamundo.
Исследование о придворных евнухах династии Чозунь в Корее 2012 года [6] показало, что продолжительность жизни евнухов составляла на 15–20 лет больше, чем продолжительность жизни мужчин с нормальной репродуктивной функцией, живущих в тех же условиях (рис. 4).
Возможно, их продолжительность жизни увеличивалась именно благодаря отсутствию инволюции тимуса под влиянием половых гомонов, а следовательно благодаря большему разнообразию TCR наивных Т-клеток.
В пользу этой гипотезы можно привести данные о том, что у женщин производство тимусом наивных Т-клеток происходит более эффективно, чем у мужчин, и уменьшение их содержания в периферической крови у женщин выражено в меньшей степени, чем у мужской части населения [7].
Возможно, лучшая работа иммунной системы у женщин связана с тем, что во время беременности иммунитет женщины необходимо «обуздать», сделав его толерантным к фактически чужеродному телу — плоду, что требует участия сложных регуляторных путей. Высокая точность регуляции иммунного ответа очень важна, так как ошибка приведёт к потере потомства.
К этим рассуждениям можно прибавить и тот факт, что у женщин с наступлением менопаузы яичники перестают вырабатывать эстрогены, а у мужчин выработка половых гормонов не прекращается. Это объясняет большую продолжительность жизни у женщин, чем у мужчин, характерную для любых национальностей. В Европе и США женщины живут дольше мужчин на 4,5–5 лет, в России — на 13 [6].
Мальчик, которому сделают орхеэктомию (удаление яичек), может быть, и получит дополнительные 10–15 лет жизни, вместе с тем лишившись возможности иметь детей и получив набор других не совсем приятных последствий. Существуют менее радикальные решения, основанные на приёме определённых препаратов, способствующих восстановлению функции тимуса.
Одно из таких веществ — грелин, этот гормон вырабатывается слизистой оболочкой желудка и вызывает чувство голода, действуя на центры гипоталамуса. Оказалось, что грелин участвует в Т-клеточном сигналлинге, способен снижать связанное с возрастными изменениями воспаление, способствует восстановлению структуры тимуса и стимуляции его функций.
Ряд цитокинов и факторов роста (интерлейкины 7 и 22, фактор роста кератиноцитов) являются потенциальными кандидатами для решения проблемы восстановления функции тимуса у взрослых людей. Интерлейкины обеспечивают дифференцировку и выживание тимоцитов.
Фактор роста кератиноцитов необходим для пролиферации и дифференцировки функциональных тканей тимуса, его использование вызывает пролиферацию тимоцитов и увеличивает размеры органа. Возможно также использование веществ, блокирующих выработку стероидных гормонов, таких как аналоги гонадотропин-релизинг гормона, например, люпрона.
Люпрон действует на гипофиз, блокируя рецепторы к гонадотропин-релизинг гормону, из-за чего уменьшается выработка лютеинизирующего и фолликуло-стимулирующего гормонов, что ведёт к снижению продукции эстрогена и тестостерона.
И всё же, все вышеперечисленные вещества имеют неоднозначное воздействие на организм, и пока ещё нет данных о долгосрочных последствиях их приёма, поэтому их назначают только в случае восстановления после химиотерапии или при ВИЧ-инфекции, когда стимуляция работы тимуса необходима для реконституции иммунной системы [1].
Хранение наивных Т-клеток — полезная инвестиция в будущее
Есть ли иной способ продлить мужскую жизнь? Авторов статьи [2] посетила смелая идея решения этой проблемы.
Кроме того, что редко встречающиеся клоны наивных Т-клеток в результате случайных событий теряются с возрастом, они, как и все клетки организма, могут поделиться лишь ограниченное количество раз (примерно 50 — лимит Хейфлика), что обусловлено укорочением теломерных участков хромосом после каждой репликации ядерной ДНК, а делятся наивные Т-клетки раз в 1–2 года. Значит примерно к 70 годам основная часть Т-клеток выйдет из строя. Решение есть — можно запасать наивные Т-клетки! У молодых людей в возрасте до 15–20 лет, когда процессы формирования основного пула наивных Т-клеток уже заканчиваются, нужно брать образцы крови в таком объёме, чтобы количества наивных Т-клеток в них хватило для полного восстановления их пула уже в пожилом возрасте, и заморозить. Очень важно, чтобы забор произошёл именно в этот промежуток времени. Если брать кровь у более взрослых людей, количества циркулирующих наивных Т-клеток просто не хватит для полной реставрации их пула в будущем. Конечно же, такой подход будет эффективен и для женского пола. Эти образцы крови будут не только средством продления жизни, но ещё и подстраховкой в случае аутоиммунных заболеваний или рака, они помогут восстановить иммунную систему после химиотерапии. Создание подобных банков с замороженными образцами крови стало бы ключевым событием в становлении абсолютно новых подходов к лечению заболеваний иммунной системы. Например, СПИД можно было бы вылечить введением в здоровые размороженные Т-клетки заразившегося СПИДом мутации по гену мембранного рецептора CCR5 (CD195), люди с такой мутацией обладают природной резистентностью к ВИЧ [8], и их пересадкой больному, предварительно прошедшему курс химиотерапии.
Итоги
Как бы молодо не выглядел человек, параметры его иммунной системы будут объективно отражать возраст. Такие параметры как количество наивных Т-клеток и разнообразие TCR практически линейно снижаются по мере старения.
Если вы являетесь счастливым обладателем повышенного разнообразия TCR, можете надеяться на несколько бонусных лет жизни.
В будущем человечество ожидают новые дерзкие подходы к увеличению продолжительности жизни с использованием собственных наивных Т-лимфоцитов, собранных и замороженных много лет назад.
- Ventevogel M.S. and Sempowski G.D. (2013). Thymic rejuvenation and aging. Curr. Opin. Immunol. 25, 516–522;
- Britanova O.V., Putintseva E.V., Shugay M., Merzlyak E.M., Turchaninova M.A., Staroverov D.B. et al. (2014). Age related decrease in TCR repertoire diversity measured with deep and normalized sequence profiling. J. Immunol. 192, 2689–2698;
- Haynes L. and Swain S.L. (2012). Aged-related shifts in T cell homeostasis lead to intrinsic T cell defects. Semin. Immunol. 24, 350–255;
- Т-лимфоциты: путешественники и домоседы;
- Википедия: Thymus (англ.);
- Gems D. (2014). Evolution of sexual dimorphic longevity in humans. Aging (Albany NY). 6, 84–91;
- Pido-Lopez J., Imami N., Aspinall R. (2001). Both age and gender affect thymic output: more recent thymic migrants in females than males as they are. Clin. Exp. Immunol. 125, 409–413;
- Википедия: HIV immunity (англ.)..
Как увеличение вилочковой железы (тимуса) влияет на иммунитет ребенка – Medaboutme.ru
В организме детей есть особый орган, который к взрослому возрасту практически полностью исчезает — это тимус (вилочковая железа). В некоторых случаях эта железа увеличивается в размерах, формируется тимомегалия.
Если родители узнают о подобном диагнозе, это пугает, особенно когда необходимо проведение рентгенографии (или даже целой серии снимков).
Зачастую такое состояние сопровождают проблемы иммунитета, частые простуды и длительно держащаяся температура, увеличение лимфоузлов. Что же это за состояние, чем оно опасно?

Тимус — это особый орган, он расположен в глубине грудной клетки детей, близко к трахее. В нем есть две доли, которые плотно соединены между собой.
В период новорожденности его масса достигает 20 г, он постепенно растет на протяжении периода детства, достигая максимума своих размеров в период пубертата, затем постепенно начинает атрофироваться, и зачастую у взрослых, после 30 лет уже не обнаруживается. Зачем детям тимус? Основная его роль — это формирование иммунитета, он производит особые клетки — Т-лимфоциты.
Если работа тимуса нарушается в силу различных причин, у детей возникают проблемы иммунитета. Наиболее часто дети страдают от тимомегалии (разрастание тканей железы), при которой размеры органа значительно превышают норму, иногда в три и более раза.
При незначительной гиперплазии (разрастании) органа, родители не отмечают никаких отклонений в состоянии здоровья и развитии детей, и зачастую этот диагноз выявляется случайно, при проведении обследований по другим поводам.
Если же размеры органа существенно превышают нормативные значения, это может приводить к частым заболеваниям, нарушению работы дыхательных органов и сердца, из-за их механического давления.
Однако, только такими проявлениями увеличение тимуса не ограничивается, родители могут отмечать у малышей частую заболеваемость, нарушения ростовых процессов, что связано с влиянием органа на иммунитет и эндокринные функции тела.
Нередко при выявлении данной проблемы родителей с малышом отправляют на консультацию к иммунологу, а также, в некоторых случаях, еще и к эндокринологу.
Наиболее часто увеличение тимуса наблюдается у детей, которые родились с повышенным весом тела (от 4000 г). Родители таких крепышей должны быть особенно внимательными к их здоровью, вовремя отмечая особые признаки, которые могут иметь отношение к проблемам тимуса и иммунитета.
При тимомегалии наблюдается общая бледность и явно просматривающаяся венозная сеть на груди. Нередко отмечается субфебрильная температура (до 37,5-37,7℃) без каких-либо признаков простуды. Нередко температура имеет тенденцию к колебанию в течение дня, она не имеет суточных ритмов.
На фоне плача у детей может отмечаться синюшность вокруг рта или на кончиках пальцев, формируется кашель без признаков простуды, кроме того, дети нередко срыгивают.
Если речь идет о детях старше года, для них признаками увеличения тимуса станут увеличение миндалин, лимфатических узлов или зернистость задней стенки глотки, появление температуры до 37,5℃ без иных признаков ОРВИ, нередко бывает похолодание конечностей или испарина на лбу, сильная потливость.
Появление пота никак не связано с повышением температуры, на фоне нее руки и ноги могут быть холодными, а лоб — потным. Также для этих детей типично понижение давления и наличие лишнего веса, вплоть до ожирения, родители замечают, что кожа имеет эффект «мраморности» из-за нарушения тонуса капилляров.
Важно знать, что для детей с тимомегалией существуют определенные внешние особенности, которые заметят родители и выявит врач.
Для них типично коренастое телосложение с широкой спиной и крупными ступнями, круглым лицом и большими ладонями, мышцы слабо развиты, в то время как жира много, кожа у них бледная, они много кушают, из-за чего развивается ожирение. Для них типичен пониженный иммунитет, они часто и длительно болеют.
Основа диагностики — это типичные внешние черты с наличием жалоб, проблем с иммунитетом (частые ОРВИ, затяжной насморк, кашель).
Если подозрения подтверждаются, врач отправляет на консультации к иммунологу и эндокринологу, для полной картины необходима рентгенография грудной клетки и УЗИ тимуса, брюшной полости и почек, анализы крови, в том числе и иммунограмма.
Изначально можно выявить увеличение тимуса на рентгенографии. В дальнейшем, рентгенография и полученные в нескольких проекциях снимки будут необходимы для определения степени выраженности проблемы и тактики лечения.
Так, после проведения рентгенографии с получением четких снимков определяют особый показатель КТТИ (кардио-тимико-торакальный индекс), по его показателю выявляют три степени тяжести тимомегалии.

При выявлении тимомегалии и определения ее степени, параллельно с этим проводят анализы крови, в которых обычно выявляется снижение количеств лимфоцитов. Это становится поводом для того, чтобы прицельно обследовать иммунитет на предмет серьезных отклонений в его функционировании. Врач назначает иммунограмму с оценкой количества Т-лимфоцитов и других иммунных клеток.
Кроме того, врач оценивает состояние иммунитета, исходя из количества эпизодов ОРВИ в течение года, у детей после года их число не должно превышать 4-6 раз в году, если же дети не вылезают из простуд, это характеризует иммунитет как сниженный, ослабленный.
По результатам обследований врач определяет тактику ведения ребенка, назначает ему план наблюдения, прием препаратов для укрепления иммунитета и общие закаливающие, режимные мероприятия.
Обычно требуется наблюдение, так как к 6 годам объем тимуса обычно существенно уменьшается в силу возрастной инволюции.
Важно определиться на это время с проведением прививок и посещением детских учреждений в связи с риском частых простуд.
Тимус – что это? Роль тимуса на первому году жизни ребенка — «Prezident-Med»
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе.
Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами.
Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую.
Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
- Аплазия – отсутствие или недоразвитие вилочковой железы
- Гипо- и дисплазия – недоразвитие тимуса
- Акцидентальная инволюция – уменьшение вилочковой железы, под влиянием гормонального дисбаланса, стресса, инфекции
- Атрофия – уменьшение, замещение железистой ткани соединительной, прекращение функционирования
- Тимомегалия – увеличение массы и объема паренхимы вилочковой железы выше возрастной нормы при сохранении ее нормального строения
- Гиперплазия – увеличение железистой ткани, с нарушением выработки иммунных клеток и функционирования тимуса.
- Тимома – опухоль вилочковой железы.
- Киста тимуса – жидкостное образование вилочковой железы.
- Патология тимуса (вилочковой железы) может вызывать: развитие ряда иммунодефицитных синдромов, аутоиммунных заболеваний и некоторых эндокринных нарушений.
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием.
Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем.
Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
- Частая заболеваемость ребенка простудными заболеваниями.
- Затяжное течение различных заболеваний, с частыми осложнениями.
- Увеличение лимфоидной ткани – лимфатических узлов, миндалин, аденоидов, ткани на задней поверхности глотки.
- Бледность и/или мраморный рисунок на коже ребёнка.
- Большой вес ребёнка при рождении.
- Ребёнок быстро теряет и быстро набирает вес.
- Кашель вне простудного заболевания, который усиливается в положении ребёнка горизонтально.
- Потливость, субфебрильная температура длительное время вне простудных заболеваний.
- Гипергидроз, холодные конечности.
- Видимая венозная сеточка на груди малыша.
- Цианоз (посинение) носогубного треугольника при нагрузках (плач, бег)
- Частые срыгивания, икоты, отрыжки
- Одышка
- Нарушение сердечного ритма
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
- УЗИ вилочковой железы,
- КТ,
- МРТ,
- рентген,
- общий анализ крови,
- иммунограмму,
- биохимический анализ крови,
- кровь на гормоны.
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
В клиниках «президент-мед» вы можете
- пройти обследование и лечение по более чем 30 медицинским специализациям, реабилитацию после инсультов, операций, травм,
- сдать различные виды анализов (более 5000 видов анализов и лабораторных исследований),
- пройти функциональную диагностику (УЗИ, эндоскопия: гастроскопия), ЭКГ, установка и расшифровка СМАД и Холтер-ЭКГ и другие,
- пройти медицинскую комиссию за один день, пройти профосмотр (как для организаций, так и для частных лиц),
- получить всевозможные справки – справки в ГИБДД и для допуска к занятиям спортом, для приобретения оружия, в санаторий,
- при наличии показаний – оформить лист временной нетрудоспособности,
- оформить и получить другие виды медицинской документации,
- сделать любые инъекции,
- воспользоваться услугами хирургии одного дня или дневного стационара.
Смотрите так же по теме:
- Детский хирург
- Детское УЗИ
- Детский дерматолог
Вилочковая железа и аутоиммунные процессы в структурах мозга
Аутоиммунные заболевания центральной нервной системы (ЦНС) связаны с высоким уровнем заболеваемости.
Наиболее распространенным и широко изученным аутоиммунным заболеванием ЦНС является рассеянный склероз (MS), который поражает около 2,3 миллиона человек во всем мире с распространенностью около 1 на 1000 человек в западных странах. Общее экономическое бремя рассеянного склероза в Европе оценивается в 14,6 млрд евро.
Другие аутоиммунные заболевания ЦНС подразделяются на специфические воспалительные заболевания ЦНС или системные воспалительные заболевания с проявлениями в ЦНС вследствие прямой реакции на паренхиму ЦНС или васкулит ЦНС.
Усилия исследователей ранее были сосредоточены на вкладе периферической адаптивной и врожденной иммунной системы в аутоиммунитет ЦНС. Однако, неудача отрицательного отбора тимуса ( вилочковой железы ) является необходимым шагом в ЦНС-реактивных Т-клетках, ускользающих на периферию.
Даже при нарушенной толерантности тимуса или периферической нервной системы развитие воспаления ЦНС встречается редко. Причины, лежащие в основе этого, в настоящее время плохо изучены.
В этой заметке рассматриваются доказательства, свидетельствующие о причастности тимусной селекции к патогенезу аутоиммунитета ЦНС.
Модели на животных предполагают, что отрицательный отбор тимуса является важным фактором, определяющим восприимчивость и тяжесть воспаления структур головногго мозга (ЦНС). Имеются косвенные клинические данные, свидетельствующие о том, что функция тимуса также важна при аутоиммунных заболеваниях ЦНС человека.
В частности, связь между тимомой и паранеопластическим энцефалитом, а также изменения в кругах эксцизии Т-клеточных рецепторов при рассеянном склерозе указывают на толерантность тимуса к этим заболеваниям.
Терапевтические манипуляции с тимопоэзом потенциально могут открыть новые методы лечения, но прежде чем это можно будет реализовать, необходимо лучшее понимание толерантности тимуса при аутоиммунитете ЦНС.
Воспаление ЦНС является результатом патологической дисфункции иммунной толерантности, что, в свою очередь, подразумевает сбой в двух механизмах, которые гарантируют, что адаптивный иммунитет распознает и реагирует на ассоциированные с патогеном неаутоантигены, сохраняя при этом толерантность к аутоантигенам.
Иммунопатология аутоиммунных заболеваний ЦНС включает нарушение толерантности как в Т-, так и в В-клеточных компартментах: ЦНС-направленные аутореактивные В-клетки, CD8 + Т-клетки и CD4 + Т-хелперы ( TH1 , TH17 ) инфильтрируют ЦНС вместе с врожденными иммунные клетки, что приводит к нейротоксичности и/или воспалительному повреждению тканей.
Толерантность в Т-клеточном компартменте поддерживается за счет его непрерывной индукции как в центре тимуса, так и на периферии в тканях-мишенях. Эти механизмы формируют репертуар антигенов, распознаваемых Т-клетками через их Т-клеточные рецепторы (TCR).
Таким образом, характер и тяжесть дефектов центральных и периферических механизмов толерантности определяют степень и разнообразие спектра аутоантигенов, характеризующих различные аутоиммунные заболевания ЦНС.
Толерантность В-клеток устанавливается последовательными контрольными точками как на ранних, так и на поздних стадиях дифференцировки В-клеток в костном мозге.
В то время как толерантность центральных В-клеток развивается независимо от модуляции Т-клеток, аутореактивные В-клетки, избегающие негативного отбора в костном мозге или генерируемые на периферии в результате соматической гипермутации, обычно предотвращаются от вызывания аутоиммунитета посредством взаимодействия ВТ-клеток, что наиболее важно, индукции В-клеток. анергией или FoxP3 + регуляторные Т-клетки ( Treg ).
Экспериментальные и клинические исследования роли иммунной толерантности в возникновении и прогрессировании аутоиммунитета ЦНС были преимущественно сосредоточены на механизмах, лежащих в основе установления и длительного поддержания периферической толерантности.
Исторически вклад механизмов толерантности тимуса как в возникновение, так и в продолжение воспаления ЦНС не изучался столь широко.
Однако накопление данных in vitro и in vivo возродило интерес к механизмам центральной толерантности, в частности селекции тимуса, в патогенезе аутоиммунных заболеваний ЦНС.
- Аутоиммунные заболевания ЦНС
- Наиболее распространенными аутоиммунными заболевания ЦНС являются : рассяенный склероз, оптический нейромиелит, синдром регидного человека , аутоиммунный энцефалит , церебеллит , энцефалит Расмуссена , энцефалит Бикерстаффа , комбинированная центральная и периферическая демиелинизация.
- Рассеянный склероз
Клиническая картина рассеянного склероза проявляется многоочаговыми рецидивирующими-ремиттирующими процессами воспаления в ЦНС. Это сопровождается прогрессирующим неврологическим дефицитом, связанным с воспалением при прогрессировании заболевания.
Множественные возможные антигены, вероятные компоненты миелина представлены в патогенезе рассеянного склероза.
В основе клеточного патогенеза рассеянного склероза лежит комбинированное воспаление, опосредованное В-клетками и Т-клетками, с участием врожденного иммунитета.
Расстройства спектра оптиконейромиелита
Оптиконейромиелит — моно-/полифазное воспалительное заболевание, в основном ограниченное спинным мозгом или зрительными нервами. Основными антигенами здесь являются: аквапорин 4 и гликопротеин миелиновых олигодендроцитов, а клеточный патогенез проявляется опосредованными аутоантителами.
Аутоиммунный энцефалит
Течение аутоиммунного энцефалита переменное и обычно включающее подострую энцефалопатию , судороги и психические расстройства , вплоть до психоза, причина которого часто просматривается психиатрами.
Сегодня известно , что антигенами аутоиммунного энцефавлита являются : NMDAR, LGI1, CASPR2, AMPAR, GABA A/B R и другие. Аутоиммунные энцефалит также , как и оптический нейромиелит опосредован аутоантителами.
- Расстройство спектра ригидного человека
- Основными симптомами ригидного человека являются спазмы и мышечная ригидность, антигены GAD и глициновый рецептор, а патогенез представляет собой комбинированное поражение В- и Т-клеток +/- антитела против GAD.
- Комбинированная центральная и периферическая демиелинизация
- Основной антиген при комбинированной центральной и периферической демиелинизации — нейрофасцин, патогенез опосредован аутоантителами , а клиника выражается в очаговом неврологическом дефиците и полирадикулоневропатии.
- Развитие и функции вилочковой железы
Тимус развивается как часть сегментации задней части глотки: все ТECs происходят из вентральной энтодермальной выстилки третьего глоточного кармана.
Эта примордиальная закладка тимуса привлекает ранние тимоциты и развивается в отдельные области коры и мозгового вещества, где взаимодействие ТECs с другими локальными антигенпрезентирующими клетками (АРС) и стромальными клетками формирует сложный трехмерный каркас, критически важный для дифференцировки и селекции тимоцито.
Дифференцировка, функциональная специализация и установление толерантности развивающихся Т-клеток (тимоцитов) зависят от их взаимодействия с эпителиальными клетками тимуса (ТECs).
TEC представляют собой MHC-экспрессирующие антигенпрезентирующие клетки (APC), взаимодействие которых с тимоцитами ограничивает репертуар Т-клеток обычными αβT-клетками, экспрессирующими TCR, которые функционально взаимодействуют с собственным MHC (позитивная селекция), не приводя к аутореактивности (негативная селекция) .
Кроме того, передача сигналов фактора роста и цитокинов с помощью TECs поддерживает тимопоэз и влияет на спецификацию линии тимоцитов. Помимо обычных αβT-клеток, вилочковая железа также продуцирует γδT-клетки, Т-клетки естественных киллеров (NKT) и инвариантные Т-клетки, ассоциированные со слизистой оболочкой. Они здесь подробно не обсуждаются, но все они связаны с аутоиммунным заболеванием ЦНС и требуют интактного тимопоэза для своего развития.
Положительный отбор обычных Т-клеток происходит в коре и опосредуется исключительно корковыми TEC (cTEC). Тимоциты отбираются по стромальным сигналам выживания, если они экспрессируют TCR с высокой аффинностью к его родственному комплексу пептид-MHC (pMHC), экспрессируемому на поверхностях cTEC.
Тимоцитам, которые не соответствуют этим критериям ограничения MHC (около 98%), запрещается дальнейшее созревание в Т-клетки из-за отказа от селективных стромальных сигналов выживания, и они умирают из-за пренебрежения. Отрицательный отбор тимоцитов происходит как в корковом, так и в мозговом веществе .
Это опосредовано cTEC или mTEC вместе с другими внутритимусными APC. При отрицательном отборе презентация антигена индуцирует апоптоз тимоцитов, экспрессирующих TCR с высоким сродством к аутоантигенам.
В то же время тимоциты, экспрессирующие TCR с промежуточным или высоким сродством к аутоантигенам, подвергаются процессу клональной диверсии: вовлечение аутоантигенов их аутореактивными TCR в присутствии благоприятной цитокиновой среды (TGFβ, IL-2) индуцирует экспрессию FoxP3 и дифференцировка в T reg тимуса (tT reg ), которые ограничивают аутореактивность периферических T клеток. Баланс между выживанием, клональной диверсией и клональной делецией в основном определяется аффинностью взаимодействий TCR-pMHC.
ЦНС — аутореактивные Т — клетки
Т-клетки вносят вклад в иммунопатогенные механизмы аутоиммунных заболеваний ЦНС как через клеточный иммунитет, включающий прямую индукцию воспаления ЦНС вместе с врожденными иммунными клетками, так и через гуморальный иммунитет, стимулирующий выработку аутоантител в В-клетках.
Доказательством того, что Т-клетки могут вызывать иммуноопосредованное повреждение ЦНС, являются либо ЦНС-реактивные Т-клетки в образцах ткани ЦНС и/или спинномозговой жидкости (ЦСЖ) пациента, либо связь между гаплотипами HLA и предрасположенностью к аутоиммунным заболеваниям ЦНС.
Нейропатологические исследования показывают, что аутореактивная Т-клеточная инфильтрация характерна как для паранеопластических форм аутоиммунного энцефалита, при которых цитотоксические Т-клетки и «онконевральные» антитела направлены против внутриклеточных аутоантигенов ЦНС, так и для аутоиммунных энцефалитов, характеризующихся аутоантителами к поверхностным аутоантигенам ЦНС, например NMDA. рецепторы, богатый лейцином и глиома-инактивированным белком 1 (LGI1). Аналогичным образом, при расстройствах спектра синдрома ригидности (SPSD) IFNγ-продуцирующие CD4 + T-клетки, специфичные к изоформе аутоантигена глутаминовой кислоты декарбоксилазы (GAD65), могут быть выделены из образцов крови и спинномозговой жидкости пациента и примерно у 90% пациентов стимулируют продукция аутоантител IgG к GAD65 интратекальными В-клетками. При энцефалите Расмуссена наблюдается заметная инфильтрация паренхимы ЦНС IFNγ-продуцирующими CD8 + , CD4 + и γδ-T-клетками, хотя пока еще нет идентифицируемой аутоантигенной мишени.






