- Что такое инертные газы?
- Где применяются благородные газы?
- Благородные, или инертные газы: свойства и применение
- Свойства
- Применение
- Гелий
- Неон
- Аргон
- Криптон и ксенон
- Радон
- Почему и какие газы называются «благородные»
- Что такое «благородные» газы
- Список «благородных» газов
- Почему газы назвали «благородными»
- Другие названия «благородных» газов
- Почему благородные газы называют благородными?
- Fun Fact
- Подробнее об элементах благородных газов
- Почему некоторые газы называют благородными
- Разница между инертными газами и благородными газами
- Основное отличие — инертные газы от благородных газов
- Что такое инертные газы
- Примеры соединений, образованных из ксенона:
- Связь между инертными газами и благородными газами
- Определение
- Частицы газа
- Химическая реактивность
- элементы
- Заключение
- Рекомендации:
- Почему гелий меняет наш голос, а также что такое инертные газы
- Гелий и его свойства:
- Почему гелий изменяет голос?
- Благородные металлы: почему они так называются и сколько их
- Признаки благородства и классификация элементов
- Основные характеристики и особенности
- Золото (aurum)
- Серебро (argentum)
- Платина (platinum) и «дочерние» представители
- История открытий
- Платиновое «серебришко»
- Остальные представители группы
- Нахождение в природе и получение
- Сферы и области использования
Даже если вы очень далеки от химии, скорее всего, вы хотя бы раз в своей жизни могли услышать выражение «благородные газы». К ним относятся всем известные неон, криптон, аргон, ксенон, гелий и радон. Так почему же именно газы стали называться благородными? И в чем же именно заключается их благородство? Давайте попробуем разобраться вместе.

Благородных газов в природе всего 6: Неон, Криптон, Аргон, Ксенон, Гелий и Радон
Что такое инертные газы?
Благородные газы, известные в химии благодаря своему уникальному свойству не смешиваться с другими веществами, также часто называют инертными.
Как можно судить из названия, “благородство” инертных газов не позволяет им взаимодействовать с более простыми субстанциями и даже друг с другом.
Такая избирательность благородных газов вызвана их атомным строением, которое проявляется в замкнутой внешней электронной оболочке, не позволяющей радону, гелию, ксенону, аргону, криптону и неону обмениваться своими электронами с атомами других газов.
Самым распространенным инертным газом в природе считают аргон, который занимает почетное третье место по содержанию в атмосфере Земли после азота и кислорода. У аргона нет вкуса, запаха и цвета, однако именно этот газ считается одним из самых распространенных во Вселенной. Так, наличие этого газа наблюдается даже в некоторых планетарных туманностях и в составе некоторых звезд.

При нагревании в газоразрядной трубке аргон приобретает розовый оттенок
Самым редким благородным газом в природе считают ксенон, который несмотря на свою редкость, содержится в атмосфере Земли наряду с аргоном. Ксенон обладает наркотическими свойствами и часто применяется в медицине в качестве анестезирующего средства.
Кроме того, согласно данным Всемирного антидопингового агентства, ингаляции этого редкого газа имеют допинговый эффект, влияющий на физическое состояние применяющих его спортсменов.
Заполнение ксеноном легких человека приводит к временному понижению тембра голоса, что является эффектом, обратным применению гелия.
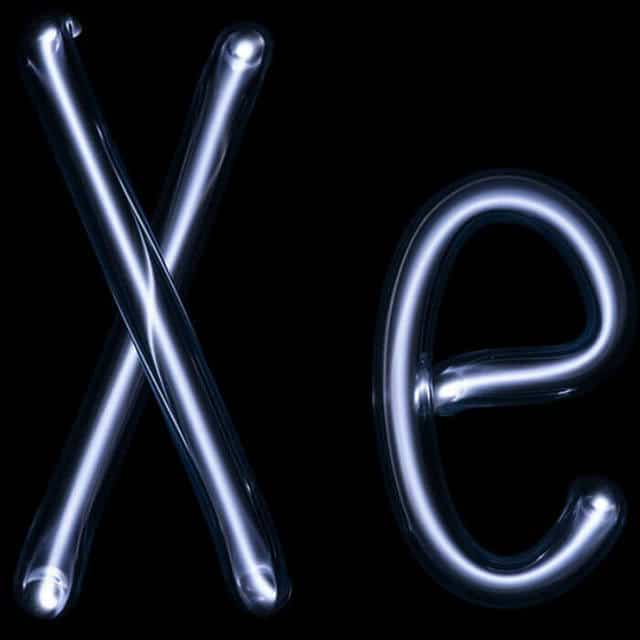
При нагревании ксенон светится фиолетовым цветом
Четверо остальных благородных газов — Радон, Гелий, Неон и Криптон — также обладают своими уникальными свойствами.
Все они не имеют какого-либо специфического вкуса, запаха или цвета, однако присутствуют в атмосфере Земли в небольших количествах и важны для нашего дыхания.
Так, гелий считается одним из самых распространенных элементов в космосе, а его наличие в атмосфере Солнца, в составе других звезд Млечного Пути и некоторых метеоритов подтверждено научными данными.
Если вам нравится данная статья, приглашаю вас присоединиться к нашему каналу на Яндекс.Дзен, где вы сможете найти еще больше полезной информации из мира популярной науки и техники.
Неон, светящийся при нагревании красноватым оттенком, получается из воздуха при его глубоком охлаждении. Из-за сравнительно небольшой концентрации этого инертного газа в атмосфере планеты, неон чаще всего получают в качестве побочного продукта при добыче аргона.
Радон — радиоактивный инертный газ, который может представлять опасность для человеческого здоровья.
Газообразный радон способен светиться голубым или синим светом, постепенно облучая человека и даже приводя к онкологическим заболеваниям.
Несмотря на это, в медицине часто применяются так называемые радоновые ванны, которые позволяют добиться положительного эффекта при лечении болезней центральной нервной системы.

Радоновое озеро в селе Лопухинка Ленинградской области
И наконец, последний благородный газ, который можно найти в природе — криптон. Это один из самых редких благородных газов во Вселенной. В отличии от остальных инертных газов, этот газ при определенных условиях может испускать резкий запах, схожий с запахом хлороформа. Воздействие криптона на человека и животных крайне мало изучено из-за невероятной редкости этого газа.
Выброс парниковых газов будет сокращен при помощи спутников для поиска их источников
Где применяются благородные газы?
Самыми применяемыми человеком инертными газами считаются аргон, гелий и неон, которые используются повсеместно от физики до медицины. Так, гелий используется при сварке металлов и в качестве хладоносителя при проведении лабораторных экспериментов. Неон и аргон часто применяются при изготовлении ламп накаливания и в металлургии, при изготовлении алюминиевых сплавов.

Благодаря своим уникальным свойствам, благородные газы нашли свое применение в разных отраслях науки
Остальные благородные газы чаще всего используются в медицине. Как уже упоминалось выше, радон находит свое применение в медицине, а ксенон и криптон используются в качестве наполнителя осветительных ламп.
Благородные, или инертные газы: свойства и применение
На нашей планете благородные газы преимущественно содержатся в воздухе, но они есть в небольших количествах в воде, горных породах, природных газах и нефти.
Много гелия в космическом пространстве, это второй по распространенности элемент после водорода. В Солнце его почти 10%. Судя по имеющимся данным, благородных газов много в атмосферах крупных планет Солнечной системы.
Все газы, кроме гелия и радона, добывают из сжиженного воздуха фракционным разделением. Гелий получают как сопутствующий продукт при добыче природного газа.
Свойства
Газы без цвета, запаха и вкуса. Они всегда есть в атмосферном воздухе, но их невозможно увидеть или почувствовать. Плохо растворяются в воде. Не горят и не поддерживают горение. Плохо проводят тепло. Хорошо проводят ток и при этом светятся. Практически не реагируют с металлами, кислородом, кислотами, щелочами, органическими веществами. Химическая активность растет по мере увеличения атомной массы.
Гелий и неон вступают в реакции только при определенных, как правило, очень сложных условиях; для ксенона, криптона и радона удалось создать достаточно «мягкие» условия, при которых они реагируют, например, со фтором.
В настоящее время химики получили несколько сотен соединений ксенона, криптона, радона: оксиды, кислоты, соли. Большая часть соединений ксенона и криптона получают из их фторидов. Скажем, чтобы получить ксенонат калия, сначала растворяют фторид ксенона в воде.
К полученной кислоте добавляют гидроокись калия и тогда уже получают искомую соль ксенона. Аналогично получают ксенонаты бария и натрия.
Инертные газы не ядовиты, но способны вытеснять кислород из воздуха, понижая его концентрацию до смертельно низкого уровня.
Смеси тяжелых благородных газов с кислородом оказывают на человека наркотическое воздействие, поэтому при работе с ними следует использовать средства защиты и строго следить за составом воздуха в помещении.
Хранят газы в баллонах, вдали от источников пламени и горючих материалов, в хорошо проветриваемых помещениях. При транспортировке баллоны следует хорошо укрепить, чтобы они не бились друг о друга.
Применение
- В газовой и газово-дуговой сварке в металлургии, строительстве, автостроении, машиностроении, коммунальной сфере и пр. Для получения сверхчистых металлов.
- Нерадиоактивные благородные газы применяются в цветных газоразрядных трубках, часто используемых в уличных вывесках и рекламе, а также в лампах дневного света и лампах для загара.
Гелий
- Жидкий гелий — самая холодная жидкость на планете (кипит при +4,2 °К), востребована для исследований при сверхнизких температурах, для создания эффекта сверхпроводимости в электромагнитах, например, ядерных ускорителей, аппаратов МРТ (магнитно-резонансной томографии).
- Гелий-газ применяют в смесях для дыхания в аквалангах. Он не вызывает наркотического отравления на больших глубинах и кессонной болезни при подъеме на поверхность.
- Так как он значительно легче воздуха, им заполняют дирижабли, воздушные шары, зонды. К тому же он не горит и гораздо безопаснее ранее использовавшегося водорода.
- Гелий отличается высокой проницаемостью — на этом свойстве основаны приборы поиска течи в системах, работающих при низком или высоком давлении.
- Смесь гелия с кислородом применяется в медицине для лечения болезней органов дыхания.
Неон
- Применяется в радиолампах. Смесь неона и гелия — рабочая среда в газовых лазерах.
- Жидкий неон используется для охлаждения, он обладает в 40 раз лучшими охлаждающими свойствами, чем жидкий гелий, и в три раза лучшими, чем жидкий водород.
Аргон
- Аргон широко применяется из-за своей низкой стоимости. Его используют для создания инертной атмосферы при манипуляциях с цветными, щелочными металлами, жидкой сталью; в люминесцентных и электрических лампах. Аргоновая сварка стала новым словом в технологии резки и сварки тугоплавких металлов.
- Считается лучшим вариантом для заполнения гидрокостюмов.
- Радиоактивный изотоп аргона применяется для проверки систем вентиляции.
Криптон и ксенон
- Криптон (как и аргон) обладает очень низкой теплопроводностью, из-за чего используется для заполнения стеклопакетов.
- Криптоном заполняют криптоновые лампы, используют в лазерах.
- Ксеноном заполняют ксеноновые лампы для прожекторов и кинопроекторов. Его используют в рентгеноскопии головного мозга и кишечника.
- Соединения ксенона и криптона со фтором являются сильными окислителями.
Радон
- Применяется в научных целях; в медицине, металлургии.
Почему и какие газы называются «благородные»
Вероятно, даже те люди, которые не так часто сталкиваются с вопросами по химии, неоднократно слышали о том, что некоторые газы называются благородными. Однако почему газы назвали благородными, задумываются немногие люди. И сегодня в рамках данной статьи мы попробуем подробно разобраться данный вопрос.

Что такое «благородные» газы
К группе благородных газов относится сразу целый перечень различных химических элементов, которые можно упорядочить или объединить по своим свойствам.
Естественно, газы не имеют полностью идентичный состав, и объединяет их то, что при самых простых условиях, которые в химии называют нормальными условиями, эти газы не имеют цвета, вкуса и запаха.
Кроме того, объединяет их также и то, что они имеют чрезвычайно низкую химическую реактивность.
Список «благородных» газов
К списку известных человечеству благородных газов можно отнести всего лишь 6 наименований. Среди них присутствуют следующие химические элементы:
- Радон;
- Гелий;
- Ксенон;
- Аргон;
- Криптон;
- Неон.
Почему газы назвали «благородными»
Что же касается непосредственно происхождения названия, которое ученые присвоили описанным выше химическим элементам, то оно было дано им по причине поведения атомов элементов с другими элементами.
Как известно, химические элементы могут воздействовать друг на друга и обмениваться между собой атомами. Это условие касается и многих газов.
Однако, если говорить об элементах из списка, представленного выше, то они не вступают в реакцию с любыми другими элементами, присутствующими в известной всем нам таблице Менделеева.
Это и привело к тому, что ученые очень быстро условно отнесли газы к одной группе, назвав её в честь их «поведения» благородной.

Другие названия «благородных» газов
Важно отметить, что благородные газы также имеют и другие названия, которыми их называют ученые и которые также можно называть официальными
«Благородные» газы еще называют «Инертные» или «Редкие» газы
Что касается второго варианта, то его происхождение вполне очевидно, ведь из всей таблицы элементов Менделеева можно отметить лишь 6 атомов, которые относятся к списку благородных газов. Если же говорить о происхождении названия «Инертные», то здесь можно воспользоваться синонимами данного слова, среди которых присутствуют такие понятия, как «бездеятельный» или же «безынициативный».
Таким образом, все три наименования, используемых для таких газов, являются актуальными и рационально подобранными.
Почему благородные газы называют благородными?
Почему благородные газы называют благородными? Способность избегать реакции на провокации — задирать нос и игнорировать меньшие человеческие слабости — в значительной степени считается благородной чертой человека.
То, что равносильно постоянному преследованию людей, естественно приходит к благородным газам. Благородные газы, чаще всего одноатомные, полностью заполнили внешние электронные оболочки, поэтому не имеют склонности вступать в реакцию с другими элементами, поэтому очень редко образуют соединения с другими элементами.
Однако, точно так же, как дворянин может потерять свое достоинство, можно заставить среагировать благородный газ.
При достаточно большом запасе энергии внешние электроны благородного газа могут быть ионизированы, а когда газ ионизируется, он может принимать электроны от других элементов. Даже в этих условиях благородные газы не образуют многих соединений.
Известно, что существует всего несколько сотен. Примеры включают гексафторид ксенона (XeF 6 ) и фторгидрид аргона (HArF).
Fun Fact
Термин «благородный газ» происходит от перевода немецкого слова Edelgas . Благородные газы получили свое собственное название еще с 1898 года.
Подробнее об элементах благородных газов
Благородные газы составляют последний столбец элементов в периодической таблице. Их обычно называют Группой 18, инертными газами, инертными газами, семейством гелия или семейством неона. Группа состоит из 7 элементов: гелия, неона, аргона, криптона, ксенона и радона. Эти элементы представляют собой газы при обычной комнатной температуре и давлении. Благородные газы характеризуются:
- низкой реакционной способностью
- низкой температурой кипения
- близкие друг к другу точки плавления и кипения (жидкость в узком диапазоне).
- очень низкая электроотрицательность
- высокая энергия ионизации
- обычно без цвета и запаха
- газы в обычных условиях
Отсутствие реакционной способности делает эти элементы полезными для многих приложений . Их можно использовать для защиты реактивных химикатов от кислорода. Они ионизированы для использования в лампах и лазерах.
Сравнимый набор элементов — это благородные металлы, которые обладают низкой реакционной способностью (для металлов).
Вам также может понравиться
Почему некоторые газы называют благородными
Всем привет. Наверняка многие из вас, даже не имея отношения к химии, хоть раз да слышали такой термин как «благородные газы». Давайте выясним, почему они так называются и что в этих газах такого благородного.
К этим газам относят гелий, неон, аргон, криптон, ксенон, радон. Ну и Оганесон (его открыли совсем недавно, и свойства почти не изучили). Если мы посмотрим на таблицу Менделеева, то совсем не сложно заметить, что все эти газы расположены по правому краю периодической таблицы.
Дмитрий Иванович построил свою таблицу по количеству электронов на внешней энергетической орбитали. В каждом периоде атомы заполняют орбиталь, начиная от самого левого, и заканчивая самым правым. А это значит, что каждый последний элемент в периоде будет иметь полностью завершённую энергетическую орбиталь. Как раз такими элементами и являются благородные газы.
Если вы читали мой пост «почему атомы взаимодействуют между собой», то знаете, что именно незавершённая орбиталь заставляет атом искать совершенства и взаимодействовать с другими. А благородные газы и так совершенны. Они настолько крутые, что не взаимодействуют ни с кем, даже сами с собой.
Долгое время считалось, что благородные газы вообще не способны к химическим реакциям, но особо рьяные химики создали экстремальные условия, для того, чтобы заставить их хоть как-то проявлять свою активность, а ксенон так и вообще способен вступать в реакции даже при нормальных условиях.
Итак, благородными газами называют такие газы, которые практически никогда не вступают в хим. реакции благодаря полностью завершённой энергетической орбитали.
Благородные газы ещё называют инертными. В значении неизменный. Вспомним, что, например, в физике инерция – это явление сохранения скорости.
Первый по порядку благородный газ – гелий, он занимает второе место по распространённости во вселенной. Но из-за своей летучести он улетел с нашей планеты ещё на ранних стадиях её развития и потому сейчас довольно редкий. А было бы его побольше, может, и история авиации двигалась бы совсем по другому пути.
Дело в том, что дирижабли на заре своего строения заполнялись крайне взрывоопасным водородом и горели как… как баллоны с водородом. Гелий так же является газом легче воздуха, но не проявляет никакой химической активности. Говоря проще, он не горит и является идеальным наполнителем для дирижаблей.
Быть может, когда гелий научатся добывать в больших количествах, наша авиация вновь пересмотрит своё отношение к этим воздушным левиафанам.
Разница между инертными газами и благородными газами
Основное отличие — инертные газы от благородных газов
Вещества могут существовать в трех основных физических состояниях, известных как твердое состояние, жидкое состояние и газообразное состояние. Газообразное состояние включает газы, которые являются либо элементами, либо соединениями.
Однако газы состоят из крошечных частиц, которые имеют незначительные массы.Силы притяжения, которые существуют между этими газообразными частицами, очень меньше. Поэтому эти частицы всегда находятся в движении из-за столкновений, которые происходят между частицами.
Газы встречаются в виде реактивных газов и инертных газов. Благородные газы являются разновидностью инертного газа.
Основное различие между инертными газами и благородными газами заключается в том, что инертные газы не подвергаются химическим реакциям, тогда как благородные газы могут вступать в химические реакции при определенных условиях.
1. Что такое инертные газы — определение, свойства, примеры 2. Что такое благородные газы — определение, свойства, примеры 3.
Какова связь между инертными газами и благородными газами — Инертные газы и благородные газы 4.
В чем разница между инертными газами и благородными газами — Сравнение основных различий
Ключевые термины: инертный газ, благородный газ, водород, гелий, неон, ксенон, азот
Что такое инертные газы
Инертные газы — это соединения, которые не подвергаются химическим реакциям. Это нереакционноспособные газы. Инертные газы могут быть элементарными или могут существовать в виде соединений. Аргон является хорошим примером для элементарного инертного газа. Азот считается инертным газом в большинстве случаев. Это соединение, состоящее из двух атомов азота.
Нереактивное поведение инертных газов возникает из-за заполненных валентных оболочек. Другими словами, внешние электронные оболочки атомов этих газов полностью заполнены.
Таким образом, нет необходимости дополнительно реагировать с другими химическими веществами, поскольку все другие атомы реагируют с другими химическими веществами, чтобы стать стабильными, заполняя все электронные оболочки или удаляя электроны в самой внешней оболочке, чтобы получить полную валентную оболочку.
Рисунок 01: Атомная структура неона
Неон — это инертный газ. Он состоит из атомов неона. Неон не может подвергаться химическим реакциям, потому что его внешняя оболочка полностью заполнена электронами.
Инертные газы полезны в ситуациях, когда следует избегать химических реакций. Например, использование инертных газов в пищевых продуктах безопасно, поскольку предотвращает рост бактерий. Инертные газы также используются для защиты вольфрама при сварке, чтобы избежать загрязнения.
Благородные газы являются химическими элементами в группе 18 периодической таблицы. Следовательно, существует 6 благородных газов. Это He (гелий), Ne (неон), Ar (аргон), Kr (криптон), Xe (ксенон) и Rn (радон).
Они показывают отсутствие или очень низкую реакционную способность среди других химических элементов. Это потому, что атомы этих элементов имеют полностью заполненные валентные оболочки. Гелий имеет только одну орбиту. Таким образом, на этой орбите находится максимум 2 электрона.
Другие элементы имеют s и p-оболочки, которые полностью заполнены 8 электронами.
Эти элементы крайне нереактивны. Но в экстремальных условиях их можно превратить в соединения. Все эти газы являются одноатомными газами при нормальных условиях.
Даже в экстремальных условиях гелий и неон не участвуют в химическом связывании. Но аргон, криптон, ксенон слабо реактивны и могут принимать участие в соединениях, образующих химические связи.
Радон обнаружен как радиоактивный элемент.
Примеры соединений, образованных из ксенона:
Гексафторид ксенона (XeF6)
Ксенон тетрафторид (XeF4)
Дифторид ксенона (XeF2)
Криптон также может образовывать фториды, такие как ксенон. Кроме того, криптон может быть химически связан с другими неметаллами, такими как водород, углерод и с переходными металлами, такими как медь.
Связь между инертными газами и благородными газами
Все благородные газы считаются инертными газами при стандартных условиях температуры и давления. Но все инертные газы не являются благородными газами.
Определение
Инертные газы: Инертные газы — это соединения, которые не подвергаются химическим реакциям.
Благородные газы: Благородные газы являются химическими элементами в группе 18 периодической таблицы.
Частицы газа
Инертные газы: Инертные газы могут состоять из атомов или молекул.
Благородные газы: Благородные газы состоят только из атомов. Там нет молекул.
Химическая реактивность
Инертные газы: Инертные газы химически не вступают в реакцию.
Благородные газы: Благородные газы обычно не реагируют, но могут быть реактивными в экстремальных условиях.
элементы
Инертные газы: Инертные газы включают все благородные газы и некоторые другие инертные газообразные соединения.
Благородные газы: Благородные газы являются элементами группы 18 периодической таблицы.
Заключение
Как инертные газы, так и благородные газы в обычных условиях не вступают в реакцию. Но благородные газы могут создавать химические связи при определенных условиях.
Для этого требуются экстремальные условия, поскольку эти атомы или соединения состоят из самых внешних оболочек, которые полностью заполнены электронами.
Однако все благородные газы являются инертными газами, но все инертные газы не являются благородными газами. В этом разница между инертными газами и благородными газами.
Рекомендации:
1. «Инертный газ». Википедия. Фонд Викимедиа, 20 июля 2017 года. Интернет.
Почему гелий меняет наш голос, а также что такое инертные газы
На уроках химии мы слышали об инертных газах.
Их еще называют благородными, такое красивое название было дано не с проста, ведь все инертные газы, а именно гелий, неон, аргон, криптон, ксенон, а также радиоактивные радон и оганесон обладают очень низкой химической активностью, их соединения с другими веществами существуют лишь в специальных, экстремальных условиях, а значит, эти газы не горят и не поддерживают горение, более того, не имея цвета, запаха и вкуса они не токсичны для человека, их вообще как будто нет, настоящее благородство!)
Но это не совсем так, инертные газы хоть и не отравляют человека, но наркотически действуют на него, однако это не относится к гелию и неону, поскольку их наркотический эффект проявляется при очень повышенном давлении, впрочем, поэтому наркоманы и не дышат шариками с гелием.
Все благородные газы одноатомны. То есть в одной молекуле газа содержится один атом. Причем химические оболочки атомов полностью заполнены электронами.
Что это значит? Вспомните уроки химии — на каждой оболочке атома может быть лишь определенное число электронов: на первой 2, на второй 8 и так далее.
Полная заполненность оболочек у благородных газов и объясняет то, что они почти не вступают в химические реакции, потому что просто не способны присоединить к себе больше электронов.
Интересным фактом является то, что инертные газы переходят в жидкое состояние при экстремально низких температурах, при этом почти сразу после переходя в твердое состояние. Таким образом разница между температурой кипения и плавления у веществ состовляющих инертные газы 2-5, максимум 10 градусов.
Гелий и его свойства:
Правда вот гелий при обычном давлении в твердое состояние так и не переходит. Он кипит при температуре -270 градусов, то есть температуре космического пространства, ниже которой ничего нет, поэтому кристаллизация гелия проходит под давлением в 25 раз больше атмосферного!
Вообще гелий удивителен. Во Вселенной он второй по распространенности после водорода, но на Земле существует в совсем малых количествах, однако не беспокойтесь, на надувание шариков всем хватит).
Из за практически самого малого размера атомов гелия, они почти не сталкиваются друг с другом, когда гелий находится в газообразном состоянии, что делает гелий идеальным газом (идеальный газ это такая теоретическая модель, можете посмотреть о ней в Википедии подробнее).
Еще одна занимательная вещь, что гелий, как и все инертные газы светится при пропускании через него электрического тока. Причем при изменении давления внутри газа, можно менять его цвет.
Это связанно с тем, что с увеличением давления, электроны начинают чаще сталкиваться с атомами гелия и общая энергия вещества увеличивается, приводя к изменению цвета.
Так гелий может светиться желтым, розовым, оранжевым и зеленым цветами.
Почему гелий изменяет голос?
Но мы то все знаем гелий как веселый газ, смешно изменяющий наш голос. Почему так происходит? Тут нужно разобраться, что вообще такое звук, издаваемый нами при выдохе.
Благородные металлы: почему они так называются и сколько их
Признаки благородства и классификация элементов
Понять, какие металлы называются благородными, а какие считаются базовыми или, иначе говоря, неблагородными, весьма просто. Этот статус определяется свойствами, которыми они обладают.
Вещества, которые относятся к благородным металлам, не окисляются и не подвергаются коррозийному воздействию.
Эти характерные особенности разительно отличают их от других элементов — все прочие металлы не могут похвастаться такой стойкостью, поэтому считаются неблагородными.
Все без исключений представители благородной категории также обладают статусом драгоценных. Принадлежность к последним обусловлена редкостью этих веществ. В список благородных металлов входят восемь элементов:
- золото;
- серебро;
- платина;
- иридий;
- осмий;
- палладий;
- родий;
- рутений.
Вещества из первой тройки считаются основными металлами благородной группы. Пять остальных относятся к так называемым дочерним элементам платины. Платиновых представителей зачастую делят на две группы:
- легкие металлы;
- тяжелые металлы.
К первым относятся палладий, родий и рутений. К последним — иридий, осмий и сама платина.
Некоторые ученые причисляют к благородным еще девятого представителя — химический элемент технеций. Но подобную точку зрения большинство специалистов не поддерживает — этот крайне редко встречающийся в природе металл обладает изрядной радиоактивностью, поэтому официально называть его в числе благородных не принято.
Основные характеристики и особенности
- мягкость;
- высокая пластичность;
- невероятная прочность;
- отличная теплопроводимость;
- высокая тугоплавкость (за исключением серебра и золота);
- хорошая тягучесть;
- прекрасная электропроводимость.
Также среди характеристик веществ благородной категории стоит особо отметить красивый внешний вид. Благодаря высочайшей химической стойкости изделия, выполненные их таких материалов, сохраняют свой привлекательный блестящий облик в течение очень долгого времени.
Для сравнения в качестве наиболее яркого противоположного примера можно привести медь. Первоначальный облик изделий из этого неблагородного металла практически не уступает драгоценностям по яркому блеску и красоте.
Но привлекательный внешний вид пропадает очень быстро — при контакте с воздухом элемент вступает в реакцию и начинается процесс окисления.
В результате на поверхности металла образуется своеобразная пленка или, иначе говоря, налет, из-за чего изделие становится тусклым и меняет свой изначальный оттенок.
Представители драгметаллов благородной группы составляют единую категорию элементов. Но, разумеется, каждый из них имеет и собственные индивидуальные особенности.
Золото (aurum)
На вещество не способны воздействовать даже такие общеизвестные разрушители, как:
- щелочи;
- соли;
- кислоты;
- высокие температуры;
- влага.
Плотность золота составляет 19,3 г/см3. Это вещество — одно из самых плотных и тяжелых среди металлов. Температура плавления металла превышает тысячу градусов Цельсия.
Серебро (argentum)
Существует две разновидности кислот, с которыми серебро вступает в реакцию:
Устойчив против влияния влаги. Но темнеет под воздействием содержащегося в воздухе сероводорода.
Платина (platinum) и «дочерние» представители
Достойная соперница золота за звание самого тяжелого металла. Плотность платины составляет 21,5 г/см3. Это бело-серебристое блестящее вещество плавится при температуре 1773 градуса Цельсия.
Представители платиновой группы и их индивидуальные свойства:
- Палладий (palladium). В отличие от других благородных представителей при определенных условиях это вещество серебристого цвета все же окисляется. Эти условия заключаются в нагревании в температурном диапазоне 300−860 градусов. Впрочем, если превысить верхний порог, образовавшийся оксидный налет исчезнет, а сам металл еще более посветлеет. Плотность вещества равна 12 г/см3. А плавится палладий при температуре 1554 градуса Цельсия.
- Родий (rhodium). Вещество голубоватого окраса почти наравне с серебром обладает хорошей отражательной способностью. Твердый, но достаточно хрупкий металл. Его плотность составляет 12,4 г/см3. Температура, необходимая для плавления родия, равняется 1962 градусам Цельсия.
- Рутений (ruthenium). Внешне почти идентичен с платиной, но по своим свойствам и характеристикам близок к родию. В частности, это касается плотности. По температуре плавления среди всех металлов благородной группы уступает только осмию и иридию. У рутения она составляет 2330 градусов Цельсия.
- Иридий (iridium). Серо-белое вещество по своим свойствам идентично рутению и родию. Но по плотности обходит даже платину — у иридия этот параметр составляет 22,4 г/см3. По температуре плавления этот металл входит в тройку лидеров среди элементов благородной группы (вместе в рутением и осмием). Иридий плавится при 2466 градусах Цельсия. Это вещество — самый стойкий металл. На него не оказывают воздействие ни кислоты, ни соли, ни какие-либо химические элементы.
- Осмий (osmium). Белое вещество совершенно невозможно растворить в кислоте. Это абсолютный чемпион среди благородных веществ как по тяжести и плотности, так и по температуре плавления. Последняя у осмия достигает 3035 градусов Цельсия, а плотность составляет 22,5 г/см3.
История открытий
Золотые и серебряные самородки были обнаружены человечеством несколько тысяч лет назад, то есть до наступления нашей эры. Разработки их природных месторождений успешно велись на территории почти всего земного шара еще во времена древности.
Несколько примитивные приспособления и методы добычи не мешали древним людям достигать поставленных целей и проникать в недра земли. Полученные золото и серебро переплавлялись и обрабатывались.
Их использовали для производства самых разных предметов.
Об этом свидетельствуют исторические сведения и разнообразные изделия из этих металлов, обнаруженные при археологических раскопках древних захоронений.
Платиновое «серебришко»
До находки испанцев платина, разумеется, существовала и даже была известна людям. Ее называли белым золотом и использовали для изготовления фальшивых золотых монет и драгоценностей. В результате подобных махинаций, прокатившихся по всему миру, этот металл был официально объявлен запрещенным, в результате чего его начали топить в морской пучине.
В XVI веке испанцы заново открыли драгметалл и реабилитировали его. Но, несмотря на это, первое описание платины с научной точки зрения было сделано только в XVIII веке английским ученым Уильямом Уотсоном.
Остальные представители группы
Оставшиеся представители, элементы платиновой группы, были открыты один за другим в XIX веке. Они прекрасно символизируют эпоху научных исследований и открытий.
Родий и палладий были получены в ходе химических опытов англичанином Уильямом Хайдом Уолластоном в 1803 году. Ровно через год таким же образом были открыты осмий и иридий, но уже другим английским химиком — Смитсоном Теннантом.
История открытия рутения более длинная, чем у его «родственников». Впервые он был извлечен из платиновой руды в 1808 году видным польским научным мужем Анджеем Снядецким. Полученному новому химическому элементу ученый дал название вестий.
Под таким именем металл просуществовал до 1844 года, когда профессор университета Казани, русский ученый Карл Клаус начал масштабное изучение этого элемента. По окончании всестороннего исследования Клаус переименовал вещество в рутений — в честь великой Руси.
Нахождение в природе и получение
Каждый из благородных элементов встречается в природе в двух формах — самородковой и примеси в рудах. Но стоит отметить, что в отличие от золота и серебра, платины в виде чистого вещества не существует в природе. А серебряные самородки попадаются очень редко.
Месторождений руд благородных металлов в мире осталось не так много, как хотелось бы. По этой причине их разработки ведутся под строжайшим контролем предприятий, которым принадлежат соответствующие разрешения на добычу драгоценных металлов в конкретных месторождениях.
Кроме того, благородные элементы зачастую выделяются при разработке руд неблагородных металлов. Способы, которыми могут добываться благородные металлы из руды, активно совершенствуются и обретают все больше вариаций.
Сферы и области использования
Уникальные неповторимые качества этих веществ обусловили их применение в самых разнообразных отраслях и сферах. Этому не помешала даже высокая стоимость таких материалов.
Разумеется, первое, с чем ассоциируется драгоценное сырье — это ювелирные изделия. Украшения и другие предметы, выполненные из таких металлов, пользуются огромным спросом, что вполне объяснимо. Это не только красиво, но и выгодно. Драгоценности всегда были отличным вложением денежных средств.
Не менее известно и использование благородных материалов в качестве валюты. Впрочем, в современном мире монеты из таких металлов — это объект инвестирования или коллекционирования. В области инвестиций драгметаллы неизменно пользуются популярностью и востребованностью. Особенно это касается золота.
Кроме того, эти элементы широко применяются (для изготовления изделий полностью, отдельных деталей и так далее):
- в производстве различной техники и электроники, включая микротехнологии;
- в авиации и космонавтике;
- в машиностроении (от различных агрегатов до автомобилей);
- в производстве радиоаппаратуры;
- в химической отрасли, включая лабораторную сферу (от посуды до техники);
- в медицине;
- в производстве различных защитных покрытий для абсолютно любых поверхностей (от ракет и аппаратуры до зеркал, труб, керамики, металлов и дерева);
- в кино- и фотопромышленности;
- в производстве часов и часовых механизмов.
Причем в медицине благородные металлы используются не только для изготовления инструментов и медтехники, но также и в производстве лекарственных препаратов. И это далеко не все — перечислить все области и сферы применения драгоценных материалов невозможно.
Вещества, относящиеся к благородным, играют крайне значительную роль. Они встречаются каждый день в какой-либо форме и используются практически во всех отраслях. Какой станет жизнь человечества и мир вокруг, когда природные запасы этих металлов иссякнут, можно только гадать.






