- Реакция металлов с соляной кислотой: признак взаимодействия цинка, железа и меди
- Какие вещества вступают в реакцию с соляной кислотой
- Признак взаимодействия с цинком, железом и другими металлами
- Как составить уравнение реакции
- Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
- Техника безопасности
- Получение
- Это любопытно
- Применение
- Хлороводородная кислота: какие свойства имеет, как выглядит
- Физические свойства
- Химические свойства хлороводородной кислоты
- Применение кислоты
- ПОИСК
- Соляная кислота. Формула. Характеристики. Применение
- Соляная кислота. Свойства, особенности использования, меры предосторожности
- С чем реагирует соляная кислота
- Как взаимодействует соляная кислота с железом
- Как взаимодействует соляная кислота с магнием
- Перманганат калия плюс соляная кислота. Результат взаимодействия
- С какими веществами соляная кислота не реагирует
- Вопросы безопасности при эксплуатации реактива
- Применение соляной кислоты
- Отрасли промышленности, где используется соляная кислота
- Соляная кислота. Применение в быту
Архив уроков › Химия 8 класс
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа.
В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок.
Это свидетельствует о наличии в пробирке водорода.
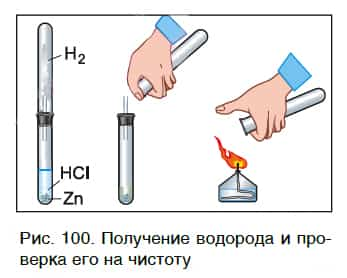
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
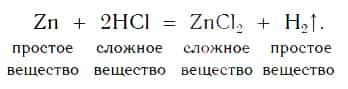
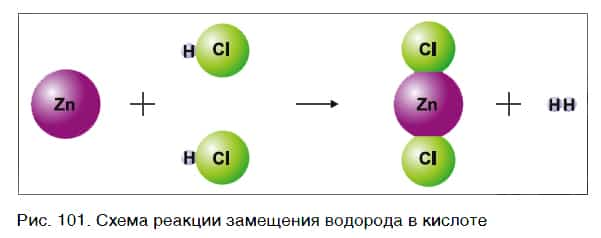
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
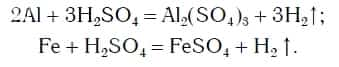
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
![]()
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей.
Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий.
Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Реакция металлов с соляной кислотой: признак взаимодействия цинка, железа и меди
Известно доказанный факт, что соляная кислота взаимодействует с активными металлами. При этом часть веществ способна реагировать на такое соединение, другая часть остается нетронутой.
Неактивные металлы не могут реагировать на вещество: к ним относят золото, серебро, ртуть.
Соляная кислота представляет собой соединение хлора и водорода. Путем растворения в воде газообразного вещества под названием хлороводород получается данное соединение.
Ионы водорода при таком уравнении исполняют роль окислителя, что вызывает реакцию у активных металлов.
Какие вещества вступают в реакцию с соляной кислотой
- На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
- Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
- Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
- Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.
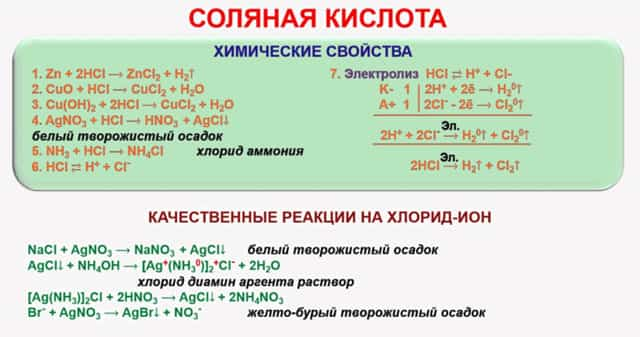
В реакцию с соляной кислотой вступают такие вещества:
- Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
К ним относят гидроксид натрия, бария, алюминия. Реакция нейтрализации дает образования соли и воды.
- Металлы. Если обратиться к электрохимическому ряду, можно увидеть, что соляная кислота реагирует со всеми элементами, стоящими до водорода в этом ряду.
Сюда относят натрий, магний, алюминий, литий, барий, кальций, цинк, железо и другие элементы. При взаимодействии они образуют хлориды и выделяют газообразный водород.
- Основные и атмосферные оксиды. Во время реакции происходит образование растворимых солей и воды. HCl взаимодействует с оксидом алюминия, меди, цинка, натрия.
- Карбонаты. При взаимодействии с карбонатами кальция получится следующее уравнение: CaCO₃ + 2HCl→ CaCl₂ + CO₂↑ + H₂O.
Из него следует, что выделяется углекислый газ, а также образуется вода и угольная кислота.
- Сильные окислители. Если вещество взаимодействует с перманганатом калия или диоксидом марганца, на выходе получается выделение газообразного хлора.
- Аммиак. Такое взаимодействие ознаменовано выделением сильного дыма, поэтому в момент проведения опытов рекомендуется открыть все окна. Тогда выделяется хлорид аммония.
Кроме перечисленных веществ и соединений, HCl также способна реагировать на нитрат серебра – при таком взаимодействии образуется осадок белого цвета творожистого типа.
Признак взаимодействия с цинком, железом и другими металлами
- Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
- Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
- Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением.
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.

Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. В результате возникает хлорид цинка ZnCl₂ |
| Железо | Во время такого взаимодействия образуется хлористое железо. Реакция происходит медленно, однако, если пробирку подогреть, то процесс пойдет быстрее |
| Литий | При реакции образуется хлорид лития 2LiCl, выделяется водород. На поверхности этого металла, относящегося к щелочной группе, можно увидеть маленькие пузыри |
| Кремний | В результате такого соединения возникает сложный компонент под названием хлорсилан. Также выделяется газообразный водород. Такая реакция происходит при условии нагревания до 350 градусов, а в качестве катализатора выступает медь |
| Магний | При таком взаимодействии наблюдает выделение теплоты, металл начинает плавиться |
Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.

Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества.
Важно! Необходимо правильно определить коэффициенты атомов в уравнении – их количество до знака = должно быть таким же, как и после знака =.
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
- Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман. Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности
Вещество очень едкое, разъедает кожу, органические материалы, металлы и их окислы. На воздухе выделяет пары хлороводорода, которые вызывают удушье, ожоги кожи, слизистой глаз и носа, повреждают органы дыхания, разрушают зубы. Соляная кислота относится к веществам 2 степени опасности (высокоопасным), ПДК реактива в воздухе составляет 0,005 мг/л. Работать с хлористым водородом можно только в фильтрующих противогазах и защитной одежде, включая резиновые перчатки, фартук, спецобувь.При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.— Обрабатывают кожу перед дублением.— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Хлороводородная кислота: какие свойства имеет, как выглядит
Хлороводородная кислота: какие свойства имеет, как выглядит добавить в закладки
Соляная или хлороводородная кислота — раствор хлороводорода (HCl) в воде. Сильная одноосновная летучая кислота. Типичный представитель минеральных (неорганических) кислот, присутствует во многих химических реакциях как реагент или катализатор, например в реакциях этерификации — образовании сложного эфира из карбоновой кислоты и спирта.
Секретируется в желудке человека и других млекопитающих. Давайте узнаем, как выглядит соляная кислота, с чем реагирует и где применяется.
Физические свойства
Хлороводородная кислота — это прозрачная жидкость без цвета с характерным едким запахом. Образуется при пропускании хлороводорода через воду. В реакциях также участвует в жидком состоянии. Хорошо растворяется в воде, т. е. смешивается с ней.
Соляная кислота, полученная промышленным путем, имеет слегка желтую окраску из-за примесей элементов. Концентрированная кислота, как и хлороводород, “дымит” во влажном воздухе.
Молекулярная кристаллическая решетка, в узлах которой находятся молекулы HCl, в молекуле — ковалентная полярная связь.
Химические свойства хлороводородной кислоты
Являясь одноосновной кислотой, т. е. в составе имеет один атом водорода, она диссоциирует в одну ступень:
HCl = H+ + Cl-
Раствор имеет кислотную среду, pH раствора 1-2 в зависимости от концентрации ионов. Окрашивает лакмус в красный цвет, метилоранж — в розовый. Поэтому хлороводородная кислота проявляет кислотные свойства и вступает в реакцию с основными соединениями. Из-за присутствия хлора является довольно сильным окислителем. В данном случает Cl имеет валентность 1, степень окисления -1.
- Взаимодействие с активными металлами (стоят в ряду напряжения до водорода). Образуется соль кислоты и выделяется молекулярный водород:
- 2K + 2HCl → 2KCl + H2 Соли хлороводородной кислоты называются хлоридами.
- С оксидами всех металлов с образованием соли и выделением воды:
- С гидроксидами (основаниями) всех металлов:
- Ca(OH)2 + 2HCl → CaCl2 + H2O Это реакция нейтрализации. В продуктах — хлорид и вода. Не образует кислых или основных солей, поскольку одноосновная.
- Вытеснение более слабых летучих кислот из солей металлов:
- Na2CO3 + 2 HCl → H2O + CO2 + 2 NaCl Обычно, в ходе таких реакций выделяется газ, т. к. большинство слабых кислот очень летучи, или выпадает осадок, например в случае с кремниевой кислотой H2SiO3, которая не растворяется в воде.

- Na2CO3 + 2 HCl → H2O + CO2 + 2 NaCl Обычно, в ходе таких реакций выделяется газ, т. к. большинство слабых кислот очень летучи, или выпадает осадок, например в случае с кремниевой кислотой H2SiO3, которая не растворяется в воде.
- Взаимодействие с сильными окислителями (хроматы, дихроматы, KMnO4):
- 2 KMnO4 + 16 HCl → 8 H2O + 5 Cl2 + 2 KCl + 2 MnCl2 Это окислительно-восстановительная реакция. Единственный случай, когда хлористоводородная кислота является восстановителем, а не окислителем.
- Специфическая реакция с аммиаком:
- NH3 + HCl → NH4 Cl По природе это реакция нейтрализации, где соляная кислота — окислитель, а аммиак выступает в роли гидроксида (имеет основных характер). Образующаяся в данной реакции соль выделяется в виде густого белого пара с мелкими кристаллами хлорида аммония.
Качественная реакция на хлорид-ион: реакция с растворимыми солями серебра (ацетатом или нитратом): AgNO3 + HCl → HNO3 + AgCl. Выпадает белый творожистый осадок AgCl, нерастворимый во всех кислотах, кроме серной, а также в избытке аммиака.
Применение кислоты
Поскольку хлороводородная кислота — едкое ядовитое вещество, оборот ее не должен превышать 15%, а при проведении опытов необходимо использовать перчатки и вентиляцию. Находит применение в нескольких отраслях:
- В металлургии используется для очистки и дезинфекции поверхности металлов при пайке и для получения хлоридов цинка, железа и др. металлов;
- Регулятор кислотности Е507;
- В медицине применяется для нормализации работы желудка при диспепсии. Выпускается в таблетках в смеси с пепсином (протеолитический фермент), активирует его действие при растворении лекарства. Такой раствор имеет pH 3-5.
ПОИСК
Опыт 2. Соляная кислота взаимодействует с активными металлами. В пробирки полол ить в одну кусочек цинка, в другую магния, в третью ж елезный гвоздик и налить разбавленной соляной кислоты (1 1).
Отметить выделение водорода и написать уравнения соответствующих реакций. [c.152]
Пользуясь рядом стандартных электродных потенциалов, определите, с какими из перечисленных в скобках металлов (Zn, F , Al, Си.
Со, Pi, d ) будет взаимодействовать соляная кислота. [c.171]
Почему соляная кислота взаимодействует с цинком и многими другими металлами (как ), а безводный сжиженный хлористый водород не вступает с ними в реакции [c.67]
Взаимодействие с разбавленной серной кислотой. Взаимодействие металлов с разбавленной серной кислотой осуществляется так же, как и с соляной кислотой [c.331]
Эквивалент металла равен 8,99. Какой объем водорода (при —3°С и 106,6 кПа) получится при взаимодействии 0,4495 г металла с соляной кислотой [c.14]
При взаимодействии 2,25 г некоторого металла, принадлежащего к элементам второй группы Периодической системы, с соляной кислотой выделяется 5,6 л (при н у.) водорода. Какой это металл [c.15]
Укажите, какие хлориды цинка, меди, железа и алюминия могут быть получены при непосредственном взаимодействии простых вешеств, и какие — при действии хлороводорода (или соляной кислоты) на металл. [c.146]
Решение. Из двух металлов с раствором соляной кислоты взаимодействует только магний [c.24]
Важной особенностью таких растворов является то, что химические свойства электролита в них как бы складываются из свойств соответствующих ионов в таких растворах. Логически это понятно, так как если недиссоциированных молекул в растворе практически нет, то и на свойства раствора они не влияют.
Это приводит, например, к появлению у электролитов групповых химических свойств, присущих всем электролитам, содержащим ион данного вида. Так, все хлориды и соляная кислота содержат ион хлора, и поэтому им свойственна реакция-образования осадка А С1 при взаимодействии с AgNOз. Подобные групповые реакции широко используются в аналитической химии.
Напрнмер, действием иона водорода обусловлены все кислотные свойства способность изменять цвет лакмуса или метилоранжа в красный цвет или соответственно изменять окраску других индикаторов, растворять некоторые металлы с выделенцем водорода и образованием соли, нейтрализовать основания и т. д.
Можно убедиться, что во всех указанных процессах кислота действует не своим анионом и не недиссоциированной молекулой, а именно водородным ионом. Чем больше концентрация водородных ионов, тем более резко проявляются все кислотные свойства раствора. Подобным же образом все свойства, общие для оснований, осуществляются действием гидроксильных ионов.
Чем выше концентрация гидроксильных ионов, тем сильнее все основные свойства раствора. К групповым свойствам принадлежит также окраска раствора, вызываемая присутствием какого-нибудь иона (синий цвет гидратированных ионов Си +, зеленый — N 2- ). [c.397]
Важнейшее химическое свойство оснований — способность образовывать соли с кислотами. Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди [c.41]
Как известно, взаимодействие металлов с серной кислотой происходит различно в зависимости от концентрации кислоты и природы металла.
Разбавленная серная кислота действует на металлы подобно разбавленной соляной кислоте растворяет металлы, стоящие в ряду напряжений до олова включительно. Приэтом водородные ионы разведенной НзЗО. окисляют атомы металла, отдающие электроны.
Так, например, окисление атомов двухналентного металла (Ме) может быть представлено схемой [c.95]
Слейте соляную кислоту с металла, снова промойте его водой и прилейте 5—10 капель концентрированной азотной кислоты.
Осторожно нагрейте пробирку на маленьком пламени горелки и отметьте взаимодействие алюминия с азотной кислотой при нагревании.
Какой газ выделяется Напишите уравнение реакции взаимодействия алюминия с концентрированной азотной кислотой при нагревании. [c.174]
В конце IX в. арабский алхимик Гебер открыл способность смеси азотной и соляной кислот взаимодействовать с золотом. Смесь получила название царской водки за уникальную способность, не свойственную водкам , т. е. кислотам, растворять золото — царя всех металлов.
Природа этого растворения имеет комплексный характер. Известно, что золото очень устойчиво к окислителям. Но эта устойчивость ослабляется в присутствии лигандов вследствие комплексообразования. В царской водке такими лигандами являются хлорид-ионы [c.
20]
В воде FeS нерастворим поэтому, накапливаясь на поверхности металла, сернистое железо играет до некоторой степени роль защитной пленки, предотвращающей дальнейшую коррозию. При взаимодействии FeS с соляной кислотой пленка превращается в хлорное железо, легко растворимое в воде. Наличие соляной кислоты способствует обнажению чистого металла, и его коррозия возрастает. Поэтому содержание солей в нефтях, выделяющих при переработке H2S, особенно опасно. Следовательно, сернистые нефти необходимо предварительно полностью обессоливать. Хлориды способствуют увеличению образования сероводорода при перегонке примерно в 2—3 раза. Сероводород (HgS) крайне ядовитый газ, вызывающий отравление обслуживающего персонала и загрязнение атмосферного воздуха. [c.10]
Рассматриваемые металлы расположены в ряду напряжений до водорода. Галлий и индий растворяются в разбавленных кислотах. В соответствии с устойчивой степенью окисления Т1 при взаимодействии с кислотами образует производные Т1 (I). Галлий в соляной кислоте пассивируется за счет образования нерастворимого в воде Т1С1. [c.463]
Взаимодействие марганца с кислотами. Небольшие кусочки металла, полученного в предыдущем опыте (королек разбейте в стальной ступке), поместите в три пробирки.
В одну пробирку добавьте 1—2 мл разбавленной соляной кислоты, во вторую — разбавленной серной, в третью — раствора щелочи. Наблюдайте растворение марганца в кислотах и отсутствие растворения в щелочи.
Изучите взаимодействие марганца с разбавленной и концентрированной азотной кислотой. Запишите наблюдения и уравнения реакций. [c.120]
Хлористоводородные растворы представляют все свойства виергической кислоты. Они не только превращают синие растительные цвета в красные, вытесняют из углекислых солей углекислый газ и т. п., но и насыщают вполне основания, даже такие энергические, как, напр., кали, известь и т. п.
В сухом состоянии газа, хлористый водород, однако, не изменяет растительных цветов и не производит многих двойных разложений, какие легко совершаются в присутствии воды. Это объясняется тем, что упруго-газообразное состояние хлористого водорода препятствует ему вступать во взаимодействие.
Однако, накаленное железо, цинк, натрий и т. п. действуют на газообразный хлористый водород, вытесняя водород, и именно, оставляя половину объема водорода против одного объема взятого хлористого водорода, что может служить и для определения состава хлористого водорода.
Хлористый водород с водою действует, как кислота, во многом очень сходная с азотною кислотою, но последняя, содержа легко выделяемый кислород, очень часто действует, как окислитель, способности к чему вовсе нет у соляной кислоты. Большинство металлов (даже не вытесняющих Н из H SO , а разлагающих ее до SO , напр.
, медь) вытесняет водород из хлористого водорода. Так, при действии на цинк, даже на медь и. олово, выделяется водород [297]. Немногие только металлы сопротивляются его действию, напр., золото, платина.
Свинец оттого только действует слабо в сплошной массе, что образующийся хлористый свинец — нерастворим и препятствует дальнейшему действию хлористого водорода на металл. То же самое должно заметить относительно слабого действия хлористого водорода [c.319]
Осадок растворяют в соляной кислоте при этом образуются хлорид металла и свободный оксихинолин. К раствору прибавляют бромистый калий и титруют его из бюретки раствором КВгО, известной концентрации.
При взаимодействии КЕгО, и КВг в кислой среде выделяется бром, реагирующий с оксихинолином.
После превращения всего оксихинолина в бромпроизводное в растворе появляется избыток брома, который легко обнаружить по обесцвечиванию им красителей. [c.104]
Хлорное железо легко растворяется в воде, а выделяющийся сероводород вновь вступает во взаимодействие с металлом и т. д. Следовательно, комбинированное действие двух таких корродирующих агентов, как сероводород и соляная кислота, приводит к весьма активному разъеданию аппаратуры. [c.135]
Соли МДЭСи (красного цвета) образуются при взаимодействии соединений Рс1 (II) и Р1 (II) в соляной кислоте с соответствующими солями щелочных металлов. Наиболее важны растворимые [c.653]
Вычислите массовую долю (%) металла в смеси с его оксидом, зная объем водорода, выделившегося при взаимодействии смеси с соляной кислотой. [c.150]
Взаимодействие с кислотами. 1. К 1—2 кусочкам цинка в отдельных пробирках добавьте по 8—10 капель разбавленной и концентрированной соляной кислоты. Отметьте интенсивность взаимодействия металла с кислотой в каждом случае. Аналогичные опыты проделайте с разбавленными и концентрированными Н2804 и НЫОз (опыт проводите в вытяжном шкафу). [c.256]
Причини, по которым данное соединение является хорошим ингибитором для железа и плохим для цинка или наоборот, могут быть связаны также со специфическим электронным взаимодействием полярных групп с металлом (хемосорбцией). Последний фактор в определенных случаях более важен, чем стерический, определяющий возможности для плотнейшей упаковки адсорбированных молекул.
Это можно проиллюстрировать очень значительным ингибирующим действием оксида углерода СО, растворенного в соляной кислоте, на коррозию в ней нержавеющей стали [36] (степень защиты 99,8%, в 6,3 М растворе НС1 при 25 °С). Об этом же свидетельствует защита железа, обеспечиваемая малым количеством иодида в разбавленных растворах Н2504 [35, 37, 38].
Как СО, так и иодид хемосорбируются на поверхности металла, препятствуя в основном протеканию анодной реакции [39]. Кеше [40] показал, что 10″ т К1 значительно лучше ингибирует железо в 0,5 т растворе N32804 с pH = 1 (степень защиты 89 %), чем в растворе с pH = 2,5 (степень защиты 17 %).
Это показывает, что адсорбция иодида в этом интервале pH зависит от значения pH [c.270]
Хроматы щелочно-земельных металлов. В три пробирки налейте небольшое количество растворов солей кальция, стронция, бария и добавьте к ним раствор хромата калия. Хроматы каких металлов выпадают в осадок Отметьте цвет полученных веществ и проверьте их взаимодействие с раствором уксусной и соляной кислот. [c.251]
Результат опыта. Из всех металлов только цинк бурно реагирует с раствором соляной кислоты. С поверхности цинковой пластинки интенсивно выделяются многочисленные пузырьки газа. Поверхность пластинок из меди и серебра остается неизменной — пузырьков газа не образуется, что свидетельствует об отсутствии реакции взаимодействия этих металлов с кислотой. [c.129]
Смесь, состоящая из 1 объема азотной и 3—4 обт>емов концен трнрованной соляной кислоты, называется царской водкой. Цар ская водка растворяет некоторые металлы, пе взаимодействующие с азотной кпслотой, в то.
ч числе и царя металлов — золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием. клороксида азо-rai ni), пл[1 хлорида нитрозила, NO I [c.
414]
Термохимическое воздействие иа ПЗП — процесс подачи на забой скважины соляной кислоты, нагретой в результате взаимодействия с металлом. В качестве реагирующего с НС1 металла обычно используют магний или его сплавы (МЛ-1, МА-1 и др.), кмторые в специальном наконечнике устанавливают в обрабатываемом интервале. [c.17]
Взаимодействие хрома с соляной и разбавленной серной кислотами. В две пробирки поместите по 0,1 г порошка хрома и прибавьте в первую пробирку концентрированную соляную, а во вторую — разбавленную серную кислоту.
Содержимое пробирки слегка подогрейте и наблюдайте интенсивное взаимодействие металла с кислотами. Каков цвет )астворов и соответствует ли он окраске солей хрома (II) 2сли нет, то почему [c.
148]
Подобные процессы происходят и прп реакциях, в ходе которых малорастворимое вещество превращаегся в растворимый, по слабо диссоциирующий продукт. К таким реакциям относится, например, растворение сульфидов некоторых металлов в соляной кислоте. Так, взаимодействие сульфида марганца с соляной кислотой выражается уравнением [c.256]
Проведен термодинамический анализ взаимодействия ксяшояен-тов флюса на основе хлористого цинка с окисной пленкой. Рассчитаны величины изобарного потенциала для взаимодействия 2% раствора соляной кислоты с металлами и их окислами.
Показано, что флюсующее действие 1-2% раствора соляной кислоты при низкотемпературной пайке связано с процессом диспергирования окисной пленки в результате протекания реакции между соляной кислотой и паяемым металлом. [c.
129]
Нет ни одного катализатора, который в условиях реакции не вступал б ы во взаимодействие с фенолом или альдегидом.
Так, напрНмер, соляная кислота взаимодействует с формальдегидом с образованием монохлбрметилового спирта и оксихлорметило-вого эфира, щелочи с фенолами дают феноляты.
Фенолы можно рассматривать как слабые кислоты, а феноляты щелочных и щелочноземельных металлов как соли сильных оснований с слабыми кислотами. Феноляты в присутствии избытка фенила, [c.27]
Соли MgiB lJ (красного цвета) образуются при взаимодействии -оединений Pd (II) и Pt (II) в соляной кислоте с соответствующими олями щелочных металлов. Наиболее важны растворимые в воде KolPt lJ и NaJPt lJ (рис. 243), являющиеся исходными вещест- [c.614]
В ряду напряжений все три элемента располагаются правее водорода, причем медь стоит почти рядом с ним, а золото — дальше всех остальных металлов. Поэтому в растворах таких кислот, как НС1, H2SO4 и т. п., при отсутствии окислителей не растворяется даже медь.
В кислотах, одновременно являющихся окислителями (HNO3 и т. п.), медь и серебро растворяются легко, а золото лишь в том случае, когда окислительные свойства кислоты выражены особенно сильно.
Лучшим растворителем для него является насыщенная хлором соляная кислота, взаимодействую- [c.388]
Используя значения стандартных электродных потенциалов, объясните, какой из металлов (железо или олово), будет энергичнее взаимодействовать с разбавленной соляной кислотой. Определите АСгэв соответствующих процессов. [c.104]
В растворах же состав может меняться непрерывно без существенного изменения химических свойств.
Так, количество H l в растворе соляной кислоты может доходить до 37%, причем все растворы соляной кислоты будут обладать химическими свойствами, характерными для данной кислоты (взаимодействие со и елочами, с металлами и пр.
), при этом однородность растворов кислоты не изменится. Это свойство понятно из приведенного здесь в виде обратимой реакщ и механизма образования раствора.
Уравнение обратимой реакции показывает, что в растворе все время находятся в равновесии сольваты разного состава, поэтому изменение количества растворителя в растворе приведет лишь к изменению соотношения между этими сольватами, но не нарушит однородности и не изменит в некоторых пределах химических свойств раствора. [c.29]
Соляная кислота. Формула. Характеристики. Применение
30
окт.
Одно из самых сильных веществ в своём классе – соляная кислота, формула вещества HCl, едкая, бесцветная жидкость. В чистом виде совершенно прозрачна.
Открытая ёмкость, содержащая вещество, постоянно «дымит», то есть, пары кислоты являются летучими, легко испаряются, наполняя окружающую среду едким газом, немного похожим на туман и небезопасным для человека, его вдыхающего.
Поэтому применение соляной кислоты в промышленности или в лабораторных условиях всегда сопряжено с определённой опасностью и требует осторожности, внимательности и соблюдения всех требований безопасности.
Соляная кислота. Свойства, особенности использования, меры предосторожности
Поскольку данное вещество относится к числу сильных неорганических кислот, то соляная кислота взаимодействует с целым рядом химических элементов и их соединений. Она способна вступать в химические взаимодействия с металлами, их оксидами и гидроксидами, с солями других (менее сильных) кислот и основаниями.
С чем реагирует соляная кислота
Как и всякая другая кислота, хлороводород (второе название вещества) вступает в химическую реакцию с большинством металлов.
Активные металлы вытесняют из молекулы кислоты водород, заменяя его собой и образуя соли соляной кислоты, именуемые хлоридами.
Во всех этих случаях при соединении металла с хлороводородом происходит бурная реакция, нередко внешне похожая на кипение. Это активно выделяется из соединения водород, улетучиваясь в окружающую среду.
Как взаимодействует соляная кислота с железом
Именно описанное выше качество заметно ограничило использование вещества в хозяйственных целях.
Чрезмерная его активность приводит к тому, что любые металлоконструкции, вблизи которых оказывается концентрированная соляная кислота, начинают бурно коррозировать.
Поскольку железо – наиболее часто применяемый конструкционный материал – также в химическом смысле очень активное вещество. А летучие испарения легко находят его и вступают в реакцию с ним.
Как взаимодействует соляная кислота с магнием
Магний принадлежит к группе щелочноземельных металлов. Вещества из этой группы характеризуются высоким уровнем химической активности, поэтому магний способен вступать с соляной кислотой в реакцию замещения в её классическом понимании. С энергичным выделением водорода и образованием хлорида магния.
Перманганат калия плюс соляная кислота. Результат взаимодействия
Реагирует данная кислота и с перманганатом калия. В результате этой реакции образовывается группа более простых веществ.
Образовываются хлориды марганца и калия, а также выделяется некоторое количество воды. И помимо названных соединений образовывается свободный газообразный хлор, выделяющийся в окружающую среду.
С какими веществами соляная кислота не реагирует
- Не подвержены взаимодействию с соляной кислотой (как и с другими кислотами) благородные металлы, вследствие своей химической инертности.
- Золото, серебро или платина не образуют никаких солей-хлоридов, также амбивалентны в этом отношении такие металлы, как вольфрам, иридий, осмий, рутений, палладий и свинец.
- Кроме указанных материалов не вступают во взаимодействие с соляной кислотой полимерные материалы, такие как поливинилхлорид, полиэтилен, полипропилен.
- Из них изготавливают тару для транспортировки и хранения данного реактива и инструменты для работы с ним.
Вопросы безопасности при эксплуатации реактива
Кроме того, что от хлороводорода нужно беречь стальные, медные и прочие металлические элементы конструкций, от них нужно обязательно беречь кожу и слизистые оболочки. Так как, соляная кислота, как мы уже сказали выше, достаточно опасное вещество.
При попадании на кожу или на слизистую оболочку она вызывает сильнейший химический ожог. Поэтому необходимо беречь от неё глаза, кожу и органы дыхания.
Любые сосуды с ней открывать нужно быстро и ненадолго, потому что пары несут не меньше опасности, чем кислота в жидком состоянии.
В случае, если химического ожога всё же не удалось избежать, то поражённое место нужно обработать раствором слабого основания или слабой щелочью, самый простой и распространённый вариант – содовый раствор.
Применение соляной кислоты
Отрасли промышленности, где используется соляная кислота
Применяют это соединение в химической отрасли, где с её помощью получают синтетические смолы и искусственный каучук. Соляная кислота является сырьём для синтеза хлористого метила, хлористого этила и хлорвинила.
Применяют её ещё во многих разновидностях химического производства, где получают хлориды железа, цинка, марганца, хлористого аммония и множества других соединений.
В обработке металлов и создании металлоконструкций хлороводород используют для протравливания металлических поверхностей, которое необходимо при пайке, лужении и очистке.
Соляная кислота. Применение в быту
На бытовом уровне соляную кислоту также используют в самых разнообразных качествах. Одним из наиболее распространённых направлений эксплуатации является очистка всевозможных объектов от щелочных наслоений.
- Это могут быть последствия от воздействия слишком жёсткой воды, оставляющей накипь и прочие подобные образования на нагревательных приборах, в трубопроводах, на стенках бассейнов, тротуарной плитке и прочих поверхностях.
- Однако используется для этих целей не чистая, а ингибированная соляная кислота, имеющая определённые добавки, замедляющие действие этого опасного химиката, благодаря чему его использование становится менее опасным в бытовых условиях.
- Кроме того, этот реактив позволяет существенно снизить уровень жёсткости воды, используемой для наполнения бассейнов и прочих производственно-хозяйственных нужд.
Различные растворы соляной кислоты – это средство для снижения pН, и используют для этих целей растворы с различной концентрацией вещества (13%, 15%, в некоторых случаях используют растворы 31,5% и прочие).
Компания Химэлемент предлагает купить соляную кислоту в Украине по выгодной цене с доставкой в любой регион Украины.






