- Радиус атома
- Период, группа и электронная конфигурация
- Длина связи
- Металлические и неметаллические свойства
- Основные и кислотные свойства
- Восстановительные и окислительные свойства
- Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
- Высшие оксиды и летучие водородные соединения (ЛВС)
- Окислительно-восстановительные свойства элементов в Периодической таблице
- В зависимости от строения их атомов
- ПОИСК
- Качественная характеристика окислительно-восстановительных реакций
- Валентность
- Степень окисления
- Как определить степень окисления атомов
- Окислитель и восстановитель
- Как определить является атом окислителем или восстановителем
- Важнейшие восстановители и окислители
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
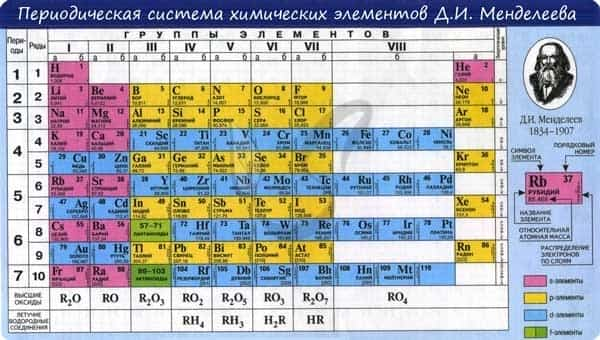
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
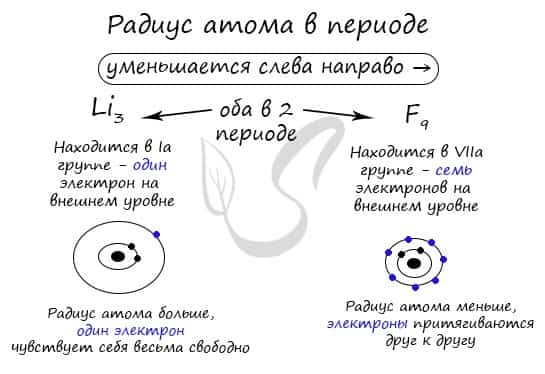
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
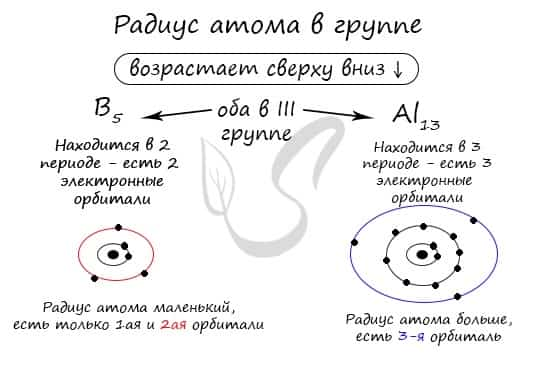
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже ?
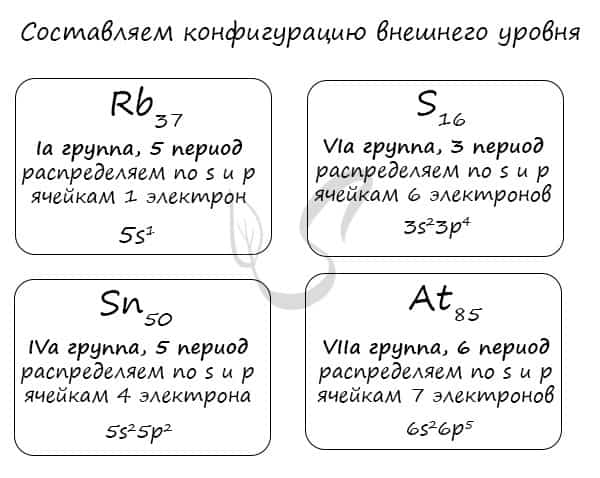
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
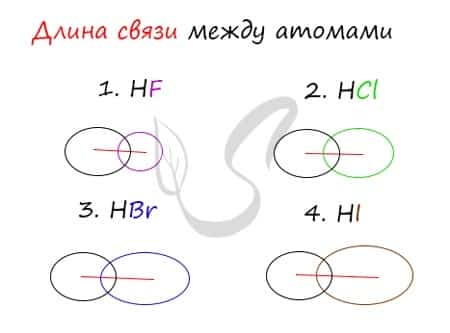
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
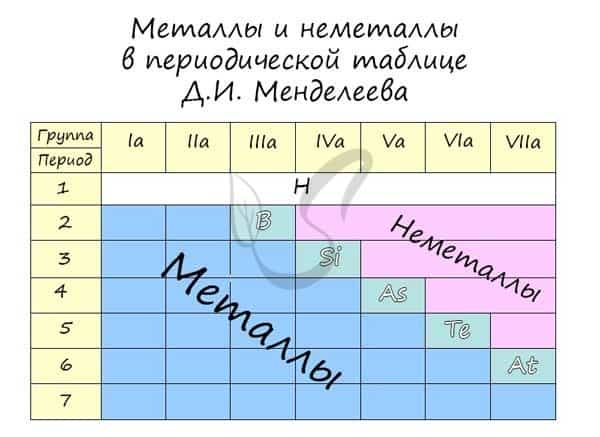
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
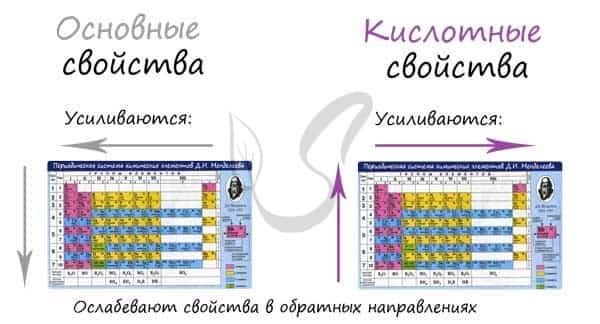
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить ?
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
Окислительно-восстановительные свойства элементов в Периодической таблице
Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц — от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные — натрий самый сильный восстановитель в третьем периоде, а хлор — самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные — в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ — восстановитель; Fe3+ — окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления — такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления — такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, — такое вещество может быть как окислителем, так и восстановителем — все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O — при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 — при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят «свою» среду — в кислотной среде сила окислителей увеличивается, а в щелочной — увеличивается сила восстановителей.
См. далее Элементы-восстановители
В зависимости от строения их атомов
Изменение окислительно–восстановительных свойств элементов
Способность химических элементов присоединять или отдавать электроны связана со строением атомов и положением их в периодической системе элементов Д.И. Менделеева.
Атомы металлов в химических реакциях способны лишь отдавать электроны и быть восстановителями. Наиболее активными восстановителями являются щелочные и щелочноземельные металлы.
- Атомы неметаллов (за исключением фтора) в зависимости от
- свойств партнеров, с которыми они взаимодействуют, могут
- проявлять как окислительные, так и восстановительные свойства.
- Например:
- Fe0 + S0 = Fe+2S-2 и S0 + O2 = S+4O2-2.
Однако, у химически активных неметаллов проявляются преимущественно окислительные свойства. Их часто используют на практике в качестве окислителей (кислород, Cl2).
Атомы водорода в зависимости от свойств партнера могут проявлять как окислительные, так восстановительные свойства. Например, в реакции
Cl20 + H20 = 2H+1Cl-1
водород восстановитель, так как в молекуле HCl электронная пара сильно смещена в сторону ядра атома хлора. При нагревании натрия в струе водорода образуется гидрид натрия (2Na0 + H20 = 2Na+1H-1).
Электронная пара, обусловливающая химическую связь, сильно смещена в сторону водорода. СО водорода в этом соединении равна -1. Таким образом, водород в этой реакции является окислителем.
Однако для водорода более характерна тенденция к отдаче электронов. Чаще всего водород используют как восстановитель.
Одноатомные молекулы благородных газов (Не, Nе, Ar…) практически не проявляют ни окислительных, ни восстановительных свойств, что находится в согласии со строением их атомов (внешний энергетический уровень полностью заполнен электронами).
У ионов металлов и неметаллов в высших степенях окисления восстановительные свойства отсутствуют. Такие частицы в окислительно–восстановительных реакциях могут проявлять только окислительные свойства (присоединять электроны). В связи с этим соединения, в состав которых входят частицы (ионы) в высшей СО, используются в качестве окислителей (KMnO4, HNO3, K2CrO4, K2Cr2O7 и т.д.).
Положительные ионы промежуточных СО в зависимости от свойств партнеров могут выступать как в роли восстановителей, так и в роли окислителей:
2Fe+2Сl2 + Cl20 = 2Fe+3Cl3-1 (Fe+2 — восстановитель);
Fe+2O + C+2O = Fe0 + CO2+4 (Fe+2 — окислитель).
Ион железа в высшей СО обладает только окислительными свойствами. Так, феррат калия К2FeO4 – один из наиболее сильных окислителей.
- Вещества, в состав которых входят ионы неметаллов (например, Cl-1,
- Br-1, S-2, I-1), за счет последних могут выступать только в роли восстановителей.
- В пределах каждого периода с возрастанием порядкового номера элемента восстановительная способность его атомов понижается, а окислительная способность — повышается.
Так, во II периоде литий – только восстановитель, а фтор – только окислитель. Это результат постепенного заполнения электронами внешнего электронного уровня (у атома лития — 1 электрон, у атома фтора — 7 электронов из 8 возможных на данном уровне).
В пределах каждой главной подгруппы с возрастанием порядкового номера элемента восстановительная способность их атомов возрастает, а а окислительная способность постепенно убывает.
Так, в главной подгруппе IV группы кислород – сильный окислитель, а теллур – очень слабый окислитель, в некоторых реакциях он выступает даже как восстановитель. Аналогичное явление наблюдается также и в отношении их химических соединений.
Эти закономерности обусловлены повышением величины радиусов атомов элементов.
ПОИСК
Укажите изменение окислительно-восстановительных свойств галогенов при переходе от фтора к йоду Как меняются эти же свойства у соответствующих ионов F , С1 , Вг, J Приведите примеры. [c.
150]
Вычислите электродные потенциалы приведенных полуреакций, протекающих в водных растворах с рН = 0, и предскажите характер изменения окислительно-восстановительных свойств веществ по мере повышения концентрации ионов водорода в растворе. [c.251]
Как следует из табл. В.32, восстановительные свойства соединений ослабляются с убыванием порядка связи. Так, гидразин в присутствии ионов Мо + восстанавливает пероксид водорода до воды, окисляясь при этом до N2. Окислительно-восстановительные свойства гидразина сильно зависят от pH [c.536]
Окислительно-восстановительные свойства элементов и их ионов определяются их способностью отдавать или присоединять электроны. Атомы или ионы, присоединяющие электроны, называются окислителями, а отдающие их — восстановителями. [c.17]
Окислительно-восстановительные свойства элементов в большой степени зависят от числа электронов на внешней оболочке и радиуса атома или иона.
Если на внешней оболочке находится один, два или три электрона, то элемент может быть только восстановителем — присоединение электронов для него практически невозможно (исключение составляют водород и бор).
При наличии четырех, пяти, шести или семи электронов возможно проявление и восстановительных, и окислительных [c.17]
Опыт 26. Окислительно-восстановительные свойства иона 0з > а) К раствору диоксида серы в воде приливайте по каплям бромную воду. Опытным путем определите продукты реакции. [c.57]
Хлороводород, строение молекулы. Растворение в воде. Хлороводородная (соляная) кислота, ее соли. Окислительно-восстановительные свойства. Качественная реакция на хлорид-ион. Получение и применение хлороводорода [c.114]
Ион металла при этом восстанавливается в одну из низших валентных форм. В результате совместного действия кислорода и углеводорода ионы металлов часто находятся в разных валентных состояниях, что в среднем соответствует некоторой дробной величине. Так, ион ванадия при окислении нафталина воздухом имеет среднюю валентность 4,3 вместо 5 в УгОб.
Очевидно, что состояние иона металла определяется окислительно-восстановительными свойствами среды и зависит от соотношения кислорода и углеводорода, от наличия водяных паров и т. д. При этом в начальный период работы катализатор постепенно формируется в состояние, стабильное для данных условий синтеза, а варьирование условий может изменить его активность и селективность.
[c.412]
Периодичность накопления электронов около ядра влечет за собой периодичность в изменении свойств атомов (элементов). Периодически изменяются валентность, радиусы атомов и ионов, окислительно-восстановительные свойства, ионизационные потенциалы, сродство к электрону, температуры плавления и кипения и др. [c.85]
Определение ионов, не обладающих окислительно-восстановительными свойствами (титрование по замещению). Этим методом могут быть определены, например, катионы кальция, стронция, бария, свинца, цинка и др., которые образуют малорастворимые оксалаты. При определении кальция осаждают оксалат кальция, затем после фильтрования и тщательного промывания растворяют осадок в серной кислоте и выделившуюся щавелевую кислоту титруют перманганатом калия. [c.276]
С переменной валентностью многих элементов Н1 аналитической группы связано наличие у ряда образуемых ими ионов окислительно-восстановительных свойств. Например, катионы Сг+++ и Мп++ при действии окислителен способны окисляться в анио- [c.127]
Отсюда возникает возможность двоякого использования окислительно-восстановительных свойств пары 12/21 в титриметрическом анализе для определения восстановителей — окислением их раствором иода и для определения окислителей — восстановлением Г-ионами. [c.396]
Изложенное показывает, что комплексообразование может сильно влиять на окислительно-восстановительные свойства ионов в растворах. Известно очень много комплексов Ре, Со, N1, некоторые из них имеют большое практическое значение. [c.561]
Одним из наиболее важных достоинств полярографического метода анализа является возможность одновременного определения нескольких полярографически активных веществ. Величина 1/2 характеризует природу иона, восстанавливающегося или окисляющегося на электроде.
Для обратимого процесса величина 1/2 практически совпадает с величиной стандартного окислительного потенциала.
Если в растворе присутствует несколько веществ, различающихся по окислительно-восстановительным свойствам, то в ряде случаев (если 1/ будут отличаться не менее чем на 100 мВ) удается фиксировать волны, соответствующие раздельному восстановлению компонентов смеси на электроде. В этом случае получают полярографический спектр. [c.169]
Приведите примеры реакций, иллюстрирующие окислительные, восстановительные свойства, а также примеры диспропорционирования иона NOr. [c.66]
Опишите окислительно-восстановительные свойства атомов и ионов щелочных металлов. [c.155]
Окислительно-восстановительные свойства галогенов зависят от электроотрицательности, энтальпии диссоциации и других факторов. С увеличением радиуса атомов окислительные свойства галогенов ослабевают. Поэтому легче всего окисляется ио-дид-ион, тогда как фторид-ион не может быть окислен обычными окислителями. [c.497]
При характеристике окислительно-восстановительных свойств сложных соединений необходимо в ряде случаев принимать во внимание степени окисления других атомов, входящих в их состав.
Так, подчеркивая восстановительные свойства H I, НВг и HI, обусловленные ионами С1, Вг» и Г, не следует упускать из виду возможность проявления ими же окислительных свойств, обусловленных ионом Н+, например [c.125]
Окислительно-восстановительные свойства свинца и олова. Соединения олова (II) в щелочной среде проявляют восстановительные свойства сильнее, чем в кислой, так как образующиеся атомы связываются кислородом иона ОН» в стан-нат-ион [c.206]
Опыт 4. Окисление алюминия ионами водорода. Внесите кусочек алюминия в 2 н. раствор НС1. Наблюдайте окисление и составьте уравнение происходящей окислительно-восстановительной реакции. Дайте сравнительную характеристику окислительно-восстановитеЛьных свойств атомов и ионов алюминия и водорода. [c.143]
Как и кислородные кислоты галогенов, окислительно-восстановительные свойства проявляют их соли, которые используют главным образом как окислители. Кислородные соединения хлора, брома и иода, проявляя окислительные свойства, восстанавливаются в зависимости от условий реакции до свободного состояния или до отрицательно заряженного иона, например [c.126]
Об окислительно-восстановительных свойствах простых веществ и соединений можно судить, руководствуясь периодической системой элементов Д. И. Менделеева.
Типичными окислителями являются а) простые вещества, атомы которых обладают большой электроотрицательностью (элементы VIA и VHA групп), из них наиболее активны фтор, а также кислород и хлор, б) ионы с дефицитом электронов, это простые катионы с высшей или большой степенью окисления, например РЬ Fe Т1 , Се , и сложные анионы, в которых более электроположительный элемент имеет высшую или значительную степень окисления, например (Сг 04) , ( rl O ) (N 03), (Мп 04)-, (S U) -, (сг Оз)- (С1 о -, (В1 0з), (Pb U) , (СГ 0)-, (Вг 0з)-. [c.217]
Участвующие в растворе ионы в данных условиях не обладают характерными окислительно-восстановительными свойствами, а поэтому реакция с Изменением степени окисления заряда ионов произойти не может. Следовательно, данная реакция относится к ионообменным. [c.46]
Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, от каких участвующих в реакции атомов, молекул или ионов и к каким атомам, молекулам или ионам переходят электроны и в каком количестве. Это можно установить на основе периодической системы Д. И.
Менделеева, зная строение атомов и молекул, окислительно-восстановительные свойства реагирующих веществ (восстановителей и окислителей), условия протекания реакций, правила и методы их составления, значения ионизационных потенциалов, сродства к электрону, электроотрицательности атомов, окислительно-восстановительные потенциалы. [c.89]
Выше было отмечено, что окислительно-восстановительные свойства могут проявляться у нейтральных атомов, молекул, элементарных ионов и сложных ионов. Характеристика нейтральных атомов и молекул дана в табл. 62. [c.197]
Окислительно-восстановительные свойства элементарных веществ и образованных ими элементарных ионов являются перио- [c.140]
Наличие нескольких характерных степеней окисления у марганца предопределяет окислительно-восстановительные свойства его соединений. Перманганат-ион проявляет окислительные свойства в водном растворе при любом значении pH, причем в кислотной среде он — сильный окислитель [c.243]
Оценка окислительно-восстановительных свойств элементарных ионов вытекает из следующих соображений [c.141]
При заполнении графы Окислительно-восстановительные свойства учтите, что вопрос относится не к ионам Н , которые могут быть только окислителями, а к анионам или к молекулам кислоты. Пробу на окислительные свойства проделайте, подействовав на одну-две капли кислоты каплей раствора, в,состав которого входит серная кислота, иодид калия и крахмальный клейстер.
Посинение раствора вследствие появления свободного иода укажет на присутствие в кислоте анионов или молекул-окислителей. Восстановительные свойства кислоты исследуйте, подействовав на две-три капли кислоты каплей раствора перманганата калия, подкисленного серной кислотой. Обесцвечивание раствора указывает на восстановительные свойства исследуемой кислоты. [c.
297]
Анион 50 Открывают реакцией с ионом Ва » . Кислота сильная, так как водный раствор ее соли с натрием показывает нейтральную реакцию. Ион S0 не обнаруживает резко выраженных окислительно-восстановительных свойств. Кислота устойчивая.
Термический распад возможен только при очень высокой температуре. Концентрированная кислота заметно отличается от разбавленной по окислительным свойствам и более резко выраженной способности к гидратации — к обезвоживающему действию. [c.
297]
Опыт 15. Окислительно-восстановительные свойства нитрат (1П)-иона. Исследуйте отношение раств1ора нитрита натрия (калия) к подкисленным растворам иоДида калия и оксоманганата (VII) калия. [c.66]
Окислительно-восстановительные свойства сложных отрицательных ионов зависят от величины положительной валентности центрального атома. При максимальной валентности они проявляют окислительные свойства (А), а при промежуточной валентности — окислительно-восстано-вительные свойства (Б). [c.198]
То, что было сказано об окислительно-восстановительных свойствах фторидов, остается справедливым и для хлоридов. Однако, так как хлор более слабый окислитель, чем фтор, то его ион СГ при известных условиях проявляет свои восстановительные свойства. [c.244]
Окислительно-восстановительные свойства нейтральных атомов и ионов можно легко объяснить с помощью периодической системы элементов Менделеева (см. табл. 11). [c.136]
Окислительно-восстановительные свойства элементарных ионов. Элементарные ионы могут быть заряжены отрицательно или положительно. [c.141]
Окислительно-восстановительные свойства сложных ионов. [c.142]
Оквслительно-восстановительные свойства элементарных ионов. Окислительно-восстановительные свойства элементарных ионов обусловливаются строением их электронных оболочек и энергетическими характеристиками энергией ионизации и сродством к электрону. Элементарные анионы образуются при присоединении к нейтральным атомам элементов шестой группы двух [c.151]
Райт и Уэллер [6] изучали влияние добавок на изменение среды. Как известно, образование клешневидных колец изменяет окислительно-восстановительные свойства ионов н поэтому, но-видимому, снособно оказать влияние иа активацию водорода.
Присутствие этилендиамина и этилепдиамиптетрауксусной кислоты вызывает уменьшение как скорости, так и степени восстановления хинона и моногидрата ацетата меди(И) в хинолиновом растворс при 100°.
Образование металлической меди авторы относят за счет присутствия органического вещества. [c.187]
Каковы окислительно-восстановительные свойства сульфидокарбонат(роданид)-иона Какие атомы иона [c.79]
Двухвалентный кислород в соединении МпО аналогично кислороду в ионе 804 не может быть восстановителем.
В реакции участвует разбавленная серная кислота, которая не проявляет окислительно-восстановительных свойств за счет ионов Следовательно, в молекуле N32803 ион 80з » — восстановитель, он отдает 2 электрона и переходит в ион 804 , в молекуле КМПО4 ион Мп04 — окислитель, он в кислой среде принимает 5 электронов и переходит— в ион Мп . [c.198]
Каковы окислительно восстановительные свойства воды Составьте ионно-элекгронные уравнения для воды как окислителя и как восстановителя. [c.153]
Закономерным образом зависят от строения атома окислительно-восстановительные свойства элементов. Восстановительные свойства атомов уменьшаются в группах снизу вверх и в периодах слева направо. Таким образом, наиболее сильные восстановители — щелочные металлы. Окислительные свойства возрастают в периодах слева направо, а в группах — снизу вверх.
Следовательно, наиболее сильными окислителями являются галогены, а также кислородсодержащие ионы неметаллов (N03-, ВгОз и т. д.) и металлов в высшей степени окисления (Сг04 -, М.ПО4 и др.). При этом окислительная способность убывает сверху вниз в группах. Восстановительные свойства, возрастающие сверху вниз в группе, могут проявлять и отрицательно заряженные ионы неметаллов (I», и т.
д.). [c.33]
В общем случае схема дробного анализа иона М в присутствии ионов Мь Ма, Мз,. ..
, М составляется следующим образом 1) из характерных реакций иона М выбирают реакцию с высоким индексом избирательности или с наименьшим числом мешающих ионов 2) выбирают реагент, связывающий мешающие ионы в прочные комплексы, но не связывающий определяемый ион М 3) если ионы Мь. ..
, М обладают окислительно-восстановительными свойствами, подбирают реагент и условия для переведения мешающих ионов в такую степень окисления, в которой они не мешают обнаружению иона М 4) если пункты 2 и 3 не выполнимы, из общих реакций выбирают такую, чтобы ион М и ионы Мь. …
М оказались в разных фазах (растворч осадок, раствор газ) 5) если пункт 4 не выполним, подбор общих реакций продолжают до тех пор, пока в одной фазе с М останутся ионы, не мешающие его [c.122]
В результате платина получает положительный заряд, а раствор у поверхности ее — отрицательный заряд за счет образовавшегося избытка ионов С1 . Равновесие в двойном электрическом слое выразится уравнением Ре +е s f Pe2. » Таким образом, возникает положительный потенциал на платине, который будет тем выше, чем больше окислительная способность катиона.
И, наоборот, чем сильнее восстановительная активность иона, тем вероятнее отдача электрона им в кристаллическую решетку платины и возникновение отрицательного заряда на ней. Так появляется отрицательный потенцйал на платине в растворе, содержащем ионы Ст . В двойном слое устанавливается равновесие Сг з Сг + е.
Потенциал платины в разобранных двух примерах определяется соотношением активных концентраций окисленной и восстановленной формы ионов и характеризует окислительновосстановительную способность каждой из систем Ре , Pe Pt и Сг2, r Pt. Потому потенциал и получил название окислительновосстановительного.
Отметим, что это название сохранилось за потенциалами систем только в тех случаях, когда в электродной реакции не участвуют непосредственно металлы газы, хотя очевидно, что во всех случаях причиной возникновения скачка потенциала является окислительно-восстановительный процесс на поверхности электрода, приводящий к образованию двойного электрического слоя и потенциала в нем. Следовательно, потенциал характеризует окислительно-восстановительные свойства системы. [c.195]
Качественная характеристика окислительно-восстановительных реакций
Среди химических реакций, в том числе и в природе, окислительно-восстановительные реакции являются самыми распространенными. К их числу относятся, например, фотосинтез, обмен веществ, биологические процессы, а также сжигание топлива, получение металлов и многие другие реакции.
Окислительно-восстановительные реакции издавна успешно использовались человечеством в различных целях, но сама электронная теория окислительно-восстановительных процессов появилась совсем недавно – в начале XX века.
Для того чтобы перейти к современной теории окисления-восстановления, необходимо ввести несколько понятий – это валентность, степень окисления и строение электронных оболочек атомов.
Изучая такие разделы, как Периодический закон Д.И. Менделеева, основы строения атомов элементов и химическая связь и строение молекул, мы уже сталкивались с этими понятиями. Далее, рассмотрим их подробнее.
Валентность
Валентность – понятие сложное, которое возникло вместе с понятием химической связи и определяется, как свойство атомов присоединять или замещать определенное число атомов другого элемента, т.е. это способность атомов образовывать химические связи в соединениях.
Первоначально валентность определяли по водороду (его валентность принимали равной 1) или кислороду (валентность равна 2).
Позднее стали различать положительную и отрицательную валентность. Количественно, положительная валентность характеризуется количеством отданных атомом электронов, а отрицательная валентность – числом электронов, которые необходимо присоединить атому для реализации правила октета (т.е. завершения внешнего энергетического уровня).
Позднее понятие валентности, стало сочетать в себе также и природу химических связей, возникающих между атомами в их соединении.
Как правило, высшая валентность элементов соответствует номеру группы в периодической системе.
Но, как и во всех правилах, есть исключения:
например, медь и золото находятся в первой группе периодической системы и их валентность должна быть равна номеру группы, т.е. 1, но в действительности же высшая валентность меди равна 2, а золота 3.
Степень окисления
- Степень окисления иногда называют окислительным числом, электрохимической валентностью или состоянием окисления и является понятием условным.
- Так, при вычислении степени окисления предполагается допущение, что молекулу составляют только ионы, хотя большинство соединений вовсе не являются ионными.
- Количественно степень окисления атомов элемента в соединении определяется числом присоединенных к атому или смещенных от атома электронов.
- Таким образом, при отсутствии смещения электронов степень окисления будет нулевая, при смещении электронов в сторону данного атома – отрицательная, при смещении от данного атома – положительная.
Как определить степень окисления атомов
Определяя степень окисления атомов необходимо следовать следующим правилам:
- В молекулах простых веществ и металлов степень окисления атомов равна 0.
- Водород почти во всех соединениях имеет степень окисления равную +1 (и только в гидридах активных металлов равную -1).
- Для атомов кислорода в его соединениях типична степень окисления -2 (исключения: OF2 и пероксиды металлов, степень окисления кислорода соответственно равна +2 и -1).
- Постоянную степень окисления имеют также атомы щелочных (+1) и щелочноземельных (+2) металлов, а также фтора (-1)
- В простых ионных соединениях, степень окисления равна по величине и знаку его электрическому заряду.
- Для ковалентного соединения, более электроотрицательный атом имеет степень окисления со знаком «-», а менее электроотрицательный – со знаком «+».
- Для комплексных соединений указывают степень окисления центрального атома.
- Сумма степеней окисления атомов в молекуле равна нулю.
- Например, определим степень окисления селена Se в соединении H2SeO3
- Так, степень окисления водорода равна +1, кислорода -2, а сумма всех степеней окисления равна 0, составим выражение, учитывая число атомов в соединении H2+SeхO3-2:
- (+1)2+х+(-2)3=0, откуда
- х=+4,
т.е. H2+Se+4O3-2
Окислитель и восстановитель
Зная какую величину имеет степень окисления элемента в соединении возможно предсказать его химические свойства и реакционную активность по отношению к другим соединениям, а также является ли данное соединение восстановителем или окислителем. Эти понятия в полной мере раскрываются в теории окисления-восстановления:
- Окисление – это процесс потери электронов атомом, ионом или молекулой, что приводит к повышению степени окисления.
- Al0 -3e— = Al+3;
- 2O-2 -4e— = O20;
- 2Cl— -2e— = Cl2
- Восстановление – это процесс при котором атом, ион или молекула приобретают электроны, что приводит к понижению степени окисления.
Ca+2 +2e— = Ca0;
2H+ +2e— =H20
- Окислители – соединения, принимающие электроны в ходе химической реакции, а восстановители – отдающие электроны соединения. Восстановители во время реакции окисляются, а окислители – восстанавливаются.
- Сущность окислительно-восстановительных реакций – перемещение электронов (или смещение электронных пар) от одних веществ к другим, сопровождающихся изменением степеней окисления атомов или ионов. В таких реакциях один элемент не может окислиться без восстановления другого, т.к. передача электронов всегда вызывает и окисление и восстановление. Таким образом, общее число электронов, отнимаемое при окислении у одного элемента, совпадает с числом электронов, получаемых другим элементом при восстановлении.
Как определить является атом окислителем или восстановителем
- Так, если элементы в соединениях находятся в своих высших степенях окисления, то они будут проявлять только окислительные свойства, в связи с тем, что отдавать электроны они уже больше не могут.
- Напротив, если элементы в соединениях находятся в своих низших степенях окисления, то они проявляют только восстановительные свойства, т.к. присоединять электроны они больше не могут.
- Атомы элементов в промежуточной степени окисления, в зависимости от условий протекания реакции, могут быть как окислителями, так и восстановителями.
- Приведем пример окислительно-восстановительные свойства серы:
- Сера в своей высшей степени окисления +6 в соединении H2SO4, может проявлять только окислительные свойства, в соединении H2S – сера находится в своей низшей степени окисления -2 и будет проявлять только восстановительные свойства, а в соединении H2SO3 находясь в промежуточной степени окисления +4, сера может быть как окислителем, так и восстановителем.
- На основании значений степеней окисления элементов можно предсказать вероятность реакции между веществами.
- Понятно, что если оба элемента в своих соединениях находятся в высших или низших степенях окисления, то реакция между ними невозможна.
- Реакция возможна, если одно из соединений может проявлять окислительные свойства, а другое – восстановительные.
- Например, в HI и H2S как йод, так и сера находятся в своих низших степенях окисления (-1 и -2) и могут быть только восстановителями, следовательно, реагировать друг с другом не будут.
Зато они прекрасно будут взаимодействовать с H2SO4, для которой характерны восстановительные свойства, т.к. сера здесь находится в своей высшей степени окисления.
Важнейшие восстановители и окислители
Важнейшие восстановители и окислители представлены в следующей таблице.
| Восстановители | |
| Общая схема окисления восстановителя:M — ne → Mn+ | |
| Нейтральные атомы |
|
| Отрицательно заряженные ионы неметаллов |
|
| Положительно заряженные ионы металлов низшей степени окисления |
|
| Сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления | Сложные или комплексные ионы, а также молекулы могут проявлять восстановительные свойства, если входящие в их состав атомы, находятся в промежуточной степени окисления. Например,SO32-, NO2—, AsO33-, [Fe(CN)6]4-, SO2, CO, NO и другие. |
| Важнейшие восстановители в технике и лабораторной практике | Углерод (С), Оксид углерода (II) (СO2), Железо (Fe), Цинк (Zn), Алюминий (Al), Олово (Sn), Сернистая кислота (H2SO3), Сульфит (Na2SO3) и бисульфит натрия (Na2HSO3), Сульфид натрия (Na2S), Тиосульфат натрия (Na2S2O3), Водород (H2), Электрический ток |
| Окислители | |
| Общая схема восстановления окислителяЭ + ne- → Эn- | |
| Нейтральные атомы |
|
| Положительно заряженные ионы металлов |
|
| Сложные ионы и молекулы, содержащие атомы металла в состоянии высшей степени окисления | Типичными окислителями являются вещества, в состав которых входят атомы металла в состоянии наивысшей степени окисления.Например, KMnO4, K2Cr2O7, K2CrO4, HAuCl4. |
| Сложные ионы и молекулы, содержащие атомы неметалла в состоянии положительной степени окисления |
|
| Важнейшие восстановители в технике и лабораторной практике | Кислород (O2), Озон (O3), Перманганат калия (KMnO4), Хромовая (HCrO4) и Двухромовая кислоты (H2Cr2O7), Азотная кислота (HNO3), Азотистая кислота (HNO2), Серная кислота (конц) (H2SO4), Пероксид водорода (H2O2), Электрический ток, Хлорноватая кислота (HClO3), Диоксид марганца (MnO2), Диоксид свинца (PbO2), Хлорная известь (Ca(OCl)2), Растворы гипохлоритов калия (KOCl) и натрия (NaOCl), Гипобромид калия (KOBr), Гексацианоферрат (III) калия (K3[Fe(CN)6]. |






