- Что такое двухатомные элементы? (Примеры) — Наука — 2022
- Видео: Что такое двухатомные элементы? (Примеры)
- Содержание:
- Двухатомные молекулы
- Азот
- Кислород
- Фтор
- Хлор
- Бром
- Йод
- Ссылки
- Большая Рнциклопедия Нефти Рё Газа
- Двухатомные молекулы: характеристика и свойства
- Свойства двухатомных молекул
- Типы двухатомных молекул
- Список двухатомных молекул
- 2.5. Металлическая связь
- 2.6. Квантовые правила образования химических
После подробного изучения строения атома и состояния электронных оболочек можно приступать к вопросу о том, каким же образом происходит соединение атомов в молекулы.
В образовании химической связи участвуют электроны внешнего электронного слоя.
На одной орбитали могут находиться не более двух электронов, причем их спины (четвертое квантовое число) должны быть противоположны. Более того, состояние атома, в котором на орбитали имеется один неспаренный электрон, является нестабильным: атом стремится к объединению с другим атомом (или с несколькими) с той целью, чтобы электроны на всех орбиталях были спаренными.
Получив недостающий электрон, атом переходит в стабильное состояние.

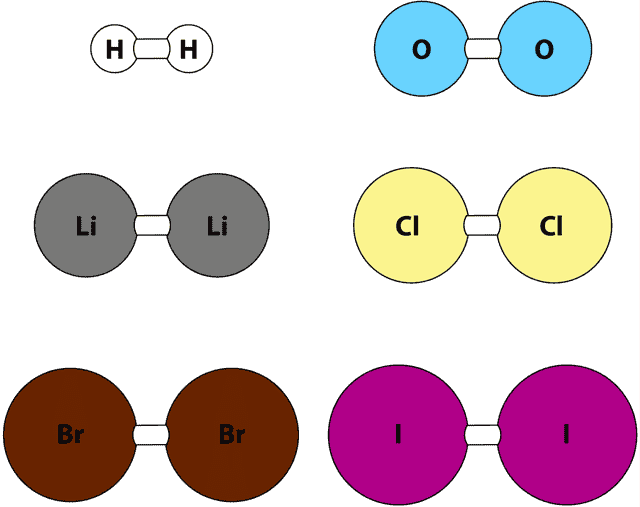
- Экспериментально доказано, что почти все вещества, находясь в газообразном состоянии, объединяются в двухатомные молекулы.
- Это касается не только привычных нам газов: водорода, кислорода, азота, хлора, но и веществ, которые при нормальном состоянии представляют собой жидкости (бром) или твердые вещества (йод).
- В двухатомные молекулы объединяются даже парыметаллов (литий, натрий).
- Рассмотрим процесс образования молекул водорода.
- При взаимодействии атомов водорода, электроны которых имеют антипараллельные спины, они взаимно притягиваются, их электронные облака перекрываются.
- В месте взаимного перекрывания плотность двухэлектронного облака увеличивается, расстояние между ядрами атомов уменьшается.
- При этом электроны образуют в пространстве уже не два электронных облака, а одно.
- Атомы перешли в более стабильное состояние, при котором электроны спарены.

Внутренняя энергия системы, состоящей из двух атомов водорода, также уменьшается (избыток энергии выделяется в виде теплоты).
Область повышенной двухэлектронной плотности связывает два атома водорода в молекулу Н2. Между атомами образовалась химическая связь.
- Итак, химическая связь между атомами водорода осуществляется обобществленной парой электронов.
- Каждый из атомов отдает на образование связи по одному электрону.
- Подобным образом осуществляется связь между атомами любого элемента.
- В молекулах водорода атомы связаны одной общей электронной парой.
Такую связь называют одинарной. Но химическая связь между атомами в молекулах может быть образована с помощью большего числа электронных пар.
- Это зависит от строения взаимодействующих атомов.
- Например, у атома азота на внешнем электронном слое 5 электронов: 2 спаренных на s-орбитали и 3 неспаренных на трёх p-орбиталях.
- Атом стремится к такому состоянию, чтобы все электроны были спарены, поэтому при объединении двух атомов азота образуется три общие пары электронов – такую связь называют тройной.
- Увеличение числа электронных пар, связывающих атомы в молекулу, увеличивает прочность молекул.
- Именно поэтому азот не так активно вступает в химические реакции, как, например, кислород или водород.
- Конечно, на реакционную способность простого вещества влияет не только кратность связи в молекуле, но и другие факторы.
Поскольку атомы при объединении в молекулы проявляют валентность (т.е. способность объединяться с другими атомами) и связь образуется с образованием общих электронных пар, такую связь называют ковалентной.
Приставка «ко-» как риз и обозначает совместное участие.

С помощью ковалентной связи между атомами неметаллов образуются молекулы простых веществ, а также и многих сложных веществ.
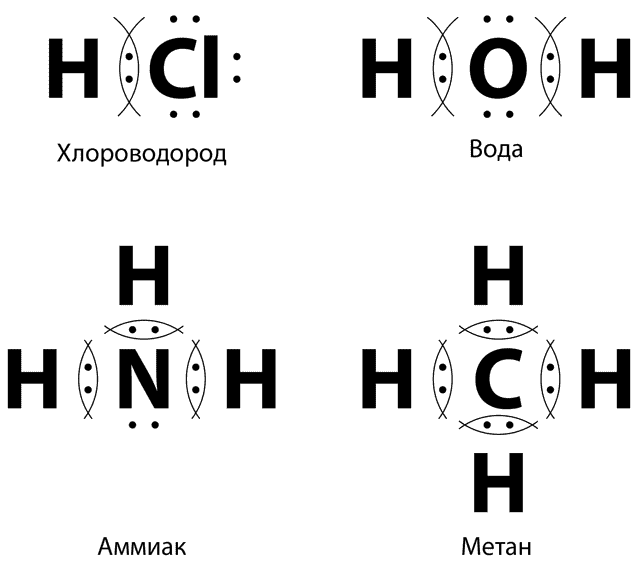
Американский физикохимик Джилберт Льюис предложил электронные формулы веществ, отражающие природу ковалентной связи, которые затем назвали формулами Льюиса.
В этих формулах валентные электроны внешнего слоя условно изображены точкой. В них ковалентные связи обозначены общей электронной парой.

Общие электронные пары, осуществляющие химическую связь, для удобства также обозначают черточками:
Ковалентная связь устанавливается между атомами не только одного элемента, но и разных.
- Рассмотрим установление химической связи между атомами разных элементов-неметаллов на примере образования фторида водорода.
- Запишем схему электронных структур атомов водорода и фтора.
- У каждого из атомов имеется по одному неспаренному электрону.
- При взаимодействии этих электронов может образоваться общая электронная пара, связывающая атомы разных элементов:

- В данном случае перекрываются сферическая s- орбиталь атома водорода и гантелеобразная p-орбиталь атома фтора.
- Эта химическая связь также ковалентная.
- Она осуществляется общей электронной парой, для образования которой каждый из этих атомов поставляет по одному электрону.
- Связывающая их электронная пара принадлежит обоим атомам, однако уже не в равной степени.
- Это связано с тем, что атомы разных элементов имеют разную электроотрицательность.
Электроотрицательность – количественная характеристика способности атома смещать в свою сторону общие электронные пары.
Общая электронная пара в молекуле сложного вещества смещена к одному из атомов, что образует вокруг этого атома избыток отрицательного заряда, а у другого – избыток положительного заряда.
Такая молекула имеет как бы два полюса: положительный и отрицательный.

- Поэтому такую связь называют ковалентной полярной.
- Молекулы хлороводорода, воды, аммиака являются полярными.
- Их еще называют диполями (имеющими два полюса).
- В противоположность этому, связь между одинаковыми атомами, где электронная пара принадлежит обоим атомам в равной степени, называют ковалентной неполярной.
- Важнейшим свойством ковалентной связи является ее прочность.
Она определяется энергией связи. Вы уже знаете, что при образовании химической связи выделяется энергия – это экзотермический процесс.
При образовании H2выделяется 431 кДж/моль, при образовании HF– 565 кДж/моль (количество энергии, выделяющееся при образовании 1 моль вещества).
Чем выше степень перекрывания электронных облаков связывающихся атомов, тем больше энергия их связи и тем прочнее образованная молекула.
Длина связи – другое ее свойство. Длину связи измеряют в нанометрах (1 нанометр = 10-9метра).
- Длина связи зависит от радиуса взаимодействующих атомов, от кратности связи между ними.
- Чем меньше длина связи, тем она прочнее.
- Направленностьковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи.
- Рассмотрим направленность ковалентных связей в молекуле воды.
- У атома кислорода два неспаренных р-электрона.
- Их р-электронные облака расположены в пространстве взаимно перпендикулярно по отношению друг к другу.
- При взаимодействии с атомами водорода образуются две химические связи.
- В молекуле воды они также образуют угол.
- Экспериментально установлено, что угол связи Н–О–Н в молекуле воды равен не 90°, а 104,45° вследствие их взаимного отталкивания: у молекулы воды угловая форма.
- Здесь настало время рассказать про ещё один вид связи.
- Эту связь нельзя назвать полностью химической, а скорее электрохимической.
- Кислород имеет очень большую электроотрицательность по отношению к водороду, вследствие чего в молекуле воды он очень сильно смещает на себя электронные пары, поэтому образующиеся вокруг атомов заряды ощутимы до такой степени, что между соседними молекулами воды образуются силы притяжения.
- Поскольку такой вид связи образуется преимущественно с участием атомов водорода, её называют водородной.
- Прочность такой связи примерно в 10 раз меньше прочности ковалентной, однако она значительно влияет на свойства веществ: повышает температуру плавления и кипения, вязкость, теплопроводность, теплоёмкость веществ.
- Для примера рассмотрим температуры кипения и плавления водородных соединений элементов VI группы периодической системы (кислород, сера, селен, теллур) и рассмотрим их в виде таблицы и графика.
| Вещество | Температура кипения | Температура плавления |
|
H2Te (теллуроводород) |
–2,2 °С | –49 °С |
|
H2Se (селеноводород) |
–41,25 °С | –65,37 °С |
|
H2S (сероводород) |
–60,28 °С | –82,30 °С |
|
H2O (вода) |
+100,00 °С | 0,00 °С |
- Если бы между молекулами воды не существовало водородных связей, температура кипения воды была бы около минус 80 °С, а температура плавления около минус 90°С.
- Водородная связь играет большую роль не только в том, что вода при нормальных условиях представляет собой жидкость.
- Она также участвует в стабилизации очень многих органических молекул в живых организмах, таких как белки или нуклеиновые кислоты.
- Молекулы разных веществ могут иметь линейное, угловое, пирамидальное и другое строение, плоскостную и неплоскостную формы.
- Двухатомные молекулы, естественно, линейной формы.
Трехатомные молекулы могут иметь линейную или угловую форму. Четырехатомная молекула аммиака имеет форму пирамиды.
- В том случае, когда электроотрицательности элементов в составе молекулы отличаются друг от друга весьма значительно, электрон в такой же степени сдвигается в сторону одного из атомов, становится почти полностью принадлежащим этому атому.
- Примером такой связи можно назвать связь атомов в хлориде натрия (поваренная соль).
- Отдав свой электрон атому хлора, атом натрия превращается в положительно заряженную частицу – ион Na+.
- Атом хлора, приобретая электрон натрия, достраивает внешний электронный слой до устойчивой структуры и приобретает отрицательный заряд, превращаясь в ион Cl–.
- Положительно заряженные ионы называют катионами, а отрицательно заряженные ионы – анионами.
- Между ними возникают силы электростатического притяжения.
- За счет этих сил разноименно заряженные ионы связываются между собой, образуя соединение NaCl(поваренная соль).
- Связь атомных частиц в ионном соединении объясняется не повышенной плотностью двухэлектронного облака (общей электронной пары), а силами электростатического притяжения ионов.
- Химическая связь между ионами, осуществляемая силами их электростатического притяжения, называется ионной связью, а соединения, которые образовались вследствие притяжения ионов, называются ионными.
Ионных соединений сравнительно немного. Их образуют типичные металлы и неметаллы, резко отличающиеся по своей электроотрицательности. Примерами таких соединений являются соединения металлов первой или второй групп периодической системы с неметаллами седьмой группы.
- С помощью ионной связи также образуются и более сложные ионные соединения: щелочи, соли, у которых сложный анион (например, гидроксид OH–, нитрат,NO3–, сульфат SO42–).
- При обычных условиях большинство ионных соединений находится в твердом состоянии.
- При определенных условиях ионные соединения распадаются на ионы.
- Обычно ионные соединения легко отличить по двум признакам: высокая температура плавления и хорошая растворимость в воде.
- Почему ионные соединения хорошо растворимы в воде?
- Вспомните, как говорили алхимики: подобное растворяется в подобном.
- Молекула воды сильно полярна, и поэтому ионы в составе ионного соединения ассоциируются с молекулами воды, при этом молекулы воды как бы «облепляют» ионы растворённого вещества, образуются водородные связи.
Понятно, что данная схема отображает состояние ионов в растворе приблизительно, чтобы вы поняли суть процесса растворения вещества с ионной связью.
При диссоциации ионной связи энергия поглощается, а при образовании водородных связей – выделяется. Однако поскольку водородная связь намного слабее ковалентной и тем более слабее ионной, выделяется энергии гораздо меньше, чем поглощается.
Диссоциация – разделение в пространстве положительных и отрицательных ионов без разрыва химической связи (т.е. с сохранением общей электронной пары, которая становится принадлежащей одному атому).
Поэтому при растворении абсолютного большинства ионных соединений в воде поглощается энергия, проще говоря, раствор охлаждается.
У меня есть дополнительная информация к этой части урока!
Закрыть
Часто проводят такой опыт: стакан, стоящий на тарелке с небольшим количеством холодной (почти ледяной) воды, наливают ту же воду и насыпают смесь хлорида калия и хлорида натрия.
Смесь этих солей при растворении в воде поглощает больше теплоты, чем такое же количество каждой соли по отдельности. Из доступных в быту веществ также можно взять аммиачную селитру.
После растворения солей температура раствора понижается настолько, что чистая вода, на которой стоит стакан, замерзает.
- Ионы в природе существуют вокруг нас.
- Много разнообразных ионов в морской воде, прибрежный воздух также ионизирован и поэтому весьма полезен для здоровья.
- Однако ионы химически активны, и результатом их взаимодействия часто бывают негативные явления, например, кислотные дожди.
- Также ионы играют большую роль в процессах обмена веществ в живых организмах, при этом отклонение концентрации ионов в тканях в обе стороны губительно сказывается на этих процессах.
- Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
- Однако чисто ионной связи практически не существует.
- Отсюда деление химической связи на типы (ковалентная и ионная) также условно.
Пройти тест
Пройти тест и получить оценку можно после входа или регистрации
Что такое двухатомные элементы? (Примеры) — Наука — 2022
Видео: Что такое двухатомные элементы? (Примеры)
Видео: Энергетические уровни. 8 класс.
Содержание:
В двухатомные элементы, также называемые гомоядерными двухатомными молекулами, состоят всего из двух атомов одного и того же химического элемента. Некоторые элементы не могут существовать сами по себе, даже если они изолированы от любого другого типа атома.
Элементы этой природы будут соединяться с атомами того же элемента, чтобы быть стабильными. Другими словами, водород, двухатомный элемент, не может существовать сам по себе. Просто не может существовать H.
Водород настолько реактивен, что, когда он изолирован от всего, кроме водорода, он объединяется в двухатомную (двухатомную) молекулу. Следовательно, водородный газ, который иногда используется в качестве топлива, существует как H2.
Двухатомные молекулы
Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, например, молекула кислорода (O2), образует гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (CO), он образует гетероядерную двухатомную молекулу.
Молекулы, содержащие более двух атомов, называются многоатомными молекулами, например, диоксид углерода (CO2) и вода (H2ИЛИ). Молекулы полимера могут содержать многие тысячи составляющих атомов.
- Двухатомные молекулы состоят из семи элементов. Следующие 5 газообразных элементов находятся в виде двухатомных молекул при комнатной температуре и давлении:
- -Водород — H2
- -Азот — N2
- -Кислород — O2
- -Фторид — F2
- -Хлор — Cl2
- Бром и йод обычно существуют в жидкой форме, но также и в виде двухатомных газов при немного более высоких температурах, что составляет всего 7 двухатомных элементов.
- -Бром — Br2
- -Йод — I2
Двухатомными элементами являются галогены (фтор, хлор, бром, йод) и элементы с окончанием -гена (водород, кислород, азот). Астатин — еще один галоген, но его поведение неизвестно.
- Все двухатомные молекулы линейны, что представляет собой простейшее пространственное расположение атомов.
- Двухатомную молекулу удобно и часто представлять в виде двух точечных масс (двух атомов), соединенных безмассовой пружиной.
- Энергии, участвующие в движениях молекулы, можно разделить на три категории:
- Трансляционные энергии (молекула, которая движется из точки A в точку B)
- Энергии вращения (молекула вращается вокруг своей оси)
- Колебательные энергии (молекулы, которые колеблются разными способами)
Все двухатомные элементы представляют собой газы при комнатной температуре, за исключением брома и йода, которые являются жидкими (йод может даже находиться в твердом состоянии), и все, за исключением кислорода и азота, связаны одинарной связью.
Молекула кислорода состоит из двух атомов, соединенных двойной связью, а молекула азота — тройной связью.
Водород (H2), с атомным номером 1, представляет собой бесцветный газ, который не был официально открыт как элемент Генри Кавендишем до 1766 года, но был случайно обнаружен примерно за сто лет до этого Робертом Бойлем.
Это бесцветный, нетоксичный газ без запаха, который существует в нашей Вселенной в природе. Водород — первый элемент периодической таблицы, самый легкий и самый распространенный из всех химических элементов во Вселенной, поскольку составляет 75% от ее массы.
Азот
Азот (N2) имеет атомный номер семь и составляет около 78,05% атмосферы Земли по объему.
Это бесцветный, в основном инертный газ без запаха и запаха, в жидком состоянии он остается без цвета и запаха.
Кислород
Кислород (O2) имеет атомный номер восемь. Этот бесцветный газ без запаха имеет восемь протонов в ядре и имеет бледно-голубой цвет в жидком и твердом состояниях.
Пятая часть атмосферы Земли состоит из кислорода, и по массе он является третьим по распространенности элементом во Вселенной.
Кислород — самый распространенный по массе элемент в биосфере Земли. Высокая концентрация кислорода в атмосфере является результатом кислородного цикла Земли, который в основном регулируется фотосинтезом растений.
Фтор
Фтор (F2) имеет атомный номер девять и является наиболее реактивным и электроотрицательным из всех элементов. Этот неметаллический элемент представляет собой бледно-желтый газ, который принадлежит к группе галогенов.
Джордж Гор был, по-видимому, первым ученым, выделившим фтор, но его эксперимент сорвался, когда образовавшийся фтор вступил в реакцию с водородом.
В 1906 году Фердинанд Фредерик Анри Муассан был удостоен Нобелевской премии по химии за свою работу по выделению фтора в 1886 году. Это самый электроотрицательный элемент в периодической таблице.
Хлор
Хлор (Cl2) является членом галогенной группы с атомным номером семнадцать. Одна из его форм, NaCl, используется с древних времен.
Хлор использовался тысячи лет во многих других формах, но он не был назван до 1810 года сэром Хамфри Дэви.
Хлор в чистом виде желтовато-зеленый, но его обычные соединения обычно бесцветны.
Бром
Бром (Br2) имеет атомный номер тридцать пять. Это тяжелая темно-коричневая жидкость, единственный неметаллический элемент, являющийся жидкостью.
Бром был открыт Антуаном Ж. Балардом в 1826 году. Он использовался в важных целях задолго до того, как был официально открыт.
Йод
Йод (I2) имеет атомный номер пятьдесят три, причем пятьдесят три протона находятся в ядре атома. Это сине-черный неметалл, который играет очень важную роль в органической химии.
Йод был открыт в 1811 году Барнардом Куртуа. Он назвал его йодом от греческого слова «iodes», что означает фиолетовый. Это сине-черное твердое вещество.
Йод играет очень важную роль в биологии всех живых организмов, поскольку его дефицит приводит к таким заболеваниям, как гипертиреоз и гипотиреоз.
Ссылки
- (С.Ф.). Гомонуклеарные двухатомные молекулы. Получено с сайта boundless.com.
- Факты о хлоре. (С.Ф.). Получено с сайта softschools.com.
- Двухатомные элементы. (С.Ф.). Восстановлено с ths.talawanda.org.
- Encyclopdia Britannica. (2016, 14 сентября). Молекула. Получено с britannica.com.
- Helmenstine, A. (2014, 28 сентября). Двухатомные элементы. Получено с сайта sciencenotes.org.
- Хельменстин, А. М. (29 марта 2017 г.). Что такое семь двухатомных элементов? Получено с сайта thinkco.com.
- Факты о кислороде. (С.Ф.). Получено с сайта softschools.com.
- Королевское химическое общество. (2015). молекулярный йод. Получено с сайта chemspider.com.
Большая Рнциклопедия Нефти Рё Газа
- Cтраница 1
- Двухатомные молекулы щелочных металлов РІ небольших количествах ( — 1 %) обнаружены РІ парах металлов; РёС… энергии диссоциации ( Li2 105, Na2 72, K249, Rb245, Cs2 44 кДж / моль) уменьшаются сверху РІРЅРёР· РІ РіСЂСѓРїРїРµ I, указывая РЅР° то, что СЃРІСЏР·СЊ становится слабее РїРѕ мере увеличения размера атомов. [2]
- При каких условиях существуют двухатомные молекулы щелочных металлов. [3]
Рассмотрены различные термодинамические методы определения энергии диссоциации двухатомных молекул щелочных металлов. Предложен новый весьма простой термодинамический метод, позволяющий определить одновременно значения D0 и АЯю, согласованные между собой и с данными по давлению насыщения. [4]
Данные РїРѕ энергиям диссоциации [35, 36] показывают, что двухатомные молекулы щелочных металлов, меди, серебра, золота относительно стабильны РІ парообразной фазе, что указывает РЅР° возможность образования ассоциатов кислородных вакансий РІ соответствующих окислах. Более того, учитывая, что энергия образования двухатомной молекулы меди составляет 1 76 — 10 — 19 Дж РЅР° атом, Р° энергия, выделяющаяся РїСЂРё конденсации парообразной меди, равна 5 6 — Р®-19 Дж, можно ожидать возникновения ассоциатов более крупных, чем бивакансии. Действительно, РёР· термодинамических данных [37] следует, что доминирующими дефектами нестехиометрического РѕРєСЃРёРґР° меди являются ассоциаты ( РЈРѕ) 4 — Двухатомные молекулы Mg, Ca, Sr, Ba малоустойчивы Рё, следовательно, РІ соответствующих оксидах трудно ожидать образования устойчивых ассоциатов нейтральных кислородных вакансий. [5]
Атомы водорода вылетают из источника в камеру, где сталкиваются и вступают в хим. реакцию с двухатомными молекулами щелочного металла, напр. В нек-рых экспериментах исследуется возбуждение колебат. [6]
�меются некоторые исключения из этого положения.
Однако энергии диссоциации двухатомных молекул щелочных металлов, подобных Na2, очень низки, тогда как энергия диссоциации Н2 очень высока, и при этих условиях возможно, что среднеарифметическое уже не является хорошим приближением для рассматриваемой энергии неполярной связи. [7]
Длина связи определяется расстоянием между центрами атомов, которые образуют данную связь. Сближение атомов ограничено возрастанием межэлектронного и межъядерного отталк вания.
Длины связей находятся в зависимости от размера атомов, образующих молекулу.
Например, межъядерные расстояния в ряду двухатомных молекул щелочных металлов Li2, Na2, К2, Rb2 и Csz увеличиваются, энергии диссоциации уменьшаются. [8]
С другой стороны, как у водорода, так и у галогенов не хватает одного электрона до электронной структуры последующего благородного газа.
Действительно, РІРѕРґРѕСЂРѕРґ, РїРѕРґРѕР±РЅРѕ галогенам, проявляет степень окисления — 1 Рё окислительные свойства.
Сходен РІРѕРґРѕСЂРѕРґ СЃ галогенами Рё РїРѕ агрегатному состоянию, Рё РїРѕ составу молекул Р2 — РќРѕ РњРћ РІРѕРґРѕСЂРѕРґР° РЅРµ имеют ничего общего СЃ таковыми молекул галогенов.
В то же время МО Щ имеют определенное сходство с МО двухатомных молекул щелочных металлов, существующих в парообразном состоянии. [9]
С другой стороны, как у водорода, так и у галогенов не хватает одного электрона до электронной структуры последующего благородного газа.
Действительно, РІРѕРґРѕСЂРѕРґ, РїРѕРґРѕР±РЅРѕ галогенам, проявляет степень окисления — 1 Рё окислительные свойства.
Но МО водорода не имеют ничего общего с таковыми молекул галогенов.
В то же время МО Н2 имеют определенное сходство с МО двухатомных молекул щелочных металлов, существующих в парообразном состоянии. [10]
С другой стороны, как у водорода, так и у галогенов не хватает одного электрона до электронной структуры последующего благородного газа.
Действительно; РІРѕРґРѕСЂРѕРґ, РїРѕРґРѕР±РЅРѕ галогенам, проявляет степень окисления — 1 Рё окислительные свойства.
Но МО водорода не имеют ничего общего с таковыми молекул галогенов.
В то же время МО Щ имеют определенное сходство с МО двухатомных молекул щелочных металлов, существующих в парообразном состоянии. [11]
Страницы: 1
Двухатомные молекулы: характеристика и свойства
Двухатомные молекулы – молекулы, включающие два атома одного или разных элементов. Атомы в такой системе связаны между собой с помощью ковалентной полярной или неполярной связи.
Свойства двухатомных молекул
Важной характеристикой двухатомных молекул является кривая потенциальной энергии. При сближении двух атомов друг к другу возникает химическая связь, что отражается на потенциальной энергии.
При образовании связи на кривой появляется минимум, характеризующий равновесное расстояние (re) между ядрами.
Если химическая связь не образуется, то минимум на потенциальной кривой не появляется, хотя атомы взаимодействуют между собой.
Электронное состояние молекулы – это совокупность электронных состояний атомов. Движение электронов происходит в молекулярных пределах. При рассмотрении необходимо учитывать то, что некоторые электроны принадлежат молекуле, а некоторые – отдельным атомам.
Это разделение важно брать во внимание при образовании ионных и ковалентных связей. В первом случае атомы с большей электроотрицательностью отдают свои электроны другим атомам. Таким образом формируются ионы с заполненными оболочками, между которыми действуют электростатические силы притяжения.
Например, ионная связь образуется в молекуле поваренной соли NaCl.
Ионная и ковалентная связи – предельные случаи, которые могут действовать с большей или меньшей степенью точности. Есть предположение, что существуют промежуточные связи с различными степенями ковалентности и ионности. Координационные, водородные и ван-дер-ваальсовские связи обладают меньшей прочностью. Последние возникают благодаря взаимной поляризации молекул.
Типы двухатомных молекул
Двухатомные молекулы – электрические системы, которые состоят из двух положительно заряженных ядер и электронов, взаимодействующих друг с другом и с ядрами. Значения энергии электронов определяют электронные состояния всей молекулы. В зависимости от симметрии все двухатомные молекулы классифицируют на типы:
- гомоядерные;
- гетероядерные.
К первому виду относятся соединения из одних атомов – азот N2, водород Н2 и др. Второй вид включает разнородные атомы – соляная кислота HCl, углекислый газ СО2 и др. В гомоядерных системах образуется неполярная связь, в гетероядерных – полярная.
Список двухатомных молекул
При нормальных условиях двухатомные молекулы формируются только в газовом состоянии:
- водород Н2;
- азот N2;
- кислород О2 и др.
Подобные структуры также могут образовываться у галогенов при нагревании:
Двухатомные молекулы возникают и у других элементов при достаточно высоких температурах. Инертные газы не образуют такие структуры и при обычных условиях они представляют собой только один атом.
Атмосфера нашей планеты включает около 21 % кислорода О2 и 78 % азота N2. Воздух, которым дышит все живое, состоит из двухатомных молекул. Озон О3 вырабатывается из кислорода и защищает Землю от воздействия вредного ультрафиолетового излучения.
2.5. Металлическая связь
Кристалл
металла (например, железа, меди, алюминия
и т.д.) содержит в узлах кристаллической
решетки положительно заряженные ионы,
а валентные электроны, осуществляющие
химическую связь, принадлежат не
определенным атомам, а всему кристаллу
металла в целом (рис. 17).
Рис.
17. Модель металлической кристаллической
решетки; черными точками обозначены
электроны
Электроны
свободно перемещаются в объеме кристалла.
За подвижность их называют «электронным
газом». «Электронный газ» прочно
удерживает положительно заряженные
ионы в узлах кристаллической решетки.
Металлическая
связь обусловлена
электромагнитным взаимодействием,
удерживающим положительно заряженные
ионы в узлах кристаллической решетки
подвижными электронами («электронным
газом»). Металлическая
связь характерна для металлов и сплавов.
Длина металлической связи –
это расстояние между узлами металлической
кристаллической решетки, в которых
расположены положительно заряженные
ионы.
2.6. Квантовые правила образования химических
связей
Для характеристики
трех типов химических связей –
ковалентной, ионной и металлической
используются методы валентных связей
(ВС) и молекулярных орбиталей (МО). На
заре использования квантовой механики
в химии (В. Гейтлер и Ф. Лондон, 1927 г.
) было
доказано, что волновое уравнение (его
называют уравнением Шредингера)
справедливо для описания как свойств
атомов, так и молекул.
В молекулах, ионных
соединениях и металлах действуют
электрические силы притяжения и
отталкивания, которые взаимно уравновешены
и обеспечивают их устойчивость.
Теоретические
расчеты квантовой механики позволили
сформулировать следующие положения
метода валентных связей:
-
в образовании связи участвуют валентные электроны, т. е. электроны внешней электронной оболочки атома;
-
каждая химическая связь образуется при участии пары электронов с противоположными спинами;
-
химическая связь образуется при перекрывании атомных орбиталей. Между ядрами появляется область повышенной электронной плотности, удерживающая ядра на расстоянии, соответствующем длине химической связи.
В
методе, предложенном Гейтлером и
Лондоном, образование химической связи
рассматривается как результат перекрывания
атомных
орбиталей
(АО), заселенных электронами с
противоположными спинами.
Но
это не единственный подход к объяснению
химической связи. Существует метод
молекулярных
орбиталей
(МО). Он основан на допущении, что
электроны, участвующие в образовании
химической связи, образуют молекулярные
орбитали, как в атоме атомные орбитали.
Принцип
запрета Паули, правило Гунда, принцип
наименьшей энергии (правило Клечковского)
справедливы и для молекулярных орбиталей.
Основы метода МО разработаны Р. Малликеном
и Ф. Гундом в 19281930
гг. и сводятся к следующим положениям:
-
молекула это единая система ядер и электронов, а не совокупность атомов, сохраняющих некоторую индивидуальность;
-
электроны в молекулах располагаются на молекулярных орбиталях (МО);
-
число образовавшихся связывающих и разрыхляющих МО равно числу АО исходных атомов;
-
устойчивость молекулы определяется разностью числа электронов на связывающих и разрыхляющих орбиталях. Эта разность выражает порядок связи.
Для
описания электронного состояния молекулы
в методе МО используются энергетические
диаграммы,
аналогичные диаграммам энергетических
уровней в атомах.
Если
в поле ядер двухатомной молекулы,
например молекулы водорода, электроны
движутся так, что «мешают» друг другу
(отталкиваются), образуется разрыхляющая
молекулярная орбиталь.
Разрыхляющая орбиталь препятствует
образованию химической связи и
располагается на более высоком
энергетическом уровне по сравнению с
энергетическими уровнями атомных
орбиталей.
Если
два электрона движутся в поле ядер так,
что они «помогают» друг другу удерживать
ядра на расстоянии длины химической
связи, образуется связывающая
молекулярная орбиталь. Она
обеспечивает образование химической
связи, располагаясь на более низком
энергетическом уровне по сравнению с
энергетическими уровнями атомных
орбиталей.
Продемонстрируем
применение метода МО на примере
двухатомных молекул. В молекуле Н2
атомы Н теряют свою индивидуальность.
Два электрона, расположенные на атомных
орбиталях, заполняют лишь связывающую
1s
молекулярную орбиталь, разрыхляющая
*1s
молекулярная орбиталь остается
незаполненной (рис. 18).
png»>
png»>
Энергия атомного и молекулярного уровней
Рис.
18. Энергетическая диаграмма молекулы
водорода: 1sсвязывающая
молекулярная орбиталь, *1sразрыхляющая
молекулярная орбиталь
Последовательность
заполнения 1s
и *1s
молекулярных орбиталей электронами
происходит в соответствии с квантовыми
правилами: от низших к высшим энергетическим
уровням при соблюдении принципа запрета
Паули и правила Гунда.
Устойчивость
молекулярного образования оценивается
по значению порядка связи. Порядок
связи (W)
это
число, равное разности между количеством
электронов на связывающих и разрыхляющих
орбиталях, поделенное на 2.
В
молекуле водорода порядок связи равен
1. Чем больше порядок связи, тем устойчивее
молекула. Если порядок связи равен нулю,
это означает, что химическое связывание
атомов невозможно.
Молекула
Не2
не существует. Порядок связи в такой
молекуле равен 0 (рис. 19).
Энергия атомного и молекулярного уровней
Рис.
19. Энергетическая диаграмма, подтверждающая,
что гипотетическая двухатомная молекула
гелия Не2
не существует
В
молекуле кислорода порядок связи равен
2.
Рис.
20 свидетельствует о более высокой
прочности химического связывания атомов
в молекуле кислорода по сравнению с
молекулой водорода.
Энергия атомного и молекулярного уровней
-
Рис.
20 Энергетическая диаграмма молекулы
кислорода; разрыхляющие молекулярные
орбитали помечены звездочкой






