- Обсуждение: «Щелочноземельные металлы»
- Щелочноземельные металлы
- Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
- Физические свойства
- Химические свойства
- Нахождение в природе
- См. также
- Ссылки
- Литература
- 2 группа (2А подгруппа) — щелочноземельные металлы (главная группа элементов)
- Erdalkalimetalle – Wikipedia
- характеристики
- Физические свойства
- Электронная конфигурация
- Реакции
- ссылки
- Жесткость воды
- Вхождение
- Бериллийсодержащие драгоценные камни
- доказательство
- Инструкции по технике безопасности
- веб ссылки
- литература
Давайте разберем эти металлы точно по подобию щелочных металлов.
Щелочноземельными эти металлы называют, т.к. они содержатся во всех минералах земли — поэтому «земельные», а «щелочные» — т.к. они придают воде щелочную реакцию.
- Строение электронных оболочек
- Электронное строение внешнего слоя у всех этих элементов одинаково – на нем всего 2 электрона на s-подуровне:
- n S2
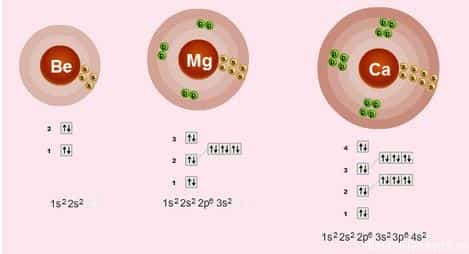
-
Что это означает?
- Валентности элементов = 2, т.е. каждый атом может образовывать 2 связи.
- Степень окисления элементов = +2 – металлические свойства – это способность отдавать электроны
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются – Ba более сильный металл, чем Be.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.
- Физические свойства щелочно-земельных металлов
-
Общие характеристики:
- все металлы сероватого цвета,
- твердые, ножом, как щелочные металлы, их уже, конечно, не порежешь ????
- плотность больше 1,
- на воздухе элементы достаточно устойчивы, но покрываются оксидной пленкой,
- окрашивают пламя в разный цвет (это используют для получения разных цветов пламени в пиротехнике):
-
Ca — в кирпично-красный - Sr – в красный
- Ba– в желтый
- Химические свойства металлов
- Имеет смысл рассмотреть химические свойства по таблице классификации неорганических соединений.
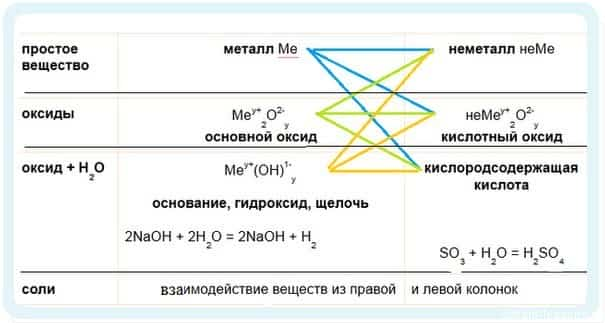
-
1. Идем по синим стрелочкам — взаимодействие металлов:
- Металлы традиционно проявляют металлические — восстановительные свойства.
-
2. Идем по зеленым стрелочкам — реакции для оксидов
-
3. Идем по оранжевым стрелочкам
- Обратите внимание, что гидроксиды щелочноземельных металлов либо малорастворимы, либо нерастворимые, поэтому их образование может служить качественной реакцией.
- Be(OH)2 — амфотерный гидроксид, он может реагировать как с основаниями, так и с кислотами!
3. Щелочноземельные металлы с водородом также образуют гидриды.
Как мы уже говорили, сверху вниз в подгруппе металлические свойства элементов возрастают. Водород, хоть и находится в первой группе при реакции с щелочноземельными металлами будет проявлять отрицательную степень окисления.
Как определить качественные реакции? Загляните в таблицу растворимости!
-
Be(OH)2 — гелеобразный белый осадок;
Сa(OH)2 — белый осадок;
Mg(OH)2 — белесый осадок;
Фториды — белесо-бесцветные осадки;
Сульфиты и сульфаты — белые осадки.
Как видите, цвета осадков не отличаются цветовым разнообразием ???? - Получение щелочно-земельных металлов
-
Обычно щелочноземельные металлы получают электролизом расплавов их солей: - CaCl2 (электролиз) → Ca + Cl2
-
[TESTME 24]
Обсуждение: «Щелочноземельные металлы»
(Правила комментирования)
Щелочноземельные металлы
Металлы главных подгрупп I и II групп. Жесткость воды
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1, во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2. Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2p1. Они относятся к p-элементам.
- В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
- Оксиды типа R2O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2, которые являются сильными окислителями.
- Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.
Физические свойства
В свободном состоянии все металлы – серебристо-белые вещества. Магний и щелочноземельные металлы – ковкие и пластичные, довольно мягкие, хотя тверже щелочных. Бериллий отличается значительной твердостью и хрупкостью, барий при резком ударе раскалывается.
В кристаллическом состоянии при обычных условиях бериллий и магний имеют гексагональную кристаллическую решетку, кальций, стронций – кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Металлы имеют температуры плавления и кипения выше, чем у щелочных металлов, причем с увеличением порядкового номера элемента температура плавления металла изменяется немонотонно, что связано с изменением типа кристаллической решетки.
Бериллий и магний покрыты прочной оксидной пленкой и не изменяются на воздухе. Щелочноземельные металлы очень активны, их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства бериллия, магния и щелочно-земельных металлов приведены в таблице.
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
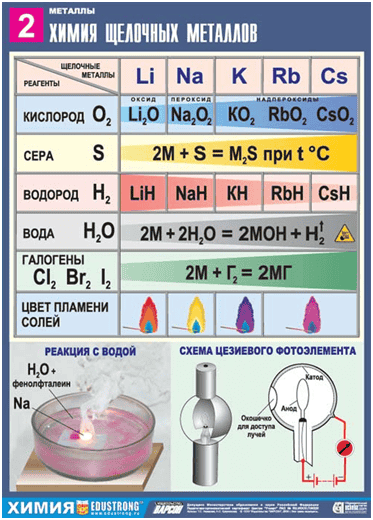
Химические свойства щелочных металлов
| Свойство | Be | Mg | Ca | Sr | Ba |
| Плотность, кг/м3 | |||||
| Температура плавления,°С | |||||
| Температура кипения,°С |
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
- 2Na + Cl2→ 2NaCl
- 2Na + S → Na2S
- 2Na + H2→ 2NaH
- 3Na + P → Na3P
- Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
- 6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
- Li3N + 3H2O → 3LiOH + NH3↑
- 2. Взаимодействие с кислородом
- Только с литием сразу образуется оксид лития.
- 4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
- 2Li + 2H2O → 2LiOH + H2↑
- 4. Взаимодействие с кислотами – сильными окислителями
- 8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
- 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
- Получение щелочных металлов
- Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
- Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
- Химические свойства щелочноземельных металлов
- 1. Взаимодействие с неметаллами
- Сa + Cl2→ 2СaCl2
- Сa + S → СaS
- Сa + H2→ СaH2
- 3Сa + 2P → Сa3 P2-
- 2. Взаимодействие с кислородом
- 2Сa + O2 → 2CaO
- 3. Взаимодействие с водой
- Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
- 4. Взаимодействие с кислотами – сильными окислителями
- 4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
- 4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
- Получение щелочноземельных металлов
- Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
- CaCl2 Сa + Cl2
- Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
- 3BaO +2Al → 3Ba + Al2O3
Щёлочноземельные металлы | это… Что такое Щёлочноземельные металлы?
Щё́лочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: бериллий, магний, кальций, стронций, барий и радий[2][3]. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают в воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название «земли
Физические свойства
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций).
Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который имеет минимальную среди них плотность (ρ = 1,55 г/см³), самый тяжёлый — радий, плотность которого примерно равна плотности железа.
Химические свойства
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера.
Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение).
Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше.
Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, так же и как щелочные металлы (и кальций), хранят под слоем керосина.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера: Be(OH)2 — амфотерный, нерастворимый в воде гидроксид, но растворим в кислотах (а также проявляет кислотные свойства в присутствии сильных щелочей), Mg(OH)2 — слабое основание, нерастворимое в воде, Ca(OH)2 — сильное, но малорастворимое в воде основание, Sr(OH)2 — лучше растворимо в воде, чем гидроксид кальция, сильное основание (щёлочь) при высоких температурах, близких к точке кипения воды (100 °C), Ba(OH)2 — сильное основание (щёлочь), по силе не уступающее KOH или NaOH, и Ra(OH)2 — одна из сильнейших щелочей, очень коррозионное вещество.
Нахождение в природе
Все щёлочноземельные металлы имеются (в разных количествах) в природе. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются.
Самым распространённым щёлочноземельным металлом является кальций, количество которого равно 3,38 % (от массы земной коры). Немногим ему уступает магний, количество которого равно 2,35 % (от массы земной коры).
Распространены в природе также барий и стронций, которых соответственно 0,05 и 0,034 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 6·10−4% от массы земной коры.
Что касается радия, который радиоактивен, то это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1·10−10% (от массы земной коры)[4].
См. также
Ссылки
- http://enc.mail.ru/article/74002900
Литература
2 группа (2А подгруппа) — щелочноземельные металлы (главная группа элементов)
31763
Во 2 группу входят Be, Mg, Са, Sr, Ва, Ra (табл. 1 и 2). Все эти элементы имеют изотопы с некомпенсированным ядерным спином.
В отличие от щелочных металлов, щелочноземельные распределяются в плазме и в клетках крови аналогично переходным металлам, то есть с увеличением радиуса иона содержание металла в плазме увеличивается.
Ионы металлов 2 группы образуют больше комплексных соединений, чем ионы щелочных металлов.
Таблица 1. Некоторые физические и химические свойства щелочноземельных металлов
| Название | Ат. № | Относит, ат. масса | Электронная формула | Радиус, пм | Основные изотопы (%) | |
| Be | Бериллий Beryllium [от греч. Beryllos — берилл] | 4 | 9,012 | [He]2s2 | Be2+ 34, атомный 113,3, ковалентный 89 | 9Be*(100) |
| Mg | Магний Magnesium [от Магнезия — полуостров в Греции] | 12 | 24,305 | [Ne]3s2 | Mg2+ 78, атомный 160, ковалентный 136 |
|
| Са | Кальций Calcium [от лат. Calx — известь] | 20 | 40,078 | [Ar]4s2 | Са2+ 106, атомный 197,3, ковалентный 174 |
|
| Sr | Стронций Strontium [в честь Strontian — Шотландии] | 38 | 87,62 | [Kr]5s2 | Sr2+ 127, атомный 215,1, ковалентный 192 |
|
| Ва | Барий Barium [от греч. Barys — тяжелый] | 56 | 137,327 | [Xe]6s2 | Ва2+ 143, атомный 217,3, ковалентный 198 |
|
| Ra | Радий Radium [от лат. Radius -луч] | 88 | 226,025 | [Rn]7s2 | Ra2+ 152, атомный 223 | 223Ra*,224Ra, 226Ra, 228Ra -встречаются |
Из этих ns2-металлов важнейшими являются Mg и Са. В живых организмах оба они относятся к макроэлементам. Например, в организме взрослого человека содержится до 1 кг Са (до 99% — в составе костей и зубов) и около 25 г Mg. Показано их значение для метаболических процессов, свертывания крови, сокращения мышц, функционирования нервной системы.
Бериллий (Be) — очень твёрдый и легкий, его сплав с медью сходен со сталью. В эпоху нанотехнологии он необходим для атомной, электронной, электротехнической, авиационной и нефтегазовой промышленности.
Be обладает некомпенсированным спином и высокой латентной токсичностью, хотя его атомная масса среди прочих металлов наименьшая. Он связан диагональным соотношением с Аl, и имеет с ним много общих свойств.
Контакт с солями Be вызывает поражение кожи, а ингаляция Be-содержащих аэрозолей вызывает хронический легочный гранулематоз — бериллиоз. Ион Ве2+ имеет малые размеры, но высокую плотность заряда.
В организме он ингибирует фосфатазы, особенно щелочную, участвующую в процессах образования костей, а также ферменты, активируемые Mg2+ и К+, нарушает репликацию ДНК. Ионы Ве2+ образуют комплексы с тетраэдрическим расположением лигандов (КЧ = 4) с различной стереохимической конфигурацией. Хелатная терапия в случае хронического отравления Be неэффективна.
Магний (Mg) — по свойствам связан диагональным соотношением с Li. Абсолютно необходим для нормальной жизнедеятельности в виде иона Mg2+. В клетках растений в основном хелатирован 4 азотами пиррольиых колец циклической структуры хлорофилла.
В организме животных служит кофактором всех реакций с участием АТФ. Является противоионом для стабилизации двойной спирали ДНК, в каждом звене цепи которой содержатся отрицательно заряженные фосфатные группировки.
Mg2+ также необходим для нервно-мышечной передачи и мышечного сокращения.
Наиболее часто недостаток магния (в норме содержащегося в плазме крови в концентрации 0,9 мМ) наблюдается при алкоголизме, сопровождаясь также накоплением Са2+. При избытке магния развиваются слабовыраженные токсические реакции. Прием больших количеств солей Mg2+ вызывает рвоту.
Интересен факт многократного усиления ферментативной активности креатиикиназы под влиянием единственного парамагнитного изотопа 25Mg с некомпенсированным ядерным спином (+5/2). В природе он составляет 10% атомов магния.
Остальные стабильные изотопы Mg, имеющие нулевой ядерный спин и не реагирующие на магнитное поле, активируют указанный фермент в несколько раз слабее. Стимуляция креатинкиназы важна для стимулирования АТФ-генерирующей деятельности митохондрий, например, при острой ишемии миокарда.
Можно предполагать, что применение парамагнитного изотопа позволит значительно увеличить эффективность препаратов Mg.
Кальций (Са) — содержится в организме в большем количестве, чем все остальные металлы. Более 99% кальция входит в состав костей и зубов в виде нерастворимого фосфата гидроксиапатита Са10(РО4)6(ОН)2 или в виде карбонатапатита Са10(РО4)6СО3.
Са участвует в большинстве процессов метаболизма, поскольку является внутриклеточным медиатором с весьма многообразными функциями. От его концентрации в межклеточной жидкости и в полости эндоплазматического ретикулума (ЭР) зависит конформационное изменение (свертывание) белковых молекул.
Поэтому Са называют главным неорганическим вторичным переносчиком (мессенджером). Дефицит Са проявляется задержкой роста, ломкостью костей, болезнями зубов и другими нарушениями, в частности, усилением всасывания нежелательных или токсичных ионов металлов.
Напротив, высокий уровень Са2+ в диете может подавлять всасывание других металлов, в том числе необходимых организму. Двухвалентный ион кальция в свободном виде цитотоксичен.
Ввиду первостепенной важности Са для жизнедеятельности в организме существует эффективный механизм обеспечения гомеостаза этого металла.
В него входят три гормона: паратиреоидный гормон (паратгормон, парати-рин, ПТГ), кальцитонин и кальцитриол (1,25-дигидроксихолекальциферол). Первый из них — полипептид, секретируемый паращитовидной железой при снижении концентрации Са2+ в плазме.
Он стимулирует высвобождение иона кальция из костей и реабсорбцию («резорбцию») в почках, одновременно подавляя реабсорбцию фосфата.
Калъцитонин — полипептидный йодсодержащий гормон, образующийся в С-клетках щитовидной железы — ингибирует реабсорбцию обоих ионов в крови, снижая их уровень. Подавляет активность остеокластов, в регуляции уровня Са2+ антагонистичен ПТГ.
Кальцитриол — стероидный гормон, образующийся в почках и печени при гидроксилировании витамина D3, причем реакция в этих органах происходит по-разному: в печени — 25-гидроксилирование, а в почках — 1а-гидро-ксилирование 25-дигидрооксихолекальциферола.
Этот процесс регулируется местными цитокинами и катализируется щелочной фосфатовой, секретируемой остеобластами. Она отщепляет фосфат от пирофосфата. В организме кости депонируют Са, РO3-4, а также Mg и Na.
В ткани зубов, в отличие от костной, белковый матрикс содержит также коллагены и протеогликаны (глюкозаминогликаны). Плотность костной ткани увеличивается в присутствии фтора.
Показано также, что фруктоборат кальция в присутствии витамина D3 стимулирует восстановление поврежденных артрозом, артритом, остеопорозом и остеохондрозом костных и хрящевых тканей в суставах. Механизмы этого влияния в деталях не изучены.
Помимо структурной функции, Са контролирует некоторые важнейшие обменные процессы: синтез секреторных или мембранных белков с дисульфидными связями, обеспечивающими правильность трехмерной структуры белка, мышечное сокращение и свертывание крови.
Стронций (Sr) — по А. Ферсману «металл красных огней», используемый в пиротехнике.
В настоящее время применяется в производстве катодно-лучевых трубок для цветного телевидения и мониторов, так как содержащее стронций стекло эффективно задерживает рентгеновское и катодное излучение. Керамика («ферриты») обладает мощными магнитными свойствами.
Является уникальной легирующей присадкой для изготовления морозостойкой стали при производстве рельсов и машин для работы в высоких широтах, за Полярным кругом.
Считается металлом, обычно не вызывающим токсических реакций; содержится в костях (до 0,3 г). При избытке, например, у курильщиков, он подавляет оссификацию, заменяя Са в костях.
Поскольку ковалентный радиус Sr2+ больше, чем у Са2+ (соответственно, 192 и 174 пм), при такой замене кристаллическая решетка апатита костной ткани разрыхляется, что проявляется болезнью Кашина-Бека.
Изотоп 90Sr с периодом полураспада (t1/2) 28 лет радиоактивен и может быть токсичен для организма.
Барий (Ва) — в виде 2-валентного катиона ядовит из-за антагонизма с К+ (но не с Са2+), поскольку ионные радиусы обоих металлов сходны (соответственно, 143 и 133 пм). Ва2+ нарушает мышечное сокращение. Лечение интоксикации состоит во внутривенном введении солей К+.
В организме Ва откладывается в костях и в пигментной оболочке глаз. На примере Ва видно, что для биологического действия ионный радиус металла более важен, чем заряд (ковалентные радиусы Ва2+ и Са2+ составляют, соответственно, 198 и 174 пм).
Как и в случае с Sr, при замене в костях Са на Ва они становятся ломкими, что проявляется в виде остеопороза.
Радий (Ra) —по химическим свойствам близок к Са. Все изотопы этого металла радиоактивны. Биологическая роль связана с радиоактивностью, однако в природных условиях из-за низкого содержания (до 2 пг/сутки) она близка к нулю.
Таблица 2. Содержание в организме, токсическая (ТД) и летальная дозы (ЛД) щелочноземельных металлов
| В земной коре (%) | В океане (%) | В человеческом организме | (ТД.ЛД) | |||
| Среднее (при массе тела 70 кг) | Кости (%) | Мышцы (%) | Кровь (мг/л) | |||
| Be | 2,6*10-4 | (3,5-22)*10-12 | 0,036 мг | 3*107 | 75*10-9 |
Erdalkalimetalle – Wikipedia
| Место в периодической таблице |
| группа | 2 |
| период | |
| 2 | 4 Be |
| 3 | 12 мг |
| 4-й | Около 20 |
| 5 | 38 Sr |
| 6-е | 56 Ba |
| 7-е | 88 Ra |
Когда щелочноземельные металлы являются химические элементы бериллий , магний , кальций , стронций , барий и радий из 2 — й основной группы в Периодической таблице упоминается.
Это блестящие химически активные металлы , в валентной оболочке которых находятся два электрона . Радий — радиоактивный промежуточный продукт ряда естественных распадов .
Название происходит от двух соседних основных групп: щелочных металлов , с которыми они образуют общие сильные основания , и земных металлов , с которыми они связаны, которые плохо растворимы в воде .
характеристики
Типичные щелочноземельные металлы — это кальций , стронций и барий . Бериллий очень мало похож на другие щелочноземельные металлы, поэтому бериллий также относится к группе цинка . Щелочноземельные металлы — это легкие металлы с металлическим блеском. Блеск исчезает быстро в воздухе , потому что металл окисляется . Бериллий и магний довольно устойчивы в сухом воздухе . Магний реагирует с азотом воздуха аналогично литию . Вот почему говорят о косвенном отношении к элементу литию. Щелочноземельные металлы проводят в электрический ток , и каждый имеет два внешних электрона . В соединениях они встречаются почти исключительно в виде двухвалентных катионов .
Типичные щелочноземельные металлы и их соли имеют определенный цвет пламени :
- Кальций и его соли окрашивают пламя в оранжево-красный цвет (622 и 553 нм).
- Стронций и его соли окрашивают пламя в красный цвет (675 и 606 нм).
- Барий и его соли окрашивают пламя в зеленый цвет (524 и 514 нм).
Из-за этого цвета пламени для фейерверков используются соединения щелочноземельных металлов .
Физические свойства
С увеличением атомного числа , атомная масса , атомный радиус и ионный радиус растут .
Кальций имеет самую низкую плотность — 1550 кг / м³. Он увеличивается вверх и особенно вниз, при этом максимальное значение радия достигает 5500 кг / м³.
Твердости Мооса бериллия находится в среднем диапазоне 5,5. Остальные элементы 2-й основной группы имеют низкую твердость, которая уменьшается с увеличением атомного номера.
Первые три щелочноземельных металла, особенно бериллий и кальций, являются очень хорошими электрическими проводниками . Хотя другие элементы этой основной группы отнюдь не плохие лидеры, разница значительна.
Энергия первой ионизации падает с увеличением атомного номера с 9,322 эВ для бериллия до 5,212 эВ для бария. Радий снова имеет немного более высокое значение — 5,279 эВ.
Электроотрицательность падает от 1,57 бериллия до 0,9 для радия.
| Температура плавления (1013 гПа) | 1560 К (1287 ° С) |
923 К (650 ° С) |
1115 К (842 ° С) |
1050 К (777 ° С) |
1000 К (727 ° С) |
973 тыс. (700 ° С) |
| Температура кипения (1013 гПа) | 3243 К (2969 ° С) |
1383 К (1110 ° С) |
1760 К (1487 ° С) |
1653 К (1380 ° С) |
1910 К (1637 ° С) |
2010 К (1737 ° С) |
| Плотность (20 ° C, 1013 гПа) | 1,848 г / см 3 | 1,738 г / см³ | 1,55 г / см 3 | 2,63 г / см 3 | 3,62 г / см 3 | 5,5 г / см³ |
| Твердость по Моосу | 5.5 | 2,5 | 1,75 | 1.5 | 1,25 | |
| Электрическая проводимость | 25 х 10 6 См / м | 22,7 х 10 6 См / м | 29,4 х 10 6 См / м | 7,41 х 10 6 См / м | 2,94 х 10 6 См / м | 1 х 10 6 См / м |
| Атомная масса | 9,012 ед. | 24 305 ю | 40 078 ю | 87,62 ед. | 137 327 u | 226,025 ед. |
| Электроотрицательность | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,9 |
| состав | ||||||
| Кристаллическая система | шестиугольный | шестиугольный | Кубическая площадь с центром | Кубическая площадь с центром | объемно-центрированная кубическая | объемно-центрированная кубическая |
Электронная конфигурация
Электронная конфигурация является [ Х ] у с ². Х обозначает электронную конфигурацию с благородным газом , который является одним периода выше , и периода , в котором элемент расположен должны быть использован для у .
Электронные конфигурации для отдельных элементов:
- Бериллий: [ He ] 2s²
- Магний: [ Ne ] 3s²
- Кальций: [ Ar ] 4s²
- Стронций: [ Kr ] 5s²
- Барий: [ Xe ] 6s²
- Радий: [ Rn ] 7s²
Степень окисления +2, так как два электрона во внешней оболочке могут быть легко отданы. Ионы Me 2+ имеют конфигурацию благородного газа .
Реакции
Щелочноземельные металлы достигают конфигурации благородного газа, высвобождая два своих внешних электрона .
Однако по сравнению со щелочными металлами они менее реактивны, потому что для отщепления двух внешних электронов требуется более высокая энергия ионизации, чем одного, как в случае со щелочными металлами.
Это может быть оправдано тем фактом, что щелочноземельные металлы имеют более высокий заряд ядра и, соответственно, меньшие атомные радиусы, чем щелочные металлы.
В группе щелочноземельных металлов реакционная способность увеличивается сверху вниз, потому что между внешними электронами и ядром атома появляется все больше и больше полных электронных оболочек, и поэтому расстояние между внешними электронами и ядром увеличивается. Это означает, что они менее сильно притягиваются к ядру атома и поэтому могут легче отщепляться.
Щелочноземельные металлы легко испускают свои два внешних электрона , образуя дважды положительно заряженные ионы , и поэтому являются основными металлами , которые окисляются на воздухе . Однако бериллий и магний образуют стабильные оксидные слои и, таким образом, пассивируются, то есть окисляется только их поверхность.
Эта пассивация также означает, что вода очень медленно атакует бериллий и магний. С другой стороны, кальций , стронций и барий реагируют с водой с образованием гидроксидов с образованием водорода . Как и щелочные металлы , щелочноземельные металлы также являются образующими основания .
В противном случае щелочноземельные металлы хорошо реагируют с неметаллами , например Б. с кислородом или с галогенами .
В следующих уравнениях реакции Me обозначает щелочноземельный металл.
2Мне+О2⟶2MeO{ Displaystyle { ce {2Me + O2 -> 2MeO}}}
Барий также образует перекись бария .
Мне+ЧАС2⟶MeH2{ displaystyle { ce {Me + H2 -> MeH2}}}
Образующиеся гидриды имеют ионную структуру.
Мне+2ЧАС2О⟶Мне(ОЙ)2+ЧАС2{ Displaystyle { ce {Me + 2H2O -> Me (OH) 2 + H2}}}
- Реакция с галогенами (на примере хлора ):
Мне+Cl2⟶MeCl2{ Displaystyle { ce {Me + Cl2 -> MeCl2}}}
Реакционная способность , которая увеличивается с атомным номером, может быть четко прослежена в поведении реакции:
ссылки
Бериллий — единственный щелочноземельный металл, который образует преимущественно ковалентные связи. Остальные элементы 2-й основной группы встречаются почти исключительно в виде ионов Me 2+ . В таблице представлен приблизительный обзор наиболее важных подключений:
Другие
BaO2+ЧАС2ТАК4-й⟶BaSO4-й+ЧАС2О2{ displaystyle { ce {BaO2 + H2SO4 -> BaSO4 + H2O2}}}
Жесткость воды
Растворенные ионы кальция и магния в основном определяют жесткость воды . Например, водорастворимый гидрокарбонат кальция (Ca (HCO 3 ) 2 ) превращается в малорастворимое соединение карбонат кальция (CaCO 3 ), которое также известно как « накипь »:
Приблизительно(HCO3)2⟶CaCO3+CO2↑+ЧАС2О{ Displaystyle { ce {Ca (HCO3) 2 -> CaCO3 + CO2 (^) + H2O}}}
Обратной реакции препятствует улетучивание диоксида углерода из раствора , накипь оседает в кастрюлях и т. Д. Таким образом, гидрокарбонат кальция относится к категории временной жесткости воды.
Другое свойство ионов щелочноземельных металлов, но особенно Ca 2+ и Mg 2+ , заключается в образовании нерастворимых соединений с мылом . Поскольку мыла с химической точки зрения являются солями , они состоят из катионов и анионов .
Анионы всегда представляют собой высшие жирные кислоты , а в качестве катионов обычно используются ионы щелочных металлов .
Ионы щелочноземельных металлов заменяют их и, таким образом, образуют нерастворимые соединения, которые обобщены термином « известковое мыло ».
Вхождение
Щелочноземельные металлы участвуют в структуре земной коры, включая воздушную и водную оболочку, следующим образом (данные в% по массе):
- 2,7 · 10 −4 % бериллия
- 2,0 х 10 0 % магния
- 3,4 х 10 0 % кальция
- 3,6 · 10 -2 % стронция
- 4,0 · 10 -2 % бария
- 1,0 х 10-10 % радия
Щелочноземельные металлы никогда не встречаются в природе и в основном связаны в виде силикатов , карбонатов или сульфатов .
Бериллийсодержащие драгоценные камни
Хотя бериллий встречается очень редко, он содержится в 30 различных минералах . К наиболее известным относятся:
доказательство
Щелочноземельные металлы обнаруживаются в основном спектральным анализом на основе характерных спектральных линий . Влажные химические методы, такие как осаждение в виде карбонатов , сульфатов или гидроксидов , теперь используются только в демонстрационных целях.
| нет | Be (OH) 2 осаждается | BeCO 3 растворим | BeSO 4 растворим | BeC 2 O 4 осаждается | BeCrO 4 растворим |
| нет | Mg (OH) 2 осаждается | MgCO 3 осаждается | MgSO 4 растворим | MgC 2 O 4 растворим | MgCrO 4 растворим |
| кирпично красный | Ca (OH) 2 осаждается | CaCO 3 осаждается | CaSO 4 осаждается | CaC 2 O 4 осаждается | CaCrO 4 осаждается |
| интенсивно красный | Sr (OH) 2 осаждается | SrCO 3 осаждается | SrSO 4 осаждается | SrC 2 O 4 растворим | SrCrO 4 осаждается |
| желтый зеленый | Ba (OH) 2 растворим | BaCO 3 осаждается | BaSO 4 осаждается | BaC 2 O 4 растворим | BaCrO 4 осаждается |
| кармин | Ra (OH) 2 растворим | RaCO 3 терпит неудачу | Расо 4 выпадает в осадок | RaC 2 O 4 осаждается | RaCrO 4 осаждается |
Инструкции по технике безопасности
На воздухе стабильны только бериллий и магний. Остальные элементы этой основной группы должны храниться в парафиновом масле или инертном газе . Хранение в спирте возможно только для бериллия, магния и кальция, так как барий уже отщепляет от них водород и вступает в реакцию с алкоголем .
Ба+2Р.-ОЙ⟶Ба2+ (Р.-О-)2+ЧАС2↑{ Displaystyle { ce {Ba + 2 R-OH -> Ba2 + (RO ^ -) _ 2 + H2 (^)}}}
В мелкодисперсной форме магний легко воспламеняется; Порошки кальция, стронция и бария могут самовоспламеняться на воздухе. Сжигание щелочноземельных металлов не должны никогда быть погашен с водой!
Щелочноземельные металлы являются сильными восстановителями, способными даже выделять щелочные металлы из своих соединений. Эти реакции сильно экзотермичны ; при определенных обстоятельствах это может даже привести к взрыву .
Бериллий — яд для легких , хотя механизм действия до сих пор в значительной степени неизвестен. Его соединения также являются канцерогенными.
Соединения бария очень токсичны, если они легко растворяются в воде. 1 грамм может быть смертельным.
Радий чрезвычайно вреден для здоровья из-за своей радиоактивности, но до 1931 года вода с добавлением радия продавалась для питья под торговым названием Radithor . Число раненых или погибших, которые, как стальной магнат Эбен Байерс , поглотили Радитор , неизвестно.
веб ссылки
литература
- Ганс Брейер: dtv-Atlas Chemie (Том 1: Общая и неорганическая химия) (2000), ISBN 3-423-03217-0 , стр. 94-113.






