- Радиус атома
- Период, группа и электронная конфигурация
- Длина связи
- Металлические и неметаллические свойства
- Основные и кислотные свойства
- Восстановительные и окислительные свойства
- Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
- Высшие оксиды и летучие водородные соединения (ЛВС)
- Таблица Менделеева для чайников – HIMI4KA
- Периодический закон
- Группы и периоды Периодической системы
- Свойства таблицы Менделеева
- Лантаниды (редкоземельные элементы) и актиниды
- Галогены и благородные газы
- Переходные металлы
- Металлоиды
- Постпереходными металлами
- Неметаллы
- Периодическая таблица химических элементов Д.И.Менделеева
- Металлы, неметаллы, металлоиды
- Металлы
- Неметаллы
- Металлоиды
- Периоды и группы
- Щелочные металлы
- Щелочноземельные металлы
- Галогены
- Инертные (благородные) газы
- Валентные элементы в группах
- Правила чтения и использования таблицы Менделеева
- Таблица Менделеева — краткое описание
- Пустые ячейки в таблице
- Структура таблицы
- Группы элементов с похожими свойствами
- Цветовое определение групп
- Различение металлов, металлоидов и неметаллов
- Обозначение элементов
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
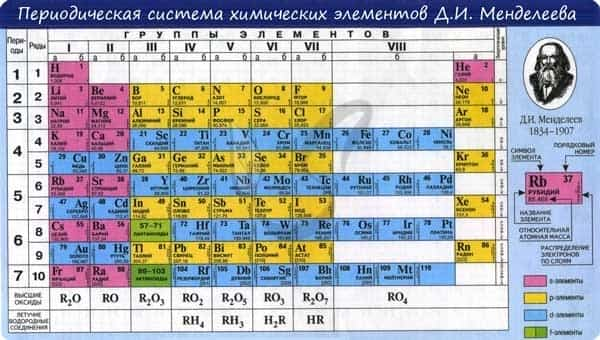
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
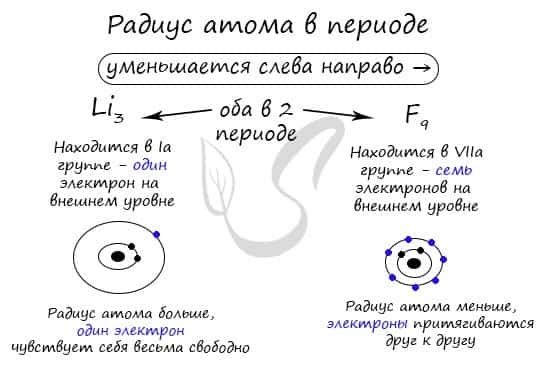
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
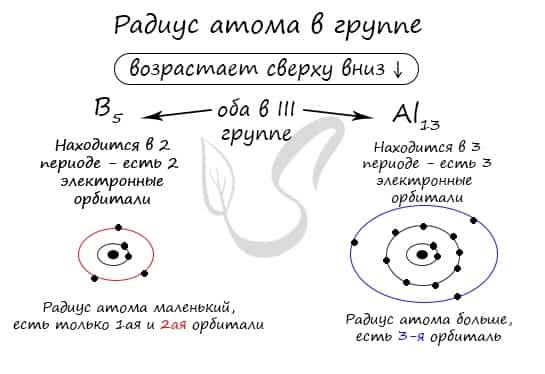
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже ?
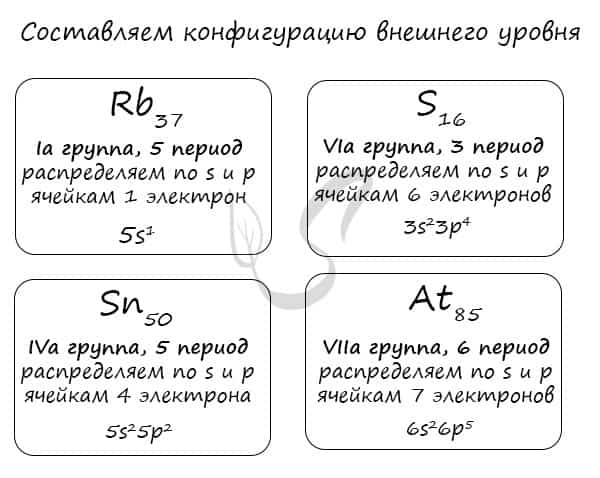
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
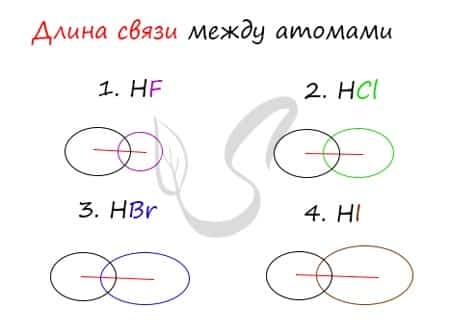
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
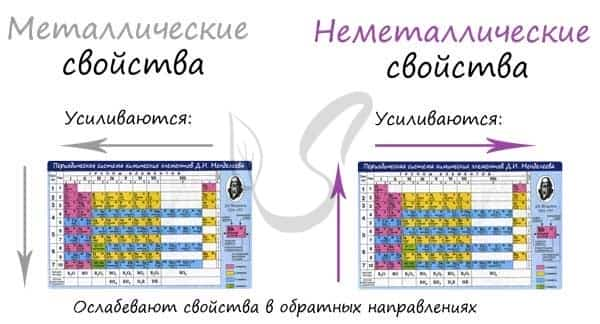
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
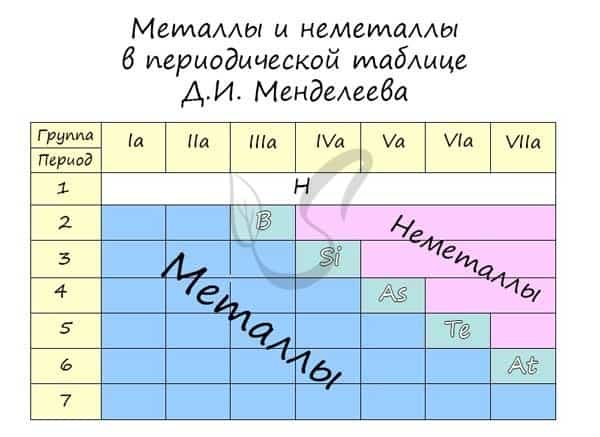
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
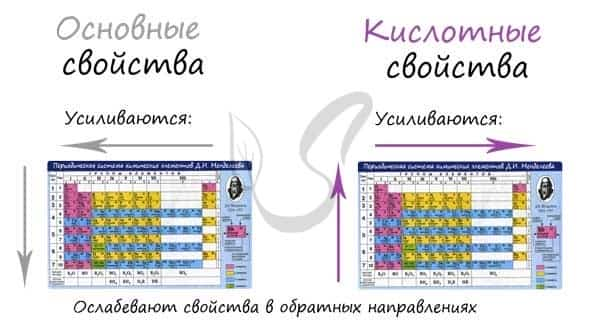
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить ?
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории.
Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная.
Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
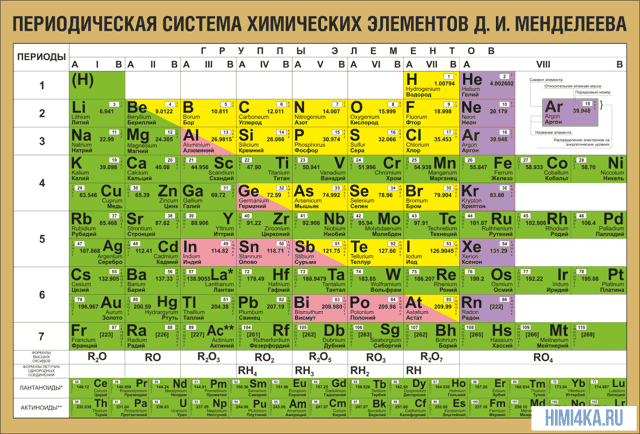 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп.
Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов.
Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений.
В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
- Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
- Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
- В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию.
Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами.
По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов.
Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке.
В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е.
ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску.
В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке.
Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Периодическая таблица химических элементов Д.И.Менделеева
В природе существует очень много повторяющихся последовательностей:
- времена года;
- время суток;
- дни недели…
В середине 19 века Д.И.Менделеев заметил, что химические свойства элементов также имеют определенную последовательность (говорят, что эта идея пришла ему во сне).
Итогом чудесных сновидений ученого стала Периодическая таблица химических элементов, в которой Д.И. Менделеев выстроил химические элементы по возрастанию атомной массы.
В современной таблице химические элементы выстроены по возрастанию атомного номера элемента (количество протонов в ядре атома).
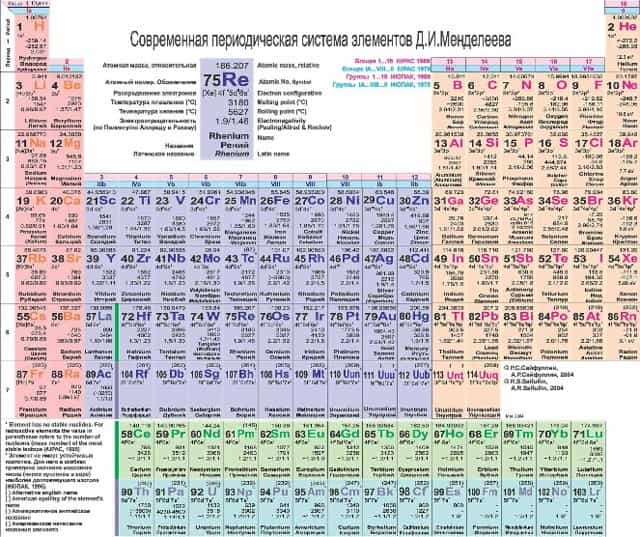
Смотреть таблицу в натуральную величину.
Атомный номер изображен над символом химического элемента, под символом — его атомная масса (сумма протонов и нейтронов). Обратите внимание, что атомная масса у некоторых элементов является нецелым числом! Помните об изотопах! Атомная масса — это средневзвешенное от всех изотопов элемента, встречающихся в природе в естественных условиях.

Под таблицей расположены лантаноиды и актиноиды.
| Горизонтальные строки Периодической таблицы называют периодами. Периоды имеют номера от 1 до 7. |
|
Вертикальные столбцы Периодической таблицы называют группами (семействами). Для нумерации групп изначально применялись римские цифры и буквы (IA, IIA, IIIB…). Ныне для обозначения групп используют номера от 1 до 18. |
Металлы, неметаллы, металлоиды
Металлы
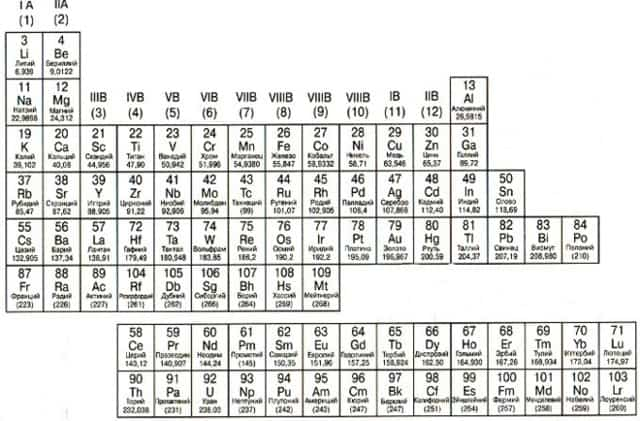
Металлы расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.
Общая характеристика металлов…
Неметаллы
Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Общая характеристика неметаллов…
Металлоиды
Между металлами и неметаллами находятся полуметаллы (металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.
Периоды и группы
Как уже говорилось выше, периодическая таблица состоит из семи периодов. В каждом периоде атомные номера элементов увеличиваются слева направо.
Свойства элементов в периодах изменяются последовательно: так натрий (Na) и магний (Mg), находящиеся в начале третьего периода, отдают электроны (Na отдает один электрон: 1s22s22p63s1; Mg отдает два электрона: 1s22s22p63s2). А вот хлор (Cl), расположенный в конце периода, принимает один элемент: 1s22s22p63s23p5.
| Свойства химических элементов в пределах одного периода различаются. |
В группах же, наоборот, все элементы обладают одинаковыми свойствами. Например, в группе IA(1) все элементы, начиная с лития (Li) и заканчивая францием (Fr), отдают один электрон. А все элементы группы VIIA(17), принимают один элемент.
Некоторые группы настолько важны, что получили особые названия. Эти группы рассмотрены ниже.
Щелочные металлы
Группа IA(1). Атомы элементов этой группы имеют во внешнем электронном слое всего по одному электрону, поэтому легко отдают один электрон.
Наиболее важные щелочные металлы — натрий (Na) и калий (K), поскольку играют важную роль в процессе жизнедеятельности человека и входят в состав солей.
Электронные конфигурации:
- Li — 1s22s1;
- Na — 1s22s22p63s1;
- K — 1s22s22p63s23p64s1
Подробнее о щелочных металлах см. Атомы элементов I группы: общая характеристика…
Щелочноземельные металлы
Группа IIA(2). Атомы элементов этой группы имеют во внешнем электронном слое по два электрона, которые также отдают во время химических реакций. Наиболее важный элемент — кальций (Ca) — основа костей и зубов.
Электронные конфигурации:
- Be — 1s22s2;
- Mg — 1s22s22p63s2;
- Ca — 1s22s22p63s23p64s2
Подробнее о щелочноземельных металлах см. Атомы элементов II группы: общая характеристика…
Галогены
Группа VIIA(17). Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до «полного комплекта» как раз не хватает одного электрона.
Наиболее известные элементы этой группы: хлор (Cl) — входит в состав соли и хлорной извести; йод (I) — элемент, играющий важную роль в деятельности щитовидной железы человека.
Электронная конфигурация:
- F — 1s22s22p5;
- Cl — 1s22s22p63s23p5;
- Br — 1s22s22p63s23p64s23d104p5
Подробнее о галогенах см. Атомы элементов VII группы: общая характеристика…
Инертные (благородные) газы
Группа VIII(18). Атомы элементов этой группы имеют полностью «укомплектованный» внешний электронный слой. Поэтому им «не надо» принимать электроны. И отдавать их они «не хотят». Отсюда — элементы этой группы очень «неохотно» вступают в химические реакции. Долгое время считалось, что они вообще не вступают в реакции (отсюда и название «инертный», т.е. «бездействующий»). Но химик Нейл Барлетт открыл, что некоторые из этих газов при определенных условиях все же могут вступать в реакции с другими элементами.
Электронные конфигурации:
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — 1s22s22p63s23p64s23d104p6
Подробнее об инертных (благородных) газах см. Атомы элементов 0 группы: общая характеристика…
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
У щелочных металлов — по 1 валентному электрону:
- Li — 1s22s1;
- Na — 1s22s22p63s1;
- K — 1s22s22p63s23p64s1
У щелочноземельных металлов — по 2 валентных электрона:
- Be — 1s22s2;
- Mg — 1s22s22p63s2;
- Ca — 1s22s22p63s23p64s2
У галогенов — по 7 валентных электронов:
- F — 1s22s22p5;
- Cl — 1s22s22p63s23p5;
- Br — 1s22s22p63s23p64s23d104p5
У инертных газов — по 8 валентных электронов:
- Ne — 1s22s22p6;
- Ar — 1s22s22p63s23p6;
- Kr — 1s22s22p63s23p64s23d104p6
| Римский номер столбца группы — это количество валентных электронов у всех элементов данной группы. |
Дополнительную информацию см. в статье Валентность и в Таблице электронных конфигураций атомов химических элементов по периодам.
Обратим теперь свое внимание на элементы, расположенные в группах с символов В. Они расположены в центре периодической таблицы и называются переходными металлами.
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали:
- Sc — 1s22s22p63s23p64s23d1;
- Ti — 1s22s22p63s23p64s23d2
Отдельно от основной таблицы расположены лантаноиды и актиноиды — это, так называемые, внутренние переходные металлы. В атомах этих элементов электроны заполняют f-орбитали:
- Ce — 1s22s22p63s23p64s23d104p64d105s25p64f15d16s2;
- Th — 1s22s22p63s23p64s23d104p64d105s25p64f145d106s26p66d27s2
Подробнее см. Атомы переходных элементов (металлов)…
Правила чтения и использования таблицы Менделеева
Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе, что значительно облегчит решение задач. Более того, периодическую систему можно использовать на ЕГЭ, и это может стать серьезным подспорьем. Главное — уметь грамотно ей пользоваться. Как это делать — читайте в нашей статье.
Таблица Менделеева — краткое описание
Таблица Менделеева — это графическое выражение периодического закона, который открыл русский ученый Д.И. Менделеев в 1869 году.
Периодическая система представляет собой классификацию химических элементов, которая основана на зависимости свойств химических элементов от заряда их атомного числа.
Первоначальный вариант предполагал зависимость свойств веществ от их атомной массы.
Существуют три формата таблицы Менделеева:
- короткий (короткопериодный);
- длинный (длиннопериодный);
- сверхдлинный.
Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного утвержден длинный вариант таблицы Менделеева, а короткий вариант официально отменен в 1989 году.
Источник: en.ppt-online.org
Пустые ячейки в таблице
Создав периодическую таблицу в 1869 году на базе уже известных миру 63-х химических элементов, Менделеев предсказал открытие новых и оставил для них пустые ячейки в таблице. Русский ученый оказался прав.
Гипотеза Менделеева в скором времени была подтверждена открытиями других ученых: в 1875 году был открыт галлий, в 1879 — скандий, в 1886 — германий. На 2022 год в таблицу собраны 118 известных элементов.
Последние из них открыты в 2016 году: ученые обнаружили нихоний, московий, теннессин и оганесон.
Структура таблицы
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Группы элементов с похожими свойствами
Группа — это вертикальная колонка в периодической таблице, определяющая основные физико-химические свойства элементов. Вещества, принадлежащие к одной и той же группе, обладают похожими химическими особенностями и демонстрируют одинаковую закономерность в изменении своих свойств по мере увеличения атомного числа.
Всем группам (колонкам таблицы) присваиваются номера от 1 до 18 — слева направо (от щелочных металлов к благородным газам). Такая система вступила в силу в 1988 году по инициативе ИЮПАК. Все прежние названия групп, которые использовали в разных странах, больше не употребляются.
Элементы, которые относятся к одной группе, показывают следующие закономерности по направлению сверху вниз:
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
Вещества в каждой группе делятся на те, которые находятся в главной подгруппе и те, которые входят в побочную подгруппу. В таблице составляющие побочной группы выделяются синим цветом, к ней относятся элементы только больших периодов (начинаются с четвертого периода). В главную подгруппу могут входить элементы и малых, и больших периодов (начинаются с первого или второго периодов).
Различение металлов, металлоидов и неметаллов
Все химические элементы в зависимости от их химических и физических свойств можно разделить на 3 типа:
- металлы;
- металлоиды;
- неметаллы.
Характеристика металлов (например, медь, алюминий, золото):
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Их характеризуют:
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Их основные черты:
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.






