- Понятие об электродном потенциале
- Урок 8. химические источники тока. ряд стандартных электродных потенциалов — Химия — 11 класс — Российская электронная школа
- Стандартный электродный потенциал | это… Что такое Стандартный электродный потенциал?
- Вычисление стандартных электродных потенциалов
- Таблица стандартных электродных потенциалов
- Нестандартные условия
- См. также
- Литература
- Ссылки
- ЭЛЕКТРО́ДНЫЙ ПОТЕНЦИА́Л
- Стандартный электродный потенциал
Потенциал электрода или электродный потенциал металла — это разность потенциалов, которая возникает на границе раздела фаз металл-раствор при погружении металла в раствор электролита в результате взаимодействия поверхностных ион-атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. Это связано с образованием двойного электрического слоя, то есть несимметричного распределения заряженных частиц у границы раздела фаз.

Явления растворения металлов в электролитах используются в химических источниках электроэнергии. Металлическая пластина, опушенная в раствор своей же соли, в той или иной мере стремится в ней раствориться. Это стремление иногда называется упругостью растворения металла.
Цинковая пластина, опущенная в раствор сернокислого цинка ZnSO4, отдает в раствор частицы цинка в виде положительно заряженных ионов.
Вследствие того, что атомы пинка уходят в виде положительно заряженных ионов, на цинковой пластине образуется избыток свободных электронов и она заряжается отрицательно, а в слое жидкости вблизи поверхности цинка образуется избыток положительных ионов и, следовательно, этот слой заряжается положительно. Таким путем на границе жидкости и металла возникает двойной электрический слой из пространственно разделенных зарядов противоположного знака.
Эти заряды будут противодействовать дальнейшему переходу металла в раствор — отрицательные пластины удерживают положительный ион металла, а положительный заряд электролита отталкивает ион металла назад на пластину.
Иными словами, электрическое поле двойного слоя на границе металл — жидкость противодействует дальнейшему переходу ионов металла в раствор.
Устанавливается равновесие между химическими по своей природе силами стремления металла перейти в раствор и электрическими силами, им противодействующими.
Схема образования двойного электрического слоя на границе металла и электролита
Таким образом, вследствие растворения в электролите металлический электрод приобретает по отношению к электролиту определенный электродный (иначе электрохимический) потенциал, зависящий от материала электрода и состава электролита.
Однако электродные потенциалы могут иметь положительное значение. Это имеет место в тех случаях, когда положительные ионы раствора переходят на электрод, заряжая его положительно, а слой электролита — отрицательно, например, когда медная пластина погружена в достаточно концентрированный раствор сернокислой меди (CuSO4).
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
Скачок потенциала на границе электрод-раствор может служить мерой окислительно-восстановительной способности системы.
Однако невозможно произвести измерение такого скачка потенциала или, что то же, разности потенциалов между двумя фазами. Но можно произвести измерение э. д. с.
элементов, составленных из интересующих нас электродов и какого-нибудь одного (одинакового во всех случаях) электрода, потенциал которого условно принят за нуль.
Измеренная э. д. с. будет характеризовать окислительно-восстановительную способность интересующего нас электрода относительно некоторого условного нуля. Полученная таким способом величина называется собственным потенциалом металла.
Чтобы измерить электродный потенциал любого металла, необходимо поместить в электролит второй электрод, который и свою очередь будет обладать определенным электродным потенциалом, зависящим от его материала. Следовательно, непосредственно измерить можно только алгебраическую сумму двух электродных потенциалов.
По этой причине электродные потенциалы различных материалов определяются по отношению к стандартному (водородному электроду, потенциал которого условно принимают за нуль.
Для измерения могут применяться и другие электроды сравнения, потенциал которых относительно водородного стандартного электрода известен. Этот потенциал также находят на основании измерения э. д. с. цепи, составленной из выбранного электрода сравнения и стандартного водородного электрода.
Если изучаемый электрод в паре со стандартным водородным электродом является отрицательным, то собственному потенциалу приписывается знак «-«, в противном случае — знак «+».
Например, измеренный таким образом в растворе соответствующей соли металла электродный потенциал цинка -0,76 В, меди +0,34 В, серебра +0,8 В. Э. д. с, которую дает элемент, определяется вычитанием потенциала более отрицательного из потенциала более положительного.
Если в соответствующий электролит помещены две пластины из металлов, имеющих различный электродный потенциал, например, в раствор серной кислоты (H2SO4) помещены цинковая (Zn) и медная (Сu) пластины, то вольтметр, присоединенный к этим пластинам, покажет между ними напряжение немного более 1 В.
Это напряжение, называемое в данном случае э. д. с. гальванической пары, будет обусловлено разностью электродных потенциалов меди, обладающей небольшим положительным потенциалам, и цинка, обладающего значительным отрицательным потенциалом. Такое устройство является простейшим гальваническим элементом — элементом Вольта.
В гальваническом элементе происходит превращение химической энергии в электрическую и с его помощью можно совершить электрическую работу за счет энергии химической реакции.

Измерение э. д. с. гальванических элементов необходимо производить при отсутствии тока в цепи элемента. В противном случае измеренная э. д. с. будет меньше, чем величина, определяемая как разность равновесных потенциалов обоих электродов.
Действительно, равновесному потенциалу отвечает определенная концентрация электронов на электродах: на более положительном она ниже, на более отрицательном выше.
Сообразно с этим различно и строение той части двойного слоя, которая расположена в растворе.
Измерение э. д. с. элемента без протекания тока обычно производится компенсационным методом. Для осуществления его необходимо иметь некоторый эталон э. д. с. Таким эталоном служит так называемый нормальный элемент. Чаще всего пользуются ртутно-кадмиевым нормальным элементом Вестона, э. д. с. которого равна 1,01830 В при 20 °С.
Понятие об электродном потенциале
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита.
Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода).
Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
Me Á Men+ + nē.
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора.
Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом.
В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.
В результате перераспределения зарядов на границе «металл – раствор» возникает двойной электрический слой (рис. 9.1) и возникает скачок потенциала между металлом и раствором.
| Рис. 9.1. Двойной электрический слой на границе раздела «металл – раствор» |
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д.
Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю.
В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j0)называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙105 Па.
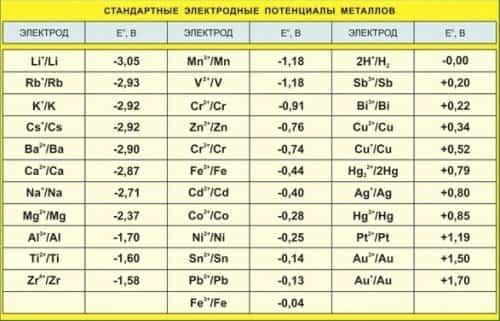
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов.
Чем меньше значение φ0, тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется.
Чем больше значение φ0, тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Таблица 9.1
Стандартные электродные потенциалы φ0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li+/Li | –3,05 | Cd2+/Cd | –0,40 |
| Rb+/Rb | –2,93 | Co2+/Co | –0,28 |
| K+/K | –2,92 | Ni2+/Ni | –0,25 |
| Ba2+/Ba | –2.90 | Sn2+/Sn | –0,136 |
| Ca2+/Ca | –2,87 | Pb2+/Pb | –0,127 |
| Na+/Na | –2,71 | 2H+/H | 0,00 |
| Mg2+/Mg | –2,37 | Sb3+/Sb | +0,20 |
| Al3+/Al | –1,70 | Bi3+/Bi | +0,22 |
| Ti2+/Ti | –1,60 | Cu2+/Cu | +0,34 |
| V2+/V | –1,18 | Ag+/Ag | +0,85 |
| Mn2+/Mn | –1,18 | Hg2+/Hg | +0,85 |
| Zn2+/Zn | –0,76 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | –0,74 | Au3+/Au | +1,5 |
| Fe2+/Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
| , | (9.1) |
- где T – температура, К;
- F – число Фарадея, равное 96 500 Кл/моль;
- R – универсальная газовая постоянная, равная 8,314 Дж/(моль. К);
- n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
При T = 298 К формула Нернста приобретает вид:
| . | (9.2) |
Урок 8. химические источники тока. ряд стандартных электродных потенциалов — Химия — 11 класс — Российская электронная школа
Химия, 11 класс
Урок № 8. Химические источники тока. Ряд стандартных электродных потенциалов
Перечень вопросов, рассматриваемых в теме: урок посвящён устройству и принципу работы гальванического элемента и других химических источников тока. Учащиеся получат представление о ряде электродных потенциалов и возможностях его использования.
- Глоссарий
- Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
- Электрод — электрический проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником — электролитом. В электрохимии — это часть электрохимической системы, включающая в себя проводник и окружающий его раствор
- Анод — электрод, на котором происходит процесс окисления
- Катод — электрод, на котором происходит процесс восстановления
- Аккумулятор — химический источник тока многоразового действия
- Топливный элемент — устройство, обеспечивающее прямое преобразования химической энергии в электрическую
- Электрохимия — наука, которая изучает закономерности взаимного превращения химической и электрической форм энергии
- Ряд стандартных электродных потенциалов — ряд металлов, расположенных в порядке возрастания значения их стандартных потенциалов
- Стандартные условия — температура 25оС, концентрация солей 1моль/л, давление 0,1МПа
- Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Химические источники тока
Рассмотрим знакомую нам окислительно-восстановительную реакцию. В раствор сульфата двухвалентной меди опустим цинковую пластинку. Со временем на поверхности цинка образуется красноватая пленка кристаллической меди. Синяя окраска раствора постепенно ослабевает. Это говорит о том, что протекает химическая реакция.
CuSO4 + Zn = ZnSO4 + Cu
Cu2+ + Zn = Zn2+ + Cu
Молекулы воды отрывают ион цинка. Отдавая электроны, цинк является восстановителем. Ион меди – окислитель — принимает электроны. Электроны передаются от цинка к меди в месте соприкосновения металлов.
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Давайте немного изменим условия проведения реакции. Цинковую пластинку опустим в сосуд с раствором сульфата цинка. Медную поместим в другой сосуд с раствором сульфата меди. Соединим пластинки с помощью металлического проводника.
Теперь на цинковой пластинке идет окисление атомов цинка, а на медной восстанавливаются ионы меди. Электроны для их восстановления передаются теперь не напрямую, а по проводнику.
Направленное движение электронов по этой внешней цепи и есть не что иное, как электрический ток.
Таким образом, произошло превращение энергии, полученной в результате химической реакции в электрическую. Устройство, в котором это осуществилось, получило название гальванический элемент.
Металлические пластинки или стержни называются электродами. Электроны перемещаются по внешней цепи от анода (цинка) к катоду (меди).
Образовавшиеся на аноде ионы цинка выходят в раствор и придают ему избыточный положительный заряд. В это же время у катода катионы меди восстанавливаются (принимают электроны), а оставшиеся в растворе анионы SO42- заряжают раствор отрицательно. Это препятствует дальнейшему течению процесса.
Чтобы не допустить этого, соединим сосуды стеклянной трубкой, которую заполним раствором хлорида калия с желатином. Теперь анионы будут двигаться в сторону цинка, а катионы – наоборот. Так будет поддерживаться электронейтральность растворов.
Гальванический элемент будет продолжать работу до полного растворения цинкового электрода или до восстановления всех ионов меди.
Впервые установку, в которой химическая реакция породила электрический ток, собрал Алессандро Вольта в 1800 году. Название «гальванический элемент» она получила позднее.
Теперь наука, которая изучает химические процессы, проходящие под действием электрического тока, а также процессы, в результате которых энергия химических реакций преобразуется в электрическую энергию, называется электрохимия.
Химические источники тока применяются очень широко. Знакомые нам «батарейки» — это разные варианты гальванических элементов. К сожалению, разрядившаяся батарейка уже не может быть восстановлена.
Этого недостатка лишены аккумуляторы, которые тоже представляют собой химические источники тока. Они устроены так, что израсходовав в процессе работы материалы электродов и электролит, способны вновь восстановить рабочие свойства после зарядки.
В свинцовом аккумуляторе чередуются решетчатые пластины, заполненные губчатым свинцом и диоксидом свинца. Электролитом служит серная кислота. Во время работы аккумулятора металлический свинец окисляется, а диоксид свинца восстанавливается.
Pb + SO42- — PbSO4 + 2e-
PbO2 + SO42- + 4H+ + 2e- = PbSO4 + 2H2O
Когда аккумулятор заряжают, то подключают его таким образом, чтобы ток шёл в направлении, противоположном тому, в котором двигались электроны во время работы. Благодаря этому, процессы окисления и восстановления на электродах поворачивают вспять. Теперь протекают обратные реакции, в результате которых снова появляются свинец, диоксид свинца и серная кислота.
- разрядка
- Pb + PbO2 + 2H2SO4 ⇄ 2PbSO4 + 2H2O
- зарядка
- Аккумулятор снова готов к работе.
Еще один источник преобразования химической энергии в электрическую – топливный элемент. Он подобен гальваническому элементу с той лишь разницей, что реагенты постоянно поступают в него извне. Поэтому он не разряжается и не требует электричества для повторной зарядки. Примером может служить водородный топливный элемент, перспективный для водородной энергетики.
Ряд стандартных электродных потенциалов
Вернемся к электродам и посмотрим поближе, что происходит там, где металл граничит с раствором.
Молекулы воды поляризованы и способны отрывать ионы металла. Удерживающиеся на поверхности электроны образуют отрицательно заряженный слой. К нему притягиваются из раствора катионы, образуя второй слой — положительный. Возникающую в двойном слое разность потенциалов называют электродным потенциалом, но определить его величину напрямую невозможно.
Однако есть такой электрод, которым пользуются для сравнения электродных потенциалов разных металлов.
Он сделан из платины, но называется водородным, потому что водород пропускается через кислоту, в которой находится электрод.
Благодаря платине, выступающей как катализатор, часть молекул водорода распадаются на атомы, которые окисляются на границе с кислотой. Одновременно идет и обратная реакция.
- H2 ⇄2H+ + 2e
- Разность потенциалов, возникающая в двойном электрическом слое водородного электрода, условно принимается за ноль.
- Потенциал металла, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и температуре раствора, равной 25 оС, называют стандартным электродным потенциалом металла.
Соберём гальванический элемент, соединив электрод из исследуемого металла со стандартным водородным электродом. Электролитом для металлического электрода послужит раствор соли этого металла, а для водородного, как всегда, кислота.
Зная, что электродвижущая сила вычисляется как разность потенциалов двух электродов, и, подставив ноль в случае водородного электрода, мы видим, что измеренная ЭДС и будет потенциалом исследуемого электрода.
Металлы, расположенные в порядке возрастания значений их стандартных потенциалов, составляют электрохимический ряд напряжений металлов или ряд стандартных электродных потенциалов. Еще одно название – ряд активности металлов.
Имея в своем распоряжении ряд напряжений, мы можем характеризовать химические свойства металлов:
- Чем меньше значение электродного потенциала металла, тем больше его восстановительная способность;
- Каждый металл, начиная с магния, вытесняет все следующие за ним металлы из растворов их солей (это касается металлов, не взаимодействующих с водой);
- Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (кроме азотной).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на использование электрохимического ряда напряжений металлов
Условие задачи: Учитель загадал металл и дал ученикам три подсказки:
- из соли ртути он вытеснит ртуть;
- но не вытеснит водород из растворов кислот;
- вам отгадать поможет вполне таблица, висящая на стене.
- — Конечно, это ___, — засмеялись ученики, — только один металл подходит под ваше описание.
- Вставьте в текст название металла.
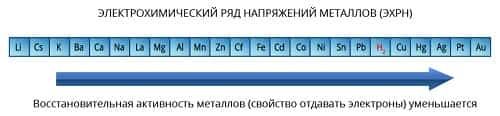
Шаг первый: из таблиц выбираем «Электрохимический ряд напряжений металлов»
Шаг второй: находим металлы левее ртути, т.к. они вытесняют ртуть из растворов солей.
Шаг третий: из выбранных металлов находим те, что расположены правее водорода, т.к. они не вытесняют водород из растворов кислот.
- Этим условиям отвечает только один металл – медь.
- Ответ: Cu
- 2. Решение задачи на расчеты по уравнению реакции
Условие задачи: Мастер решил покрыть железную фигурку слоем меди и поместил её в сосуд с раствором медного купороса. Он знал, что на изготовление фигурки было использовано ровно 120 г железа. Когда мастер достал фигурку из раствора, её масса оказалась уже 121,56 г. Сколько граммов меди осело на фигурке?
- Шаг первый: Запишем уравнение реакции
- CuSO4 + Fe = FeSO4 + Cu
- Шаг второй: Выразим массу железа через массу меди.
- Из уравнения реакции следует, что количество вещества выделившейся меди равно количеству вещества прореагировавшего железа
- m(Fe)/M(Fe) = m(Cu)/M(Cu)
- m(Fe)/56 = m(Cu)/64, тогда
- m(Fe) = 56m(Cu)/64
- Шаг третий: Рассчитаем массу меди.
- Так как масса пластинки уменьшилась на величину массы прореагировавшего железа и увеличилась на величину массы выделившейся меди, можно записать равенство:
- 120 – m(Fe) + m(Cu) = 121,56
- m(Cu) – m(Fe) = 1,56
- m(Cu) — 56m(Cu)/64 = 1,56
- 0,125m(Cu) = 1,56
- m(Cu) = 12,48 г
- Ответ: 12,48
Стандартный электродный потенциал | это… Что такое Стандартный электродный потенциал?
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки.
Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки.
Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов.
Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
- Например:
- Fe3+ + 3e− → Fe(тв) −0.036 В
- Fe2+ + 2e− → Fe(тв) −0.44 В
- Для получения третьего уравнения:
- Fe3+ + e− → Fe2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель.
Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр.
, H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔGo должна быть отрицательной, в соответствии со следующим уравнением:
ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Электрохимический потенциал
- Равновесный электродный потенциал
- Уравнение Нернста
- Электрохимическая ячейка
- Гальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Ссылки
ЭЛЕКТРО́ДНЫЙ ПОТЕНЦИА́Л
Авторы: О. А. Петрий
ЭЛЕКТРО́ДНЫЙ ПОТЕНЦИА́Л, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение Э. п. обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрич. слоя. На границе между металлич.
электродом и раствором электролита пространственное разделение зарядов связано со следующими явлениями: переносом ионов из металла в раствор (или наоборот) в ходе установления электрохимич. равновесия; электростатич.
(кулоновской) адсорбцией ионов из раствора на поверхность металла; смещением электронного газа металла относительно положительно заряженного ионного остова кристаллич. решётки; специфич. (некулоновской) адсорбцией ионов или полярных молекул растворителя на электроде.
Последние два явления приводят к тому, что Э. п. не равен нулю даже при условиях, когда свободный заряд поверхности металла равен нулю.
Абсолютную величину Э. п. отд. электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого электрода сравнения. Э. п. равен эдс электрохимич.
цепи, составленной из исследуемого электрода и электрода сравнения (диффузионный потенциал на границе между разными электролитами при этом должен быть устранён).
Для водных растворов в качестве электрода сравнения обычно используют водородный электрод ($ce{Pt,H2∣H+}$), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности $a$ ионов $ce{H+}$ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.). При схематич.
изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в растворе соли меди равен эдс цепи $ce{Pt,H2∣HCl┊┊CuCl2∣Cu∣Pt}$ (две вертикальные штриховые черты означают, что диффузионный потенциал на границе растворов $ce{HCl}$ и $ce{CuCl2}$ устранён).
Если металл электрода инертен и погружён в раствор, который содержит окисленную $ce{Ox}$ и восстановленную $ce{Red}$ формы компонентов раствора, находящиеся в равновесии $ce{Ox + ne⇄Red}$, то возникающий Э. п. называют окислительно-восстановительным (или редокс) потенциалом.
В стандартных условиях, когда активности всех компонентов, определяющих Э. п., равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение Э. п. называют стандартным (обозначение $E^0$). Ранее для этой величины использовали термин «нормальный потенциал».
Величина $E^0$ связана со стандартным изменением энергии Гиббса и константой равновесия $K_р$ электрохимич. реакции, определяющей величину Э. п., уравнением: $–ΔG=nFE^0=RTln K_р$ ($F$ – число Фарадея; $n$ – число электронов, участвующих в реакции; $R$ – газовая постоянная; $T$ – абсолютная темп-ра).
Значения $E^0$ электрохимич. систем по отношению к водородному электроду (найденные экспериментально либо рассчитанные из термодинамич. данных) и соответствующие электродные реакции сведены в спец. таблицы. При помощи таких таблиц можно составлять уравнения разл. химич.
реакций, решать вопрос о направлении этих реакций и полноте их протекания.
Если расположить металлы в порядке увеличения их стандартных Э. п., получим т. н. электрохимич. ряд напряжений. Он характеризует изменение химич. активности при переходе от одного металла к другому.
В сокращённом виде этот ряд выглядит следующим образом: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Металлы, стоящие слева от H2, вытесняют водород из водных растворов кислот-неокислителей; металлы, стоящие левее, вытесняют металлы, стоящие правее, из растворов солей последних.
Зависимость Э. п. от термодинамич. активностей $a_i$ участников электрохимич. реакции выражается уравнением Нернста: $E=E^0-(RT/2F)sum_iv_iln a_i$ ($v_i$ – стехиометрич. коэф. участника реакции, причём для Ox формы это отрицат.
величина, для Red формы – положительная). Т. о., напр.
, для медного электрода в растворе соли меди $E_{ce{Cu^2+ / Cu}}=E_{ce{Cu^2+ / Cu}}^0+(RT/2F)ln a_{ce{Cu^2+}}$,а для редокс-реакции $ce{MnO4-}+5e+ce{8H+}=ce{Mn^2+}+ce{4H2O}$ $$E_{ce{MnO4- /Mn^2+}}=E^0_{ce{MnO4- /Mn^2+}}++(RT/5F)ln (a_{ce{MnO4- }}a^8_{ce{H+}}/a_{ce{Mn^2+}}).$$
Если через электрод протекает электрич. ток, величина Э. п. отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод – электролит.
Стандартный электродный потенциал
Простейшая электрохимическая система состоит из двух электродов, соединенных металлическим проводником, и электролита между ними. В электрохимии электродом
принято считать любой проводящий электроны материал (металлы, графит и т.д.), находящийся в контакте с электролитом (полу- элемент).
Рис. 11.1. Строение и потенциал двойного электрического слоя:
а — активный металл; б — металл;
Me — металл; S — раствор его соли; Р — поверхность раздела; Е — электрический потенциал; R — расстояние от поверхности металла
При погружении металла в раствор собственной соли у поверхности раздела на границе металл — раствор возникает электрический потенциал вследствие образования двойного электрического слоя (рис. 11.1). В случае активного металла возможен переход его атомов, легко оставляющих электроны » на электроде, из металла в раствор в виде катионов, т.е. процесс окисления:
За счет этого в растворе появляется избыток катионов, а на металле — электронов. Поверхностный слой металла заряжается отрицательно, а граничный с ним слой раствора — положительно.
Для пассивного металла, ионы которого в растворе электролита энергично принимают электроны, наблюдается обратный переход, т.е. процесс восстановления:
Это приводит к связыванию катионов поверхностью металла электрода, заряжающейся положительно, и к появлению в растворе избытка анионов из электролита, притягивающихся к поверхности металла.
И в этом случае возникает двойной электрический слой, характеризующийся противоположными зарядами на металле и в растворе и соответственно разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
Электрические заряды в растворе вследствие теплового движения ионов распределены менее плотно, чем в металле, что видно из зависимости электрического потенциала от расстояния от поверхности раздела (см. рис. 11.1). Поэтому заряженный слой в растворе называется диффузным.
Описанные выше процессы являются обратимыми. По мере перехода ионов активного металла в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует протеканию этого процесса и вызывает обратную реакцию восстановления ионов металла до атомов.
С увеличением разности (скачка) потенциала между электродом и раствором скорость прямой реакции уменьшается, а обратной — возрастает. При некотором значении потенциала скорости прямой и обратной реакции станут равными и установится динамическое равновесие.
Аналогичный процесс протекает и в случае пассивного металла.
Потенциал, устанавливающийся в условиях равновесия, называется равновесным электродным потенциалом (Е )•
Ме”+/Ме
Непосредственно измерить величину этого потенциала нельзя. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов, измеренными по отношению к потенциалу нормального водородного электрода, величина которого условно приравнивается к нулю (/:° = 0).
2Н /Н2
Нормальный водородный электрод состоит из платиновой пластинки, играющей роль инертного проводника электрического тока, на которую электролитически наносят слой платиновой черни.
Платиновая чернь, представляющая собой платину в тонкодисперсном состоянии, обладает способностью адсорбировать газообразный водород.
Пластинку опускают в раствор хлороводородной (соляной) (НС1) или серной кислоты (H2S04) с активной концентрацией ионов водорода, равной 1 моль/л (например, используется 1,25 М раствор НС1).
Во время работы очищенный газообразный водород непрерывно пропускают под давлением 1,01 • 105 Па (1 атм) при температуре 25°С через раствор НС1 или H2S04. При этом протекает обратимая реакция:
Для определения электродного потенциала металла Ме”+ / Me собирают цепь из нормального водородного электрода и электрода, изготовленного из исследуемого металла (вертикальные черточки означают границу раздела полуэлементов, емкостей с двумя электролитами (раствор кислоты с платиной и раствор соли с металлом) и электродами, которые соединены электролитическим мостиком — U-образной стеклянной трубкой, заполненной раствором электролита, а электроды полуэлементов замкнуты — внешняя цепь — через высокоомный гальванометр), что схематично может быть представлено следующим образом:
Потенциал металлического электрода в растворе собственной соли с активной концентрацией 1 моль/л при 25°С и давлении 1,01 • 105Па называется стандартным электродным потенциалом. Величина этого потенциала количественно характеризует восстановительную и окислительную способности металла и его ионов.
Чем меньше значение стандартного электродного потенциала, тем сильнее восстановительные свойства металла и слабее окислительная способность его ионов. Чем больше значение стандартного электродного потенциала, тем сильнее окислительная способность ионов металла и слабее восстановительные свойства металла.
Величины стандартных электродных потенциалов различных элементов и их ионов приведены в справочниках в порядке их возрастания. Ряд металлов, расположенных последовательно по признаку увеличения стандартного электродного потенциала, называется рядом напряжений металлов:
Ряд напряжений характеризует химические свойства металлов.
- 1. Все металлы, стоящие левее (выше) водорода, имеют отрицательные значения стандартных электродных потенциалов, правее (ниже) — положительные.
- 2. Отрицательные значения электродных потенциалов означают, что данные металлы являются восстановителями по отношению к водороду и вытесняют (восстанавливают) его из растворов минеральных кислот, анионы которых не проявляют окислительных свойств (НС1, разбавленная H2SO и т.п.).
~3. Чем ближе к началу ряда напряжений расположен металл, тем сильнее восстановительная и слабее окислительная способность его иона в растворе (т.е. тем легче его ионы отдают (окисляются) и труднее присоединяют (восстанавливаются) электроны).
- 4. Положительное значение электродного потенциала означает, что данные металлы являются окислителями по отношению к атомам водорода, т.е. не разлагают воду и не вытесняют водород из растворов. Наоборот, водород вытесняет металлы из растворов их солей.
- 5. Каждый металл способен вытеснять из растворов солей те металлы, которые стоят в ряду напряжений после него и восстанавливает ионы следующих за ним металлов в электронейтральные атомы, отдавая электроны, а сам превращается в ионы.
В табл. 11.1 приведены величины стандартных окислительно-восстановительных потенциалов для некоторых металлов, кислорода и воды.
Если атомы или ионы, находящиеся в правой колонке таблицы (восстановители), вступают в реакции с атомами или ионами, находящимися в левой колонке (окислители) и притом расположенными в таблице ниже, то первые отдают электроны (окисляются), т.
е. являются восстановителями, а вторые — принимают электроны (восстанавливаются), т.е. являются окислителями.
Пример 11.1. Возможно ли взаимодействие меди (Си) с раствором сульфата цинка (ZnSO^)?
Решение.
Согласно табл. 11.1 стандартные электродные потенциалы этих металлов составляют: Е° = +0,34 В и ?° _ = -0,76 В. Так
Си^ /Си Zn2+/Zn
как медь имеет больший электродный потенциал и стоит в ряду напряжений после цинка, то она не способна восстанавливать ионы Zn2+ и вытеснять цинк из его соли. Реакция протекать не будет.
Таблица 11.1
Стандартные электродные потенциалы металлов, кислорода и воды
| Окислитель | +пё | Восстановитель | E° (B) |
| Li* | +ё | Li | -3,04 |
| Rb+ | +ё | Rb | -2,93 |
| К+ | +ё | К | -2,92 |
| Ва2* | +2ё | Ва | -2,91 |
| Sr2+ | +2ё | Sr | -2,89 |
| Са2+ | +2ё | Са | -2,87 |
| Na+ | + ё | Na | -2,71 |
| Mg2* | +2ё | Mg | -2,36 |
| Al3+ | +3ё | Л1 | -1,66 |
| Мп2+ | +2ё | Мп | -1,18 |
| Сг2+ | +2ё | Сг | -0,91 |
| 2Н20 | +2ё | Н2 + 20Н | -0,83 |
| Zn2+ | +2ё | Zn | -0,76 |
| Сг3+ | +3ё | Сг | -0,74 |
| Fe2+ | +2ё | Fe | -0,44 |
| 2Н*(10 7М) | +2ё | н2 | -0,41 |
| Cd2+ | +2ё | Cd | -0,40 |
| Со2* | +2ё | Со | -0,28 |
| Ni2* | +2ё | Ni | -0,25 |
| Sn2* | +2ё | Sn | -0,14 |
| Pb2+ | +2ё | Pb | -0,13 |
| Fe3* | +3ё | Fe | -0,04 |
| 2H+ | +2ё | н2 | 0,00 |
| Sn4* | +4ё | Sn | +0,01 |
| Bi3* | +3ё | Bi | +0,22 |
| Cu2+ | +2ё | Cu | +0,34 |
| 02 + 2H20 | +4ё | 40H | +0,40 |
Окончание табл. 11.1
| Окислитель | +пё | Восстановитель | E°(B) |
| Си+ | +ё | Си | +0,52 |
| Hgf | +2ё | 2Hg | +0,79 |
| Ag~ | +ё | Ag | +0,80 |
| 02 + 4Н* (10 7М) | +4ё | 2Н20 | +0,82 |
| IIg2+ | +2ё | Hg | +0,85 |
| Pd2+ | +2ё | Pd | +0,99 |
| Pt2+ | +2ё | Pt | + 1,19 |
| 02 + 41Г | +4ё | 2II20 | + 1,23 |
| Au3+ | +3ё | Au | + 1,50 |
| Au+ | +ё | Au | + 1,69 |
Пример 11.2. Возможно ли взаимодействие, если цинковую пластинку (Zn) опустить в водный раствор сульфата меди (CuS04)?
Решение.
Согласно табл. 11.1 стандартные электродные потенциалы этих металлов составляют: Е° = +0,34 В и Е° 9+ „ = -0,76 В. Так
Cu2+/Cu Zn2+/Zn
как цинк имеет меньший электродный потенциал и стоит в ряду напряжений до меди, то он способен восстанавливать ионы Си2+ и вытеснять медь из ее соли. В данном случае ион Си2+ является окислителем, a Zn — восстановителем. Реакция будет протекать но следующей схеме:
Таким образом, цинк будет растворяться, а медь выделяться на цинковой пластинке.
Если концентрация (активность) одноименных ионов в растворах солей, в которые погружены металлы, не соответствует стандартному значению (1 моль/л), то величины электродных потенциалов металлов будут отличаться от величин их стандартных электродных потенциалов, приведенных в табл. 11.1.
В этом случае для определения величин электродных потенциалов металлов используют уравнение Нернста. Так как для металлов концентрация восстановленной формы (т.е.
самого металла) является постоянной величиной, а концентрация окисленной формы соответствует концентрации его ионов в растворе соли, то уравнение Нернста можно записать в следующем виде:
где ^мея+/ме — искомый электродный потенциал металла (В); ?^1еЯ+/Ме — его стандартный электродный потенциал (В); п — количество электронов, участвующих в процессе окисления-восстановления; С + — концентрация ионов металла в растворе (моль/л); в случае очень концентрированных растворов вместо концентрации ионов подставляется их активность (а = у • с).
Пример 11.3. Определим величину потенциала серебряного электрода (Ag) в растворе нитрата серебра (AgN03) с концентрацией 0,1 моль/л.
- Решение.
- Стандартный электродный потенциал серебра равен Е° + =
- = 0,80 В. Ag /Ag
- По уравнению Нернста вычисляем потенциал серебряного электрода в данных условиях:






