- Гипермаркет знаний>>Химия>>Химия 7 класс>> Простые и сложные вещества. Типы простых веществ: металлы и неметаллы
- Простые и сложные вещества. Типы простых веществ: металлы и неметаллы
- Материал параграфа поможет вам:
- > различать простые и сложные вещества, органические и неорганические вещества;> распознавать металлы и неметаллы;
> определять металлические и неметаллические элементы по их расположению в периодической системе Д. И. Менделеева; понять, почему все металлы похожи по свойствам.
Атомы в обычных условиях не могут долго существовать поодиночке. Они способны соединяться с такими же или другими атомами, что обуславливает большое разнообразие в мире веществ.
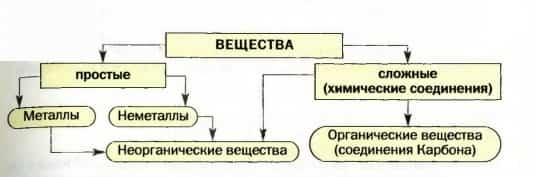
Вещество, образованное одним химическим элементом, называется простым, а вещество, образованное несколькими элементами, — сложным, или химическим соединением.Простые вещества
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил выдающийся французский ученый A.Л. Лавуазье в конце XVIII в.
Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, — неметаллическими. В длинном варианте системы Д. И. Менделеева (форзац II) они разграничены ломаной линией.
Металлические элементы находятся слева от нее; их значительно больше, чем неметаллических.
- Это интересно
- Простые вещества 13 элементов — Au, Ag, Cu, Hg, Pb, Fe, Sn, Pt, S, С, Zn, Sb и As были известны еще в древности.
- Металлы.
Каждый из вас может, не задумываясь, назвать несколько металлов (рис. 36). Они отличаются от остальных веществ особым «металлическим» блеском. Эти вещества имеют много общих свойств.

Рис. 36. Металлы
Металлы в обычных условиях являются твердыми веществами (только ртуть — жидкость), хорошо проводят электрическии ток и теплоту, имеют в основном высокие температуры плавления (свыше 500 °С).
Рис. 37. Упрощенная модель внутреннего строения металла
Они пластичны; их можно ковать, вытягивать из них проволоку.
Благодаря своим свойствам металлы уверенно вошли в жизнь людей. Об их огромном значении свидетельствуют названия исторических эпох: медный век, бронзовый1 век, железный век.
Сходство металлов обусловлено их внутренним строением.
Строение металлов. Металлы — кристаллические вещества. Кристаллы в металлах намного мельче, чем кристаллы сахара или поваренной соли, и увидеть их невооруженным глазом невозможно.
Атомы в металле «упакованы» очень плотно, поэтому часть электронов постоянно переходит от одних атомов к другим. Именно благодаря этим «свободным» электронам металлы проводят электрический ток. Атомы, которые теряют электроны, превращаются в положительно заряженные частицы — ионы (рис. 37).
Неметаллы.
Простых веществ этого типа значительно меньше. К неметаллам относятся азот и кислород (компоненты воздуха), графит (стержни карандашей, материал электрических контактов), алмаз, сера и др. (рис. 38).

Рис. 38. Неметаллы
1Бронза — сплав меди с оловом.
Внешне неметаллы отличаются от металлов прежде всего отсутствием металлического блеска. Только графит и иод имеют слабый блеск. Неметаллы не проводят электрический ток (исключение — графит). В обычных условиях половина неметаллов находится в газообразном состоянии, другие являются твердыми веществами и только бром — жидкостью. Ни одного металла-газа не существует.
Неметаллы заметно отличаются друг от друга.
Строение неметаллов. Часть неметаллов состоит из атомов. В алмазе, графите, красном фосфоре все атомы соединены друг с другом, а в инертных газах — гелии, неоне, аргоне, криптоне, ксеноне и радоне — разъединены.
Другие неметаллы образованы молекулами 1.
Молекула — электронейтральная частица, состоящая из двух или большего числа соединенных атомов.
В каждой молекуле атомы соединены между собой достаточно прочно, а молекулы друг с другом в веществе — очень слабо. Поэтому вещества молекулярного строения имеют невысокие температуры плавления и кипения.
Кислород и озон являются молекулярными веществами. Это простые вещества Оксигена. Молекула кислорода содержит два атома Оксигена, а молекула озона — три (рис. 39).
Рис. 39. Модели молекул
He только Оксиген, но и многие другие элементы образуют по два и более простых веществ. Поэтому простых веществ в несколько раз больше, чем химических элементов.
Названия простых веществ.
Большинство простых веществ называют так, как и соответствующие элементы. Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия элемента (рис. 40).
► Назовите простые вещества элементов Гидргена, Лития, Магния, Нитрогена.
1 Термин «молекула» происходит от латинского слова moles (масса), уменьшительного суффикса cula и в переводе означает «маленькая масса».Названия простых веществ записывают внутри предложения с маленькой буквы.
Рис. 40. Клетка периодической системы
- Сложные вещества (химические соединения)
- Соединение атомов разных химических элементов порождает множество сложных веществ (их в десятки тысяч раз больше, чем простых).
Существуют сложные вещества с молекулярным, атомным и ионным строением. Поэтому их свойства очень разные.
Молекулярные соединения в основном летучи, нередко имеют запах. Температуры их плавления и кипения значительно ниже, чем соединений с атомным или ионным строением.
Молекулярным веществом является вода. Молекула воды состоит из двух атомов Гидрогена и одного атома Оксигена (рис. 41).
Рис. 41. Модель молекулы воды
Молекулярное строение имеют угарный и углекислый газы, сахар, крахмал, спирт, уксусная кислота и др. Количество атомов в молекулах сложных веществ может быть разным — от двух атомов до сотен и даже тысяч.
Некоторые соединения имеют атомное строение.
Одним из них является минерал кварц, главная составляющая песка. В нем содержатся атомы Силиция и Оксигена (рис. 42).
Рис. 42. Модель соединения атомного строения (кварца)
Существуют также ионные соединения. Это — поваренная соль, мел, сода, известь, гипс и многие другие. Кристаллы поваренной соли состоят из положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора (рис. 43). Каждый такой ион образуется из соответствующего атома (§ 6).
Рис. 43. Модель ионного соединения (поваренной соли)
- Это интересно
- В молекулах органических соединений, кроме атомов Карбона, содержатся, как правило, атомы Гидрогена, нередко — атомы Оксигена, иногда — некоторых других элементов.
- Взаимное притяжение многих противоположно заряженных ионов обуславливает существование ионных соединений.
- Ион, образовавшийся из одного атома, называют простым, а ион, который образовался из нескольких атомов, — сложным.
- Положительно заряженные простые ионы существуют для металлических элементов, а отрицательно заряженные — для неметаллических элементов.
- Названия сложных веществ.
В учебнике до сих пор приводились технические или бытовые названия сложных веществ. Кроме того, вещества имеют и химические названия.
Например, химическое название поваренной соли — натрий хлорид, а мела — кальций карбонат. Каждое такое название состоит из двух слов.
Первым словом является название одного из элементов, которыми образовано вещество (оно пишется с маленькой буквы), а второе происходит от названия другого элемента.
Органические и неорганические вещества.
Раньше органическими веществами называли те вещества, которые содержатся в живых организмах. Это белки, жиры, сахар, крахмал, витамины, соединения, придающие цвет, запах, вкус овощам и фруктам, и др.
Co временем ученые начали получать в лабораториях подобные по составу и свойствам вещества, которых нет в природе.
Сейчас органическими веществами называют соединения Карбона (за исключением угарного и углекислого газов, мела, соды, некоторых других).
Большинство органических соединений способны гореть, а при нагревании в отсутствие воздуха обугливаются (уголь почти полностью состоит из атомов Карбона).
К неорганическим веществам принадлежат остальные сложные вещества, а также все простые. Они составляют основу минерального мира, т. е. содержатся в почве, минералах, горных породах, воздухе, природной воде. Кроме того, неорганические вещества есть и в живых организмах.Материал параграфа обобщен в схеме 6.
Схема 6. Типы веществ
- Лабораторный опыт № 2
- Ознакомление с веществами различных типов
- Вам выданы такие вещества (вариант укажет учитель):
- вариант I — сахар, кальций карбонат (мел), графит, медь; вариант II — парафин, алюминий, сера, натрий хлорид (поваренная соль).
- Вещества находятся в банках с этикетками.
Внимательно рассмотрите вещества, обратите внимание на их названия. Определите среди них простые (металлы, неметаллы) и сложные вещества, а также органические и неорганические.
Внесите в таблицу название каждого вещества и укажите его тип, записав в соответствующих столбцах знак «+».
| Название вещества | Простое вещество | Сложное вещество | Органическое вещество | Неорганическое вещество |
| металл | неметалл |
- Выводы
- Вещества бывают простыми и сложными, органическими и неорганическими.
- Простые вещества делят на металлы и неметаллы, а химические элементы — на металлические и неметаллические.
- Металлы имеют немало общих свойств благодаря сходству их внутреннего строения.
- Неметаллы состоят из атомов или молекул и по своим свойствам отличаются от металлов.
- Сложные вещества (химические соединения) имеют атомное, молекулярное или ионное строение.
- Почти все соединения Карбона принадлежат к органическим веществам, а остальные соединения и простые вещества — к неорганическим веществам.
- ?
56. Какое вещество называют простым, а какое — сложным? Какие типы простых веществ существуют и как называют соответствующие элементы?
57. По каким физическим свойствам металл можно отличить от неметалла?
58. Дайте определение молекулы. Чем отличается молекула простого вещества от молекулы сложного вещества?59. Заполните пропуски, вставив в соответствующих падежах слова «Нитроген» или «азот», и объясните свой выбор:а ) … — газ, которого в воздухе содержится наибольшее количество;б) молекула… состоит из двух атомов…;в) соединения… попадают в растения из почвы;
г)… плохо растворяется в воде.
60. Заполните пропуски, вставив слова «элемент», «атом» или «молекула» в соответствующем падеже и числе:а)… белого фосфора содержит четыре… Фосфора;б) в воздухе есть… углекислого газа;
в) золото — простое вещество… Аурума.
61. Какими элементами образованы простые вещества фтор, цинк, фосфор, ртуть? Какие из названных элементов являются металлическими, а какие — неметаллическими?
62. Назовите простые вещества элементов, символы которых — Pb, Ca, He, Ag, В.
63. Какая ошибка допущена в выражении «В яблоках есть железо»? Предложите свой вариант, правильный относительно названий элементов и простых веществ.
64. Какие из веществ являются органическими, а какие — неорганическими: алмаз, вода, крахмал, витамин С (аскорбиновая кислота), халькозин (медная руда)?
65. Какими элементами образованы сложные вещества с такими химическими названиями: алюминий оксид, силиций нитрид, натрий гидрогенсульфид?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл.
Содержание урока
конспект урока и опорный каркас
презентация урока
интерактивные технологии акселеративные методы обучения Практика
тесты, тестирование онлайн
задачи и упражнения домашние задания
практикумы и тренинги
вопросы для дискуссий в классе Иллюстрации
видео- и аудиоматериалы
фотографии, картинки графики, таблицы, схемы
комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты Дополнения
рефераты
шпаргалки фишки для любознательных статьи (МАН)
литература основная и дополнительная
словарь терминов Совершенствование учебников и уроков
исправление ошибок в учебнике
замена устаревших знаний новыми Только для учителей
календарные планы
учебные программы
методические рекомендации обсуждения Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Простые и сложные вещества в химии. Что это такое?
- Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
- Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
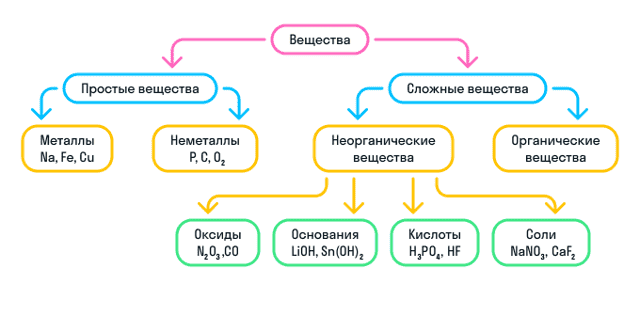
- В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
- одноатомные: He, Si, Ar и другие;
- двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
- трехатомные — например, молекула озона O3;
- и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
-
Проведите диагональ от 5-го до 85-го номера химических элементов.
-
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
-
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
|
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
|
- Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
- Образующиеся простые вещества называют аллотропными модификациями.
- Аллотропия характерна для следующих химических элементов:
- углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
- фосфор (красный, белый и черный);
- кислород (кислород и озон);
- кремний (аморфный и кристаллический);
- Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of «Crystal» by manfredxy on Envato Elements.
The image 2 is a derivative of «Rough Graphite rock» by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
- Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
- Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
- К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
-
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
-
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
-
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
-
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
- Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
- В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
- В систематической номенклатуре название зависит от вида неорганического вещества.
- Оксиды
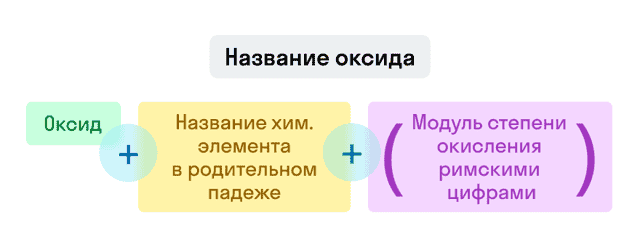
Если степень окисления у элемента постоянная, то она в конце названия не указывается.
Примеры названий оксидов:
- Fe2O3 — оксид железа (III). Читается: феррум два о три;
- Na2O — оксид натрия. Читается: натрий два о.
Основания
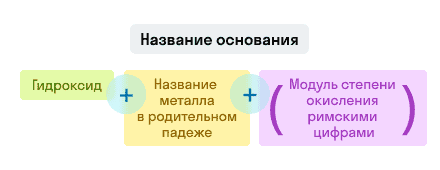
Примеры названий гидроксидов:
- Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
- NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
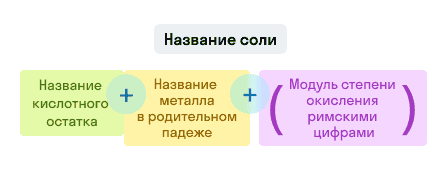
Примеры названий солей:
- KNO3 — нитрат калия. Читается: калий эн о три;
- AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
| HF | Фтороводород, плавиковая | F− | Фторид |
| HCl | Хлороводород, соляная | Cl− | Хлорид |
| HBr | Бромоводород | I− | Йодид |
| H2S | Сероводород | S2− | Сульфид |
| HCN | Циановодородная | CN− | Цианид |
| HNO2 | Азотистая | NO2− | Нитрит |
| HNO2 | Азотная | NO3− | Нитрат |
| H3PO4 | Ортофосфорная | PO43− | Фосфат |
| H3AsO4 | Мышьяковая | AsO43− | Арсенат |
| H2SO4 | Сернистая | SO32− | Сульфит |
| H2SO4 | Серная | SO42− | Сульфат |
| H2CO3 | Угольная | CO32− | Карбонат |
| H2SiO3 | Кремниевая | SiO32− | Силикат |
| H2CrO4 | Хромовая | CrO42− | Хромат |
| H2Cr2O7 | Дихромовая | Cr4O72− | Дихромат |
| HMnO2 | Марганцовая | MnO4− | Перманганат |
| HClO | Хлорноватистая | ClO− | Гипохлорит |
| HClO2 | Хлористая | ClO2− | Хлорит |
| HClO3 | Хлорноватая | ClO3− | Хлорат |
| HClO4 | Хлорная | ClO4− | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO− | Формиат |
| CH3COOH | Этановая, уксусная | CH3COO− | Ацетат |
| H3C2O4 | Этандиовая, щавелевая | C2O4− | Оксалат |
Знать свойства и строение простых и сложных веществ важно не только на экзамене, но и в жизни. Поэтому на курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart мы разбираем много реальных примеров, смотрим опыты и учимся применять полученные знания в быту.
Учёба без слёз
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой

Металлы


Средняя оценка: 4
Всего получено оценок: 1819.
Средняя оценка: 4
Всего получено оценок: 1819.
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
 Рис. 2. Металлы в таблице Д.И. Менделеева.
Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см3). Металлы с плотностью больше 5 г/см3 относят к тяжелым, меньше 5 г/см3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
 Рис. 3. Металлы главных подгрупп.
Рис. 3. Металлы главных подгрупп.
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4
Всего получено оценок: 1819.
А какая ваша оценка?
Гость завершил
Тест на тему «Социализация»с результатом 6/10
Гость завершил
Тест на тему «Ускорение»с результатом 3/5
Гость завершил
Тест «Толстый и тонкий»с результатом 7/8
Гость завершил
Тест «Тихое утро»с результатом 9/10
Гость завершил
Тест «Бирюк»с результатом 10/12
Не подошло? Напиши в х, чего не хватает!
Металлы — Химия
 Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
- Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
- В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
- Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³).
Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.
6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь.
Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- Химические свойства металлов
- На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
- Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития пероксид натрия надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- Взаимодействие кислот с металлами
- Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
- Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:






