- Свойства металлов
- Электрофизическое свойство металлов
- Свойства металлов
- Большая Рнциклопедия Нефти Рё Газа
- ПОИСК
- В чем причина металлического блеска?
- Чем объясняется такое свойство металлов как металлический блеск?
- Почему все металлы блестят?
- Почему многие металлы не имеют металлический блеск на поверхности?
- Какой из химических элементов является металлом?
- Почему металлы обладают пластичностью?
- Как ведут себя атомы металлов в химических реакциях и почему?
- Какие металлы Жидкие при обычной температуре?
- Какой самый мягкий металл в мире?
- Какой металл имеет блеск?
- Где используют металлический блеск?
- Почему все металлы проводят электрический ток?
- Как образуется связь в металлах?
- Чем обусловлены общие физические свойства металлов тепло электропроводность металлический блеск?
- Какой блеск бывает у минералов?
В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа.
В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят.
Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.

Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.
- По степени пластичности металлы принято подразделять следующим образом:
- -высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
- -пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
- -хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
- Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.
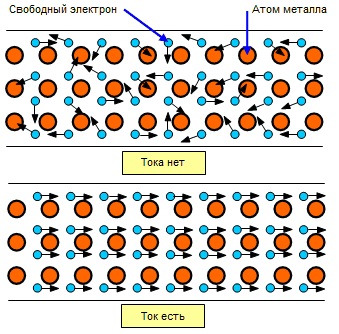
Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.
Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.
Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.
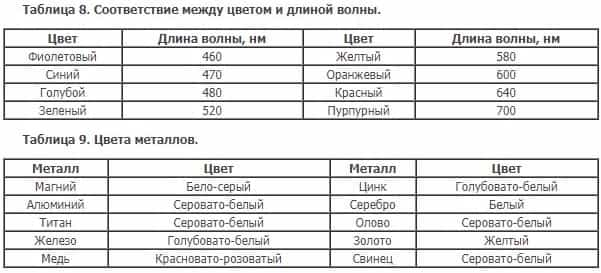
Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».
Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
- https://libmetal.ru/prop/tverd.htm
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами.
Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов.
В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
- Карбид вольфрама: 8.5-9
- Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
- -лёгкие (плотность не более 5 г/см3) — магний, алюминий, титан и др.:
- -тяжёлые — (плотность от 5 до 10 г/см3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
- -очень тяжёлые (плотность более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
- Таблицы с плотностями:
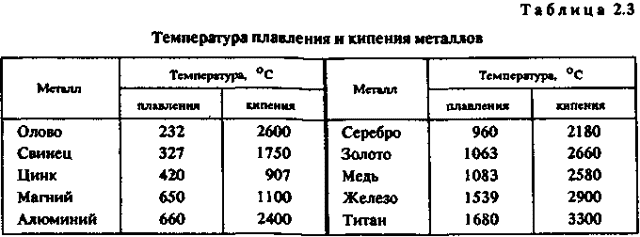
- Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
- Делят металлы на несколько групп:
- -легкоплавкие (температура плавления не превышает 600 oС) — цинк, олово, свинец, висмут и др.;
- -среднеплавкие (от 600 oС до 1600 oС) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
- -тугоплавкие ( более 1600 oС) — вольфрам, молибден, титан, хром и др.
- Больше про плавление написано здесь:
Дополнительная общая ссылка:
- https://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv
Большое спасибо за внимание!
Свойства металлов
Все чистые (с химической точки зрения) металлы — это простые вещества, состоящие из атомов одного химического элемента. В таблице Менделеева металлические свойства элементов возрастают справа налево. Все чистые металлы (как элементы) — являютя простыми веществами.
Сверхчистые металлы Кристаллический кремний — полупроводник Фотоэффект
Различают физические и химические свойства металлов. В общем случае, свойства металлов достаточно разнообразны.
Различают металлы щелочные, щелочноземельные, чёрные, цветные, лантаноиды (или редкоземельные — близкие по химическим свойствам к щелочноземельным), актиноиды (большинство из них — радиоактивные элементы), благородные и платиновые металлы. Кроме того, отдельные металлы проявляют как металлические, так и неметаллические свойства. Такие металлы — амфотерные (или как говорят — переходные).
Практически все металлы имеют некоторые общие свойства: металлический блеск, строение кристаллической решётки, способность в химических реакциях проявлять свойства восстановителя, при этом окисляясь. В химических реакциях ионы растворённых металлов при взаимодействии с кислотами образуют соли, при взаимодействии с водой (в зависимости от активности металла) образуют щёлочь или основание.
Почему блестят металлы
Свойства металлов
В узлах кристаллической решётки металлов содержатся атомы. Электроны, движущиеся вокруг атомов, образуют «электронный газ» который свободно может перемещаться в разных направлениях. Это свойство объясняет высокую электропроводность и теплопроводность металлов.
Электронный газ отражает почти все световые лучи. Именно поэтому металлы так сильно блестят и чаще всего имеют серый или белый цвет.
Связи между отдельными слоями металла невелики, что позволяет перемещать эти слои под нагрузкой в разных направлениях (по-другому — деформировать металл). Уникальным металлом является чистое золото.
С помощью ковки из чистого золота можно сделать фольгу толщиной 0,002 мм! такой тончайший листочек металла полупрозрачен и имеет зелёный оттенок если смотрень через него на солнечный свет.
Электрофизическое свойство металлов
Электрофизическое свойство металлов выражено в его электропроводности. Принято считать, что все металлы имеют высокую электропроводность, то есть хорошо проводят ток! Но это не так, да и к тому же, всё зависит от температуры, при которой замеряют ток.
Представим себе кристаллическую решётку металла, в которой ток передаётся с помощью движения электронов. Электроны движутся от одного узла кристаллическрой решётки к другому. Один электрон «выталкивает» из узла решётки другой электрон, который продолжает двигаться к другому узлу решётки и т.д.
То есть электропроводность также зависит от того, насколько легко электроны могут перемещаться между узлов решётки. Можно сказать, что электропроводность металла зависит от кристаллического строения решётки и плотности расположения в ней частиц. Частицы в узлах решётки имеют колебания, и эти колебания тем больше, чем выше температура металла.
Такие кролебания значительно препятствуют перемещению электронов в кристаллической решётке. Таким образом, чем ниже температура металла, тем выше его способность проводить ток!
Отсюда вытекает понятие сверхпроводимости, которое наступает в металле при температуре близкой к абсолютному нулю! При абсолютном нуле (-273 0C) колебания частиц в кристаллической решётке металла полностью затухают!
Электрофизическое свойство металлов, связанное с прохождением тока, называют температурным коэффициентом электросопротивления!
Электрофизическое свойство металлов
Электрофизическое свойство металлов
Установлен интересный факт, что, например у свинца (Pb) и ртути (Hg) при температуре, которая выше абсолютного нуля всего на несколько градусов, почти полностью исчезает электросопротивление, то есть наступает условие сверхпроводимости.
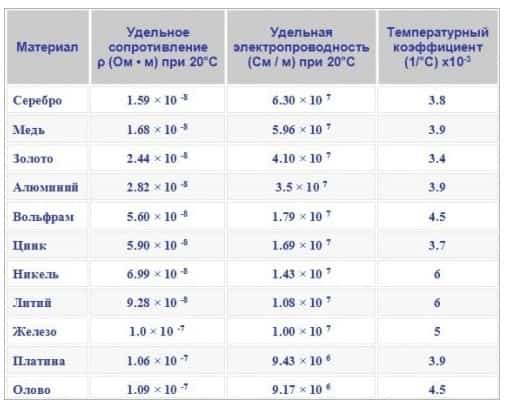
Самую высокую электропроводность имеет серебро (Ag), затем медь (Cu), далее идёт золото (Au) и алюминий (Al). С высокой электропроводностью этих металлов связано их использование в электротехнике. Иногда, для обеспечения химической стойкости и антикоррозионных свойств используют именно золото (позолоченные контакты).
Надо отметить, что электропроводность металлов значительно выше, чем электропроводность неметаллов. Вот например, углерод (С — графит) или кремний (Si) имеют электропроводность в 1000 раз меньше, чем, например, у ртути.
Кроме того, неметаллы, в своём большинстве не являются проводниками электричества.
Но среди неметаллов встречаются полупроводники: германий (Ge), кремний кристаллический, а также некоторые оксиды, фосфиты (химические соединения металла с фосфором) и сульфиды (химические соединения металла и серы).
Вам, наверное, знакомо явление фотоэффекта — это свойство металлов под действием температуры или света отдавать электроны.
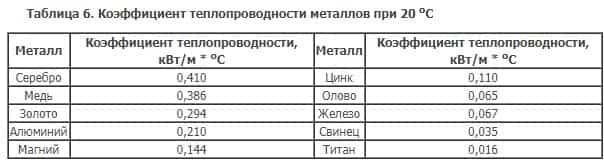
Что касается теплопроводности металлов, то её можно оценить из таблицы Менделеева, — она распределяется точно также, как электроотрицательность металлов.
(Металлы, находящиеся слева вверху имеют наибольшую электроотрицательность, например, электроотрицательность натрия Na равна -2,76 В).
В вою очередь, теплопроводность металлов объясняется наличием свободных электронов, которые переносят тепловую энергию.
Свойства металлов
Подавляющее большинство простых веществ – это металлы. Физические свойства металлов – это непрозрачность, специфический «металлический» блеск, высокие тепло- и электропроводность, а также пластичность. Именно благодаря этим свойствам металлы сыграли решающую роль в истории человечества.
Какова причина того, что металлы имеют такие свойства и почему они так отличаются от неметаллов? Периодический закон и теория строения атома объяснили структуру и свойства металлов. Оказалось, что металлические свойства элементов обусловленные электронным строением их атомов.
Металлы на внешних электронных оболочках имеют 1–4 электрона. Эти электроны подвижные, так как слабо притягиваются ядром. Через это металлы легко отдают все или часть внешних электронов, вследствие чего возникают положительно заряженные ионы – катионы. Чем легче металлы теряют свои электроны, тем они активнее и тем сильнее выражены их металлические свойства.
В атомах неметаллов на внешних электронных оболочках много электронов 4–8, за исключением водорода (1) и бора (3). Эти электроны сильно притягиваются ядром и поэтому оторвать их от атома очень тяжело. Но атомы неметаллов могут присоединять избыточные электроны и превращаться в отрицательно заряженные ионы – анионы.
Все металлы, за исключением жидкой ртути, при обычных условиях твердые и имеют кристаллическую структуру. Свойства металлов тесно связаны со строением их кристаллов.
В узлах кристаллической решетки размещены атомы и ионы (катионы), причем количество ионов и электронов в кристаллах разные металлы имеют неодинаковое.
Внешние электроны, поскольку они подвижны и слабо притягиваются ядрами, образовывают так называемый «электронный газ», который «блуждает» между ионами в кристалле. «Электронный газ» принадлежит не отдельным ионам, а кристаллу в целом.
Именно благодаря наличию в кристаллической решетке металлов таких подвижных электронов можно объяснить их высокие электро- и теплопроводность. «Электронный газ» хорошо отражает свет (поэтому металлы непрозрачны и имеют характерный блеск), а также короткие радиоволны. Последнее свойство металлов положено в основу радиолокации.
Металлы можно ковать и их способность к вытягиванию поясняется скольжением (перемещением) одних пластов ионов относительно других.
Как уже отмечалось, чем легче металлы отдают свои валентные электроны, тем они активнее и, поэтому, легче вступают в химические реакции. Более активные металлы вытесняют менее активные с их соединений.
Кроме того, многие металлы вытесняют водород с некоторых кислот, а также из воды. Исходя из этого, все металлы можно расположить в так называемый ряд активностей, или электрохимический ряд напряжений.
Платиновые металлы, золото и серебро издавна называют благородными. Они химически довольно инертные, и поэтому не реагируют ни с водой, ни с многими кислотами.
Как и благородные металлы ведут себя титан, цирконий, гафний, ниобий, тантал, молибден, вольфрам и рений, которые также химически пассивные. Они жароустойчивые и имеют замечательные механические свойства.
Именно поэтому эти металлы и их сплавы играют огромную роль в современной авиации, ракетостроении и ядерной энергетике.
Большая Рнциклопедия Нефти Рё Газа
Cтраница 1
Металлический блеск проявляют лишь компактные массы металла.
Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать этот порошок и отшлифовать его, чтобы метал лический блеск появился. [1]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [2]
Металлический блеск металлы проявляют в компактной своей массе.
Так, пластинка платины имеет серебристо-белый цвет и металлический блеск, тогда как в мелкораздробленном состоянии этот металл черного цвета и без металлического блеска.
Металлы, отражающие примерно в одинаковой степени все лучи видимого спектра, имеют серебристо-белый цвет. [3]
Металлический блеск, появляющийся РЅР° некоторых пленках красок, РЅРµ содержащих металлических пигментов, Рё маскирующий обычный цвет покрытия РїСЂРё наблюдении его вблизи Рє углам возникновения блеска68, называется бронзированием, так как отраженный свет РїСЂРё этом окрашен обычно РІ желтоватый цвет. Рто, РїРѕ-РІРёРґРёРјРѕРјСѓ, обусловлено очень высоким показателем преломления пигмента РїРѕ отношению Рє СѓР·РєРѕРјСѓ диапазону длин волн падающего света33, вследствие чего для этих длин волн пигмент более непрозрачен, чем для РґСЂСѓРіРёС…. [5]
Металлический блеск — сильный блеск, свойственный металлам.
�м обладают непрозрачные минералы, дающие в большинстве случаев черную черту на фарфоровой пластинке.
Таким блеском обладают самородные металлы ( золото, серебро, платина), многие сульфиды и окислы железа. [6]
Металлический блеск имеют, например, галенит пирит. Все минералы с металлическим блеском непрозрачные, цвет их черты черный или темноокрашенный. [7]
Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. [8]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [9]
Металлический блеск наблюдается обычно только в том случае, когда металл образует компактную массу.
Только магний и алюминий в виде порошков имеют металлический блеск.
Блеск металлов обусловлен отражением падающего на металл света от электронов в его поверхностном слое. [11]
Металлический блеск проявляют лишь компактные массы металла.
Так, РїСЂРё восстановлении РІРѕРґРѕСЂРѕРґРѕРј РѕРєРёСЃРё меди медь получается РІ РІРёРґРµ порошка, лишенного металлического блеска, РЅРѕ достаточно утрамбовать-этот порошок Рё отшлифовать его, чтобы металлический блеск — появился. Лишь РґРІР° металла сохраняют металлический блеск Рё РІ порошкообразном состоянии: магний Рё алюминий. Поэтому алюминиевая пыль применяется РІ качестве серебряной краски. [13]
- Металлическим блеском различной степени интенсивности обладают некоторые минералы, например графит, пирротин, пирит, никелин, арсенопирит. [14]
- Кроме металлического блеска и пластичности, все металлы обладают выср-кой электропроводностью и теплопроводностью. [15]
- Страницы: 1 2 3 4
ПОИСК
Металлы обладают металлическим блеском, если они находятся в крупнокристаллическом состоянии. Порошкообразные металлы блеска не имеют. Исключение составляют лишь магний и алюминий, которые и в мелкораздробленном состоянии сохраняют свой блеск. [c.
235]
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с.
обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Если необходимо показать некоторые физические свойства металлов (блеск, цвет), можно продемонстрировать образцы (по возможности, крупные) различных металлов Ре, А1, Мд, 2п, Сг, Т1, Си, 8п, РЬ и др. Для сравнения можно показать и образцы неметаллов. [c.165]
Алюминий — серебристо-белый легкий металл, р = 2,699 г/см , 660,24 С, i .,j,= 2500 С. Он очень пластичен, легко прокатывается в фольгу к протягивается в проволоку.
Прекрасный проводник электрического тока — его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида АЬОз.
Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск). [c.150]
Иод I 2 AI = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,940 [c.65]
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны. [c.29]
Соблюдение этих условий дало возможность получить светлое качественное покрытие с максимальной толщиной 10—12 мк на медной основе, с содержанием таллия 12,5—22,4 вес. %.
Покрытие имеет хорошее сцепление с поверхностью основного металла. Блеск покрытия достигается небольшим полированием. Это покрытие обладает устойчивыми сверхпроводящими свойствами при низких температурах.
[c.127]
Применяют для придания металлу блеска при никелирований. [c.1001]
Следует подчеркнуть, что положение этой граничной диагонали и само деление элементов на металлы и неметаллы весьма условны. Целый ряд элементов, обладая характерными физическими свойствами металлов — блеском, высокой электропроводностью, пластичностью, проявляет химические свойства двойственной природы — [c.109]
Сложных веществ насчитывается в природе сотни тысяч, простых около двухсот, а элементов, из которых образуются все вещества, известно 92.
Большее количество известных простых веществ в сравнении с количеством элементов объясняется свойством последних образовать несколько простых веществ.
Например, общеизвестные вещества — уголь, графит и алмаз, резко различающиеся по своим свойствам, являются видоизменениями одного и того же химического элемента — углерода. Хи.мические элементы подразделяются на металлы и металлоиды.
В группу металлов входит 71 элемент, а в группу металлоидов 21 элемент. Металлы обладают характерным блеском, хорошо проводят тепло и электричество,- обладают ковкостью и т. д. Металлоиды не имеют характерного для металлов блеска и плохо или совсем не проводят тепло и электрический ток. [c.8]
Класс 3. Карбиды промежуточного типа представляют собой огнеупорные материалы с некоторыми характерными свойствами металлов (блеск, металлическая проводимость) и, кроме того, отличаются необычной твердостью и тугоплавкостью.
Атомы металла в них плотно упакованы, а атомы С занимают октаэдрические пустоты, но следует отметить, что упорядочение атомов металла в карбиде не всегда такое, как в самом металле.
В таких случаях карбид МС нельзя рассматривать как предельный твердый раствор углерода в структуре металла наоборот, присутствие атомов С влияет на упорядочение [c.50]
Иод I2 Ai = 253,81 фиол.-черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
В свободном металле атомы плотно заполняют пространство, а их наружные энергетические уровни, весьма слабо заполненные электронами, перекрывают друг друга. Благодаря этому наружные электроны легко переходят от атома к атому, так что принадлежат не отдельному атому, а как бы обобществлены.
Таким образом ионы металла (ядра с внутренними энергетическими уровнями) крепко связываются в одно целое суммой свободно блуждающих между ними электронов. Эти свободные электроны обусловливают и физические свойства металлов (блеск, тепло- и электропроводность и пр.). [c.
75]
В связи с большим разнообразием вопросов, решаемых при изучении электроосаждения металлов, методы, применяемые в этой области, также очень разнообразны и охватывают не только электрохимические, но и физические, механические и другие способы исследования.
Это связано с тем, что при электроосаждении металлов изучают как кинетику электродных процессов, так и физико-механические свойства металлов, блеск, пористость, сцепляемость и другие свойства электролитических осадков.
Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Роспись фаянсовых и фарфоровых изделий проводят с использованием окислов и солей металлов, которые при обжиге переходят в силикаты, обладающие различной окраской окись кобальта дает синюю окраску, окись хрома — зеленую, закись урана — черную и т. д. Из солей легко восстанавливающихся металлов (золота и платины) при обх[c.121]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, прочностью на изгиб, стойкостью при эксплуатации на воздухе, внутри и вне помещения, преимущественно в условиях умеренного климата. [c.12]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, эластичностью. С повышением жирности алкидной смолы улучшается эластичность покрытий, но уменьшаются твердость, стойкость к растворителям и маслам, стабильность блеска и цвета при горячей сушке и действии света. [c.47]
Иод 1 2 М = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,9402 [c.65]
ТЕЛЛУР Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р — = 6,25 = 449,8 = 990 Ср = 0,202 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯпл = 17,5 ДЯ сп = 51,0 р = 0,1 2. [c.103]
Алкидные ЛКП имеют высокую адгезию к металлу, блеск, стойкость на изгиб. [c.10]
Металлические и неметаллические элементы различаются по своим физическим и химическим свойствам. Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности.
В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями.
Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы.
Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Теллур Те >1=127,60 серебр.-сер. с металл, блеском, триг. р = 6,252 44g g. ggg. 25,77 s = 49,50 [c.104]
Мышьяк обладает свойством придавать металлам блеск олову при- дает твердость и зво Н и делает его более плотным медь Т же.
юзо отбеливает, а соедипенный с неблагородными металлами сплавлезшем при болео длительной обработке облагораживает часть их Поэтому весьма вероятно, чтч з в состав блеска металлов входит некоторая мышьяковистая часть (особенно металлов, кото рые добываются из ншл чаще в соединении с мышьяком, чем с серою) и что благодаря ей они От других отличаются блеском и крепостью. Это можно с достаточным основанием утверждать П1режде Всего об олове. [c.53]
Теллур Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р = 6,25 5 = 449.8 / ип = 90 Ср = 0,20225 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯт=17,5 ДЯисп = 51,0 р=0,01 в 0,1 2 sn. 10632. 1001792. н р S2 реаг. H2SO4, HNO3, Ц. в. медл, реаг. [c.104]
Смотреть страницы где упоминается термин Металлы блеск: [c.81] [c.104] [c.107] [c.81] [c.107] [c.43] [c.50] [c.81] [c.107] [c.65] [c.81] [c.105]
Химический тренажер. Ч.1 (1986) — [ c.6 , c.21 ]
- Блески
- Изучение блеска в процессе электрополировки металлов
- Переходные металлы металлический блеск
© 2022 chem21.info Реклама на сайте
В чем причина металлического блеска?
Металлический блеск — наблюдается у самородных металлов, но некоторые минералы с относительно невысокой электропроводностью, например пирит, халькопирит, галенит также имеют металлический блеск, похожий на блеск металла, что обусловлено наличием в кристаллической решётке этих веществ относительно свободных электронов.
Все металлы обладают более или менее выраженным блеском, который принято называть металлическим, и непрозрачностью, что связано с взаимодействием свободных электронов с падающими на металл квантами света. Металлический блеск характерен для куска металла в целом.
Чем объясняется такое свойство металлов как металлический блеск?
Физические свойства металлов Особая структура кристаллических решеток металлов придает им много общих свойств. Металлический блеск. Все металлы имеют характерный металлический блеск. Это свойство объясняется тем, что металл хорошо отражает световые лучи от поверхности.
Почему все металлы блестят?
В узлах кристаллической решётки металлов содержатся атомы. Электроны, движущиеся вокруг атомов, образуют «электронный газ» который свободно может перемещаться в разных направлениях. … Электронный газ отражает почти все световые лучи. Именно поэтому металлы так сильно блестят и чаще всего имеют серый или белый цвет.
Почему многие металлы не имеют металлический блеск на поверхности?
При обычных условиях все металлы (за исключением ртути, её температура плавления — –39 °C) являются твёрдыми веществами. Способность металлов отражать падающий на них свет является причиной наличия у них особого металлического блеска. Металлы не имеют запаха.
Какой из химических элементов является металлом?
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Почему металлы обладают пластичностью?
Пластичность Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь.
Как ведут себя атомы металлов в химических реакциях и почему?
В химических реакциях металлы проявляют себя только как восстановители, они отдают электроны и повышают свою степень окисления. Принимать электроны от атомов металлов могут атомы, составляющие простые вещества неметаллы, а также атомы, входящие в состав сложных веществ, которые способны понизить свою степень окисления.
Какие металлы Жидкие при обычной температуре?
При обычных температурах большинство металлов находятся в твердом состоянии. Чтобы сделать их жидкими, необходимо расплавить. Единственным природным исключением является ртуть. Остальные жидкие металлы — это искусственные сплавы.
Какой самый мягкий металл в мире?
Мягкими металлами кроме золота являются медь, серебро, алюминий, но самые мягкие – это цезий, калий, натрий, рубидий и др. Притом, что серебра на планете в двадцать раз больше чем золота, этот драгоценный металл так же считается редким. Его легко обрабатывать, в этом оно уступает лишь золоту.
Какой металл имеет блеск?
Металлическим блеском обладают металлы в компактном состоянии и только некоторые сохраняют его в порошке (Al, Mg и др.). Наиболее яркий блеск имеют серебро, палладий, индий, благодаря чему они нашли применение в производстве зеркал.
Где используют металлический блеск?
Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии.
Почему все металлы проводят электрический ток?
Металлы хорошо проводят электрический ток и теплоту из-за наличия в кристаллических решётках подвижных электронов. Они(электроны) на внешних слоях слабо связаны с ядром, имеют возможность свободно передвигаться по всему объёму металла.
Как образуется связь в металлах?
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов.
Чем обусловлены общие физические свойства металлов тепло электропроводность металлический блеск?
Металлы хорошо проводят тепло и электричество — это обусловлено подвижностью электронов в кристаллической решётке металлов. Металлы блестят («металлический блеск») — также обусловлено наличием подвижных, почти свободных электронов в решётке.
Какой блеск бывает у минералов?
Восковой блеск — кремни Матовая поверхность — мел Жирный блеск — сера Перламутровый отлив — слюда, гипс
Интересные материалы:
Чем можно отполировать прозрачный пластик? Чем можно отстирать пятна от красного вина? Чем можно оттереть клей момент от чехла? Чем можно перекусить проволоку? Чем можно почистить утюг Тефаль? Чем можно подклеить ноготь? Чем можно покрасить еловые шишки? Чем можно покрасить готовую свечу? Чем можно покрасить тканевые кеды? Чем можно покрыть гитару?