- Физические свойства
- Химические свойства
- Скачать:
- Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
- Химические свойства неметаллов
- Окислительные свойства
- 2.3 Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
- Химические свойства неметаллов
- Химические свойства неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп.
К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s1), у атомов гелия – два электрона (1s2), у атома бора – три электрона (2s22p1).
Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns2np2 у атомов элементов главной подгруппы IV группы до ns2np6 у атомов инертных газов.
Физические свойства
- Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
- Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
- Жидкость: бром
- Твердые вещества: йод, углерод, кремний, фосфор, и др.
- 7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).
 Бром
Бром
Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
- Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами. Например:
4Al + 3C = Al4C3
2Al + N2 = 2AlN
- Все неметаллы играют роль окислителя при взаимодействии с водородом. Например:
H2 + Cl2 = 2HCl
3H2 + N2 = 2NH3
- Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкую ЭО. Например:
2P + 5S = P2S5
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
- Окислительные свойства неметаллов проявляются в реакциях с некоторыми сложными веществами. Здесь важно особо отметить окислительные свойства неметалла – кислорода в реакциях окисления сложных веществ:
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
- Не только кислород, но и другие неметаллы (фтор, хлор, бром и другие) также могут играть роль окислителя в реакциях со сложными веществами. Например, сильный окислитель Cl2 окисляет хлорид железа (II) в хлорид железа (III):
- 2FeCl2 + Cl2 = 2FeCl3
- На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
- 2KI + Br2 = 2KBr + I2
- Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
- Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом, так как ЭО кислорода больше ЭО всех других неметаллов (кроме фтора):
4P + 5O2 = 2P2O5
S + O2 = SO2
Горение фосфора в кислороде
- Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями:
- — взаимодействие с кислотами-окислителями:
- S + 6HNO = H2SO4 + 6NO2 + 2H2O
- — взаимодействие с солями-окислителями:
- 6P + 5KClO3 = 5KCl + 3P2O5
- Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
- ZnO + C = Zn + CO
- SiO2 + 2C = Si + 2CO
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например: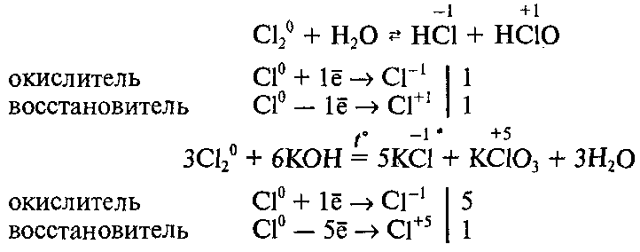
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» [download id=»1594″]
Скачать рефераты по другим темам можно здесь
Видеоурок «Химические свойства металлов. Взаимодействие металлов с неметаллами»
§ 1 Взаимодействие металлов с неметаллами
- В этом уроке мы рассмотрим взаимодействие металлов с неметаллами.
- Металлы проявляют восстановительные свойства, так как их атомы отдают свои электроны и образуют положительные ионы – катионы, а атомы неметаллов выступают в роли окислителей – принимают электроны.
- Взаимодействие металлов с галогенами (элементами седьмой группы главной подгруппы: фтором, хлором, бромом, иодом).

- При взаимодействии металлов с хлором образуются хлориды, например, если тонкую стальную проволоку накалить и опустить в колбу, заполненную газообразным хлором, проволока сгорает, образуя бурый хлорид железа (III).
- Запишем уравнение реакции: 2Fe + 3Cl2 = 2FeCl3 .
- Если высыпать в колбу с хлором порошок меди, он горит без нагревания с образованием хлорида меди (II). Уравнение этой реакции записывается так:
- Cu+Cl2 = CuCl2.
При взаимодействии металлов с бромом образуются бромиды, например, при смешивании порошок алюминия с бромом загорается, и образуется бромид алюминия. Уравнение этой реакции записывается так: 2Al + 3Br2 = 2AlBr3.
При взаимодействии металлов с иодом образуются иодиды, если взять смесь порошков цинка и иода (в соотношении 1:1) и капнуть из пипетки несколько капель воды, начнется бурная химическая реакция, в результате которой образуется иодид цинка. Уравнение этой реакции записывается так: Zn+I2=ZnI2. Вода в данной реакции является катализатором.
- Взаимодействие металлов с кислородом.
- С кислородом воздуха легко взаимодействуют щелочные и щелочноземельные металлы с образованием оксидов, пероксидов, поэтому их хранят под слоем керосина, а литий — в вазелиновом масле.
- При взаимодействии лития с кислородом образуется оксид лития.
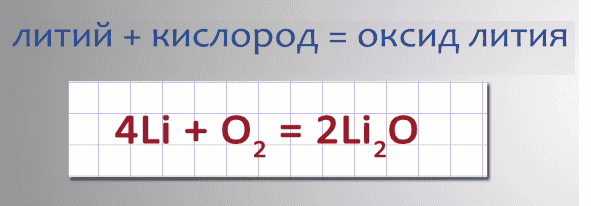
Запишем уравнение реакции: 4Li + O2 = 2Li2O.

Кальций на воздухе окисляется до оксида кальция, уравнение этой реакции записывается так: 2Ca+ O2 = 2CaO.
Химические реакции с менее активными металлами происходят при нагревании.
Например, для реакции кислорода с магнием необходимо порошок магния поджечь. Магний моментально сгорает ярким пламенем с образованием белого оксида магния.

Уравнение этой реакции записывается так: 2Mg+ O2 = 2MgO.
Это свойство магния – ярко гореть – используется в пиротехнике. Измельченный магний – составляющая смесей для фейерверков. Вспышку магния использовали фотографы 100 лет назад для освещения моделей.
Медь и другие менее активные металлы энергично окисляются кислородом только при нагревании. Если прокаливать медную проволоку на пламени спиртовки, она покрывается черным налетом оксида меди (II). Запишем уравнение этой реакции: 2Cu+O2 = 2CuO.
- Золото и платиновые металлы кислородом воздуха не окисляются.
- Взаимодействие металлов с другими неметаллами.
- При взаимодействии металлов с серой образуются сульфиды. Если смесь порошков цинка и серы поджечь, образуется сульфид цинка по следующему уравнению:
- Zn+ S= ZnS.
Сульфид ртути образуется при взаимодействии серы с ртутью, при комнатной температуре реакция идет очень медленно, при нагревании процесс ускоряется. Уравнение этой реакции: Hg+ S= HgS. Это соединение нелетучее и не растворяется в воде, поэтому его можно использовать при демеркуризации помещений.
Металлы могут реагировать с водородом с образованием гидридов, реакции протекают при нагревании. Например, уравнение реакции получение гидрида натрия: 2Na+ H2 = 2NaH.
§ 2 Краткий итог урока
Взаимодействие металлов с неметаллами происходит с образованием бинарных соединений: хлоридов, оксидов, бромидов, сульфидов и других.
Условия протекания химических реакций зависят как от активности металла, так и от активности неметалла.
Наиболее активные металлы (щелочные и щелочноземельные) вступают в реакции без нагревания, менее активные металлы реагируют только при нагревании. В результате химических реакций металлы отдают свои электроны, а неметаллы принимают.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений. — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя./О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- school-collection.edu.ru/catalog/res/55a4babd-d3a0-e5b4-6daa…/view/
Использованные изображения:
Химические свойства неметаллов


Средняя оценка: 4
Всего получено оценок: 461.
Средняя оценка: 4
Всего получено оценок: 461.
Неметаллы – химические элементы, которые имеют типичные неметаллические свойства и располагаются в правом верхнем углу Периодической системы. Какие же свойства присущи этим элементам, и с чем реагируют неметаллы?
Неметаллы отличаются от металлов тем, что на внешнем энергетическом уровне они имеют большее количество электронов. Поэтому их окислительные свойства выражены сильнее, чем у металлов. Неметаллы характеризуются высокими значениями электроотрицательности и высокий восстановительный потенциал.
К неметаллам относятся химические элементы, которые находятся в газообразном, жидком или твердом агрегатном состоянии. Так, например, азот, кислород, фтор, хлор, водород – газы; йод, сера, фосфор – твердые; бром – жидкость (при комнатной температуре). Всего существует 22 неметалла.
Рис. 1. Неметаллы – газы, твердые, жидкости.
С увеличением заряда ядра атома наблюдается закономерность изменения свойств химических элементов от металлических к неметаллическим.
Водородные свойства неметаллов в основном являются летучими соединениями, которые в водных растворах имеют кислотный характер. Они имеют молекулярные структуры, а также ковалентную полярную связь. Некоторые, например, вода, аммиак или фтороводород образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Пример:
S+H2 =H2S (до 350 градусов равновесие смещено вправо)
Все водородные соединения имеют восстановительные свойства, причем их восстановительная сила возрастает справа налево по периоду и сверху вниз в группе. Так, сероводород сгорает при большом количестве кислорода:
2H2 S+3O3 =2SO2 +2H2 O+1158 кДж.
Окисление может идти по другому пути. Так, уже на воздухе водный раствор сероводорода мутнеет в результате образования серы:
Соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты (оксокислоты). Структура оксидов типичных неметаллов молекулярная.
Чем выше степень окисления неметалла, тем сильнее соответствующая кислородосодержащая кислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Наиболее известны такие соли этих кислот, как хлорная известь CaOCl2 (смешанная соль хлорноватистой и хлороводородной кислот), бертолетова соль KClO3 (хлорат калия).
Азот в оксидах проявляет положительные степени окисления +1, +2, +3, +4, +5. Первые два оксида N2O и NO – несолеобразующие и являются газами. N2O3 (оксид азота III) – является ангидридом азотистой кислоты HNO2 . Оксид азота IV – бурый газ NO2 – газ, который хорошо растворяется в воде, образуя при этом две кислоты. Этот процесс можно выразить уравнением:
2NO2 +H2 O=HNO3 (азотная кислота)+HNO2 (азотистая кислота) – окислительно-восстановительная реакция диспропорционирования
 Рис. 2. Азотистая кислота.
Рис. 2. Азотистая кислота.
Ангидрид азотной кислоты N2O5 – белое кристаллическое вещество, которое легко растворяется в воде. Пример:
Соли азотной кислоты называются селитрами, они растворимы в воде. Соли калия, кальция, натрия используют для получения азотных удобрений.
Фосфор образует оксиды, проявляя степени окисления +3 и +5. Наиболее устойчивый оксид – фосфорный ангидрид P2O5 , образующий молекулярную решетку, в узлах которой находятся димеры P4O10 . Соли ортофосфорной кислоты применяются в качестве фосфорных удобрений, например, аммофос NH4 H2 PO4 (дигидрофосфат аммония).
| Группа | I | III | IV | V | VI | VII | VIII |
| Первый период | H | He | |||||
| Второй период | B | C | N | O | F | Ne | |
| Третий период | Si | P | S | Cl | Ar | ||
| Четвертый период | As | Se | Br | Kr | |||
| Пятый период | Te | I | Xe | ||||
| Шестой период | At | Rn |
 Рис. 3. Таблица химические свойства неметаллов.
Рис. 3. Таблица химические свойства неметаллов.
В школьной программе по химии (8-9 класс) большое внимание уделяется изучению общих свойств неметаллов. В данной статье изучается информация, чем отличаются металлы от неметаллов, и какими особенностями они обладают. Также приведена таблица химических свойств неметалов.
Чтобы попасть сюда — пройдите тест.
Средняя оценка: 4
Всего получено оценок: 461.
А какая ваша оценка?
Гость завершил
Тест «Маленький принц»с результатом 8/14
Гость завершил
Тест «Отцы и дети»с результатом 15/15
Гость завершил
Тест «Изумруд»с результатом 8/10
Гость завершил
Тест «Горе от ума»с результатом 9/15
Гость завершил
Тест Кольчатые червис результатом 7/10
Гость завершил
Тест «Пиковая дама»с результатом 14/14
Не подошло? Напиши в х, чего не хватает!
Окислительные свойства
Химические свойства неметаллов. Характерными для большинства неметаллов являются окислительные свойства. Как окислители неметаллы реагируют — с металлами: Ca + Cl2 = Mg + Si = Li + O2 = Ca + P = Na + S = Na + H2 = (Пожалуйста допишите уравнения этих реакций. Кто не может сделать сам, можно воспользоваться учебником стр. 225).
Слайд 10 из презентации «Химические свойства неметаллов». Размер архива с презентацией 184 КБ.
Скачать презентацию
краткое содержание других презентаций
«Бородин» — Музыка – моя забава. Похоронен в Александрово-Невской лавре. Детские годы. Н.Н.Зинин. Первые успехи в музыке. Первые успехи в учебе. Новый тип реакции. Русский композитор и талантливый химик.
Могучая кучка. Общественный деятель. Александр Порфирьевич Бородин. Работа в химической лаборатории г.Пизы. Н.А.Римский-Корсаков. Песня «Спящая княжна». Медико-хирургическая академия. Съезд химиков в Карлсруэ.
«Типы изомерии» — — Явление существования изомерных соединений. Какие вещества называются изомерами? Берцелиус Йенс Якоб (1779-1848). БУТАН (С4Н10) (t кип. = — 0,5 С). Структурная. Термин изомерия предложен в 1830 г.
Шведским химиком И.Берцелиусом. Сн3 сн сн3 сн3. Типы изомерии. Изомеры. 3.Типы изомерии. Какие изомеры называют структурными? Оптическая. Бутлеров Александр Михайлович (1828-1886). Виды структурной изомерии: 3.
Межклассовая изомерия.
«Свойства бензола» — Реакции по алкильному заместителю. Особенности строения. Модель молекулы бензола. Изомеры ксилола: 1,2-диметилбензол. -HBr.
?Для гомологов бензола характерна изомерия положения нескольких заместителей; ?Межклассовая . С2н5. Физические свойства. Применение. (Орто- ксилол). В молекулах Аренов содержится одно или несколько бензольных колец. C6H6. С3н3.
CnH2n-6. Этилбензол. Способы получения. Толуол используют для получения взрывчатых веществ.
«Получение и свойства алканов» — Реакции замещения. Реакция нитрования. Номенклатура. Изомерия. Окисление. Определение. Реакция Вюрца – Гриньяра. Вещества. Реакции замещения атомов водорода.
Физические свойства. Углеводороды нормального строения. Связь. Получение. Термическое превращение алканов. Химические свойства. Строение молекулы метана. Реакция Дюма. Применение. Углеводороды. Ряд метана.
Алканы.
«Химические свойства алканов» — Реакции изомеризации. Химическая устойчивость. Общая схема реакции. Нитрование алканов. Реакции отщепления. Взаимодействие со фтором. Механизм реакции замещения. Реакции замещения. Реакции окисления. Реакции. Крекинг алканов. Ароматизация. Виды крекинга. Применение алканов. Химические свойства алканов.
««Аминокислоты» химия» — Органические соединения. Общая формула. Диаминогексановая кислота. Свойства. Применение аминокислот. Получение аминокислот. Способы получения. Биологическая роль. Составьте формулу. Образование полипептидов. Изомерия углеродного скелета. Природные аминокислоты. Аминокислоты. Номенклатура аминокислот.
Всего в теме «Химия 10 класс» 58 презентаций
2.3 Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Видеоурок: Свойства неметаллов
Лекция: Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Водород
Водород (Н) — элемент особого значения, широко распространенный в природе. В переводе с латинского Hydrogenium означает «порождающий воду».
Двухатомные молекулы Н2 достаточно легки, подвижны и неполярны. Межмолекулярное взаимодействие — дисперсионное. Именно поэтому водород достаточно плохо растворяется в жидкостях.
Водород возможен во всех агрегатных состояниях. Н2 в обычных условиях — это газ, без цвета, запаха и вкуса. При t ок. −253oC сжижается и превращается в бесветную, легкую и текучую жидкость. А при t ок.
−259oC затвердевает, образуя снегоподобную массу.
Химические свойства:
- Энергия связи атомных ядер довольно велика, равна 434 кДж. Поэтому, химические реакции с участием водорода, обычно протекают при нагревании или освещении. При обычных условиях реакция возможна только с очень активными металлами и только с одним неметаллом — фтором.
- Проявляет одновременно восстановительные и окислительные свойства.
- В состав соединений входит со степенями окисления -1 и +1. Самая распространенная из них +1. Соединения водорода, имеющие степень окисления -1 называются гидридами (Li+1H-1, Ca+2H-12 и др.).
Взаимодействие с другими элементами:
1. С кислородом образует гремучий газ. Реакция взрывоопасная:
2. С щелочными и щелочноземельными металлами образует гидриды: В данных реакциях проявляет окислительные свойства. С оксидами металлов проявляет восстановительные свойства, вытесняя металл:3. Соединения с галогенами образуют галогеноводороды, водные растворы которых являются кислотами:
- водный р-р хлороводорода HCl — соляная кислота;
- водный р-р фтороводорода HF — плавиковая кислота;
- водный р-р бромоводорода HBr — бромоводородная кислота;
- водный р-р иодоводорода HI — иодоводородная кислота;
- водный р-р астатоводорода HAt — астатоводородная кислота.
4. С азотом при нагревании, давлении и в присутстсвии катализатора (Fe), образуя аммиак:5. С серой при нагревании, образуя сероводород. Это обратимая реакция:6. С углеродом, образуя метан:Галогены
Вы можете повторить характеристику галогенов, которую мы рассматривали на уроке 1.2.4 Общая характеристика неметаллов IVA – VIIA групп.
На данном уроке рассмотрим химические свойства и взаимодействие галогенов с другими элементами. Все галогены являются окислителями. Окислительные свойства уменьшаются при перемещении от фтора вниз по группе. Все галогены обладают двухатомными молекулами.
Фтор. Наиболее сильным окислителем является фтор. Он легко вступает в реакцию со всеми металлами и со многими неметаллами. И не образует фторидов лишь с тремя инертными газами: гелием, неоном и аргоном.
При обычных условиях и даже при низких t фтор реагирует с водородом с воспламенением и со взрывом, образуется фтороводород: Н2 + F2 → 2HF. При реакции фтора с водой, последняя начинает гореть: 2F2 + 2H2O → 4HF + O2.
Со фтором непосредственно не реагируют азот (N), кислород (O), алмаз, углекислый и угарный газы. Во всех соединениях фтор проявляет только одну степень окисления –1.
Хлор — газ в обычных условиях. Сильный окислитель. В соединениях проявляет степени окисления -1, 0, +1, +3, +5, +7. Почти со всеми металлами реагирует непосредственно, образуя хлориды: 2Na + Cl2 → 2NaCl; 2Fe + 3Cl2→ 2FeCl3. Также непосредственно реагирует с неметаллами, кроме углерода, азота и кислорода. Оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7 взаимодействуют с водой и образуют кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4. Из них наиболее сильным окислителем является хлорноватистая. Все названные кислоты неустойчивы. Водный р-р хлора содержит две кислоты — соляную HCl и хлорноватистую HСlO. Соляную кислоту получают путем растворения хлороводорода (газообразного соединения HCl) в воде при повышенной t: H2 + Cl2 → HCl.
Бром имеет такие же степени окисления, как и хлор. Он также активно взаимодействует с металлами и неметаллами, образуя бромиды, но менее энергичнее, чем хлор. Немного лучше других галогенов растворяется в воде. В результате получается р-р называемый бромная вода. В ней образуются две кислоты (бромоводородная и бромноватистая): Br2 + H2O → HBr + HBrO. С серой образует S2Br2, с фосфором — PBr3 и PBr5, с водородом при нагревании — HBr. С кислородом и азотом непосредственно не реагирует. Образует большое число соединений с другими галогенами. С растворами щелочи на холоде образует соли бромиды и броматы: Вr2 + 2NаОН → NaBr + NаВrО + Н2О.
Йод. Степени окисления йода, такие же как у хлора и брома. Химическая активность немного меньше, чем у предыдущих элементов. С металлами хорошо реагирует при нагревании, образуя йодиды, к примеру: Hg + I2 → HgI2. С водородом реагирует плохо и только при нагревании, образуя йодистый водород или йодоводород HI. Образует ряд кислот: иодоводородную HI, иодноватистую HIO, иодистую HIO2, иодноватую HIO3, иодную HIO4. Непосредственно не реагирует с углеродом, азотом, кислородом.
Астат. По химическим свойствам близок к йоду. Как и другие галогены образует соли — астатиды, например, AgAt. При взаимодействии с металлами образует соединения со стпенью окисления — 1, что также свойственно всем галогенам.
Кислород, сера, азот
Кислород является наиболее распространенным среди элементов. Его молекула состоит из двух атомов. Отличается высокой реакционностью. Уже при обычных условиях окисляет многие вещества, например: 4Li + O2 → 2Li2O.
А если проводить реакции с нагревом или с применением катализаторов, то они протекают довольно таки бурно, выделяя большое количество тепла. Взаимодействует со всеми элементами Периодической системы, кроме золота и инертных газов.
Соединения, включающие в себя кислород, имеют степени окисления, равные -2, -1, +2 и +1. Соединения, имеющие степень окисления, равную -2 (оксиды, основания, кислоты, соли) наиболее распространены. В степени окисления -1 кислород находится в пероксидах.
Последние получают при сгорании щелочных металлов в кислороде: 2Na + O2 → Na2O2. Выступая в реакциях как окислитель, только со фтором кислород проявляет восстанавливающие свойства: O2 + F2 → F2O2.
Сера. Данный химический элемент существует в виде восьмиатомных молекул S8. Химическая активность повышается с повышением температуры. при обычных условиях реагирует только с ртутью. Начинает плавиться при 1150С. Кипит при 4450С.
В случае проведения реакций с металлами, данный химический элемент выступает в роли окислителя, образуя сульфиды: Zn + S → ZnS; 2Al + 3S → Al2S3. При взаимодействии с сильными окислителями и сложными веществами является восстановителем: S + 6HNO3 → H2SO4 + 6NO2 + 2H2O. Сера не взаимодействует с водой.
В щелочах при нагревании диспропорционирует по уравнению: 3S + 6NaOН → 2Na2S + Na2SО3 + 3Н2О. В последней реакции образуются сульфиды и сульфиты.
Азот содержится в атмосфере в виде прочных двухатомных молекул N2, имеющих тройную связь. Малая химическая активность азота объясняется его большой прочностью. В соединениях проявляет степени окисления от от +5 до -3.
Азот взаимодействует как окислитель, всего с несколькими активными металлами (например, литием) при невысоких температурах, при этом образует нитриды: 6Li+N2 → 2Li3N. Другие металлы, а так же водород окисляются азотом только при повышенных температурах. В реакции с кислородом азот является восстановителем.
Взаимодействие этих веществ с образованием NO становится заметным только при температуре свыше 4000 С. Энергия «запуска» этой реакции — самая высокая из всех известных. Она равна 540 кДж/моль. Главная сфера применения азота — синтез аммиака. Аммиак, NH3, получают с помощью взаимодействия простых веществ по обратимой реакции: N2+ 3H2 → 2NH3+Q.
Далее аммиак используется для получения разбавленной азотной кислоты. Реакция ступенчатая, суммарное уравнение выглядит так: NH3 + 2О2 → HNO3 + Н2О.
Фосфор, углерод, кремний
Фосфор обладает высокой химической активностью, поэтому в свободном виде его не встретить. В природе существует в разных модификациях: белый, красный, чёрный, металлический. Это явление, когда одно химическое вещество образует несколько веществ называется аллотропией.
Белый фосфор — это мягкое, воскообразное вещество, имеющее молекулярную кристаллическую решетку и состоящее из тетраэдрических молекул Р4. Не растворяется в воде, но растворяется в органических растворителях. Белый фосфор является реакционноспособным веществом.
На воздухе быстро окисляется вплоть до Р4О10, а при 400С, происходит самовоспламенение и бурное горение фосфора: Р4+ 5О2 → Р4О10. Поэтому хранится он под водой. Белый фосфор — сильный яд. Противоположными белому фосфору свойствами обладает красный фосфор, имеющий порошкообразную структуру.
Не растворяется в воде и не растворяется в органических растворителях. На воздухе не окисляется и не воспламеняется. Не ядовит.
Фосфор проявляет как окислительные, так и восстановительные свойства. Во взаимодействии с металлами, ведет себя как окислитель и образует фосфиды: 2P + 3Ca → Ca3P2.
С неметаллами реагирует, как восстановитель: 2P + 3Cl2 → 2PCl3. С водородом не реагирует. С водой диспропорционирует, образуя фосфорноватистую кислоту: 4Р + 6Н2О → РН3 + 3Н3РО2.
Под действием сильный окислителей превращается в фосфорную кислоту: 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Практически каждый день мы наблюдаем реакцию фосфора с бертолетовой солью, когда от удара фосфор воспламеняется: 5KClO3 + 6P → 3P2O5 + 5KCl. Наверняка вы догадались, что речь идет о зажигании спичек (бока спичечной коробки намазаны красным фосфором, а в головке спички содержится бертолетова соль). Эта реакция является реакцией окисления.
Углерод еще более, чем фосфор, аллотропное вещество. В природе можно встретить в составе минералов: в углекислом газе в атмосфере, в карбонате кальция, природном газе, торфе, каменном угле. В свободном состоянии в виде графита и алмаза. Графит и алмаз достаточно инертны. Они не взаимодействуют с HNO3. Достаточно устойчивы в щелочах.
Взаимодействуют с кислородом, серой, галогенами и металлами только при повышенной температуре. Простые вещества, образованные углем являются неметаллами. Горение угля образует оксид углерода (IV) — углекислый газ: С + О2 → СО2. Так выглядит реакция, проведенная в избытке кислорода, недостаток которого образует оксид углерода (II) – угарный газ: 2С + О2 → 2СО.
Взаимодействие угля с водородом при нагревании образует метан: C + 2H2 → CH4. В данной реакции углерод проявляет себя окислителем. Также окислителем является в реакциях с металлами, при которых образуются карбиды: 4Al + 3C → Al4C3. С оксидами металлов проявляет восстановительные свойства: C + 2CuO → 2Cu + CO2.
Углерод окисляться концентрированными азотной и серной кислотами: С + 4HNO3(конц.) → СO2 + 4NO2 + 2H2O.
Углерод достаточно широко применяется в деятельности человека. Применяться в виде кокса в металлургии для восстановления металлов.
Кремний является вторым по распространенности (после кислорода) элементом. Входит в состав множества минералов, образующих горные породы и земную кору. Кремний достаточно инертный элемент. При нормальной t взаимодействует со фтором. Химические реакции с хлором и кислородом протекают с заметной скоростью при t 400 — 6000С. С кислотами кремний не взаимодействует. В раствор в виде комплексного соединения, кремний переводит смесь азотной и фтороводородной кислоты: 3Si + 4HNO3 + 18HF → 3H2SiF6 + 4NO + 8H2O. Реагирует с расплавами и растворами щелочей, не диспропорционирует, а только окисляется: Si + 4KOH → K4SiO4+ 2H2.
При высоких температурах, элемент реагирует со многими металлами. При взаимодействии с металлами образуются силициды.
В силицидах щелочных и щелочноземельных металлов химическая связь носит ионно-ковалентный характер. Состав данных химический соединений является постоянным.
Так же состав соответствует степени окисления кремния (-4): Na4Si, Mg2Si. Следовательно, кремний проявляет окислительные свойства.
Кремний не способен взаимодействовать с водородом. Но, несмотря на это, его соединения с водородом всё же существуют. Например: SiH4 (моносилан). С галогенами кремний образует тетрагалогениды: газообразный SiF4, жидкие SiCl4 и SiBr4 и твердый SiI4. С серой кремний образует дисульфид кремния SiS2. С углеродом кремний образует карбид кремния.
| Предыдущий урок | Следующий урок |
Химические свойства неметаллов
Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие.
Атомы самого электроотрицательного элемента — фтора — не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы.
Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
Cпособы получения металлов
| неметалл | Лабораторный способ | Промышленный сопособ |
| H2 |
|
2NaCl + 2H2O = H2 + Cl2 + 2NaOH 3Fe + 4H2O = Fe3O4 + 4H2 |
| Cl2 | 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O | 2NaCl = Cl2 + 2Na |
| O2 | 2KClO3 = 2KCl + 3O2 | Сжижение воздуха при низких t и его дальнейшая фракционная перегонка |
| S | H2SO3 + 2H2S = 3S + 3H2O | В автоклавах |
| N2 | NH4NO2 = N2 + 2H2O | Получают из сжатого воздуха |
| P | Ca3(PO4)2 + 3SiO2 = 3CaSiO3 + P2O5 | |
| Si | SiO2 + 2Mg = Si + 2MgO | SiO2 + 2C = Si + 2CO |
- Взаимодействие с простыми веществами:
- 1. Взаимодействие с металлами:
- 2Na + Cl2 = 2NaCl;
- Fe + S = FeS;
- 6Li + N2 = 2Li3N;
- 2Ca + O2 = 2CaO.
- в этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.
- 2. Взаимодействие с другими неметаллами:
- взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды:
3H2 + N2 = 2NH3;
H2 + Br2 = 2HBr.
- взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства:
- S + O2 = SO2;
- t, эл. разряд
- N2 + O2 = 2NO – Q
- 4P + 5O2 = 2P2O5.
- Si + O2 = SiO2
- при взаимодействии с фтором фтор является окислителем
- F2 + Cl2 = 2ClF
- 3F2 + Br2 = 2BrF3
- Со сложными веществами
- 2F2 + 2H2O = O2 + 2HF
- 2F2 + H2O = OF2 + 2HF
- 2F2 + SiO2 = O2 + SiF4
- Специфические реакции
- 3Si + 4HNO3 + 12HF = 3SiF4 + 4NO + 8H2O
- Si + 2NaOH + 2H2O = Na2SiO3 + 3H2
- Si + 4NaOH(тв.) = Na2SiO3 + 2H2 + Na2O (При нагревании)
- Cl2 + H2O = HCl + HClO
- Cl2 + 2NaOH = NaCl + NaClO + H2O
- 3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (При нагревании)
- Br2 + H2O = HBr + HBrO
- 2Br2 + 2Ca(OH)2 = CaBr2 + Ca(BrO)2 + 2H2O
- 6Br2 + 6Ca(OH)2 = 5CaBr2 + Ca(BrO3)2 + 6H2O (При нагревании)
- S + H2O = РЕАКЦИЯ НЕ ИДЁТ
- 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
- 4P + 3NaOH + 3H2O = PH3 + 3NaH2PO4
Химические свойства неметаллов
Взаимодействие с водой
Многие неметаллы взаимодействуют с водой с образованием оксидов (и/или других соединений). Реакции идут при сильном нагревании.
- С + H2O → CO + H2
- 6B + 6H2O → 2H3B3O3(бороксин)+ 3H2
- 4P + 10H2O → 2P2O5 + 5H2
- 3S + 2H2O → 2H2S + SO2
Галогены при взаимодействии с водой диспропорционируют (образуют из соединения с одной степенью окисления соединения с различными степенями окисления)- кроме F2. Реакции идут при комнатной температуре.
- Cl2 + H2O → HCl + HClO
- Br2 + H2O → HBr + HBrO
- 2F2+ 2H2O → 4HF + O2
- Взаимодействие с неметаллами
- Взаимодействие с кислородом.
- Большинство неметаллов (кроме галагенов, благородных газов) взаимодействуют с кислородом с образованием оксидов, а при определенных условиях (температура, давление, катализаторы) – высших оксидов.
- N2 + O2 → 2NO (реакция идет при температуре 2000°C или в электрической дуге)
- С + O2 → СO2
- 4B + 3O2 → 2B2O3
- S + O2 → SO2
- Взаимодействие с фтором
- Большинство неметаллов (кроме N2, С (алмаз), некоторые благородные газы) взаимодействуют с фтором с образованием фторидов.
- O2 +2F2 → 2OF2 (при пропускание электрического тока)
- C + 2F2 → CF4 (при температуре 900°C)
- S +3F2 → SF6
- 2.3 Взаимодействие с галогенами (Cl2, Br2)
- C неметаллами (кроме углерода, азота, фтора, кислорода и инертных газов), образует соответствующие галогениды (хлориды и бромиды).
- 2S + Cl2 → S2Cl2
- 2S + Br2 → S2Br2
- 2P + 5Cl2 → 2PCl5 (сжигание в атмосфере хлора)
- Cl2 + Br2 → 2BrCl
- Cl2 + I2 → 2ICl (нагрев до 45°C))
- Br2+ I2→ 2IBr
- Взаимодействие с оксидами
Углерод и кремний восстанавливают металлы и неметаллы из их оксидов. Реакции идут при нагревании.
- SiO2+C=CO2+Si
- MnO2 + Si → Mn + SiO2.
- Взаимодействие со щелочами
- Большинство неметаллов (кромеF2, Si) диспропорционируют при взаимодействии со щелочами. Благородные газы, O2, N2 и некоторые другие металлы не взаимодействуют со щелочами
- Cl2 + 2NaOH → NaCl + NaClO
- 3Cl2 + 6NaOH → 5NaCl + NaClO3 + H2O (при нагревании)
- 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O (присплавлении)
- P + NaOH → Na3PO3 + PH3
- Si +2NaOH+ H2O → Na2SiO3 + 2H2
- 4F2 + 6NaOH → OF2 + 6NaF + 3H2O + O2
- Взаимодействие с кислотами-окислителями
- Все неметаллы (кроме галогенов, благородных газов, N2, O2, Si) взаимодействуют с кислотами – окислителями с образованием соответсвующей кислородсодержащей кислоты (или оксида).
- C + 2 H2SO4→ CO2 + 2SO2 +2H2O
- B + 3HNO3 → H3BO3 + 3NO2
- S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
- Взаимодействие с солями
- Более электроотрицательный галоген вытесняет менее электроотрицательный реагент из его соли или водородного соединения
- 2NaBr + Cl2 → 2NaCl + Br2
Химические свойства неоксидных бинарных соединений различно. Большинство из них (кроме галогенидов) при взаимодействии с кислородом образуют два оксида (в случае аммиака необходимо использовать катализаторы).
- Химические свойства основных оксидов
- Взаимодействие с водой
- Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых (малорастворимых) соединений – щелочи
- Na2O + H2O → 2NaOH
- Взаимодействие с оксидами
- Основные оксиды взаимодействуют с кислотными и амфотерными оксидами с образованием солей.
- Na2O + SO3 → Na2SO4
- CaO + Al2O3→ CaAl2O4 (сплавление)
- Взаимодействие с кислотами
- Основные оксиды взаимодействуют с кислотами
- CaO + 2HCl→ CaCl2 + H2O
- FeO + 2HCl→ FeCl2 + H2O
- Окислительно – восстановительные реакции
- Основные оксиды элементов с переменной степенью окисления могут участвовать в окислительно-восстановительных реакциях
- FeO + 4HNO3→Fe(NO3)3 + NO2 + 2H2O
- 2MnO + O2 → 2MnO2
- Химические свойства амфотерных оксидов
- Взаимодействие с оксидами
- Амфотерные оксиды взаимодействуют с основными, кислотными и амфотерными оксидами с образованием солей.
- Na2O + Al2O3→ 2NaAlO2
- 3SO3+ Al2O3→ 2Al2(SO4)3
- ZnO + Al2O3→ ZnAl2O4 (сплавление)
- Взаимодействие с кислотами и основаниями
- Амфотерные оксиды взаимодействуют с основаниями и кислотами
- 6HCl + Al2O3→ 2AlCl3 + 3H2O
- ZnO + 2NaOH → Na2ZnO2 + H2O (при нагревании)
- Взаимодействие с солями
- Малолетучие амфотерные оксиды вытесняют более летучие кислые оксиды из их солей
- Al2O3 + Na2CO3 → 2NaAlO2 + CO2
- Окислительно – восстановительные реакции
- Амфотерные оксиды элементов с переменной степенью окисления могут участвовать в окислительно-восстановительных реакциях.
- MnO2 + 4HCl→ MnCl2 + Cl2 + 2H2O
- Химические свойства кислотных оксидов
- 1. Взаимодействие с водой
- Большинство кислотных оксидов растворяется в воде с образованием соответствующей кислоты (оксиды металлов с высшими степенями окисления и SiO2 не растворяются в воде).
- SO3 + H2O → H2SO4
- P2O5 + 3H2O → 2H3PO4
- Взаимодействие с оксидами
- Кислотные оксиды взаимодействуют с основными и амфотерными оксидами с образованием солей.






